下调miR-210的表达对U87细胞增殖、侵袭及凋亡的影响*
2017-04-08任志文王业忠张永超
任志文,赵 冬,刘 祺,王 洋,许 健,王业忠#,张永超
1)新疆石河子大学医学院第一附属医院神经外科 新疆石河子 832008 2)山东省立医院神经外科 济南 250021
下调miR-210的表达对U87细胞增殖、侵袭及凋亡的影响*
任志文1),赵 冬1),刘 祺1),王 洋1),许 健1),王业忠1)#,张永超2)
1)新疆石河子大学医学院第一附属医院神经外科 新疆石河子 832008 2)山东省立医院神经外科 济南 250021
#通信作者,男,1967年8月生,博士,主任医师,研究方向:颅内肿瘤和脑血管疾病,E-mail:3081217747@qq.com
miR-210;胶质瘤;细胞增殖;细胞侵袭力
目的:探讨miR-210在胶质瘤组织中的表达及下调miR-210对U87细胞增殖、侵袭及凋亡的影响。方法:选取64例择期行手术治疗的胶质瘤患者的胶质瘤组织和30例因脑外伤行内减压术患者的正常脑组织。培养人脑胶质瘤U87细胞,根据转染物不同将细胞分为反义miR-210组、阴性对照组和空白对照组,利用实时荧光定量PCR技术检测不同脑组织及细胞中miR-210及HIF-1α基因表达,MTT比色法检测细胞增殖情况,Transwell法检测细胞迁移及侵袭能力,利用流式细胞术检测细胞凋亡情况,Western blot法检测细胞Bcl-2、Bax、Caspase-3、Caspase-8和Caspase-9蛋白表达。结果:胶质瘤组织中miR-210和HIF-1α mRNA的表达均高于正常脑组织(P<0.05);胶质瘤组织中miR-210和HIF-1α mRNA相对表达量均与肿瘤直径和病理分级有关(P<0.05);反义miR-210组细胞中miR-210和HIF-1α mRNA的表达均低于阴性对照组和空白对照组(P<0.05)。与阴性对照组和空白对照组相比,反义miR-210组细胞在48、72和96 h时光密度值降低,迁移细胞数和侵袭细胞数减少,细胞凋亡率升高(P<0.05)。反义miR-210组细胞中Bcl-2蛋白相对表达量低于阴性对照组和空白对照组,而Bax、Caspase-3、Caspase-8和Caspase-9蛋白相对表达量则升高(P<0.05)。结论:miR-210在胶质瘤组织中呈高表达,下调miR-210表达可抑制细胞增殖、迁移及侵袭能力,促进细胞凋亡发生。
胶质瘤作为颅内高发的恶性肿瘤,占颅内肿瘤的35%~60%,具有发病率高、复发率高、病死率高等特点,患者预后往往较差[1]。目前,其发生、进展及复发的机制尚未研究清楚。微小RNA(micro RNA,miRNA)作为广泛存在于机体内的高度保守的短小RNA,在多种生理、病理功能中发挥重要作用,它参与了胶质瘤发生及进展过程,且与患者预后密切相关[2]。作为miRNA的重要类型,有研究[3]认为,miR-210在缺氧环境下促进肿瘤发生及进展。亦有研究[4]指出,下调miR-210可抑制肝癌细胞增殖,诱导细胞凋亡发生,增强缺氧环境中肝癌细胞对放射的敏感性。该研究对胶质瘤组织中miR-210的表达进行分析,并利用反义技术下调miR-210的表达,观察其对胶质瘤U87细胞增殖、侵袭及凋亡的影响。
1 资料与方法
1.1 临床资料 选取2011年3月至2015年4月在新疆石河子大学医学院第一附属医院神经外科择期行手术治疗的胶质瘤患者64例,男35例,女29例,年龄36~73(53.7±8.6)岁,所有患者均经术后病理确诊,术前均未行放化疗。根据2007年WHO关于胶质瘤组织病理学和临床标准:低级别(Ⅰ、Ⅱ期)21例,高级别(Ⅲ、Ⅳ期)43例。同期,留取因脑外伤行内减压术患者的正常脑组织30例作为对照,男17例,女13例,年龄(54.2±9.1)岁。两组患者性别、年龄等一般情况无差异,均衡可比。该研究通过医院伦理委员会批准,所有患者均知情同意。
1.2 细胞来源、主要试剂及仪器 人脑胶质瘤细胞株U87购自上海奥陆生物公司,DMEM/F12培养基、胎牛血清均购自美国Gibco公司,脂质体转染试剂盒Lipfectamine 2000、Trizol总RNA提取试剂盒均购自美国 Invitrogen公司,反转录试剂盒和PCR试剂盒均购自大连宝生物公司,miR-210、miR-210反义序列、阴性对照序列及内参、缺氧诱导因子1α(HIF-1α)及内参引物均由上海生工生物工程有限公司设计合成,四甲基偶氮唑蓝(MTT)、碘化丙啶(PI)和二甲基亚砜(DMSO)均购自美国Sigma公司,Annexin V-FITC细胞凋亡检测试剂盒购自北京宝赛生物公司,Transwell小室购自美国Corning公司,鼠抗人Bcl-2单克隆抗体、鼠抗人Bax单克隆抗体和HRP标记二抗均购自上海酶联生物研究所,鼠抗人Caspase-3单克隆抗体、鼠抗人Caspase-8单克隆抗体和鼠抗人Caspase-9单克隆抗体均购自美国Abcam公司,实时荧光定量PCR仪购自美国ABI公司,FACSAria流式细胞仪购自美国BD公司。
1.3 细胞培养及处理 将人脑胶质瘤细胞株U87置于含胎牛血清和谷氨酰胺的DMEM/F12培养基上,于体积分数50%CO2、37 ℃恒温培养箱中进行无菌培养。待细胞贴壁生长,取对数生长期细胞,利用脂质体转染试剂盒Lipfectamine 2000进行转染处理。将细胞分为3组,反义miR-210组:转染miR-210反义序列(5’-TCAGCCGCTGTCACACGCACAG-3’);阴性对照组:转染阴性序列(5’-TTCTC CGAACGTGTCACGTTTC-3’);空白对照组:不处理。各组细胞转染后继续进行恒温培养。
1.4 利用实时荧光定量PCR技术检测组织和各细胞中miR-210及HIF-1α mRNA的表达 取胶质瘤及正常脑组织,研磨后,加入细胞裂解液进行裂解,取各组细胞,加入细胞裂解液进行裂解。用Trizol总RNA提取试剂盒提取RNA,用反转录试剂进行反转录获得模板单链cDNA,以cDNA为模板进行PCR。miR-210引物序列:上游 5’-GGAGATCTGAC CAGGTCATTTGCATAC-3’,下游5’-GGGAATTCG ATATGACCACACCTGTG-3’;U6引物序列:上游5’-TCAGTTTGCTGTTCTGGGTG-3’,下游5’-CGGTTG GCTGGAAAGGAG-3’; HIF-1α引物序列:上游5’-ATCGCGGGGACCGATT-3’,下游5’-CGACGTTCA GAACTTATCTTTTTCTT-3’;β-actin引物序列:上游5’-GATCATTGCTCCTCCTGAGC-3’,下游5’-TGTG GACTTGGGAGAGGACT-3’。反应条件:94 ℃ 60 s,92 ℃ 30 s,56 ℃ 30 s,74 ℃ 30 s,连续进行36次循环。每个样品均设置3个复孔。用2-ΔΔCt法获得miR-210及HIF-1α mRNA的相对表达量。
1.5 MTT比色法检测细胞增殖情况 取各组细胞接种于96孔板进行培养,将细胞密度调整为1×104个/孔,每组均设6个复孔。分别于转染后24、48、72和96 h时,将20 μL的MTT液加入各孔,培养4 h,加入150 μL的DMSO,振荡15 min,使结晶充分溶解后,用酶标仪对各孔570 nm处光密度(OD)值进行检测。
1.6 Transwell法检测细胞迁移及侵袭能力 迁移能力检测:取各组转染培养48 h的细胞,接种于24孔板中,制备无血清细胞悬液,细胞密度2×104个/孔,将含体积分数10%胎牛血清的DMEM加入下室,置于恒温培养箱中培养12 h后,取出小室,轻轻将上室的培养基去除,用甲醛固定5 min,利用结晶紫染色10 min,于倒置显微镜下取5个视野进行观察拍照,计数穿膜细胞。侵袭能力检测:将Matrigel胶均匀地铺于Transwell小室上室,于37 ℃恒温箱中预置1 h后配用。其余步骤同迁移能力检测。
1.7 利用流式细胞术检测细胞凋亡情况 取各组转染后培养48 h的细胞,制备单细胞悬液,PBS洗涤3次,离心后弃去上清,重悬,室温下孵育,用体积分数70%的乙醇固定25 min,用PBS冲洗,分别加入5 μL的Annexin V-FITC和10 μL的PI,4 ℃避光孵育60 min后,用FACSAria流式细胞仪进行检测,计算各转染组细胞凋亡率。
1.8 Western blot法检测细胞中Bcl-2、Bax、Caspase-3、Caspase-8和Caspase-9蛋白表达 取各组转染后培养48 h的细胞,加入细胞裂解液进行裂解,用总蛋白提取试剂盒对各组细胞中总蛋白进行提取,用BCA法对蛋白浓度进行检测并加热变性。各组取20 μg蛋白,在80 V条件下电泳30 min,在120 V条件下电泳90 min,之后电转移至PVDF膜上,BSA封闭后,孵育过夜,用TBST洗涤3次,分别加入鼠抗人Bcl-2、Bax、Caspase-3、Caspase-8和Caspase-9单克隆抗体(分别稀释200、800、500、1 500、1 200倍),孵育2 h,TBST洗涤3次,加入HRP标记二抗(稀释2 000倍),孵育2 h,用TBST洗涤3次,用ECL化学发光超敏试剂盒进行显色,利用凝胶成像系统对获得的条带进行拍照并分析各蛋白相对表达量。

2 结果
2.1 胶质瘤和正常脑组织中miR-210和HIF-1α mRNA表达的比较 胶质瘤组织中miR-210和HIF-1α mRNA相对表达量均高于正常脑组织,见表1。

表1 胶质瘤和正常脑组织中miR-210和HIF-1α mRNA表达的比较
2.2 不同病理特征人群胶质瘤组织中miR-210和HIF-1α mRNA表达的差异 胶质瘤组织中miR-210和HIF-1α mRNA的表达均与性别和年龄无关,而均与肿瘤直径和病理分级有关,见表2。

表2 不同病理特征人群胶质瘤组织中miR-210和HIF-1α mRNA表达的差异
*:与肿瘤直径<2 cm相比,P<0.05;#:与肿瘤直径2~5 cm相比,P<0.05。
2.3 各组细胞中miR-210和HIF-1α mRNA表达的比较 反义miR-210组细胞中miR-210和HIF-1α mRNA相对表达量均低于阴性对照组和空白对照组,见表3。

表3 各组细胞中miR-210和HIF-1α mRNA表达的比较(n=3)
*:与阴性对照组和空白对照组相比,P<0.05。
2.4 各组细胞增殖情况比较 反义miR-210组细胞在48、72和96 h时OD值均低于阴性对照组和空白对照组,见图1。

图1 各组细胞增殖情况比较
2.5 各组细胞迁移和侵袭能力比较 反义miR-210组迁移细胞数和侵袭细胞数均低于阴性对照组和空白对照组,见表4和图2。
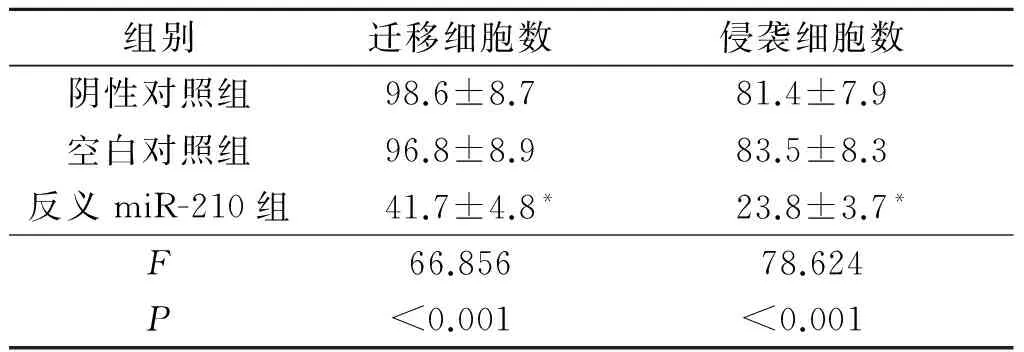
表4 不同转染组细胞迁移和侵袭能力比较(n=3)
*:与阴性对照组和空白对照组相比,P<0.05。

A:反义miR-210组;B:阴性对照组;C:空白对照组。图2 不同转染组细胞迁移(1)和侵袭(2)能力比较(×100)
2.6 各组细胞凋亡情况比较 反义miR-210组、阴性对照组和空白对照组细胞凋亡率分别为(27.8±4.9)%、(8.9±2.7)%和(9.2±2.9)%,差异有统计学意义(F=18.793,P<0.001),反义miR-210组高于阴性对照组和空白对照组(P<0.05)。
2.7 各组细胞中Bcl-2、Bax、Caspase-3、Caspase-8和Caspase-9蛋白表达 反义miR-210组细胞中Bcl-2蛋白相对表达量低于阴性对照组和空白对照组,而Bax、Caspase-3、Caspase-8和Caspase-9蛋白相对表达量均高于阴性对照组和空白对照组,见图3和表5。
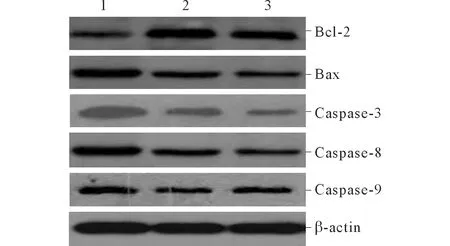
1:反义miR-210组;2:阴性对照组;3:空白对照组。图3 各组细胞中Bcl-2、Bax、Caspase-3、Caspase-8和Caspase-9蛋白的表达
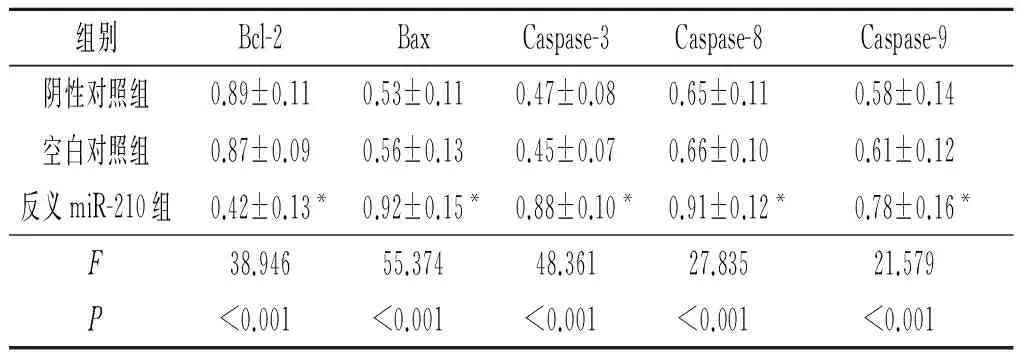
表5 各组细胞中Bcl-2、Bax、Caspase-3、Caspase-8和Caspase-9蛋白表达(n=3)
*:与阴性对照组和空白对照组相比,P<0.05。
3 讨论
胶质瘤作为颅内频发恶性肿瘤,由于其呈侵袭、浸润性生长且血供丰富,患者在接受手术及放化疗等手段治疗后,往往预后不佳,复发率、病死率居高不下[5]。miRNA作为一类高度保守的短小RNA,在多种恶性肿瘤发生中发挥重要作用。有研究[6]指出,miRNA参与了胶质瘤的发生、进展及侵袭、转移,影响患者预后,不仅可用于胶质瘤临床诊断,还有望成为基因治疗的靶位。有研究[7]将胶质母细胞瘤细胞miR-21基因敲除,其增殖、侵袭性降低,凋亡加速。miR-210作为一种较为重要的miRNA,在细胞增殖、迁移、侵袭及DNA修复等多种生物学功能中发挥重要作用[8]。miR-210是低氧或缺氧诱导的miRNA类型,其表达受HIF-1α控制,HIF-1α可直接与miR-210启动子起始位点上游的缺氧反应原件结合而诱导miR-210表达[9]。胶质瘤作为一种实体瘤,在生长过程中由于细胞大量增殖而大量消耗氧气,会导致局部组织呈低氧或缺氧状态,使HIF-1α表达上调[10]。该研究结果显示,胶质瘤组织中miR-210和HIF-1α mRNA的表达均高于正常脑组织,说明胶质瘤组织呈低氧或缺氧状态,使HIF-1α大量表达,从而促使miR-210表达上调。作者还发现,胶质瘤组织中miR-210和HIF-1α mRNA的表达与肿瘤直径和病理分级有关,肿瘤直径越大、病理分级越高,miR-210和HIF-1α mRNA的表达越高,提示miR-210高表达可能加速胶质瘤生长,而瘤体的生长又会加速组织缺氧,上调HIF-1α基因表达,而又进一步上调miR-210表达,加速胶质瘤进展。
为进一步探讨miR-210在胶质瘤发生、进展中的作用,作者采用反义RNA技术特异性将U87细胞中miR-210基因进行抑制,结果显示,反义miR-210组细胞中miR-210和HIF-1α mRNA相对表达量均低于阴性对照组和空白对照组,反义miR-210组细胞在48、72和96 h时OD值均低于阴性对照组和空白对照组,说明特异性下调miR-210表达后可减少U87细胞增殖,从而改善了细胞缺氧状态,使HIF-1α基因表达下调,进一步减少miR-210的表达。该研究结果显示,反义miR-210组迁移细胞数和侵袭细胞数均低于阴性对照组和空白对照组,提示特异性下调miR-210表达不仅可抑制细胞增殖,而且抑制U87细胞迁移及侵袭能力,进一步提示miR-210表达上调可能促进胶质瘤细胞侵袭转移过程。该研究结果还显示,反义miR-210组细胞凋亡率显著高于阴性对照组和空白对照组,说明特异性下调miR-210表达可促进细胞凋亡的发生。
Bcl-2和Bax分别在线粒体家族中发挥抗凋亡及促凋亡作用,Bcl-2可通过抑制细胞凋亡而延长细胞寿命,通过阻断线粒体细胞色素C的合成释放而发挥抗细胞凋亡发生,Bax存在于线粒体内,是参与调控细胞凋亡的主要结构[11]。Caspase-3、Caspase-8和Caspase-9作为半胱氨酸蛋白家族成员,是促凋亡蛋白[12]。该研究结果显示,反义miR-210组细胞中Bcl-2蛋白相对表达量低于阴性对照组和空白对照组,而Bax、Caspase-3、Caspase-8和Caspase-9蛋白相对表达量均高于阴性对照组和空白对照组,说明特异性下调miR-210可抑制凋亡抑制蛋白Bcl-2表达,而促进凋亡促进蛋白Bax、Caspase-3、Caspase-8和Caspase-9表达,通过激活两条细胞凋亡路径而促进细胞凋亡的发生。
综上所述,miR-210在胶质瘤组织中呈高表达;下调miR-210表达可抑制细胞增殖、迁移及侵袭,促进细胞凋亡发生,可能通过调控细胞凋亡路径而实现对肿瘤发生、发展的调控,但具体作用机制尚待进一步研究明确;miR-210有望成为胶质瘤基因治疗的潜在靶位。
[1]NOBUSAWA S,HIRATO J,YOKOO H.Molecular genetics of ependymomas and pediatric diffuse gliomas: a short review[J].Brain Tumor Pathol,2014,31(4):229
[2]MIZUGUCHI Y,TAKIZAWA T,YOSHIDA HA.Dysregulated miRNA in progression of hepatocellular carcinoma: A systematic review[J].Hepatol Res,2016,46(5):391
[3]KYVAN D,MYERS KA.The role of hypoxia-induced miR-210 in cancer progression[J].Int J Mol Sci,2015,16(3):6353
[4]YANG W,SUN T,CAO J,et al.Downregulation of miR-210 expression inhibits proliferation, induces apoptosis and enhances radiosensitivity in hypoxic human hepatoma cells in vitro[J].Exp Cell Res,2012,318(8):944
[5]TRISCOTT J,ROSE PAMBID M,DUNN SE.Concise review: bullseye: targeting cancer stem cells to improve the treatment of gliomas by repurposing disulfiram[J].Stem Cells,2015,33(4):1042
[6]刘楠,涂艳阳,张永生.MicroRNAs在胶质瘤中生物学功能及基因治疗潜力研究进展[J].转化医学电子杂志,2015,2(2):5
[7]HARMALKAR M,UPRAITY S,KAZI S,et al.Tamoxifen-induced cell death of malignant glioma cells is brought about by oxidative-stress-mediated alterations in the expression of BCL2 family members and is enhanced on miR-21 inhibition[J].J Mol Neurosci,2015,57(2):197
[8]KYVAN D,MYERS KA.The Role of hypoxia-induced miR-210 in cancer progression[J].Int J Mol Sci,2015,16(3):6353
[9]ZHANG C,TIAN W,MENG L,et al.PRL-3 promotes gastric cancer migration and invasion through a NF-κB-HIF-1α-miR-210 axis[J].J Mol Med(Berl),2016,94(4):401
[10]LIU Q,CAO P.Clinical and prognostic significance of HIF-1α in glioma patients: a meta-analysis[J].Int J Clin Exp Med,2015,8(12):22073
[11]UM HD.Bcl-2 family proteins as regulators of cancer cell invasion and metastasis: a review focusing on mitochondrial respiration and reactive oxygen species[J].Oncotarget,2016,7(5):5193
[12]葛雅琨,张元新,陈云鹏,等.Nutlins类似物NL-608诱导人乳腺癌MCF-7细胞凋亡[J].中华肿瘤杂志,2012,34(2):100
(2016-06-05收稿 责任编辑李沛寰)
Effects of down-regulation miR-210 expression on proliferation,invasion and apoptosis of U87 cells
RENZhiwen1),ZHAODong1),LIUQi1),WANGYang1),XUJian1),WANGYezhong1),ZHANGYongchao2)
1)DepartmentofNeurosurgery,theFirstAffiliatedHospital,MedicalCollege,ShiheziUniversity,Shihezi,Xinjiang832008 2)DepartmentofNeurosurgery,ShandongProvincialHospital,Jinan250021
miR-210;glioma;cell proliferation;cell invasion
Aim: To investigate the expression of miR-210 in glioma tissue and effects of antisense miR-210 on proliferation, invasion and apoptosis of U87 cells. Methods: The glioma tissue from 64 cases of patients with glioma and normal brain tissue from 30 patients undergoing decompression surgery were collected. The human glioma cells U87 were cultured and divided into antisense miR-210 group, negative control group and blank control group, according to different transfectant. The expressions of miR-210 and HIF-1α genes in different tissues and different transfected groups were detected by real-time PCR. The cell proliferations,migration and invasion as well as cell apoptosis in different transfected groups were detected by MTT,Transwell assay, and flow cytometry,respectively. The expressions of Bcl-2, Bax, Caspase-3, Caspase-8 and Caspase-9 proteins in the transfected groups were detected by Western blot. Results: The relative expression levels of miR-210 and HIF-1α mRNA in glioma tissue were higher than the normal brain tissue(P<0.05). The relative expression levels of miR-210 and HIF-1α mRNA in glioma tissue were related with tumor size and pathological grade(P<0.05).Compared with the negative control group and blank control group, the relative expression levels of miR-210 and HIF-1α mRNA in antisense miR-210 group and the density values at 48, 72 and 96 h were lower, the migration cells and invasion cells reduced, while the cell apoptosis rate increased(P<0.05). The relative expression level of Bcl-2 protein in antisense miR-210 group was lower than the negative control group and blank control group, while the relative expression levels of Bax, Caspase-3, Caspase-8 and Caspase-9 proteins were higher(P<0.05). Conclusion: miR-210 is highly expressed in glioma tissue. Down-regulating the expression of miR-210 could inhibit cell proliferation, migration and invasion, and promote apoptosis of U87 cells.
10.13705/j.issn.1671-6825.2017.02.018
*山东省科技发展计划 2013YD18024
R651.1
