嗜热链球菌M5-5冻干保护剂配方的优化
2017-04-07焦琳郑晓卫屈晓宇申彤杨洁
焦琳,郑晓卫,屈晓宇,申彤,杨洁*
(1.新疆大学生命科学与技术学院,新疆乌鲁木齐830046;2.中粮营养健康研究院生物技术中心,北京102209)
嗜热链球菌M5-5冻干保护剂配方的优化
焦琳1,郑晓卫2,屈晓宇1,申彤1,杨洁1*
(1.新疆大学生命科学与技术学院,新疆乌鲁木齐830046;2.中粮营养健康研究院生物技术中心,北京102209)
为了研究不同冻干保护剂在真空冷冻干燥过程中对嗜热链球菌M5-5菌体细胞的保护效果,采用单因素试验和正交试验,以冻干后的菌体存活率为评价指标,考察9种冻干保护剂在冷冻干燥过程中对M5-5菌体的保护效果,以期获得最优保护剂配方。结果表明,海藻糖、甘油和脱脂乳作为单一冻干保护剂时,菌体细胞存活率分别为43.85%、47.51%和40.86%,显著高于其他6种保护剂(P<0.05);通过正交试验确定冻干保护剂的最优配方为海藻糖60 g/L、谷氨酸钠20 g/L、甘油20 g/L、脱脂乳150 g/L,此时嗜热链球菌M5-5的冻干存活率可达88.41%。扫描电镜结果显示,添加保护剂配方组菌体细胞完整,表面光滑,说明该保护剂配方能有效减少冷冻干燥过程对菌体细胞的损伤。
嗜酸链球菌;冻干保护剂;扫描电镜
目前,糖类和脱脂乳是使用较广泛且保护效果明显的保护剂,但其作用机理尚不明确[14]。就效果而言,单一的保护剂不足以保护菌体抵抗不良的冻干环境[15],且同种保护剂对不同菌株的保护效果不尽相同,不同浓度的保护剂保护效果也存在差异。因此,只有复配保护剂中各组分比例和浓度达到协调时,才能达到理想的保护效果。本研究以从新疆民丰县采集的酸乳中筛选分离的嗜热链球菌(Streptococcusthermophilus)M5-5为试验菌株,采用单因素法筛选出保护效果显著的保护剂,采用正交试验法确定最优的保护剂的浓度和比例,并经扫描电镜验证该保护剂配方对菌体细胞的保护效果,以期最大限度地发挥保护作用,减少菌体细胞在冻干过程中的死亡和损伤,为高效冻干发酵剂的开发提供理论依据。
1 材料与方法
1.1 材料与试剂
试验菌株:本试验室从新疆民丰县收集的酸奶中分离得到的一株高产胞外多糖的乳酸菌M5-5,经16S rDNA鉴定,菌株M5-5为嗜热链球菌(S.thermophilus)。
脱脂乳粉:新西兰恒天然集团;海藻糖、甘露醇、谷氨酸钠:美国Sigma公司;抗坏血酸:国药集团化学试剂有限公司;甘油、麦芽糊精、谷氨酸:北京化工厂;以上试剂均为分析纯。
MRS培养基:蛋白胨10.00 g,酵母浸粉5.00 g,牛肉膏10.00 g,葡萄糖20.00 g,磷酸氢二钾2.00 g,柠檬酸氢二铵2.00 g,无水乙酸钠5.00 g,硫酸锰0.25 g,硫酸镁0.58 g,Tween-801.00g,蒸馏水1L,pH值为6.8,121℃灭菌15min。
1.2 仪器与设备
Alpha1-2LDplus型真空冷冻干燥机:德国CHRIST公司;BHC-1300IIA2型超净工作台:苏净集团安泰公司;Neofuge 23R型力康高速低温离心机:香港力康有限公司;YX280B型手提式不锈钢蒸汽消毒器:上海三申医疗器械有限公司;AL104型分析天平:梅特勒-托利多仪器(上海)公司;GXZ型恒温培养箱:宁波江南仪器厂;HH-S型水浴锅:巩义市英峪予华仪器厂;Spectrumlab24型紫外分光光度计:上海棱光技术有限公司。HITACHI S-3400型扫描电镜:日本日立公司。
1.3 方法
1.3.1 工艺流程
菌种活化→扩大培养→离心→收集菌泥→加入保护剂溶液→悬浮液的制备→预冻→真空冷冻干燥→复水→计数活菌数(CFU/mL)→计算菌体细胞存活率
1.3.2 菌株M5-5生长曲线的测定
将菌株M5-5在MRS固体培养基上划线,放入37℃恒温培养箱培养24 h,连续活化3次,使菌株活力达到最佳状态。
按接种量3%接种于若干个MRS液体培养基。将其放入37℃培养。取出0 h的培养液测OD600nm值,并记录。此后,每隔1 h测一次OD600nm值。以时间为横坐标,OD600nm为纵坐标绘制菌株M5-5的生长曲线,以确定菌株M5-5的对数生长末期和稳定生长前期。
1.3.3 菌悬液的制备和冷冻干燥
将处于对数期末期的菌株M5-5加入离心管中,4000r/min离心20 min后在无菌操作台中迅速倾去上清液,得到细胞糊状物(即菌泥)备用。按菌泥∶保护剂=1∶3的体积比加入灭菌保护剂,制成菌悬液备用。
各取2 mL菌悬液分装至无菌的小西林瓶中,在-80℃预冻12 h使其完全冻结,然后转移至真空冷冻干燥机内进行真空冻干12~15 h。利用冻干后的菌体细胞存活率来比较保护剂的效果。
1.3.4 细胞存活率计算
采用梯度稀释倾注平板计数法,分别计算冻干前和冻干后菌体活细胞数,对于冻干后活菌数的计算,先将冻干后的菌粉加入与冻干前等体积的无菌生理盐水复水,以MRS培养基为计数培养基,37℃培养48h后计活菌数。菌体细胞存活率计算公式如下:
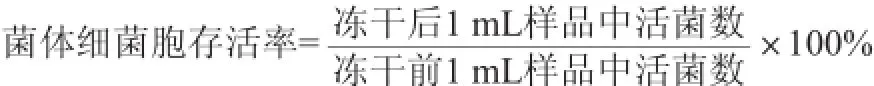
1.3.5 单因素试验
根据文献报道,选择9种冻干保护剂,分别为海藻糖、麦芽糊精、谷氨酸、甘油、甘露醇、谷氨酸钠、脱脂乳、抗坏血酸、MRS培养基,按菌泥∶保护剂=1∶3体积比添加冻干保护剂,以冻干后菌体细胞存活率为指标筛选出效果较好的冻干保护剂,进行下一步的试验。
1.3.6 正交试验
根据单因素筛选出合适的保护剂,最终选择海藻糖、谷氨酸钠、甘油、脱脂乳为试验因素,以细胞存活率为评价指标,每个因素取3个浓度水平,进行正交试验设计L9(34),正交试验因素与水平见表1,每组试验重复3次。

表1 冻干保护剂配方优化正交试验因素与水平Table 1 Factors and levels of orthogonal experiments for cryoprotectants formula optimization
1.3.7 扫描电镜观察
利用扫描电镜观察嗜热链球菌M5-5冻干前细胞形态,及添加最优保护剂配方和未添加保护剂条件下冻干后的细胞形态,验证最优保护剂配方对菌体细胞的保护效果。
2 结果与分析
2.1 菌株M5-5生长曲线的测定
由于菌种收获时期会影响细胞的复苏能力和代谢活性[16]。乳酸菌在停滞期时,不具有强的繁殖能力,且耐受力和活力较差;处于对数生长期的乳酸菌繁殖能力较强,细胞代谢活性强,适合用于扩大培养时接种,但对温度比较敏感,不宜进行低温处理;在处于对数末期和稳定前期的细胞,生理结构和代谢功能都处于稳定期,菌体抗逆性强,因此收获此时的细胞作为冷冻干燥的细胞进行研究更具有代表性。
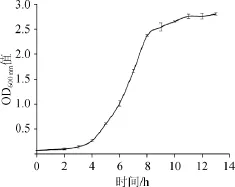
图1 菌株S.thermophilusM5-5的生长曲线Fig.1 Growth curve ofS.thermophilusM5-5
由图1可知,在0~3 h时,OD600nm值基本没有变化,说明在此期间,菌种处于停滞期;从4 h开始OD600nm值增长速率加快,菌种生长进入对数期。到8 h后OD600nm值虽仍有上升趋势,但非常缓慢,说明菌种已经逐渐进入稳定期。故选择培养8~13 h的菌体作为冻干保护剂筛选的研究对象。
2.2 单因素试验
保护剂效果可能与保护剂类型有关,渗透型的保护剂被认为是最理想的保护剂,如甘油既能透过细胞壁也能透过细胞膜,对菌体的保护效果明显。而仅能通过细胞壁不能穿过细胞膜(如多糖等)效果次之[17]。本试验选用9种保护剂,不同冻干保护剂下菌体细胞存活率计算结果见表2。
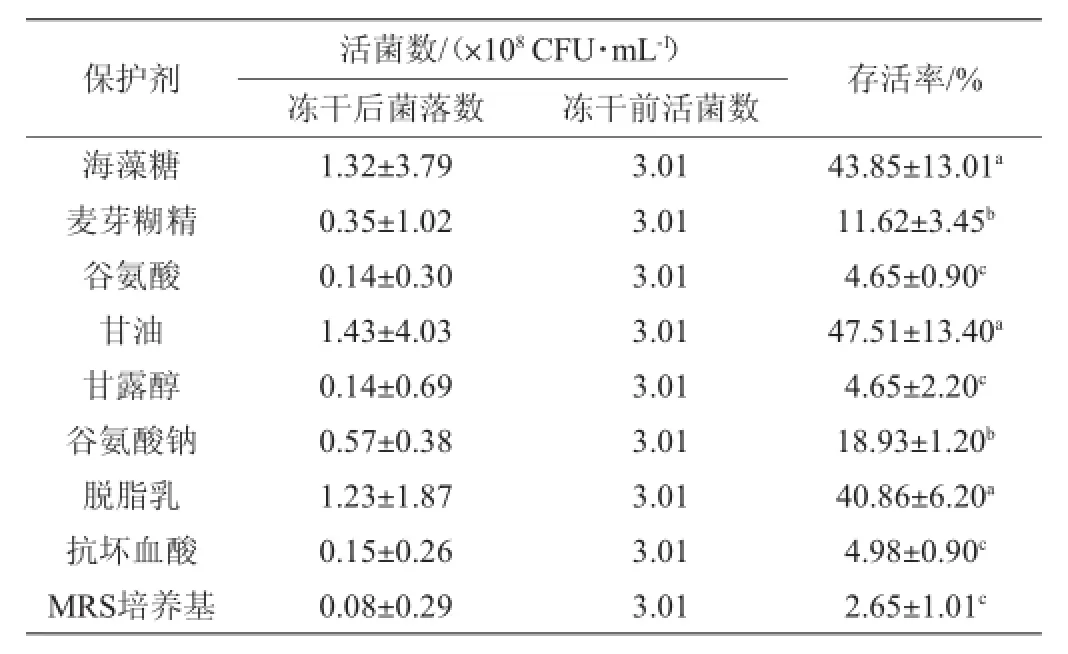
表2 不同冻干保护剂下存活率(n=4)Table 2 Cell survival rate under different cryoprotectants(n=4)
由表2可知,海藻糖、甘油和脱脂乳对菌体保护效果最佳,菌体细胞存活率分别为43.85%、47.51%和40.86%。3种保护剂对菌体保护效果之间无显著性差异(P>0.05)。而其他6种保护剂对菌体保护效果次之(P<0.05)。
2.3 正交试验
为了使菌体细胞在冷冻干燥过程中达到最大存活率,仅使用单一的保护剂难以达到预期的保护效果,采用复配保护剂可以在冷冻过程中各自发挥作用,又能发挥协同作用,对菌体的保护效果较理想,为确定最优的保护剂配方,对海藻糖、甘油、脱脂乳和谷氨酸钠进行用量正交试验,得到用量正交试验结果见表3。
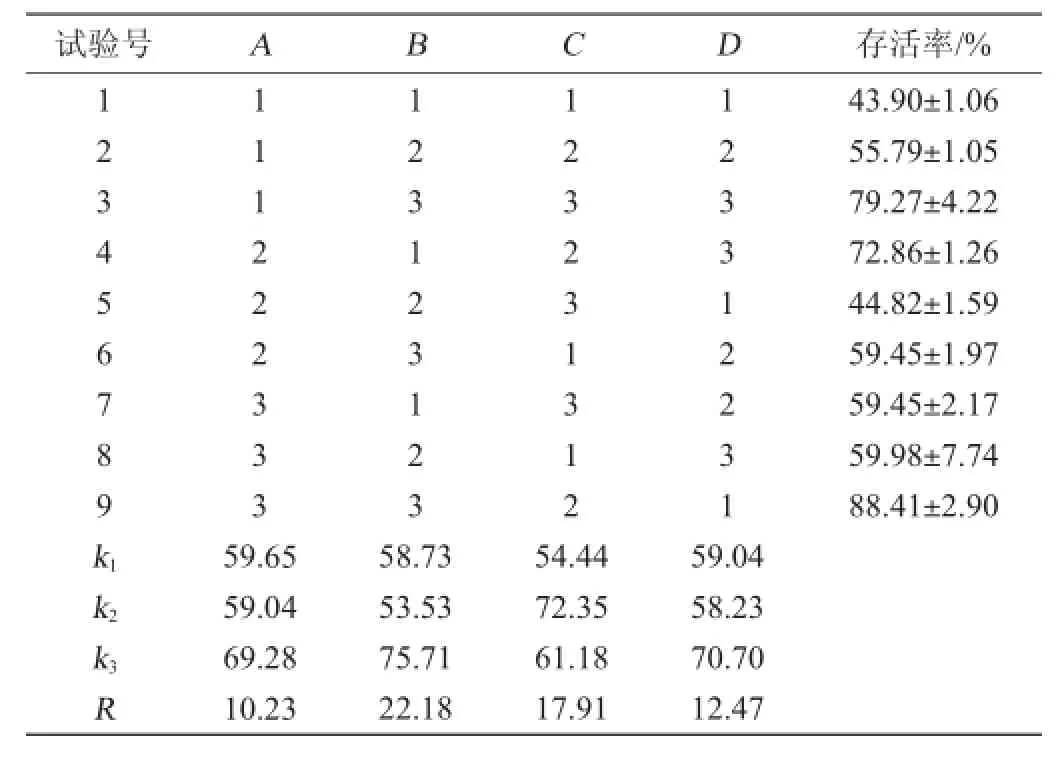
表3 冻干保护剂配方优化正交试验结果与分析Table 3 Results and analysis of orthogonal experiments for cryoprotectants formula optimization
由表3可知,海藻糖、谷氨酸钠、甘油和脱脂乳4种冻干保护剂的极差分别为10.23、22.18、17.91、12.47,说明4种保护剂对细菌冻干前后存活率的影响大小依次为谷氨酸钠>甘油>海藻糖>脱脂乳。根据冻干后的菌体细胞存活率可得,最佳保护剂配方为海藻糖60 g/L、谷氨酸钠20 g/L、甘油20 g/L、脱脂乳150 g/L。在此最佳条件下,菌体细胞存活率可达88.41%。
海藻糖由于具有多个羟基,能与菌体表面的自由基结合,避免菌体暴露在介质中,同时可与蛋白质形成氢键取代水,维持蛋白质的稳定性[18];脱脂奶粉主要是在菌体表面形成保护层[19];甘油和谷氨酸钠能渗透到细胞内部,使结合水的能力更强,抑制过度失水,防止细胞在冷冻过程中冰晶的形成[19]。而不同菌种最适的保护剂是不同的,复合保护剂体系中每种成分在冷冻干燥过程中都发挥各自的作用,所以,相比于单一的保护剂,以一定比例复配的保护剂效果更好。
2.4 扫描电镜验证最优保护剂配方
为确定最优保护剂配方的保护效果,嗜热链球菌M5-5添加保护剂冻干前后菌体的形态进行观察,结果见图2。

图2 冻干保护剂对细菌细胞形态的影响Fig.2 Effect of cryoprotectants on bacterial cell morphology
由图2可知,未加保护剂组的菌体细胞相互黏连,细胞不完整,可能是由于细胞膜破坏造成的,加入复配保护剂后,菌体细胞完整性较好,表面光滑,结果表明,添加保护剂能有效地保证在冻干过程中细胞膜仍保持渗透系统和细胞膜的完整性,避免细胞内容物的流出而导致细胞死亡[20]。
3 结论
本试验研究了不同冻干保护剂对嗜热链球菌M5-5的存活率和形态的影响。结果表明:相比于其他6种保护剂,海藻糖、甘油和脱脂乳对菌体的保护效果更显著,冻干后菌体存活率分别为43.85%、47.51%和40.86%。正交试验结果表明,冻干保护剂的最佳配方为海藻糖60 g/L、谷氨酸钠20g/L、甘油20g/L、脱脂乳150g/L,此时嗜热链球菌M5-5冻干后菌体存活率可达88.41%。扫描电镜观察结果显示,优化后的复合保护剂配方对嗜热链球菌M5-5的菌体形态和生物膜均有良好的保护作用。
[1]LAURENT B,PIERRE B,FRANCOIS G,et al.MutantLactobacillus bulgaricusstrains free from beta-galactosidase activity:US,7563436 [P/OL].2009-07-21.
[2]周晓莹,陈晓琳.乳酸菌的益生作用及其应用研究进展[J].中国微生物杂志,2011,23(10):946-949.
[3]HANSEN E B.Commercial bacterial starter cultures for fermented foods of the future[J].Int J Food Microbiol,2002,78(1):119-131.
[4]CARVALHO A S,SILVA J,HO P,et al.Survival of freeze-driedLactobacillus plantarumandLactobacillus rhamnosusduring storage in the presence of protectants[J].Biotechnol Lett,2002,24(19):1587-1591.
[5]徐致远,刘荣,郭本恒,等.保护剂在乳酸菌冻干过程中的应用[J].乳业科学与技术,2006,29(4):155-165.
[6]ZDENEK H.Protectants used in the crypreservation of microorganisms [J].Cryobiology,2003,46:205-229.
[7]HIDAKA M,FUSHINOBU S,OHTSU N,et al.Trimeric crystal structure of the glycoside hydrolase family 42 beta-galactosidase fromThermus thermophilusA4 and the structure of its complex with galactose[J].J Mol Biol,2002,322(1):79-91.
[8]ZHAN Y,XU Q,YANG M M,et al.Screening of freeze-dried protective agents for the formulation of biocontrol strains,Bacillus cereusAR156, Burkholderia vietnamiensisB418 andPantoea agglomerans2Re40[J]. Lett Appl Microbiol,2011,54:10-17.
[9]DONG Y N,LIU X M,CHEN H Q,et al.Enhancement of the hydrolysis activity of beta-galactosidase fromGeobacillus stearothermophilusby saturation mutagenesis[J].J Dairy Sci,2011,94(3):1176-1184.
[10]CHEN W,CHEN H,XIA Y,et al.Production,purification and characterization of a potential thermostable galactosidase for milk lactose hydrolysis fromBacillus stearothermophilus[J].J Dairy Sci,2008,91(5): 1751-1758.
[11]HUBÁLEK Z.Protectants used in the cryopreservation of microorganisms[J].Cryobiology,2003,46(3):205-229.
[12]LIM C M,RAHA A B,HO Y W,et al.Formulation of protective agents for improvement ofLactobacillus salivariusI 24 survival rate subjected to freeze drying for production of live cells in powderized form[J].Food Bioproc Technol,2009,2:431-436.
[13]ZHAO G Q,ZHANG G.Influences of protectants rehydration media and storage on the viability of freeze-driedOenococcus oenifor malolactic fermentation[J].World J Microbiol Biotechnol,2009,25(10): 1801-1806.
[14]王琳.干酪乳杆菌冷冻干燥保护剂筛选及作用机理研究[D].天津:天津科技大学,2011.
[15]刘建丽,郭丽娜,张充,等.嗜酸乳杆菌NX2-6冻干发酵剂的研究[J].食品工业科技,2014,35(23):154-157.
[16]ALINE R,MARIELLE B,CATHERINE B.Cryotolerance ofLactobacillus delbrueckiisubsp.bulgaficusCFLl is influenced by the physiological state during fermentation[J].Int Dairy J,2010,20:792-799.
[17]张光磊.活菌制剂冻干保护剂的研究进展[J].微生物学免疫学进展,2015,43(4):80-84.
[18]蒲丽丽,刘宁.保加利亚乳杆菌冻干保护剂保护作用的研究[J].中国酿造,2010,29(5):46-48.
[19]蒲丽丽,刘宁,张英华,等.乳酸菌冻干保护剂及保护机理的研究进展[J].中国乳业,2005(6):50-52.
[20]焦月华,张爽,黄晓峰,等.青贮饲料用乳酸菌发酵剂冻干保护剂的筛选[J].中国乳品工业,2015,43(8):13-15.
Optimization of cryoprotectant formula forStreptococcus thermophilusM5-5 during freeze-drying
JIAO Lin1,ZHENG Xiaowei2,QU Xiaoyu1,SHEN Tong1,YANG Jie1*
(1.College of Life Science and Technology,Xinjiang University,Urumqi 830046,China; 2.Biotechnology Center,Nutrition and Health Institute,COFCO,Beijing 102209,China)
In order to investigate the effect of different cryoprotectants on cell viability ofStreptococcus thermophilusM5-5 in the process of vacuum freeze-drying,single-factor experiments combining with orthogonal experiments were carried out to optimize protective agents formula based on the cell survival rate ofS.thermophilusM5-5 after vacuum freeze-drying.Results showed that the cell survival rate ofS.thermophilusM5-5 using trehalose,glycerol and skim milk as protective agents was 43.85%,47.51%,and 40.86%,respectively,higher than that using other six protective agents. The optimum protective agents formula forS.thermophilusM5-5 were determined as follows:trehalose 60 g/L,sodium glutamate 20 g/L,glycerol 20 g/L,skim milk 150 g/L,and the cell survival rate ofS.thermophilusM5-5 after vacuum freeze-drying reached 88.41%.Scanning electron microscope results showed that the cell with cryoprotectant addition was intact with smooth surface,which indicated that the well-performed cryoprotectant could effectively reduce the damage on bacterial cells during vacuum freeze-drying.
Streptococcus thermophilus;cryoprotectant;scanning electron microscope
TS202.3
0254-5071(2017)03-0095-04
10.11882/j.issn.0254-5071.2017.03.020
2016-12-05
新疆维吾尔自治区科技兴新项目(2010037B26)
焦琳(1992-),女,硕士研究生,研究方向为乳酸菌发酵剂。
*通讯作者:杨洁(1963-),女,教授,博士,研究方向为功能性食品。月后的存活率与冻干后直接测得的存活率分别是71.3%和72.4%,表现出较好的贮藏稳定性[13]。
乳酸菌是公认的益生菌,在维护人和动物肠道健康、促进体内微生物生态平衡方面起着重要作用。乳酸菌在发酵过程中产生的各种代谢产物能有效改善肠胃功能、增加免疫力、清除自由基。因此,乳酸菌的潜在应用价值使其成为研究的热点[1]。但乳酸菌本身对外界环境的耐受能力差,很难在生产加工和运输过程中保持高活性,从而影响其本身的发酵性能[2],因此保持乳酸菌在生产流通过程中的高活性至关重要,也是未来发酵领域的发展方向[3]。
目前,真空冷冻干燥是有效保存菌种的方法之一[4]。然而在冷冻过程中,细胞内水形成冰晶,会改变细胞内的pH值和离子强度,增加细胞膜的通透性,对细胞造成严重损伤;而且真空干燥过程会加速样品表面水分流失,破坏生物大分子的水保护层,降低细胞生物活性[5]。因此,为了尽可能减小冷冻干燥过程对细胞的损伤,降低乳酸菌的死亡率,延长菌种保藏期[6-8],选择合适的保护剂至关重要。
冷冻保护剂分为非渗透性和渗透性两种。非渗透性保护剂可以在细胞表面形成保护层,而渗透性保护剂则能进入细胞内部与水分子结合,减缓冰晶形成,且减少细胞在干燥过程中的水分流失[9-10]。HUBÃLEK Z[11]研究发现,将非渗透性和渗透性保护剂进行复配可以更有效维持细胞在冷冻干燥过程中的生物活性。LIM C M等[12]研究发现,在冷冻干燥过程中添加脱脂乳和蔗糖后,Lactobacillus salivariusI 24的存活率可达13%和9%;添加2.5%的谷氨酸钠作为保护剂冻干酒类酒球菌(Oenococcusoeni),贮藏6个
