传统酱香大曲与机械化酱香大曲中酵母菌的初步研究
2017-04-07蒋思峡邱树毅邹江鹏陈琳琳罗小叶王晓丹
蒋思峡,邱树毅,邹江鹏,陈琳琳,罗小叶,王晓丹,4*
(1.贵州大学贵州省发酵工程与生物制药重点实验室,贵州贵阳550025;2.贵州大学酿酒与食品工程学院,贵州贵阳550025;3.贵州国台酒业有限公司,贵州仁怀564501;4.贵州大学生命科学学院,贵州贵阳550025)
传统酱香大曲与机械化酱香大曲中酵母菌的初步研究
蒋思峡1,2,邱树毅1,2,邹江鹏3,陈琳琳1,2,罗小叶1,2,王晓丹1,2,4*
(1.贵州大学贵州省发酵工程与生物制药重点实验室,贵州贵阳550025;2.贵州大学酿酒与食品工程学院,贵州贵阳550025;3.贵州国台酒业有限公司,贵州仁怀564501;4.贵州大学生命科学学院,贵州贵阳550025)
采用可培养方法从传统酱香大曲和机械化酱香大曲中分离筛选酵母,并对这些酵母的数量、种类及功能差异进行分析比较。结果表明,机械化酱香大曲中酵母数量为传统酱香大曲的1.44倍;传统酱香大曲中酵母种类为机械化酱香大曲的2倍;相同条件下两者中产酒性能最高的酵母产酒精度在20℃时均为10.2%vol,机械化酱香大曲中筛选得到的酵母菌株平均产酒性能为传统酱香大曲的1.04倍;从产香上看,两种大曲中的产香酵母均能产生醇、酸、酯、酮类挥发性物质。
酱香型;传统大曲;机械大曲;酵母;功能
酱香型白酒属于大曲酒,大曲具有糖化、发酵、生香等作用,原料经自然界的微生物接种、繁殖,在高温堆积及入窖贮存的过程中与环境中的微生物发生复杂的生化反应,为酱香型白酒独特风味形成提供基础[1]。
酱香型大曲传统制曲是将水和母曲加入粉碎的小麦中搅拌,转入木盒,工人站在曲盒中踩曲,制成曲块。这种方法劳动强度大,效率低,因人的体质量和技术有差异,做成的曲块也会有差异[2]。20世纪80年代以来,茅台、泸州老窖、四特酒、会稽山绍兴酒业等酒企用一些简单的机械设备来节约人力[3-7],机械化制曲具有节省人力、效率高、均一性好、节约生产场地等优点。目前酱香型大曲的生产还基本采用传统制曲。2013年贵州国台酒庄有限公司开始研发机械化成套制曲设备,并投入生产使用,降低劳动力强度50%以上,从根本上改善了人工操作凭经验、靠感觉的不确定性,确保了曲块质量的稳定性和食品安全性。
酵母作为大曲微生物区系中最重要的类群之一,其种类和数量的差异,影响着酒质和出酒率[8]。酵母在白酒酿造过程中除了表现出很强的酒精生成能力,还可以产生酯类、醇类、酮类、烯类、酚类等挥发性化合物[9]。对于传统大曲和机械大曲的质量,主要集中在曲块外观、理化指标、微生物数量等方面的比较研究上,对两者微生物类群结构及功能研究还尚未见报道[5-7]。因此对传统大曲和机械大曲中的酵母进行比较研究具有重要意义。
本研究对酱香型传统大曲和机械大曲中的酵母采用可培养方法进行分离筛选,对酵母的数量、种类及功能差异进行分析比较,探讨酵母类群结构,为提高机械化制曲的大曲品质提供理论支持。
1 材料与方法
1.1 材料与试剂
1.1.1 大曲样品来源
GT01:贵州国台酒庄有限公司生产车间储存6个月大曲,采用自主研发的机械化制曲方式生产。
GT02:贵州国台酒业集团有限公司生产车间储存6个月大曲,采用酱香型高温大曲的传统制曲工艺生产。
两种大曲在制酒生产前将大曲曲块粉碎成曲粉,在曲粉的存放处随机20个点取样,混合均匀,保证其微生物种类的多样性和均匀性,样品4℃冰箱保存。
1.1.2 主要试剂
酵母基因组DNA提取试剂盒:美国Biomiga公司;脱氧核糖核苷三磷酸(deoxy ribonucleoside triphosphate,dNTP)、TaqDNA聚合酶:北京天根生物技术有限公司;糖化酶(5000U/g):湖南鸿鹰祥生物工程有限公司。其他试剂均为国产分析纯和生化试剂。
1.1.3 培养基
孟加拉红琼脂培养基、马铃薯琼脂(potatodextroseagar,PDA)培养基、麦芽汁琼脂(malt extract agar,MEA)培养基、麦芽汁液体培养基:上海博微生物科技有限公司。
酵母浸出粉胨葡萄糖(yeast extract dextrose medium,YEPD)液体培养基:酵母膏1%,蛋白胨2%,葡萄糖2%。115℃灭菌20 min。
产酒初筛培养基:
上层培养基采用红四氮唑培养基:红四氮唑(2,3,5-triph enyltetrazoliumchloride,TTC)0.05g,葡萄糖0.5g,琼脂1.5g,蒸馏水100mL。(将未加入TTC的培养基灭菌后冷却至50℃左右,再加入TTC溶液)。
下层培养基采用YEPD固体培养基:酵母膏1%,蛋白胨2%,葡萄糖2%,琼脂2%。115℃灭菌20 min。
产酒复筛培养基(葡萄糖发酵培养基):葡萄糖200g/L,酵母膏10 g/L,(NH4)2SO41 g/L,KH2PO41 g/L,MgSO4·7H2O 1 g/L,115℃灭菌30 min。
产香培养基(高粱-小麦培养基):将小麦全部粉碎,高粱整粒和碎粒比为3∶1(g∶g),高粱和小麦比1∶1(g∶g),混匀,加入60%左右95℃水润粮5 h,按200 U/g淀粉加入糖化酶,60℃糖化2 h,装瓶,115℃灭菌20 min[12]。
生理生化实验培养基,参考《酵母菌的特征与鉴定手册》等[10-11]。
1.2 仪器与设备
YS100光学显微镜:日本尼康公司;50/30 μm DVB/ CAR/PDMS萃取头、手动SPME进样器:美国Supelco公司;HP7890/5975C气相色谱-质谱(gas chromatograph mass spectrometer,GC-MS)联用仪:美国Agilent公司;Sorvall ST16R高速冷冻离心机:美国Thermo公司;Flex cycler多功能PCR仪:德国耶拿分析仪器股份公司。
1.3 实验方法
1.3.1 酱香大曲的理化指标测定
参见国标QBT4257—2011《酿酒大曲通用分析方法》[13]。
1.3.2 酵母菌的计数及分离筛选
分别称取10 g样品至加有玻璃珠的90 mL无菌生理盐水的三角瓶中,160 r/min振荡30 min,分别按10-1、10-2、10-3、10-4、10-5的梯度稀释,各梯度取1 mL菌液在孟加拉红琼脂培养基上进行和倾注培养和平板涂布,每个梯度3个平行,28℃培养箱培养2 d,选择菌落数在30~300个之间的倾注平板进行计数。挑取涂布平板上典型酵母菌落在PDA培养基平板上划线纯化,将纯化后的菌种编号,接种于MEA培养基试管斜面28℃培养3 d后4℃保藏。
1.3.3 酵母菌的单菌落形态、细胞形态鉴定以及生理生化鉴定
参照《酵母菌的特征与鉴定手册》进行[10]。
1.3.4 酵母菌的分子生物学鉴定
挑取酵母菌单菌落接种到30mLYEPD液体培养基中,28℃、160 r/min条件下摇床培养24 h,吸取1 mL菌悬液,采用Biomiga公司的酵母DNA基因组试剂盒提取DNA。聚合酶链式反应(polymerase chain reaction,PCR)扩增采用酵母序列通用引物NL1(5′-GGTCCGTATTTCAAGACG-3′)和NL4(5′-GGTCCGTATTTCAAGACGG-3′)。
PCR反应体系(25μL体系):primer1和primer2各1μL,DNA模板2μL,ddH2O8.5μL,Mix12.5μL。PCR反应程序:94℃预变性5 min,94℃变性30 s,55℃退火45 s,72℃延伸1 min,35个循环反应,最后72℃继续延伸10 min。
引物对合成及PCR产物测序由上海立菲生物技术有限公司完成,测序结果在GenBank数据库中进行同源序列搜索(BLAST search,http://blast.ncb-i.nlm.nih.gov/Blast.cgi),选取同源性较高的菌株的26S rDNA D1/D2区域序列作为参比对照[14],用MEGA5.05软件构建系统发育树[15]。
1.3.5 产酒酵母的一级筛选
酵母菌在YEPD固体培养基上纯化,28℃培养2d,然后倾入50℃左右的TTC上层培养基,28℃条件下避光保存2h,观察菌落颜色变化。选取颜色较深的菌株进行产酒实验[16]。
1.3.6 产酒酵母的二级筛选
将上述颜色较深的酵母,挑取单菌落接入20mLYEPD液体发酵培养基中,28℃、160 r/min摇床培养28 h,再按体积分数5%接种至140 mL发酵培养基中,28℃发酵8 d,记录CO2总质量损失,测定20℃时酒精度(%vol)及残糖含量(g/100 g)[17]。
1.3.7 酒精含量测定
取100 mL发酵液和50 mL蒸馏水于装有数粒玻璃珠的蒸馏瓶,蒸馏,收集100 mL馏出液,控制蒸馏时间在30~40 min以内。用酒精浓度计记录此时的刻度即酒精浓度,同时测定温度,按照酒精温度与浓度换算表,换算成20℃时的酒精度(%vol)[18]。
1.3.8 CO2质量损失测定
在发酵前测定三角瓶和发酵液的总质量,发酵开始后定期测量三角瓶和发酵液总质量。当12 h内质量损失小于0.1 g时即可认为发酵结束,此时的总质量损失即可认为发酵过程中CO2的总质量损失。
1.3.9 残糖含量测定
参见国标GB/T 5009.7—2008《食品中还原糖的测定》中的直接滴定法[19]。
1.3.10 酵母菌株的固态发酵[12,19]
挑取活化后的酵母菌株,接入50 mL麦芽汁液体培养基中,28℃、160 r/min摇瓶培养36 h,将菌悬液按质量浓度4g/100mL的比例接入盛有50g产香培养基,28℃固态发酵7 d,对发酵后样品的酯味(10分)、酸味(10分)、酒味(10分)进行评定,总分(30分),气味强度按照数字1~10逐渐升高,可接受性数值越高接受性越强[20]。邀请10位专业人员对样品的酯、酸、酒味及总体可接受性评分,筛选出感官评定总体可接受性评分较高的菌株样品。
1.3.11 挥发性成分分析
采用顶空固相微萃取(headspace solid-phase microextraction,HS-SPME)技术对菌株固态发酵样品的挥发性成分进行萃取,然后采用气相色谱-质谱联用(GC-MS)技术对挥发性成分进行分析检测。
HS-SPME条件:菌株固态发酵样品在60℃下,用50/30 μm DVB/CAR/PDMS Supelco纤维头,手动SPME进样器,顶空萃取40 min。
GC条件:DB-CP97723A色谱柱,载气为He(99.999%),载气流速为1mL/min;程序升温:起始温度40℃,保持5min,以5℃/min升温至200℃,并保持9 min;不分流进样;溶剂延迟时间:2 min。
MS条件:离子源为电子电离(electronic ionization,EI)源;离子源温度230℃;四极杆温度150℃;电子能量70 eV;发射电流34.6 μA;倍增器电压1 125 V;接口温度280℃;质量范围20~450 u。以峰面积定量。
2 结果与分析
2.1 酱香型大曲理化指标对比
两种酱香型大曲理化指标测定结果见表1。

表1 酱香型大曲理化指标对比Table 1 Physical and chemical indexes comparison of sauce-flavorDaqu
由表1可知,采用两种工艺操作制得的大曲理化指标均符合制曲标准,GT02的水分、淀粉含量、酸度高于GT01,糖化力小于GT01。大曲的水分和大曲成型力度有关,机械方法比人工踩曲受力更均匀,压力更大,使得机械曲曲料间的间隙较传统曲小,这些原因可能导致机械曲的水分低于传统曲;大曲的酸度差异在于产酸微生物的数量及功能差异比如醋酸菌、乳酸菌的差异,这些微生物的数量也与大曲水分相关;淀粉含量和糖化力有关,GT01的糖化力高于GT02,故GT01中剩余淀粉量低于GT02。
2.2 酵母菌的计数、分离筛选及鉴定
采用平板稀释涂布法,从GT01中分离筛选到9株酵母,将这些菌株按FBKL2.0200—FBKL2.0208编号;从GT02中分离筛选到12株酵母,将这些菌株按FBKL2.0209—FBKL 2.0220编号。
通过这些酵母菌株在PDA培养基上的单菌落形态图、1 000×光学显微镜下镜检图和细胞显微形态,进行了形态学和生理生化鉴定,菌株鉴定结果及来源见表2。

表2 酵母菌株形态学及生理生化鉴定结果Table 2 Morphologic,physiological and biochemical identification results of yeast strains
计数得到GT01酵母菌数为(4.71±0.11)×104CFU/g,GT02酵母菌数为(3.28±0.13)×103CFU/g。传统认为高温大曲中酵母数量较少,现在通过聚合酶链式反应-变性梯度电泳技术对中国白酒微生物群落结构的分析得知,在成品高温大曲中仍存在大量酵母[21]。可能是在高温制曲过程中,多数酵母死亡,但依然有部分酵母处于存活或休眠状态,且成品曲出房后储存在常温下,可以继续网络环境中的酵母,因而导致成品曲粉中酵母数量较多。酵母的数量与大曲的水分有关[7],水分含量高会使产酸微生物数量增加,这些微生物的生长会在一定程度上抑制酵母的数量,所以可能导致了GT02中的酵母数量低于GT01。由表2可知,GT01中酵母的种类少于GT02,由于GT01生产的曲块全程机械化生产,许多微生物在环境中还没有稳定,GT02是传统制曲工艺,在长期的制曲环境中已经经过选择形成稳定的菌群,在制曲过程中通过传统工人操作也会被带入大曲的大量微生物,所以这些原因可能导致GT01与GT02中酵母种类上的差异。
2.3 酵母菌的分子生物学鉴定
测序结果在GenBank数据库中搜索,同源性均≥99%,MEGA5.05软件构建系统发育树,结果见图1。GT01和GT02中酵母种类维恩图见图2。
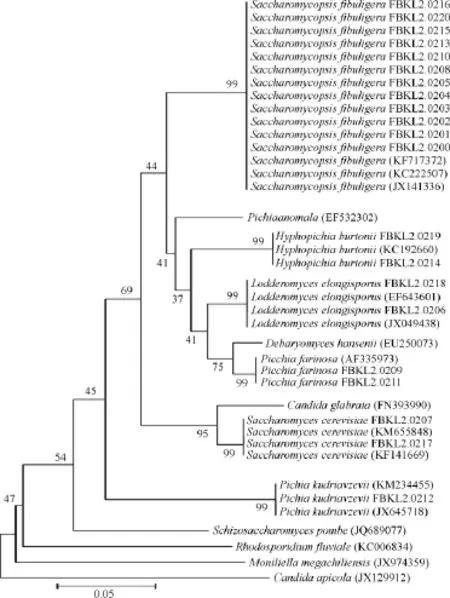
图1 酵母菌株系统发育树Fig.1 Phylogenetic tree of yeast strains
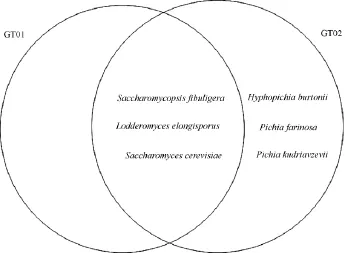
图2 GT01和GT02中酵母种类维恩图Fig.2 Yeast classies Venn diagram in GT01 and GT02
结合酵母菌的形态学、生理生化和分子生物学鉴定,确定GT01中筛选出来的酵母共有3种:扣囊复膜酵母(Saccharomycopsis fibuliqura)、酿酒酵母(Saccharomyces cerevisiae)、长孢娄德酵母(Lodderomycese longisporus);GT02中筛选出来的酵母共有6种:扣囊复膜酵母(Saccharomycopsisfibuliqura)、酿酒酵母(Saccharomycescerevisiae)长孢娄德酵母(Lodderomyces elongisporus)、伯顿毕赤酵母(Hyphopichia burtonii)、粉状毕赤酵母(Pichia farinosa)、库德里阿兹威氏毕赤酵母(Pichia kudriavzeviil)。
扣囊复膜酵母(S.fibuliqura)大量存在于酸性潮湿的环境,为大曲上霉主要微生物,和酿酒酵母(S.cerevisiae)一样在白酒成品曲中广泛存在,具有较好的产酒和产香能力[22-23]。毕赤酵母属(Pichiasp.)也属于大曲中的常见酵母属[24],从酱香白酒酒醅中筛选出来的库德里阿兹威氏毕赤酵母(P.kudriavzeviil)具有高产乙酸苯乙酯的能力,对白酒有增香作用[25],这种酵母对葡萄糖、酒精度、pH值具有较高耐受性,也用来作为果酒发酵专用菌种[26];粉状毕赤酵母(P.farinosa)具有高产甘油的能力[27]。伯顿毕赤酵母(H.burtonii)可能在大曲中对白酒香味的形成有影响[28]。从浓香型白酒酒窖中筛选出的长孢娄德酵母(L.elongisporus)具有高产β-葡萄糖苷酶的能力,在葡萄酒酿造过程中与其余酵母混菌发酵时能够明显提高葡萄酒的香气感官品质[29],粉状毕赤酵母(P.farinosa)和长孢娄德酵母(L.longisporus)这两种酵母的功能虽然目前在酱香型白酒酿造过程中还未见报道,但是它们产生的代谢产物和胞外酶等在一定程度上能提高白酒风味的复杂性[30],随着人们对白酒酿造微生物认识的不断深入,这类酵母在酱香型白酒酿造中的具体功能将逐渐被揭示。
2.4 酵母菌的产酒功能

表3 TTC培养基上的显色反应结果Table 3 Chromogenic reaction results in TTC medium
TTC是一种无色显色剂,能和酵母细胞中的还原性脱氢物质发生显色反应,因此可以根据酵母菌株在TTC培养基上的显色程度,初步判定酵母呼吸酶活力的大小,即酵母产酒精能力的大小[31]。呼吸酶活力较强的菌株显色较深,即显色较深的酵母菌株产酒精能力较强[32]。酵母菌株在TTC培养基上显色反应结果如表3所示。
通过显色反应,选择表3中颜色为玫红色、深玫红、深红色的17株酵母菌株进行产酒复筛实验,以市售安琪酵母菌株为对照组进行实验,以发酵8d后的CO2质量损失,20℃时的酒精度和残糖含量为参考指标,对这些酵母的产酒性能进行进一步的比较,结果见图3。
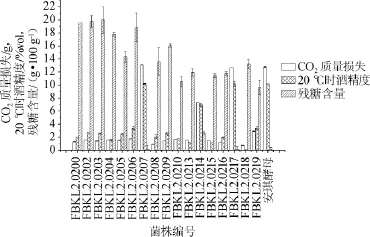
图3 不同菌株的CO2质量损失、20℃时酒精度及残糖含量分析Fig.3 Analysis of CO2weightloss,alcohol content at 20℃and residual sugar content of different strains
从图3可以看出,GT01中筛选出来的产酒精度最高的酵母菌株为FBKL2.0207,发酵8 d后,发酵液残糖含量为(1.10±0.6)g/100 g,CO2质量损失为(13.06±0.02)g,20℃时酒精度为(10.2±0.1)%vol;GT02中筛选出来的产酒精度最高的酵母菌株为FBKL2.0217,发酵8 d后,发酵液残糖含量为(1.10±0.4)g/100 g,CO2质量损失为(12.68±0.01)g,20℃时酒精度为(10.2±0.4)%vol;这两株酵母都为酿酒酵母(S.cerevisiae)。对照组市售安琪酵母菌株,发酵8 d后,发酵液残糖含量为(0.7±0.3)g/100 g,CO2质量损失为(12.87±0.09)g,20℃时酒精度为10.2%vol;与对照组相比,两者中的其余菌株产酒性能均较弱。通过计算GT01和GT02中进行产酒复筛实验的菌株在20℃时产酒精度平均值,发现GT01中筛选出的菌株的平均产酒性能为GT02的1.04倍。两者中产酒精度最强的菌株在相同条件下产酒精度基本一致。总体来看GT01中酵母菌株的产酒精度较强。
2.5 酵母菌的产香功能
酵母菌株经固态发酵后的产物,以酯味(10分)、酸味(10分)、酒味(10分)、总分(30分)为评定指标,邀请10位专业人员进行感官评定,感官评定结果见表4。

表4 菌株固态发酵产物感官评定结果Table 4 Sensory evaluation results of product from strains with solid state fermentation
根据表4的感官评定结果,可以看出大曲中筛选出来的不同种属的酵母产香能力各异,同种属酵母间产香功能差异不大。选择感官评定总体评分≥15分的菌株作为产香优势菌株,将它们的固态发酵产物经HS-SPME后进行GC-MS分析检测,对总离子流图中的各峰经质谱计算机数据系统检索及核对Nist2005和Wiley275标准质谱图,确定挥发性化学成分,用峰面积归一化法测定了各化学成分的相对百分含量,筛选出来的优势菌株FBKL2.0207、FBKL2.0211、FBKL2.0217固态发酵产物挥发性成分的相对含量结果如图4所示。
由图4可知,在菌株FBKL2.0207固态发酵产物挥发性香气成分中检测到醇类物质5种,相对含量总和为37.356%;酯类物质6种,相对含量总和为17.453%;酮类物质1种,相对百分含量为0.603%;酸类物质2种,相对含量总和为13.167%;烯类物质1种,相对含量为1.101%。其中带有水果香气的挥发性物质相对含量为17.526%,带甜味的挥发性物质相对含量为16.645%,带有芳香气味的挥发性物质的相对含量为1.101%,带有奶油香气味的挥发性物质的相对含量为0.603%,带酸味的挥发性物质的相对含量为11.261%,带有愉快的玫瑰香气的物质相对含量为17.788%。
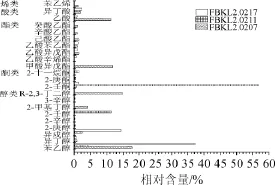
图4 产香优势菌株挥发性成分相对含量Table 4 Relative content of volatile components of aroma-producing superiority strains
在菌株FBKL2.0211固态发酵产物挥发性香气成分中检测到醇类物质6种,相对含量总和为18.252%;酮类物质3种,相对含量总和为58.479%;酸类物质2种,相对含量总和为2.306%。其中带有水果香气的挥发性物质相对含量为5.943%,具有芳香气味的挥发性物质的相对含量为0.1%,带有草药香味挥发性物质的相对含量为0.7%,带有青草香气味的挥发性物质相对含量为0.232%,带有蜡香气味的挥发性物质相对含量为11.322%,带有奶油香气味的挥发性物质相对含量为56.654%,带酸味的挥发性物质相对含量为0.534%,带有愉快的玫瑰香气的挥发性物质含量为4.086%。
在菌株FBKL2.0217固态发酵产物挥发性香气成分中检测到醇类物质4种,相对含量总和为38.821%;酯类物质3种,相对含量总和为17.092%;酮类物质2种,相对含量总和为1.416%;酸类物质1种,相对含量为0.802%。其中带有水果香气的挥发性物质相对含量为17.797%,带甜味的挥发性物质相对含量为1.751%,带有草药香味的挥发性物质相对含量为1.051%,带有奶油香气味的挥发性物质相对含量为1.264%,带酸味的挥发性物质相对含量为0.802%,带有愉快的玫瑰香气的挥发性物质含量为37.119%。
综上,两种大曲中的产香酵母均能产生醇、酸、酯、酮类挥发性物质。挥发性化合物在白酒风味中扮演着重要的角色,这些挥发性化合物一些来自原料老熟过程,但主要为酵母在发酵过程中代谢产生[33]。酱香型白酒的风味与挥发性成分所占比例密切相关,这些成分之间相互协调的比例,才使酱香型白酒具有了独特的风味。
3 结论
GT01中酵母菌的数量为GT02的1.44倍,GT02中的酵母种类为GT01的2倍;两个大曲中同时存在的酵母属有复膜孢酵母属(Saccharomycopsissp.)、娄德酵母菌属(Lod deromycessp.)、酵母属(Saccharomycessp.)。两种大曲中数量最多的酵母均是扣囊复膜酵母(S.fibuligera)。GT01和GT02中产酒精度最高的两株菌均为酿酒酵母(S.cerevisiae),且在相同条件下两株菌的产酒精度相同。从产酒精度平均值水平上看,GT01中筛选出来的酵母菌株的产酒功能为GT02的1.04倍。从产香上看,两种大曲中的产香酵母均能产生醇、酸、酯、酮类挥发性物质。通过对GT01和GT02中酵母菌的初步研究,可以看出两者各有优劣,科学技术的发展创新,可使机械大曲逐步改良优化使其性能更接近于传统大曲,同时结合机械化生产节省人力物力,降低成本的优点,未来大规模的机械化生产在保证大曲质量的前提下,还能提高企业生产效率和经济效益。
[1]杨国华,邱树毅,黄永光.酱香白酒生产中产香微生物研究[J].中国酿造,2011,30(4):24-27.
[2]付捷,王瑛,罗钢.一种新型酒厂制曲压块机[J].包装与食品机械,2006(4):46-47.
[3]周剑丽,黄平,杨国华,等.麸曲酱香白酒自动化通风制曲技术的应用及工艺总结[J].中国酿造,2016,35(9):138-140.
[4]沈才洪,许德富.中国白酒必将步入制曲专业化道路[J].酿酒,2003(4):5-6.
[5]严楠峰.兼香型白云边酒不同工艺高温大曲差异性分析[D].武汉:华中农业大学,2013.
[6]李超,穆林,王建耀,等.汾型大曲的理化指标和微生物指标分析[J].中国酿造,2009,28(1):140-142.
[7]边佳娜.黄酒手工制曲与机械化制曲工艺之比较[J].江苏调味副食品,2007,24(6):33-34.
[8]WU Q,CHEN L Q,XU Y.Yeast community associated with the solid state fermentation of traditional Chinese Maotai-flavour liquor[J].Int J Food Microbiol,2013,166(2):323-330.
[9]WU Q,XU Y,CHEN L.Diversity of yeast species during fermentative process contributing to Chinese Maotai-flavour liquor making[J].Lett Appl Microbiol,2012,55(4):301-307.
[10]巴尼特,佩恩·亚罗.酵母菌的特征与鉴定手册[M].青岛:青岛海洋大学出版社,1991:50-57.
[11]王小红,徐康,赵山,等.孝感凤窝酒曲中酵母菌的分离及特性研究[J].现代食品科技,2008,24(2):134-137.
[12]沈怡方.白酒生产技术全书[M].北京:中国轻工业出版社,2013:20-25.
[13]中华人民共和国轻工行业.QB/T 4257—2011《酿酒大曲通用分析方法》[S].北京:中国标准出版社,2011.
[14]惠丰立,柯涛,褚学英,等.大曲中酵母菌种群结构及多样性分析[J].食品与生物技术学报,2009,28(1):102-106.
[15]TAMURA K,DUDLEY J,NEI M,et al.MEGA4:Molecular evolutionary genetics analysis(MEGA)software version 4.0[J].Molecul Biol Evol,2007,24(8):1596-1599.
[16]余婷婷,赖世强,曹文涛,等.酱香型白酒高温堆积糟醅中耐高温产香酵母的筛选及鉴定[J].贵州职教论坛,2015(2):15-18.
[17]刘庆军.新疆野生酵母的耐受性、发酵特性及生产适用性研究[D].济南:山东轻工业学院,2009.
[18]郜希璐.白酒窖泥中酵母菌的分离鉴定及发酵特性研究[D].天津:天津大学,2009.
[19]中华人民共和国轻工行业.GB/T 5009.7—2008《食品中还原糖的测定》[S].北京:中国标准出版社,2008.
[20]庞博,王晓丹,魏燕龙,等.金沙窖酒酒醅中产香酵母分离与鉴定[J].中国酿造,2014,33(12):42-46.
[21]高亦豹.聚合酶链式反应—变性梯度电泳技术(PCR-DGGE)研究中国白酒大曲中微生物群落结构[D].无锡:江南大学,2010.
[22]MACHIDA M,OHTSUKII,FUKU S,et al.Nucleotide sequences of Saccharomycopsis fibuligeragene for extracellular beta-glucosidases as expressed inSaccharomyces cerevisiae[J].Appl Environ Microbiol, 1988,54(12):3147-3155.
[23]冯薇,段绪果.面包酵母研究进展[J].化工时刊,2008(7):42-45.
[24]张亚丽.贵州省仁怀地区茅台空气微生物的鉴定与分离[D].北京:北京化工大学,2014.
[25]王晓丹,庞博,陈孟强,等.酱香白酒酒醅中产香酵母分离与鉴定[J].食品安全质量检测学报,2014,5(6):1799-1808.
[26]郝瑶,王陶,李文,等.富硒猕猴桃果酒酵母的筛选及鉴定[J].食品科学,2014,35(21):175-179.
[27]乔代蓉,曹毅,魏亮,等.产甘油酵母菌株的分离与鉴定[J].四川大学学报:自然科学版,2003,40(5):986-989.
[28]谭淑君,蒋爱民,刘慧君.伯顿毕赤酵母菌对混合奶酪成熟期间蛋白质降解的影响[J].食品与发酵科技,2015,51(5):10-13.
[29]牟含.川南白酒酿造环境中葡萄酒增香酿造酵母菌株的筛选[D].杨凌:西北农林科技大学,2015.
[30]HIERRO N,GONZALEZ A,MAS A,et al.Diversity and evolution of non-Saccharomycesyeast populations during wine fermentation:effect of grape ripeness and cold maceration[J].Fems Yeast Res,2006,6(1): 102-111.
[31]陆栋.重离子束辐照酵母菌种选育及诱变机理研究[D].北京:中国科学院,2010.
[32]王梅,张彭湃,帅桂兰,等.TTC在黄酒酵母选育中的应用[J].酿酒,2001(5):62-64.
[33]CHEN S,XU Y.The Influence of yeast strains on the volatile flavour compoundsofChinesericewine[J].J Inst Brew,2010,116(2):190-196.
Preliminary studies on yeasts from sauce-flavorDaqumade by traditional and mechanical methods
JIANG Sixia1,2,QIU Shuyi1,2,ZOU Jiangpeng3,CHEN Linlin1,2,LUO Xiaoye1,2,WANG Xiaodan1,2,4*
(1.Guizhou Provincial Key Laboratory of Fermentation Engineering and Biological Pharmacy,Guizhou University,Guiyang 550025,China; 2.School of Liquor and Food Engineering,Guizhou University,Guiyang 550025,China;3.Guizhou Guotai Distillery Co.,Ltd.,Renhuai 564501,China;4.College of Life Sciences,Guizhou University,Guiyang 550025,China)
The yeasts were screened and isolated from sauce-flavorDaqumade by traditional and mechanical methods.The quantity,species and functional differences of yeasts were analyzed and compared.Results showed that the quantity of yeasts in mechanical-madeDaquwas 1.44 times than that in traditional-madeDaqu;but the yeasts species in traditional-madeDaquwas 2 times than that in the mechanical-madeDaqu.In the same condition,the alcohol content of the highest performance yeast by both methods at 20℃were 10.2%vol,the alcohol production capacity of yeasts screened from mechanical-madeDaquwas 1.04 times than that from traditional-madeDaquin average.In aroma-producing aspect,bothDaqucan produce alcohols,acids,esters and ketones.
sauce-flavor;traditional-madeDaqu;mechanical-madeDaqu;yeast;function
TS261.1
0254-5071(2017)03-0059-07
10.11882/j.issn.0254-5071.2017.03.013
2016-10-17
贵州省科技支撑计划项目(黔科合支撑[2016]2340);贵州省工业攻关项目(黔科合GZ字[2014]3012);贵州省重大专项项目(黔科合重大专项字[2015]6012)
蒋思峡(1993-),女,硕士研究生,研究方向为微生物与发酵技术。
*通讯作者:王晓丹(1980-),女,高级实验师,博士,研究方向为应用生物技术。
