塔城地区酸马奶中耐乙醇乳酸菌的筛选与鉴定
2017-04-07金丹蒋彩虹蒋艾廷乔传丽郭金凤卢士玲李宝坤
金丹,蒋彩虹,蒋艾廷,乔传丽,郭金凤,卢士玲,李宝坤*
(石河子大学食品学院,新疆石河子832000)
塔城地区酸马奶中耐乙醇乳酸菌的筛选与鉴定
金丹,蒋彩虹,蒋艾廷,乔传丽,郭金凤,卢士玲,李宝坤*
(石河子大学食品学院,新疆石河子832000)
以新疆塔城地区酸马奶为研究对象,采用传统方法初步筛选出乳酸菌共53株,通过生理生化试验,确定有乳酸杆菌24株,乳酸球菌29株,以不同体积分数乙醇溶液进行胁迫12 h。结果表明,乙醇对菌株的生长有抑制作用,筛选出对乙醇耐受性较强的菌株,其中菌株S7-1、S7-2、SMN3-3、SMN10-1、SNT16可耐受体积分数13%的乙醇胁迫。通过总DNA序列分析,确定菌株SMN3-3为副干酪乳杆菌(Lactobacillus paracasei),菌株SMN10-1为鼠李糖乳杆菌(Lactobacillus rhamnosus),菌株S7-1与S7-2为面包乳杆菌(Lactobacillus crustorum),菌株SNT16为乳酸片球菌(Lactobacillus fermentum)。
酸马奶;乳酸菌;筛选;乙醇胁迫;鉴定
酸马奶又被称作“艾日格”或“策格”,是一种以生马奶为原材料[1],由乳酸菌与酵母菌共同发酵而成的历史悠久的发酵乳饮品[2],是哈萨克族与蒙古族等少数民族的传统发酵饮品,且具有一定的保健功能,在日常饮食生活中占据重要地位。乳酸菌是一类能够发酵糖类物质产生乳酸的细菌的统称,其革兰氏染色为阳性,形态多为杆状或球状[3-4]。生产发酵中所需的优良乳酸菌应具有良好的发酵性能和较强的耐受性[5],以确保发酵制品被食用后微生物能够在人体胃肠道中生存,这也是益生乳酸菌发挥其作用的关键所在[6]。
在发酵产品的生产过程中,乳酸菌自身会受到多种不利条件的影响,严重制约其自身的生长代谢能力,进而将会影响乳酸菌功能作用与活性能力的发挥和利用[7]。如高酸、低温、渗透压改变、乙醇浓度影响等,其中,乙醇是在马奶酒正产发酵中最常见的胁迫条件之一[8]。乙醇是一种能够造成细胞膜通透性改变[9]、细胞内物质流失、影响酶活性等的有机溶剂[10]。在菌体生长的过程中,乙醇浓度过高会对菌体的生理活性及其新陈代谢等方面造成不同程度的影响[11]。在对菌体进行胁迫时,不仅要从生理角度了解胁迫机制,更需要从分子生物学方面对其进行研究。目前国内外对乳酸菌乙醇耐受性及其机理的研究较少。
本试验以新疆塔城地区的酸马奶样品为研究对象,采用传统方法对乳酸菌进行初步筛选,通过不同乙醇溶液的胁迫作用,选取最佳耐受菌株,并对其进行总DNA测序分析鉴定,以期为进一步研究乳酸菌微观结构与代谢组学奠定基础。
1 材料与方法
1.1 材料与试剂
酸马奶:分别取自新疆塔城地区奇巴吉尔(简称S)、种羊场(简称SMN)、图尔滚村(简称SNT)农牧民家庭自制。
MRS液体培养基[12-13]:蛋白胨10.0 g,牛肉膏5.0 g,酵母粉5.0 g,葡萄糖20.0 g,吐温80 1.0 mL,磷酸氢二钾2.0 g,乙酸钠5.0 g,柠檬酸三铵2.0 g,硫酸镁0.58 g,硫酸锰0.25 g,蒸馏水1 000 mL,调pH为6.2~6.4,于121℃灭菌20 min。
MRS固体培养基:在MRS液体培养基中加入15 g/L琼脂,121℃灭菌20 min。
无水乙醇(体积分数≥99.7%):天津市富宇精细化工有限公司;细菌基因组总DNA提取试剂盒(离心柱型)、溶菌酶(活力单位>20 kU/mg)、Marker Ι、2×PCR Mixture、ddH2O与EB染液:北京天根生化科技有限公司。
嗜酸乳杆菌(Lactobacillus acidophilus)ATCC4356、嗜热链球菌(Streptococcus thermophilus)ATCC19258、粪肠球菌(Enterococcus faecalis)ATCC 29212:石河子大学食品学院畜产实验室。
1.2 仪器与设备
SW-CJ-2D双人单面洁净工作台:江苏苏洁净化设备有限公司;DNP-9272型电热恒温培养箱:上海精宏实验设备有限公司;XH-C旋涡混合器:金坛市医疗仪器厂;LDZX-30KB6立式压力蒸汽灭菌器:上海申安医疗器械厂;SL2002N电子天平:上海民桥精密科学仪器有限公司;伯乐BIO-RAD凝胶成像仪:美国GelDocXR公司。
1.3 方法
1.3.1 乳酸菌的分离
取1 mL酸马奶样品接种于50 mL MRS液体培养基,37℃活化24 h,用灭菌生理盐水做10倍梯度稀释至10-7。取三个适当稀释梯度(10-5、10-6、10-7)的菌液以同心圆形式涂布于MRS固体培养基上,37℃培养48 h,待菌落形成后,再用接种环挑取单个菌落,以井字形划线接种到MRS固体培养基中,37℃培养48 h,进行纯化[14]。纯化两次后,观察菌落形态特征,并对菌株进行革兰氏染色、镜检。革兰氏染色阳性、接触酶阴性菌即为乳酸菌属[15]。将已经分离纯化的菌株转接到冻藏管上,在-18℃条件下保藏备用[16]。
1.3.2 乳酸菌生理生化试验
对分离得到的菌株,参照《伯杰氏系统细菌学手册》[17]对所分离的菌株进行耐盐性、运动性、硝酸盐还原、糖醇发酵、葡萄糖产气、吲哚试验等生理生化试验鉴定。
1.3.3 不同含量乙醇胁迫对乳酸菌存活率的测定[18]
选取对数生长末期的菌株,以2%的接种量加入不同含量(5%、8%、9%、10%、11%、12%、13%、14%)乙醇的培养基中[19]进行乙醇胁迫12 h,胁迫后进行梯度稀释,选取适合梯度在MRS固体培养基中进行涂布37℃培养48 h,每个稀释度做3个平行试验,测定菌株存活率。存活率计算公式如下:
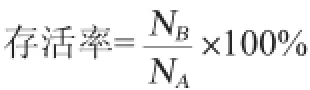
式中:NA为未添加乙醇的活菌数,CFU/mL;NB为不同乙醇含量胁迫后的活菌数,CFU/mL。
1.3.4 菌株分子生物学鉴定
(1)菌株的DNA提取
采用细菌组总DNA提取试剂盒(离心柱型)进行提取,按照说明书操作(第二步略做改动,在实验操作第二步时需添加溶菌酶,37℃水浴30min,可用来破坏乳酸菌的细胞壁)。
(2)PCR扩增
对所筛选菌株的16S rDNA进行聚合酶链式反应(polymerase chain reaction,PCR)扩增。引物由上海生工股份有限公司合成,分别为上游引物341F(5-CCTACGGGN GGCWGCAG-3)和下游引物805R(5-GACTACHVGGGTA TCTAATCC-3),PCR反应体系为50 μL,引物各2 μL,2 μL的DNA稀释液,预混液25 μL,补充19 μL ddH2O至终体积为50 μL。PCR反应条件:95℃预变性10 min,95℃预变性30 s,56℃退火30 s,72℃延伸30 s,30个循环,72℃延伸10 min。PCR扩增产物经0.8%琼脂糖凝胶电泳检测,并在凝胶成像仪中进行观察。扩增后的产物由上海生工生物工程股份有限公司对其进行测序,测序结果经美国国立生物技术信息中心(NationalCenter for BiotechnologyInformation,NCBI)官网Nucleotide BLAST中的已知序列进行比对[20],选择与其相似性最高的已知菌株,对两者相似性进行分析。使用MEGA 5软件中的邻接法(Neighbor-Joining,NJ)建立系统发育树。
2 结果与分析
2.1 菌株初筛
从新疆塔城地区3份农牧民家庭自制酸马奶中所分离出的乳酸菌菌落形态和镜检结果如图1所示。

图1 分离菌株菌落形态(A)和显微镜镜检(B)结果Fig.1 Results of colony morphology(A)and microscope inspection (B)of isolated strains
由图1可知,采用传统纯培养分离的方法,从新疆塔城地区的3份酸马奶样品中初步筛出53株乳酸菌,乳酸菌菌落颜色呈乳白色,有独特气味,表面微凸、光滑呈粘稠状,均以单个菌落或成对出现于平板中。所筛选菌株革兰氏染色均为阳性,接触酶阴性,镜检后发现所筛得的菌株分为杆状与球状两种形态,其中杆菌有24株,球菌有29株。
2.2 生理生化试验结果
对杆菌分离株属特性的鉴定时,所分离到的24株杆菌接触酶试验、硝酸盐还原试验、6.5%NaCl均不生长,发酵葡萄糖不产气,因此鉴定为乳杆菌属(Lactobacillus)。29株无芽孢球菌,革兰氏染色阳性、接触酶试验、硝酸盐还原试验、葡萄糖产气试验均为阴性,其结果与对照菌株一致,从而将这29株分离菌鉴定为乳酸球菌。以标准菌株嗜酸乳杆菌(Lactobacillus acidophilus)ATCC4356及嗜热链球菌(Streptococcus thermophilus)ATCC19258与粪肠球菌(Enterococcusfaecalis)ATCC29212为参考。参照《乳酸菌细菌分类鉴定及实验方法》[14]和《伯杰氏系统细菌学手册》[17]对24株乳杆菌及29株乳酸球菌进行糖醇发酵与最适生长温度等生理生化试验,将生理生化及糖醇发酵结果相同的菌株分为一类,选取其中一株为代表菌株进行鉴定试验。

表1 乳酸菌生理生化试验鉴定结果Table 1 Identification results of physiological and biochemical experiments of lactic acid bacteria
由表1可知,结合生理生化与糖醇发酵试验结果,菌株SMN3-3可发酵多种糖类,但不发酵鼠李糖与木糖,且15℃条件下生长,即鉴定为干酪乳杆菌,而菌株S6-1对乳糖、木糖等均不发酵,即判断为消化乳杆菌。菌株S7-1在15℃条件下不生长且不发酵甘露醇,可将其鉴定为詹氏乳杆菌,而将不发酵木糖与山梨醇的菌株S3-1鉴定为耐酸乳杆菌。菌株S7-2不发酵乳糖、半乳糖、木糖与两种醇类,将其鉴定为德式乳杆菌,但菌株SMN10-1可发酵鼠李糖在内的单糖及多糖,即判断为糖乳杆菌。菌株SMN5-1在15℃条件下生长但不发酵鼠李糖,可鉴定为植物乳杆菌,将15℃条件下不生长但可发酵蔗糖等多种糖类的菌株SNT15鉴定为发酵乳杆菌。
菌株SNT8在pH9.6与6.5%NaCl环境中及在15℃、45℃条件下也均可生长,可发酵甘露醇,不发酵山梨醇,将其鉴定为粪肠球菌。菌株S1-1在pH9.6、6.5%NaCl与15℃条件下均不生长,且不发酵麦芽糖、木糖、甘露醇,可将其鉴定为嗜热链球菌。菌株SNT10在15℃、45℃条件下及pH9.6、 6.5%NaCl环境中均能生长,但不发酵山梨醇与甘露醇,将其鉴定为植物乳球菌。菌株SNT16在15℃条件下不生长,45℃条件下生长,可发酵鼠李糖,不发酵甘露醇、山梨醇与蔗糖,将其鉴定为乳酸片球菌。
2.3 乙醇胁迫试验筛选结果
将筛选出的12株菌株进行乙醇胁迫试验,结果如表2所示。由表2可知,在体积分数为5%乙醇胁迫后,菌株均能够存活,其最高存活率为31.95%,最低仅为1.24%,而在体积分数为8%乙醇胁迫时,菌株的存活率有明显的下降,乙醇胁迫效果达显著水平(P<0.05)。与朱敏等[21]研究结果相似,均在乙醇含量8%时有较大幅度的降低,但其菌株最高耐受乙醇含量为8%,而本试验在继续提高乙醇含量时发现,在体积分数为9%乙醇胁迫时会有部分菌株死亡,仅5株菌株(S7-1、S7-2、SMN3-3、SMN10-1、SNT16)能够耐体积分数为13%乙醇胁迫,但在体积分数为14%乙醇胁迫时,存活率极低。因此所筛菌株可最高耐受体积分数为13%乙醇胁迫,并且随着乙醇含量的增加,菌株存活率逐步降低,故乙醇对菌株的生长具有抑制作用。
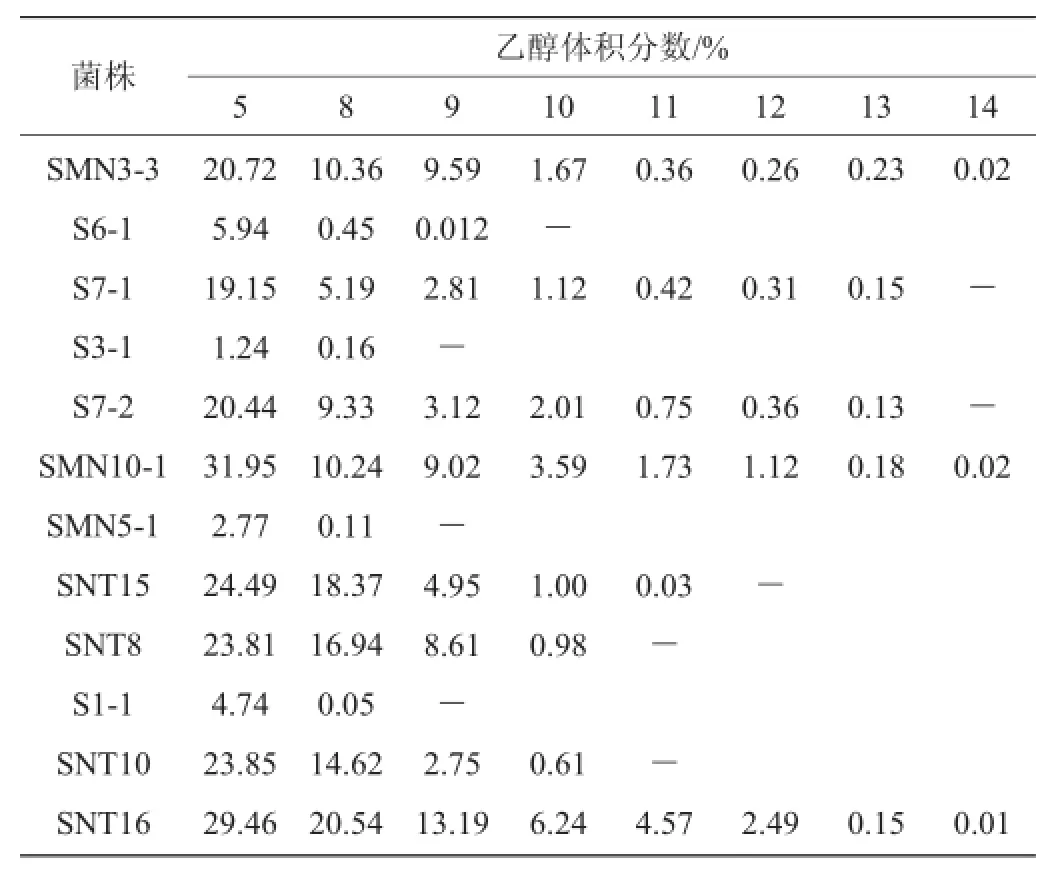
表2 乙醇胁迫试验结果Table 2 Results of ethanol stress experiments
2.4 16S rDNA序列分析
2.4.1 16S rDNA分析
在对菌株进行乙醇胁迫后,对最终筛的5株菌株(S7-1、S7-2、SMN3-3、SMN10-1、SNT16)的16SrDNA序列进行PCR扩增,而后经0.8%的琼脂糖凝胶电泳检测,结果见图2。由图2可知,除Marker条带外得到5条清晰的特异性条带,片段大小均在400~500 bp间。

图2 5株菌的16S rDNA的琼脂糖凝胶电泳图Fig.2 Agarose gel electrophoretogram of 16S rDNA of 5 strains
2.4.2 系统发育树构建
对所筛选出的5株菌(S7-1、S7-2、SMN3-3、SMN10-1、SNT16)进行分子生物学鉴定,对所扩增的16S rDNA序列进行分析,分析结果与BLAST中的已知序列进行比对,选择与其相似性最高的已知菌株,建立系统发育树,结果如图3所示。
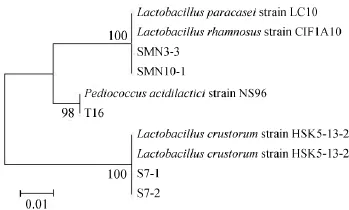
图3 基于16S rDNA的耐受乙醇菌株系统发育树Fig.3 Phylogenetic tree based on 16S rDNA of ethanol tolerant strains
由图3可知,菌株SMN3-3、SMN10-1与副干酪乳杆菌(Lactobacillus paracasei)及鼠李糖乳杆菌(Lactobacillus rhamnosus)的同源性为100%,菌株SNT16与乳酸片球菌(Pediococcus acidilactici)的同源性为98%,菌株S7-1、S7-2与面包乳杆菌(Lactobacillus crustorum)的同源性为100%。因其同源性较高,故将菌株SMN3-3鉴定为副干酪乳杆菌(Lactobacillusparacasei)、菌株SMN10-1鉴定为鼠李糖乳杆菌(Lactobacillus rhamnosus)、菌株S7-1与S7-2鉴定为面包乳杆菌(Lactobacillus crustorum),菌株SNT16鉴定为乳酸片球菌(Lactobacillus fermentum)。
3 结论
本研究以新疆塔城地区乳样为原料,共分离出53株乳酸菌,经生理生化试验后鉴定有乳酸杆菌共24株,乳酸球菌共29株。通过对所筛选出的12株菌株进行乙醇胁迫,其中菌株S7-1、S7-2、SMN3-3、SMN10-1、SNT16可耐受浓度为13%的乙醇胁迫。对所筛选5株菌进行16S rDNA序列分析,结果表明,菌株SMN3-3被鉴定为副干酪乳杆菌(Lactobacillus paracasei),菌株SMN10-1被鉴定为鼠李糖乳杆菌(Lactobacillus rhamnosus),菌株S7-1与S7-2被鉴定为面包乳杆菌(Lactobacillus crustorum),菌株SNT16被鉴定为乳酸片球菌(Lactobacillus fermentum)。为进一步研究乳酸菌受乙醇胁迫后微观结构差异提供理论基础,使得耐受乙醇微生物资源库的到扩充和广泛的应用。
[1]霍小琰,李少英.酸马奶中乳酸菌的鉴定及生物学特性的研究[J].微生物学通报,2012,39(7):940-948.
[2]闫彬,贺银凤.酸马奶中乳酸菌和酵母菌的共生发酵特性[J].食品科学,2012,33(7):131-137.
[3]KEKKONEN R A.Immunomodulatory effects of probiotic[J].Aust J Dairy Technol,2009,64:128-132.
[4]王晓雯,蒋彩虹,卢士玲,等.耐受乙醇乳酸菌诱变的研究[J].中国酿造,2015,34(10):32-37.
[5]LIONG M T.Safety of probiotics:translocation and infection[J].Nutr Rev,2008,66(4):192-202.
[6]ABDULLA A A,ABED T A.Isolation and Identification by PCR and analysis for probiotic properties ofLactobacillusspp.from dairy products [J].J Biol Agr Heal,2013,3(12):83-89.
[7]吴重德.干酪乳杆菌抵御酸胁迫的生理机制解析[D].无锡:江南大学,2012.
[8]张敏,毛健,黄桂东,等.清酒酿酒酵母酒精耐受机理的研究进展[J].食品工业科技,2012,33(20):342-350.
[9]SPANO G,MASSA S.Environmental stress response in wine Lactic acid bacteria:beyondBacillus subtilis[J].Crit Rev Microbiol,2006,32(2): 77-86.
[10]G-ALEGRIA E,ISABEL L.High tolerance of wildLactobacillus plantarumandOenococcus oenistrains to lyophilisation and stress environmental conditions of acid pH and ethanol[J].FEMS Microbiol Lett, 2004,230(1):53-61.
[11]李爱霞,王盼雪,樊明涛,等.植物乳杆菌对pH、酒精浓度和SO2浓度耐受性的研究[J].中国酿造,2013,32(9):42-46.
[12]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001: 169-207.
[13]陈天寿.微生物培养基的制造与应用[M].北京:中国农业出版社,1995:171-192.
[14]凌代文.乳酸细菌分类鉴定及实验方法[M].北京:中国轻工业出版社,1996:117-128.
[15]毛季琨.微生物学实验[M].北京:中国医药科技出版社,1998:12-53.
[16]周德庆.微生物学实验手册[M].上海:上海科学技术出版社,1986:78-92.
[17]PETER H A.Bergeys manual of systematic bacteriology[M].Volume 2,Williams&Wilkins,1986:15-39.
[18]李宝坤.乳酸杆菌冷冻干燥生理损伤机制及保护策略的研究[D].无锡:江南大学,2011.
[19]SILVEIRA M G,LOVINA E A,al.Membrane fluidity adjustments in ethanol-stressedOenococcus oenicells[J].Appl Environ Microbiol, 2003,69(10):5826-5832.
[20]杜紫萱,卢世玲,李宝坤,等.新疆哈族奶酪中产蛋白酶非发酵剂乳酸菌的筛选及其系统发育树分析[J].中国酿造,2016,35(5):20-25.
[21]朱敏,李宝坤,李开雄,等.乙醇胁迫对乳酸杆菌关键酶活力的影响[J].食品发酵与工业,2015,41(1):40-46.
Screening and identification of ethanol tolerance lactic acid bacteria from Tacheng kumiss
JIN Dan,JIANG Caihong,JIAN Aiting,QIAO Chuanli,GUO Jinfeng,LU Shiling,LI Baokun*
(College of Food Science,Shihezi University,Shihezi 832000,China)
Using the kumiss in Xinjiang Tacheng prefecture as research object,53 strains of lactic acid bacteria were screened preliminarily,in which 24 strains wereBacillusspp.and 29 strains wereCoccusspp.by physiological and biochemical experiments.The strains screened were stressed with different concentrations of ethanol solution for 12 h.The results showed that ethanol had an inhibitory effect on the growth of the strains.The strains with high ethanol tolerance were screened,including strains S7-1,S7-2,SMN3-3,SMN10-1 and SNT16 which could tolerate concentration of 13% ethanol.By total DNA sequence analysis,the strain SMN3-3 and SMN10-1 were identified asLactobacillus paracaseiandLactobacillus rhamnosus, respectively.Strain S7-1 and S7-2 were identified asLactobacillus crustorum,and strain SNT16 was identified asLactobacillus fermentum.
kumiss;lactic acid bacteria;screening;ethanol stress;identification
TS201.3
0254-5071(2017)03-0044-05
10.11882/j.issn.0254-5071.2017.03.010
2016-11-21
国家自然科学基金地区项目(31560444)
金丹(1992-),女,硕士研究生,研究方向为畜产品加工与安全。
*通讯作者:李宝坤(1979-),男,副教授,博士,研究方向为畜产品加工与质量安全。
