108份抗菌药物药品说明书调查研究
2017-04-07胡进平陶箭飞李化冰
胡进平,陶箭飞,李化冰
(1.安徽省马鞍山市疾病预防控制中心,安徽马鞍山 243000;2.上海杨思医院,上海 200126;3.安徽省马鞍山市中心医院,安徽马鞍山 243000)
·管理科学·
108份抗菌药物药品说明书调查研究
胡进平1,陶箭飞2,李化冰3
(1.安徽省马鞍山市疾病预防控制中心,安徽马鞍山 243000;2.上海杨思医院,上海 200126;3.安徽省马鞍山市中心医院,安徽马鞍山 243000)
目的为进一步规范抗菌药物药品说明书提供参考。方法收集马鞍山市疾病预防控制中心、上海杨思医院和马鞍山市中心医院2016年1月至8月的108份抗菌药物药品说明书,对其标注项信息进行汇总和分析。结果药品名称、成分、性状、适应证、规格、用法用量、贮藏、包装、有效期、执行标准、批准文号、生产企业等项的标注率均达100.00%;不良反应、禁忌、注意事项、孕妇及哺乳期妇女用药、老年用药、药物相互作用、药理作用、药代动力学等项虽标注率较高,但有些项缺乏具体说明内容;儿童用药、药物过量、毒理、警示语等项的标注率均偏低;临床试验项均未标注。结论部分抗菌药物药品说明书的项目内容不完整,修改不及时,书写不规范,难以满足使用者的需求,也难以保证用药安全。生产企业应尽可能将抗菌药物药品说明书项目内容标注完整,并及时修改、补充、规范和完善。
抗菌药物;药品说明书;标注项;药品监管
药品说明书是药品生产企业对药品主要特性及技术标准的介绍,是医师开具处方、药师审核处方的法律依据[1-2]。抗菌药物与公众生命健康息息相关,其在临床应用广泛,不良反应、禁忌与用药注意事项较多,医师、药师、护理人员及患者对其说明书的内容具有依赖性,故其内容的规范性与严谨性至关重要。笔者对马鞍山市疾病预防控制中心、上海杨思医院和马鞍山市中心医院(以下合称笔者单位)108份在用的抗菌药物药品说明书的内容进行整理,对其标注项信息进行汇总、分析,为进一步规范抗菌药物药品说明书提供参考。现报道如下。
1 资料与方法
收集笔者所在3家单位2016年1月至8月在用的108份供注射和口服的抗菌药物药品说明书(包括部分不同生产企业相同或不同规格的相同品种及相同主药成分的品种),依据《抗菌药物临床应用管理办法》[3]《药品说明书和标签管理规定》[4]《化学药品和治疗用生物制品说明书规范细则》[5]规定,对其相关标注项信息进行统计、分析,重点对其中的不良反应、禁忌、注意事项、药物相互作用、药物过量、药理毒理、药代动力学标注情况进行分析。其中,抗菌药物的分类参考第17版《新编药物学》[6]。
2 结果与分析
2.1 结果
2.1.1 品种分布
药品说明书按药理作用分类共有11类抗菌药物,108个品规,详见表1。
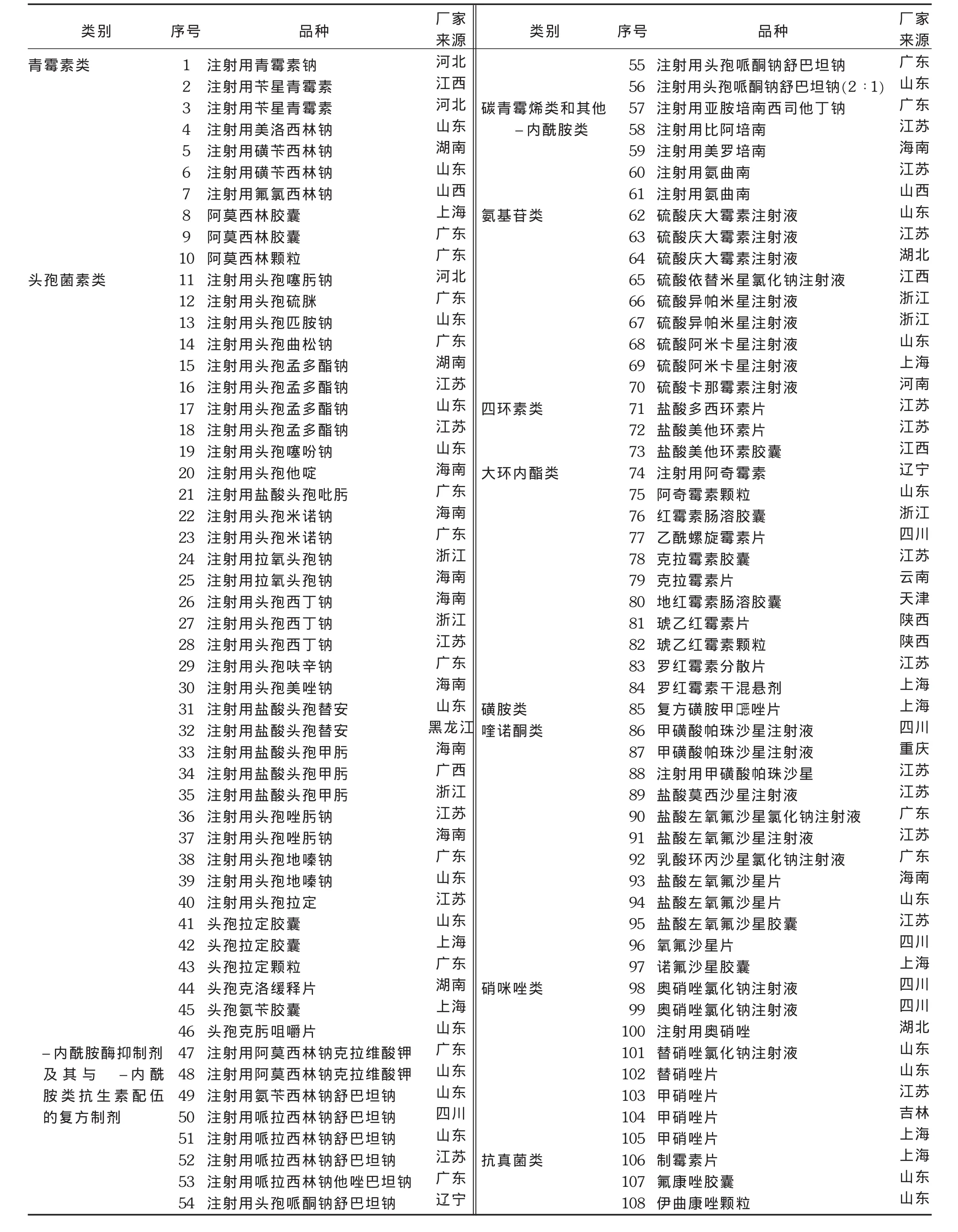
表1 抗菌药物品种分布
2.1.2 药品说明书项目标注情况
药品说明书中,考察项目如标注“未进行该项实验且无可靠参考文献”“尚不明确”等以未标注计。“药品名称”“成分”“性状”“适应证”“规格”“用法用量”“贮藏”“包装”“有效期”“执行标准”“批准文号”“生产企业”项的标注率均达100.00%;“孕妇及哺乳期妇女用药”项标注102份(94.44%);“儿童用药”项标注68份(62.96%);“老年用药”项标注86份(79.63%);“警示语”项标注25份(23.15%);“临床试验”项均未标注。部分说明书修改不及时,修改滞后,在108份说明书中,标注修改日期为2008年和2010年的分别有2,31份;标注核准日期为2006年而无修改日期的有1份。基本项目中,“不良反应”“禁忌”“注意事项”“药理作用”“药动学”项的标注率均达100.00%,“药物相互作用”项的标注率相对较高,而“药物过量”“毒理”项的标注率均偏低,详见表2。

表2 药品说明书基本项目的标注情况(n=108)
2.1.3 药品说明书基本项目的相关项目标注情况详见表3。
2.2 分析
2.2.1 基本项目标注情况
在调查的108份抗菌药物药品说明书中,一些项目虽标注率较高,但有的缺乏具体说明内容;“儿童用药”“药物过量”“毒理”“警示语”项的标注率均偏低,部分说明书虽在“不良反应”“药理毒理”等项中表述了药物临床试验的内容,但在“临床试验”项中均未标注。说明书部分内容缺失较多,可能与药物在药代动力学、药理毒理、临床试验等方面开展的研究少及相关信息收集难等因素有关[7]。可通过汇总抗菌药物药品说明书,获取较多的用药信息。目前,抗菌药物药品说明书项目内容虽有所改进,但部分说明书仍存在不少缺陷,主要表现为:表述过于简单,形式各异;提供信息不全面;修改不及时;标注不规范;部分说明书印刷纸张与字体过小,影响临床医师、药师、护理人员及患者的阅读和理解。

表3 药品说明书基本项目的相关项目标注情况(n=108)
2.2.2 不良反应
药品的疗效和不良反应并存,利弊相伴。抗菌药物新品种的不断问世,要求临床医务人员关注在用药中所出现的任何不良反应,及时发现并采取相应措施,减少药源性疾病造成的危害。该项中,“各种可能不良反应”均有标注,但“临床试验数据说明”“不良反应发生比例或频率”“出现不良反应的处理措施”的标注率均偏低。且有的品种相同、生产企业不同药品的说明书在“不良反应”项中标注也不一致,如同为甲硝唑片,1家生产企业在其说明书“不良反应”项中标注“本品最严重的不良反应为高剂量时引起癫痫发作和周围神经病变,后者主要表现为肢端麻木和感觉异常,某些病例长期用药可产生周围神经病变”,而另有2家生产企业在相应项中均无此标注。建议生产企业注重收集抗菌药物在使用过程中所发生的不良反应,加强其药品不良反应的研究,及时修改与补充说明书中有关内容。
2.2.3 禁忌
该项中,“对任何一种成分过敏”的标注率相对较高,而“某些疾病或症状”“孕妇”“哺乳期妇女用药”“儿童”的标注率均较低。有的说明书标注内容过于简单,如“孕妇禁用”“孕妇及哺乳期妇女慎用”,却未对禁用或慎用的情况作任何说明。有的主药成分和给药途径相同的品种,不同生产企业在其说明书“禁忌”项所标注的信息详略不尽相同,如同为口服的大环内酯类抗菌药物罗红霉素,1家生产企业在“罗红霉素分散片”说明书“禁忌”项中标注“对本品、红霉素或其他大环内酯类药物过敏者禁用”,而另有1家生产企业在“罗红霉素干混悬剂”说明书相应项中仅标注“对本品过敏者禁用”。前者标注较为详细,而后者标注过于简单。建议不同生产企业对相同主药成分的品种在“禁忌”项的标注信息应尽量详细且相同,以便患者安全用药。
2.2.4 注意事项
该项中,“需要慎用的情况”“用药过程需观察的情况”的标注率相对较高。有些说明书在“影响药物疗效的因素”“用药对临床检验的影响”等标注不够详细或未标注。在统计中发现,多数说明书在“注意事项”项中所标注的内容虽然相对较多,但也存在一些问题。有的相同品种不同生产企业的说明书在“注意事项”项的标注不统一,如同为注射用盐酸头孢替安,1家生产企业在其说明书“注意事项”项中标注“肾功能严重受损者给药应慎重,适当调节给药量”“使用本品时,为防止出现耐药菌,原则上应确认其敏感性”“在确保疗效的基础上,尽量缩短给药时间”“本品与氨基糖苷类药呈配伍禁忌,两药联合时不可置于同一容器内”,而另有1家生产企业在相应项中无此标注。由于抗菌药物的应用非常广泛,其说明书应当列出用药时必须注意的事项,以保证患者的用药安全。
2.2.5 药物相互作用
药物相互作用主要是探讨2种或2种以上药物不论通过何种途径给予(相同或不同途径,同时或先后)在体内所产生的联合效应。随着联合用药的增加,药品说明书中提供的药物相互作用信息在临床治疗中占有越来越重要的地位[8]。该项中,一些说明书仅列出“相互作用的药物”,部分说明书对“相互作用的结果”“合并用药的注意事项”进行了简单说明。有的品种相同而生产企业不同药品的说明书在“药物相互作用”项标注不一致,如同为注射用头孢孟多酯钠,有3家生产企业在其说明书“药物相互作用”项中均标注“本品制剂中含有碳酸钠,因而与含有钙或镁的溶液有配伍禁忌,两者不能混合在同一容器中;如必须合用时,应分开在不同容器中给药”,而另有1家生产企业在其说明书相应项中无此标注。建议生产企业做好抗菌药物相互作用的资料收集与整理工作,重视对药物相互作用的研究,在说明书中列出与用药产生相互作用的药品或药品类别,并说明相互作用的结果及联合用药的注意事项。
2.2.6 药物过量
该项中,只有部分说明书标注“药物过量出现的不良反应及其处理措施”“用药出现不良反应与剂量相关”“大剂量或长期用药可产生严重不良反应”。调查中发现,有的说明书对药物过量造成的危害表述较少;有的品种相同、生产企业不同药品的说明书在“药物过量”项所标注的信息各异,如同为注射用头孢西丁钠,1家生产企业在其说明书“药物过量”项中标注“成年雄性小鼠与兔急性静脉注射本品的半数致死量(LD50)分别为8.0 g/kg与大于1.0 g/kg,成年大鼠急性腹腔注射本品的LD50大于10.0 g/kg”,1家生产企业在其说明书“药物过量”项中标注“未进行该项实验且无可靠参考文献”,而另有1家生产企业在其说明书相应项中标注“尚不明确”。可见,部分生产企业缺乏药物过量的研究资料,开展药物过量的研究不足,给患者安全用药带来隐患。建议生产企业加强对药物过量的研究,注重收集药物过量的研究资料,详细列出过量用药可能发生的不良反应、剂量及其处理方法,保障临床安全用药。
2.2.7 药理毒理
“药理毒理”是药品说明书的灵魂[9]。临床医务人员掌握药品说明书“药理毒理”项药物对人体的作用,包括剂量(浓度)-效应关系、时间-效应关系及作用机制等内容,可指导患者用药,保证临床用药安全、有效。该项中,“药理作用机制”的标注率相对较高,而“毒理说明”“临床和(或)动物实验说明”的标注率均明显偏低。有的品种相同、生产企业不同药品的说明书在“药理毒理”项中标注却不同,如同为“注射用头孢哌酮钠舒巴坦钠”,有2家生产企业在其说明书“药理毒理”项毒理中详细标注了“临床前安全性资料”,而另有1家生产企业在其说明书相应项中未标注毒理内容。部分药品说明书“毒理”项被“药理毒理”词条所替代,说明书只标注“药理作用”而不标注“毒理”作用。建议生产企业加强药品的毒理研究,以便医务人员了解药品的毒理作用,指导患者安全用药。
2.2.8 药代动力学
药品说明书“药动学”项通过介绍药物的吸收、分布、代谢、排泄及相关药代动力学参数,为制订个体化给药方案提供理论依据,在提高药物疗效、降低不良反应发生率等方面发挥着重要作用[10]。该项中,“特殊人群药动学参数”的标注率相对较低。部分说明书对药物的“吸收情况”“代谢过程”等标注不够完整。在统计中发现,“药动学”项虽均有标注,但也存在标注详略不同与不够完整的问题。有的主药成分和给药途径相同的品种,不同生产企业在其说明书“药动学”项标注的内容详略不尽相同,如同为口服的喹诺酮类抗菌药物左氧氟沙星,有2家生产企业在左氧氟沙星片说明书“药动学”项中详细说明左氧氟沙星口服后的吸收情况、分布部位、代谢过程、排泄途径和比例,以及老年人、儿童、性别、种族、肾脏损害、细菌感染、药物相互作用的药代动力学研究情况,而另有1家生产企业在左氧氟沙星胶囊说明书相应项中只简略地标注口服后的药代动力学情况。“药动学”参数项应当为临床医务人员提供重要且有用的资料,否则不利于临床制订合理的治疗方案,尤其是对特殊人群,将难以根据其生理、病理特点制订个体化给药方案。建议生产企业做好抗菌药物药代动力学资料的收集与整理,重视药代动力学相关参数的研究,为临床制订合理的治疗方案提供参考。
3 启示
药品说明书在临床用药中有着重要地位,所含信息的准确性直接影响临床用药的疗效[11],其完整性和规范性对指导临床用药起着至关重要的作用[12]。由于一些抗菌药物药品说明书标注不规范,包括许多项目的缺失和临床或非临床试验数据缺乏支撑,在临床实践中并未很好地起到指导安全、合理用药的作用。
药品说明书的规范与加强管理很有必要,医务人员在临床用药中如发现不规范说明书,医师、护士在用药时要注意观察,药师在发药时要向患者说明清楚,并及时上报抗菌药物在临床应用过程中所出现的问题,为安全用药提供保障;生产企业应做好抗菌药物上市前临床试验与上市后药物监测等多方面的基础研究工作,根据药品上市后应用的安全性和有效性,并兼顾不同人群的信息需求,加强对特殊人群用药的研究工作,重视说明书的规范性,严格按其说明书的各项规定,在申报药品说明书时要注意准确和再版修改,尽可能将抗菌药物药品说明书项目内容标注完整,保证患者的用药安全;国家药品监督管理部门应加强对抗菌药物药品说明书的审查力度,严把药品说明书审批关并进行抽查,发现不合格说明书时应要求企业进行修改、补充,使之符合法律规定标准和更加规范与完善,以便临床医务人员及患者安全、合理用药。
[1]葛饮南,邵蓉,谢金平.医院“超说明书用药”管理与应对流程初探[J].中国药事,2013,27(5):544-547.
[2]陈永法,黄丽.我国超说明书用药现象探析[J].中国药房,2013,24(13):1162-1164.
[3]卫生部.抗菌药物临床应用管理办法[Z].卫生部令第84号.
[4]国家食品药品监督管理局.药品说明书和标签管理规定[Z].国家食品药品监督管理局令第24号.
[5]国家食品药品监督管理局.关于印发《化学药品和生物制品说明书规范细则》的通知[Z].国食药监注[2006]202号.
[6]陈新谦,金有豫,汤光.新编药物学[M].第17版.北京:人民卫生出版社,2011:34-118.
[7]陈东伟.药品说明书的调查与分析[J].中国实用医药,2013,8(8):271-273.
[8]张欣悦,孙成春,谢继青,等.33份抗肿瘤药类注射剂药品说明书的调查分析[J].中国药房,2014,25(1):91-93.
[9]李雪梅,萧惠来.申报注册药品说明书样稿[药理毒理]部分问题案例讨论[J].中国新药杂志,2011,20(16):1499-1502.
[10]朱刚直,何小爱.国产药品说明书“药代动力学”项常见错误分析[J].中国药师,2009,12(11):1574-1576.
[11]毕瑞,洪雪娇.4种不同规格哌拉西林钠他唑巴坦钠药品说明书分析[J].中国药业,2014,23(16):10-11.
[12]邱季,朱文靖,许杰.我院266份静脉用药品说明书中配制方法和贮存时限的标注情况分析及建议[J].中国药房,2016,27(10):1433-1435.
Survey and Analysis of 108 Copies of Drug Instructions of Antibacterial Drug
Hu Jinping1,Tao Jianfei2,Li Huabing3
(1.Maanshan Municipal Center for Disease Prevention and Control,Maanshan,Anhui,China243000;2.Shanghai Yangsi Hospital,Shanghai,China 200126;3.Maanshan Central Hospital,Maanshan,Anhui,China243000)
ObjectiveToprovidethereferenceforthefurtherstandardizationofthedruginstructionsofantibacterialdrug.M ethods108 copies of the drug instructions of antibacterial drug were collected from M Maanshan Municipal Center for Disease Prevention and Control,Shanghai Yangsi Hospital and Maanshan Central Hospital from January to August 2016.The information of marked item was summarized and analyzed.ResultsAmong the 108 drug instructions of antibacterial drug,the mark rates of drug names,main ingredients,character,indications,specification,usage and dosage,reposition,package,term of validity,operative norm,license number,manufacturing enterprise and other items all reached 100.00%.Although the mark rates of ADR,contraindication,precaution,drug use of pregnant women and nursing mothers,drug interactions,pharmacokinetics,drug use of the elderly,storage and other items were relatively high,some items lacked the specific description of the content.The label rates of children′s drug use,drug excess,toxicology and warning were very low,and the clinical trials were not marked.ConclusionSome drug instructions of antibacterial drug were not revised timely and not completed in content and non-standard in writing,which could not meet the needs that clinical pharmacists and patients get enough drug safety information from the drug instructions of antibacterial drug.Manufacturing enterprise is suggested to label the content of package inserts completely,verify and supplement related content,standardize and improve the drug instructions of antibacterial drug.
antibacterial drug;drug package inserts;the labelling of items;drug regulation
R954;R978.1
A
1006-4931(2017)02-0078-05
10.3969/j.issn.1006-4931.2017.02.024
2016-10-11)
胡进平(1961-),男,大学本科,执业药师,副主任药师,研究方向为临床药学、药事管理,(电子信箱)1872386815@qq.com。
