利用杨木水解液制备细菌纤维素
2017-04-06陈慧慧刘玉王慧梅
陈慧慧 刘玉 王慧梅
(齐鲁工业大学 制浆造纸科学与技术教育部重点实验室,济南 250353)
利用杨木水解液制备细菌纤维素
陈慧慧 刘玉 王慧梅
(齐鲁工业大学 制浆造纸科学与技术教育部重点实验室,济南 250353)
选用杨木木屑水解液为发酵基质,利用木醋杆菌发酵制备细菌纤维素。研究还原糖浓度、初始pH值、接种量、发酵温度和发酵时间对细菌纤维素产量、持水性和复水率的影响。结果表明,生产细菌纤维素的适宜条件为:杨木木屑水解液还原糖浓度为2.5%,初始pH为6.0,接种量为6%,发酵时间6 d,发酵温度30℃,在此条件下,细菌纤维素产量为3.14 g/L,持水性为98.72%,复水率为86.69%。采用扫描电镜、红外光谱、热失重分析法等技术分析了所制备的细菌纤维素的结构与性能,结果表明合成产物为超微细网状结构,且产物中含有的基团与纤维素结构相符合。
杨木木屑水解液;扫描电镜;红外光谱;热失重分析法
细菌纤维素(bacterial cellulose,BC)是由部分细菌产生的纤维素。木醋杆菌在静化培养时,培养基气液交界处会形成一层白色透明的膜,这种膜被鉴定为纤维素,由Brown首次报道[1]。细菌纤维素相对于其他纤维素,具有很多优良的特性,如高持水性、高结晶度和高聚合度等[2,3]。BC在许多领域都有广泛应用[3-5],在医药方面,BC具有改善消化系统功能、降低胆固醇、避免便秘、预防癌症和延缓衰老等独特功能[6,7]。在食品行业,BC可以作为一种膳食纤维[8]、乳化剂和增稠剂[9]。在造纸行业,把BC添加到纸张中,纸张的强度、弹性、膨胀性和耐用性都有相应的提高,同时还可以增加纸张吸水性能[10]。在纺织行业,细菌纤维素可作为Lyocell人造纤维原料[11]和人造皮革制品等。
目前,利用单糖等合成或半合成培养基碳源制备细菌纤维素效果较好,但其成本太高,限制了细菌纤维素的规模化生产。寻找产量大且价低的天然培养基是实现细菌纤维素规模化生产的突破口,而水果类原料、低值淀粉类原料、糖质原料和废弃纤维类原料成为寻找的方向。Kurosumi等[12]利用各种果汁,如橘子汁、菠萝汁、苹果汁、梨汁等作为发酵碳源生产细菌纤维素。水果类原料虽来源丰富,但其季节波动性和地域局限性比较大,限制其大规模推广。2010年,韩国Jung等[13]分别利用糖蜜和玉米浆为碳氮源制备细菌纤维素,8 d后产量最高达3.12 g/L。糖蜜和低值淀粉类原料因含糖高,来源广泛,被作为生产细菌纤维素的优良碳源,但如果将其作为大规模生产细菌纤维素的碳源,可能会存在与其他行业(如燃料酒精)争夺原料的问题。而木质纤维类原料不存在占用耕地等问题,来源广泛且价格低廉。东华大学的洪枫等[14-17]以农作物秸秆为原料制备出了细菌纤维素,经过两步法水解,脱毒得到水解液,然后配成发酵培养基来制备细菌纤维素。2010年,Chia-Hung等[18]研究了通过对废弃纤维织物做不同的预处理,进而比较了不同的预处理方法对细菌纤维素产量的影响。杨木木屑是一种纤维素废料,来源广且价格低廉,最主要的是纤维素含量高。本研究是以杨木木屑为原料,经过预处理,酶水解,脱毒和发酵4个过程制备细菌纤维素,研究发酵条件对BC产量、持水性、复水率的影响,并对BC的结构与性质进行分析,旨在为BC的低成本生产提供新的可能。
1 材料与方法
1.1 材料
1.1.1 材料与菌种 木醋杆菌(Acetobacter xylinum),由齐鲁工业大学造纸重点实验室提供;杨木木屑(40目),由济南市齐河冠军纸业提供。
1.1.2 主要试剂 氢氧化钠、柠檬酸、葡萄糖均为分析纯,购自天津大茂化学试剂厂;蛋白胨、酵母浸粉均为生物试剂,购自北京奥博里生物技术有限公司;磷酸氢二钠为分析纯,购自天津市科密欧化学试剂有限公司。
1.1.3 培养基 固体培养基(用于菌种的活化):葡萄糖2%、蛋白胨0.5%、酵母粉0.5%、磷酸氢二钠0.5%、柠檬酸0.1%、琼脂2% pH6.0,121℃高压灭菌20 min。
种子培养基(扩种培养):葡萄糖2%、蛋白胨0.5%、酵母粉0.5%、磷酸氢二钠0.5%、柠檬酸0.1%、pH 6.0,121℃高压灭菌20 min。
发酵培养基(用于细菌纤维素的制备):(1)葡萄糖2%、蛋白胨0.5%、酵母粉0.5%、磷酸氢二钠0.5%、柠檬酸0.1%,121℃高压灭菌20 min;(2)在杨木木屑水解液中添加蛋白胨0.5%、酵母粉0.5%、磷酸氢二钠0.5%、柠檬酸0.1%,121℃高压灭菌20 min。
1.1.4 仪器与设备 Agilent8453紫外可见分光光度计(美国安捷伦公司);数显生化培养箱(正基仪器有限公司);压力蒸汽灭菌器(武汉市鸿雁医疗器械制造有限公司);气浴恒温振荡器(金坛市国旺实验仪器厂);SU8010场发射扫描电镜(日本日立);IRPrestige-21傅里叶红外光谱测定仪(日本岛津公司);TGA Q50热重分析仪(美国)。
1.2 方法
1.2.1 杨木木屑水解液制备 称取一定质量绝干原料放入反应器中,加入5%的稀硫酸进行预水解,底物浓度为5%,反应结束后用氢氧化钠将pH调至5。向预水解液中加入纤维素酶50 FPU/g,将反应器放入摇床中,温度设为50℃,转速设为150 r/min,反应48 h。反应完毕后进行抽滤,将水解液进行稀释中和后,用紫外分光光度计测定还原糖的含量。水解液经过活性炭脱毒处理后,放入冰箱中备用。
1.2.2 培养方法 斜面菌种的活化:将冷冻保存的木醋杆菌接种到新的斜面培养基中,在30℃的培养箱中培养,待长出新菌落,反复接种到新的斜面培养基,至在短时间内长出新的菌落为止。
种子培养:用接种环挑取一环活化好的菌落接种到装有100 mL种子培养基的250 mL锥形瓶中,于30℃下160 r/min摇床培养24 h(菌悬液浓度约为1×107个/mL)使用。
发酵培养:用移液枪从种子培养基中吸取一定量的种子培养液,接入分别以葡萄糖和杨木木屑水解液所制备的发酵培养基,纱布封口,恒温静置培养数天。
1.2.3 细菌纤维素处理 在恒温培养箱培养数天后,取出BC,先用去离子水进行多次冲洗,然后将BC放入0.1 mol/L的NaOH溶液中,在90℃的水浴中加热4 h至BC呈半透明乳白色,此过程是除去菌体和残余培养基,然后将BC放入0.1 mol/L HCl溶液中,30 min后再用去离子水反复冲洗至pH为中性。
1.2.4 以杨木木屑水解液制备细菌纤维素条件的优化
1.2.4.1 还原糖浓度对细菌纤维素产量、持水性和复水率的影响 在培养温度30℃,发酵时间5 d,pH5,接种量为4%的条件下,以杨木木屑水解液所配制的培养基来制备细菌纤维素,探究培养基中还原糖浓度对细菌纤维素产量、持水率和复水率的影响。
1.2.4.2 pH对细菌纤维素产量、持水性和复水率的影响 在还原糖浓度2.5%,培养温度30℃,接种量为4%,发酵时间5 d的条件下,以杨木木屑水解液所配制的培养基来制备细菌纤维素,探究初始pH对细菌纤维素产量、持水率和复水率的影响。
1.2.4.3 接种量对细菌纤维素产量、持水性和复水率的影响 在还原糖浓度2.5%,培养温度30℃,pH6.0,发酵时间5 d的条件下,以杨木木屑水解液所配制的培养基来制备细菌纤维素,探究接种量对细菌纤维素产量、持水率和复水率的影响。
1.2.4.4 温度对细菌纤维素产量、持水性和复水率的影响 在还原糖浓度2.5%,pH6.0,接种量6%,发酵时间5 d的条件下,以杨木木屑水解液所配制的培养基来制备细菌纤维素,探究温度对细菌纤维素产量、持水率和复水率的影响。
1.2.4.5 发酵时间对细菌纤维素产量、持水性和复水率的影响 在还原糖浓度2.5%,pH6.0,接种量6%,温度为30℃的条件下,以杨木木屑水解液所配制的培养基来制备细菌纤维素,探究发酵时间对细菌纤维素产量、持水率和复水率的影响。
1.2.5 细菌纤维素产量的计算 将处理后的细菌纤维素放入烘箱中将其烘干后,用分析天平测得其干重,细菌纤维素的产量的计算公式为:
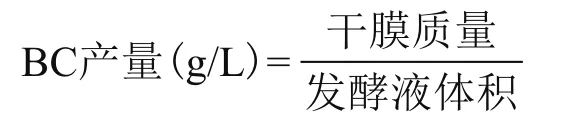
1.2.6 细菌纤维素持水率的计算
(1)BC的持水性:将细菌纤维素湿膜经过适当的处理,用滤纸对湿膜表面水分进行吸附,然后对细菌纤维素湿膜进行称重,重复此操作至恒重,接着将细菌纤维素湿膜放入80℃的烘箱中烘24 h至重量不在变化,最后对细菌纤维素的干膜进行称重,按下列公式 计算BC持水性:

(2)BC干膜复水率:对细菌纤维素干膜称质量后,将细菌纤维素干膜浸在蒸馏水中。室温下过夜,直到细菌纤维素膜不在吸水为止,称量细菌纤维素膜吸水后的质量,计算BC复水率:

1.2.7 扫描电镜(SEM)观察细菌纤维素干膜的形貌 将干燥后的细菌纤维素膜分成直径约为0.2 cm小碎片,然后把细菌纤维素固定在样品台上,用扫描电子显微镜观察其微纤维结构。
1.2.8 细菌纤维素膜红外光谱的测定 红外光谱采用傅里叶红外光谱仪(FTIR)进行测定。波长范围400-4 000 cm-1。干燥的KBr粉末与细菌纤维素样品(1∶60)充分研磨混合,压片进行检测。
1.2.9 热失重分析法 采用热重分析仪(TGA)进行测定。取一定量的细菌纤维素干膜于加热炉中,升温速率为10℃/min,观察在25-800℃温度范围内,细菌纤维素质量的变化情况。
2 结果
2.1 以杨木木屑水解液制备细菌纤维素条件优化
2.1.1 还原糖浓度对细菌纤维素产量、持水性和复水率的影响 由图1可以看出,随着培养基中还原糖浓度的增加,细菌纤维素的产量、持水率和复水率均呈现先增加后减少的趋势,在还原糖浓度为2.5%时达到最大,细菌纤维素产量为1.62 g/L,细菌纤维素持水率和复水率分别为97.87%和84.13%。
2.1.2 pH对细菌纤维素产量、持水性和复水率的影响 从图2可以观察到,细菌纤维素的产量、持水性和复水率随pH值的增加呈现出先增加后减少的趋势,当pH值为6.0时,细菌纤维素产量为1.86 g/L,细菌纤维素持水性和复水率分别为97.87%和84.33%,均达到最大值。因此,适合木醋杆菌生长的最适pH值为6.0。

图1 还原糖浓度对细菌纤维素产量、持水性和复水率的影响
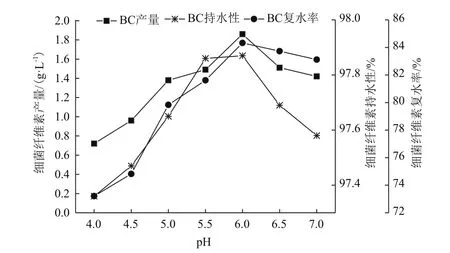
图2 初始pH对细菌纤维素产量、持水性和复水率的影响
2.1.3 接种量对细菌纤维素产量、持水性和复水率的影响 从图3可以观察到,在2%-6%的接种量范围内,细菌纤维素的产量、持水性和复水率增长趋势比较快,当接种量为6%时,细菌纤维素产量、持水性和复水率达到最大值,分别为2.71 g/L,98.56%和84.41%,接种量超过6%时,细菌纤维素产量,持水性和复水率出现下降趋势。所以最适的接种量为6%。

图3 接种量对细菌纤维素产量、持水性和复水率的影响
2.1.4 温度对细菌纤维素产量、持水性和复水率的影响 从图4可以明显的观察到,温度对木醋杆菌的生长影响比较大,在温度为20-40℃范围内,细菌纤维素的产量、持水性和复水率均呈现出先增后减的趋势,并且当温度为30℃时,细菌纤维素产量、持水性和复水率相比其他温度下所以制备的细菌纤维素高的多,分别达到2.79 g/L,98.71%和84.61%。所以由此可以看出,木醋杆菌最适的发酵温度为30℃。

图4 发酵温度对细菌纤维素产量、持水性和复水率的影响
2.1.5 发酵时间对细菌纤维素产量、持水性和复水率的影响 从图5可以观察到,在前6 d发酵阶段,细菌纤维素产量、持水性和复水率增长趋势比较明显,在发酵到6 d时,细菌纤维素的产量为3.14 g/L,细菌纤维素的持水性和复水率分别为98.72%和86.69%。当发酵时间超过6 d时,细菌纤维素的产量、持水性和复水率变化非常不明显。所以选取木醋杆菌的发酵时间为6 d。
2.2 以杨木木屑为碳源制备的细菌纤维素的扫描电镜
从图6可以观察到,以杨木木屑为碳源制备的细菌纤维素由高密度微纤维相互缠绕而成,具有超微细网状结构特点,纤维属于纳米尺寸。正是由于细菌纤维素具有这种结构,才使得细菌纤维素具有很好的透水性能及较强的亲水性能。

图5 发酵时间对细菌纤维素产量、持水性和复水率的影响
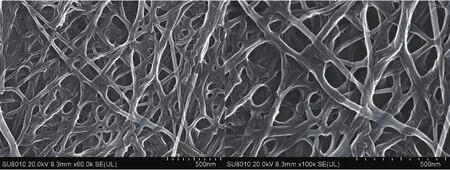
图6 BC的电镜照片
2.3 不同碳源所制细菌纤维素的红外光谱图
从BC的红外图谱(图7)可得到,以不同的碳源所制备的产物都含有纤维素分子的特征峰,3 351 cm-1处的吸收峰反映了O-H键的伸缩振动;2 924 cm-1处的吸收峰是CH2-CH伸缩产生的;1 652 cm-1处的吸收峰是C-H键伸缩振动引起的,1 059 cm-1处的吸收峰是由C-O的伸缩振动引起的,是纤维素分子的特征峰;约900 cm-1处的吸收峰是糖苷键的特征峰;在620 cm-1处的吸收峰可能为一些无机盐的杂质峰,基本符合标准峰的结构,由此可以得出产物为细菌纤维素。

图7 BC膜的红外光谱图
2.4 细菌纤维素的热重分析
从图8和图9中观察到,以葡萄糖和杨木木屑水解液分别为碳源制备细菌纤维素的TG-DTG曲线大致相同。
从TG曲线和DTG曲线可以看出在温度为0-100℃范围内,细菌纤维素质量稍有下降。随着温度的逐渐升高,细菌纤维素质量变化明显。在温度大约为240-400℃范围内,细菌纤维素的质量呈现出急剧下降的趋势,在此温度范围内,两种细菌纤维素的质量损失率分别达到64.28%和73.64%,最大失重速率温度分别为327.93℃和330.09℃。400℃以后,细菌纤维素下降缓慢,到700℃时,纤维素的失重率分别达到了71.64%和79.27%。

图8 葡糖糖合成BC的TG-DTG曲线

图9 杨木木屑水解液合成BC的TG-DTG曲线
3 讨论
杨木木屑经过预处理、酶解、脱毒制备的水解液可以作为一种优质、廉价且来源丰富的培养基碳源用于细菌纤维素生产。细菌纤维素的制备受多种因素的影响,本研究主要是利用单因素实验考察了培养基中还原糖浓度、pH值、温度、接种量和发酵时间等因素对纤维素产量、持水性和复水率的影响。还原糖浓度对细菌纤维素产量、持水性和复水率有较大影响,细菌纤维素产量、持水性和复水率随着还原糖浓度的增加呈现先增后减的趋势。这可能是在发酵初期还原糖作为营养物质和能源物质,被菌体快速利用,满足菌体细胞的生长进而促进纤维素的产生,但还原糖浓度的增加会加速产酸过程,反而抑制菌体生长,限制纤维素的产生。木醋杆菌虽适合在酸性条件下生长,但过酸的环境不利于木醋杆菌的生长,从而抑制细菌纤维素的合成。温度主要通过影响微生物细胞膜的流动性和生物大分子的活性来影响微生物的生命活动[19],每一种微生物都有其最适的生长温度。本实验确定木醋杆菌最适生长温度为30℃,这与黄丹[20]等研究木醋杆菌QAX993发酵合成细菌纤维素的最适温度为30℃相符合。接种量大小会影响木醋杆菌在发酵体系内的生长、代谢、繁殖的速度。接种量过大,会导致底物前期消耗过快,不利于后期产物积累;接种量过少,会延长发酵周期,对生产纤维素不利。该实验确定的适宜接种量为6%。这与赵克勤[21]利用谷氨酸提取液制备细菌纤维素使用3%-4%的接种量较为接近。发酵周期也是影响细菌纤维素合成量的一个因素,本实验确定最适的发酵周期为6 d。这与汤卫华[22]等研究的利用木葡糖酸醋杆菌的突变株合成细菌纤维素的最佳发酵时间为6 d相一致。
通过扫描电镜可以看出,利用杨木木屑水解液所制备的细菌纤维素微纤维直径不足100 nm,属于纳米级尺寸,而棉花纤维直径一般在10-100 μm,超细人造纤维直径约为1 μm。通过扫描电镜还可以看出,细菌纤维素膜表面有许多纳米极的小孔,这可能与细菌纤维素具有高的持水性相关,也有可能与细菌纤维素外面的物质交换有关,这方面的研究未见报道,具体情况有待进一步研究。通过红外光谱可以观察到,以杨木木屑水解液和葡萄糖分别为碳源所制备的细菌纤维素含有相同基团。这与沈金朋等[5]利用酒糟浸出液制备细菌纤维素的红外光谱图基本一致。这证明了以杨木木屑为原材料制备细菌纤维素的可行性。由于细菌纤维素含有水分,所以在0-100℃会出现质量缓慢下降趋势。在温度大约为240-400℃范围内,为细菌纤维素分解过程,细菌纤维素发生各种物理化学反应,在分解产物产生的同时放出大量的热,所以质量出现急剧下降趋势,两种细菌纤维的最大失重温度分别为327.93℃和330.09℃。在温度为400-700℃范围内,为分解产物煅烧阶段。这与George等[23]研究通过NaOH处理后的细菌纤维素分解温度为350℃结果基本一致。从两种细菌纤维素DTG曲线可以得出,所制备的细菌纤维素纯度较高。也由此得出在细菌纤维素材料应用处理过程中,温度不能超过240℃。
杨木木屑为实现细菌纤维素规模化生产提供了可能,但如何降低水解液制备成本问题,还有待深入研究。
4 结论
杨木木屑水解液进行木醋杆菌发酵制备细菌纤维素,利用单因素实验确定生产细菌纤素的培养条件为:杨木木屑水解液还原糖浓度为2.5%,接种量为6%,初始pH6.0,30℃恒温静止发酵6 d,细菌纤维素产量达3.14 g/L,持水性为98.72%,复水率为86.69%。扫描电镜表明合成产物是一种超微网状结构,其纤维直径属于纳米尺寸,是由高密度的微纤维相互缠绕而成的。红外光谱分析验证了合成的产物确为细菌纤维素。热重曲线显示两种细菌纤维素最大失重温度分别为327.93℃和330.09℃,热稳定性好。
[1]马霞, 土瑞明, 贾士儒. 细菌纤维素在食品工业中的应用[J].食品研究与研发, 2002, 23(5):11-12.
[2]Wu RQ, LI ZX, Yang JP, et al. Mutagenesis induced by high hydrostatic pressure treatment:a useful method to improve the bacterial cellulose yield of a Gluconacetobacter xylinus strain[J]. Cellulose, 2010, 17(2):399-405.
[3]Vandamme EJ, de Baets S, Vanbaelen A, et al. Improved production of bacterial cellulose and its application potential[J]. Polymer Degradation and Stability, 1998, 59(1):93-99.
[4]Jonas R, Farah LF. Production and application of microbial cellulose[J]. Polmer Degradation and Stability, 1998, 59(1):101-106.
[5]沈金朋, 罗庆平, 段晓惠, 等. 利用酒糟浸出液制各细菌纤维素[J]. 食品科学, 2010, 31(3):203-206.
[6]Okiyama A, Motoki M, Yamanaka S. Bacterial cellulose II. Processing of the gelatinous cellulose for food material[J]. Food Hydrocolloids, 1993, 6(5):503-511.
[7]Sheu FS, Wng CL, Shyu YT. Fermentation of Monascus purpureus on bacterial cellulose-nata and the color stability of Monascus-nata complex[J]. Food Microbiology and Safety, 2000, 65(2):342-345.
[8]Carvalheiro F, Duarte LC, Lopes S, et al. Evaluation of the detoxification of brewery's spent grain hydrolysate for xylitol production by Debaryomyces hansenii CCMI 941[J]. Process Biochemistry, 2005, 40(3-4):1215-1223.
[9]Larsson S, Reimann A, Nilvebrant N O, et al. Comparison of different methods for the detoxification of lignocellulose hydrolyzates of spruce[J]. Applied Biochemistry and Biotechnoloev, 1999, 77(1):91-103.
[10]宋海农, 张远秋, 郭华清. 细菌纤维素在造纸工业中的应用和展望明[J]. 广西大学学报:自然科学版, 2004, 29(1):73-76.
[11]Gao Q, Shen X, Lu X. Regenerated bacterial cellulose fibers prepared by the NMMO·H2O process[J]. Carbohydrate Polymers, 2011, 83(3):1253-1256.
[12]Kurosumi A, Sasaki C, Yamashita Y, et al. Utilization of various fruit juices as carbon source for production of bacterial cellulose by Acetobacter xylinum NBRC 13693[J]. Carbohydrate Polymers, 2009, 76(2):333-335.
[13]Jung HI, Lee OM, Jeong JH, et al. Production and characterization of cellulose by Acetobacter sp. V6 using a cost-effective molassescorn steep liquor medium[J]. Appl Biochem Biotechnol, 2010, 162(2):486-497.
[14]洪枫, 朱颖雪, 郭建平, 等. 一种利用麦秆生产细菌纤维素的方法:中国, 200910047348.5[P].
[15]洪枫, 韩士芬, 曹张军, 等. 一种利用玉米秆制备细菌纤维素的方法:中国, 201010580800[P].
[16] Hong F, Zhu YX, Yang G, et al. Wheat straw acid hydrolysate as a potential cost-effective feedstock for production of bacterial cellulose[J]. J Chem Technol Biotechnol, 2011, 86:675-680.
[17] Hong F, Han SF. Biorefinery of bacterial cellulose from rice straw:enhanced enzymatic saccharification by ionic liquid pretreatment[J]. Engineering Sciences, 2011, 9(4):23-26, 54.
[18]Kuo CH, Lin PJ, Lee CK. Enzymatic saccharification of dissolution pretreated waste cellulosic fabrics for bacterial celluloseproduction by Gluconacetobacter xylinus[J]. Journal of Chemical Technology & Biotechnology, 2010, 85(10):1346-1352.
[19]陈代杰, 金飞燕, 主译[M]. 生物高分子(第五卷). 北京:化学工业出版社, 2004.
[20]黄丹, 王清路, 王云飞. 木醋杆菌QAX993发酵生产细菌纤维素条件的探讨[J]. 中国酿造, 2008, 12:36-37.
[21]赵克勤, 谭平, 鲁伦文, 等. 利用谷氦酸提取液生产细菌纤维素的研究[J]. 食品与机械, 2003, 23(2):53-54.
[22]汤卫华, 李飞, 贾原媛. 细菌纤维素高产菌株的诱变选育和发酵条件的研究[J]. 2009, 25(9):1016-1019.
[23]George J, Ramana K, Sabapathy SN, et al. Characterization of chemically treated bacterial(Acetobacter xylinum)biopolymer:Some thermo-mechanical properties[J]. International Journal of Biological Macromolecules, 2005, 37(4):189- 194.
(责任编辑 狄艳红)
Employing Poplar Wood Hydrolysate to Prepare Bacterial Cellulose
CHEN Hui-hui LIU Yu WANG Hui-mei
(Key Laboratory of Pulp and Paper Science & Technology of Ministry of Education,Qilu University of Technology,Jinan 250353)
Selecting the hydrolysate of poplar wood sawdust for fermentation substrate,we used Acetobacter xylinum to prepare bacterial cellulosee,and further studied the effect of reducing sugar concentration,the initial pH,inoculum size,fermentation temperature,and fermentation time on production,water holding capacity,and rehydration rate of bacterial cellulose. The results showed that the production of bacterial cellulose was 3.14 g/L,water holding capacity of bacterial cellulose was 98.72%,and bacterial cellulose rehydration was 86.69% when reducing sugar concentration of hydrolyzed poplar wood sawdust was 2.5%,the initial pH was 6.0,inoculum size was 6%,fermentation time was 6 d,and fermentation temperature was 30℃.The detection results of scanning electron microscope,infrared spectroscopy,and thermo-gravimetric analysis indicated that the structure of synthetic product was super fine mesh and the groups of the product corresponded to the structure of cellulose.
hydrolysate of poplar wood sawdust;scanning electron microscope;infrared spectroscopy;thermo-gravimetric analysis
10.13560/j.cnki.biotech.bull.1985.2017.03.021
2016-07-08
国家自然科学基金项目(31270626)
陈慧慧,女,硕士研究生,研究方向:植物资源化学工程与木质纤维基功能材料;E-mail:chhuihui2016054@163.com
刘玉,男,博士,教授,研究方向:植物资源化学工程与木质纤维基功能材料;E-mail:leoliuyu@163.com
