汉阳地区湖泊摇蚊幼虫群落结构及其与环境因子的关系
2017-04-06刘红艳张繁荣
刘红艳,熊 飞,张繁荣,郭 爽
(江汉大学生命科学学院, 武汉 430056)
汉阳地区湖泊摇蚊幼虫群落结构及其与环境因子的关系
刘红艳,熊 飞,张繁荣,郭 爽
(江汉大学生命科学学院, 武汉 430056)
为了解武汉市汉阳地区湖泊摇蚊幼虫群落结构和多样性及其与湖泊富营养化的关系,2011-2012年对后官湖、三角湖、南太子湖、墨水湖和龙阳湖等5个湖泊的摇蚊幼虫群落及环境因子进行了季节性调查。在汉阳5个湖泊共采集摇蚊科幼虫6属6种。中国长足摇蚊是这些湖泊摇蚊幼虫群落的共同优势种,优势度变化范围为26.8%~86.4%。摇蚊幼虫年平均密度为(748 ± 162) ind./m2,年平均生物量为(2.77 ± 0.98) g/m2,后官湖摇蚊幼虫密度和生物量最低[(171 ± 32)ind./m2,(0.32 ± 0.12)g/m2],龙阳湖最高[(1 066 ± 468)ind./m2,(5.37 ± 2.48)g/m2])。摇蚊幼虫密度和生物量最高值出现在1月份。摇蚊幼虫Margalef指数(dM)和Shannon-Wiener指数(H′)平均值分别为0.38 ± 0.05和0.72 ± 0.12,后官湖摇蚊幼虫多样性指数最高(dM= 0.58±0.12,H′ = 1.03 ± 0.19),南太子湖最低(dM= 0.28 ± 0.14,H′= 0.38 ± 0.13)。相关分析表明,汉阳地区湖泊摇蚊幼虫密度和生物量与水体总氮、氨氮、总磷和叶绿素a呈显著正相关。冗余分析(RDA)表明,透明度和总氮是影响摇蚊幼虫群落组成的关键因子。研究结果表明汉阳湖泊摇蚊幼虫优势种、密度、生物量和多样性指数对湖泊水质有较好的指示作用。
摇蚊幼虫; 群落结构; 多样性; 环境因子;汉阳
摇蚊幼虫(Chironomid larvae)是底栖动物群落的主要组成部分,广泛分布于各类淡水水体中,在生态系统物质循环和能量流动中具有重要作用[1]。摇蚊幼虫可加速水底有机碎屑分解,调节沉积物-水界面物质交换[2],同时其扰动作用可促进沉积物氮、磷的释放[3]。摇蚊幼虫对污染等不利环境因素的回避能力较弱,一旦水体污染加重,敏感种数量将下降甚至消失,只有耐污种能存活下来,因此摇蚊幼虫是很好的环境指示生物[4,5]。摇蚊幼虫密度和生物量与水体营养盐水平呈正相关[6],其生物多样性与营养水平呈负相关[7]。通过分析摇蚊幼虫群落的变化,可以了解水体的富营养化过程[8]。目前国内对摇蚊幼虫生态学的研究,大都是将其结合在底栖动物中[9]。系统研究摇蚊幼虫群落结构和多样性将更有利于理解摇蚊幼虫群落与湖泊富营养化的关系。
武汉市汉阳地区湖泊众多,水资源丰富。这些湖泊多为小型浅水湖泊,面积在3 km2以内,水深2 m以内,后官湖稍大,面积约11 km2,最大水深3.0 m[10]。该区域随着城市化的快速发展,水环境压力不断增大。目前,对这些湖泊的关注主要集中在水质方面[11,12],缺少对湖泊生物群落和多样性的关注,特别缺乏对湖泊重要生物类群底栖动物群落的研究。姜苹红等[13]根据2002-2005年的调查资料侧重研究了该地区三角湖和月湖等湖泊底栖动物群落结构和空间分布,但未涉及其群落结构和多样性的季节变化规律。随着人类的活动加剧,我国大部分湖泊富营养化趋势加剧,生物多样性下降[14]。汉阳地区湖泊摇蚊幼虫群落结构和多样性对湖泊富营养化的响应如何?2011年7月-2012年4月对汉阳地区5个湖泊(后官湖、三角湖、墨水湖、南太子湖和龙阳湖)的摇蚊幼虫群落及其环境因子进行了季节性调查,以了解这些湖泊的摇蚊幼虫群落结构和多样性及其季节变化规律,探讨摇蚊幼虫群落与湖泊富营养化的关系,为城市湖泊富营养化防治和生态修复提供依据。
1 材料与方法
1.1 样品采集
2011年7月、10月及2012年1月、4月分别对汉阳地区后官湖(H)、三角湖(S)、墨水湖(M)、南太子湖(N)、龙阳湖(L)等5个湖泊的摇蚊幼虫进行调查。样点设置和水质参数的现场测定见文献[15]。水质参数现场测定指标包括水深(Depth)、透明度(SD)、水温(WT)、电导率(Cond.)、溶解氧(DO)、氧化还原电位(ORP)和pH值。用彼得生采泥夹(面积为1/20 m2)采集表层沉积物,每个样点采集2夹混合后用0.45 mm孔径的网兜筛洗,将筛洗后的样品用封口袋装好,带回实验进一步处理。各样点采集少量表层沉积物,用封口袋装好,带回实验室分析沉积物营养盐。
1.2 水质和沉积物营养盐分析
1.3 群落结构和多样性分析
将样品中的摇蚊幼虫挑选出,用10%的福尔马林固定保存备用。在解剖镜和显微镜下进行种类鉴定[19,20],并对摇蚊幼虫进行分类计数和称重。用滤纸将摇蚊幼虫体表保存液轻轻吸干,用万分之一天平进行称量。将各样点底栖动物数量和重量换算成密度(ind./m2)和生物量(g/m2)。
物种优势度计算公式为[21]:优势度=(相对密度+相对生物量+相对频度)/3。式中,相对密度(相对生物量、相对频度)=密度(生物量、频度)/所有物种密度(生物量、频度)之和,频度=物种出现样点数/总样点数。
采用Margalef指数(dM)[22]和Shannon-Wiener指数(H′)[23]分析摇蚊幼虫群落多样性:
dM=(S-1)/lnN
H′=-∑(ni/N)ln(ni/N)
式中:S为物种的数目,N为底栖动物的总密度,ni为物种i的密度。
1.4 生物与环境关系分析
采用相关分析分析摇蚊幼虫密度、生物量及多样性指数与环境因子的关系,在相关分析前,先将数据作自然对数(log(x))转换,分析采用Excel和SPSS软件。采用约束排序分析摇蚊幼虫群落组成和环境因子的关系,物种数据先进行对数转化(log(x + 1)),剔除出现频率小于5%的物种;先用除趋势对应分析(DCA)对物种数据进行排序分析,当各排序轴中最大的梯度长度大于3时,选典范对应分析(CCA)对物种和环境因子进行排序,当梯度小于3时,选冗余分析(RDA)[24]。通过逐步选择(Forward selection)和蒙得卡罗筛选检验法筛选有效的环境因子组合,对物种数据进行解释。分析采用CANOCO4.5软件。
2 结果与分析
2.1 种类组成
2011-2012年在汉阳地区5个湖泊中共采集摇蚊幼虫6种(表1),隶属于摇蚊科的3亚科6属。其中,后官湖、三角湖和南太子湖各5种,墨水湖和龙阳湖各4种。异腹鳃摇蚊仅在后官湖采集到,而羽摇蚊在后官湖中未采集到。5个湖泊中摇蚊幼虫年平均出现率为84.2%,其中,墨水湖摇蚊幼虫出现频率最高(100%),龙阳湖摇蚊幼虫出现频率最低(56.3%)。龙阳湖摇蚊幼虫出现频率较低,表明该湖摇蚊幼虫的空间分布不均匀。
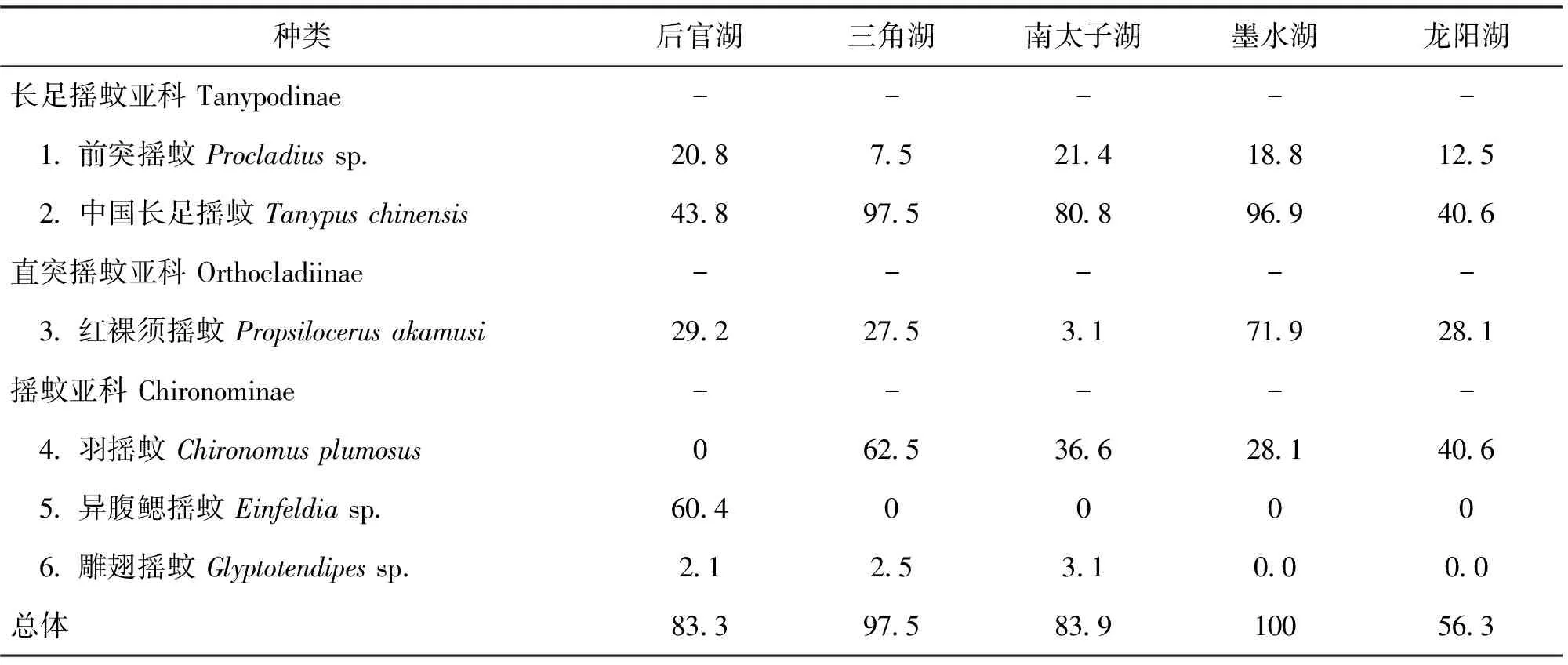
表1 武汉市汉阳5个湖泊摇蚊幼虫种类组成及出现频率
2.2 密度和生物量
汉阳地区5个湖泊摇蚊幼虫平均密度为(748 ± 162)ind./m2,平均生物量为(2.77±0.98)g/m2。后官湖摇蚊幼虫密度和生物量最低,平均密度为(171±32)ind./m2,平均生物量为(0.32±0.12)g/m2;龙阳湖摇蚊幼虫密度和生物量最高,平均密度为(1 066±468)ind./m2,平均生物量为(5.37 ±2.48)g/m2(图 1)。摇蚊幼虫密度和生物量存在明显的季节变化,不同湖泊摇蚊幼虫密度和生物量最低值出现的季节不同(图 2),但除南太子湖外,其它湖泊摇蚊幼虫密度和生物量最高值都出现在1月份。5个湖泊摇蚊1月份摇蚊幼虫平均密度为(1 302 ± 398)ind./m2,平均生物量为(6.62 ± 2.56)g/m2。
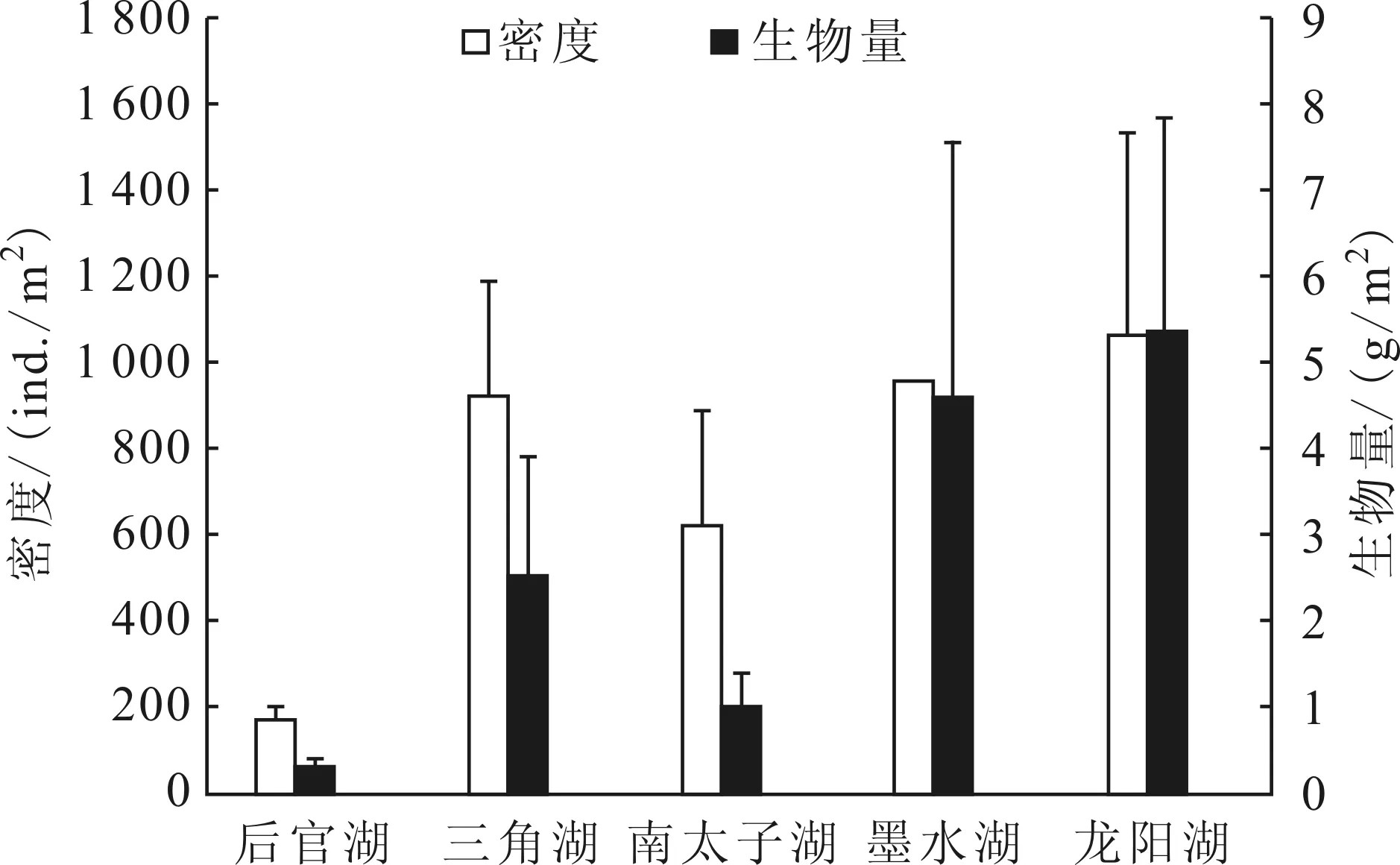
图1 武汉市汉阳5个湖泊群摇蚊幼虫密度和生物量Fig.1 Density and biomass of chironomid larvae in the five lakes of Hanyang, Wuhan
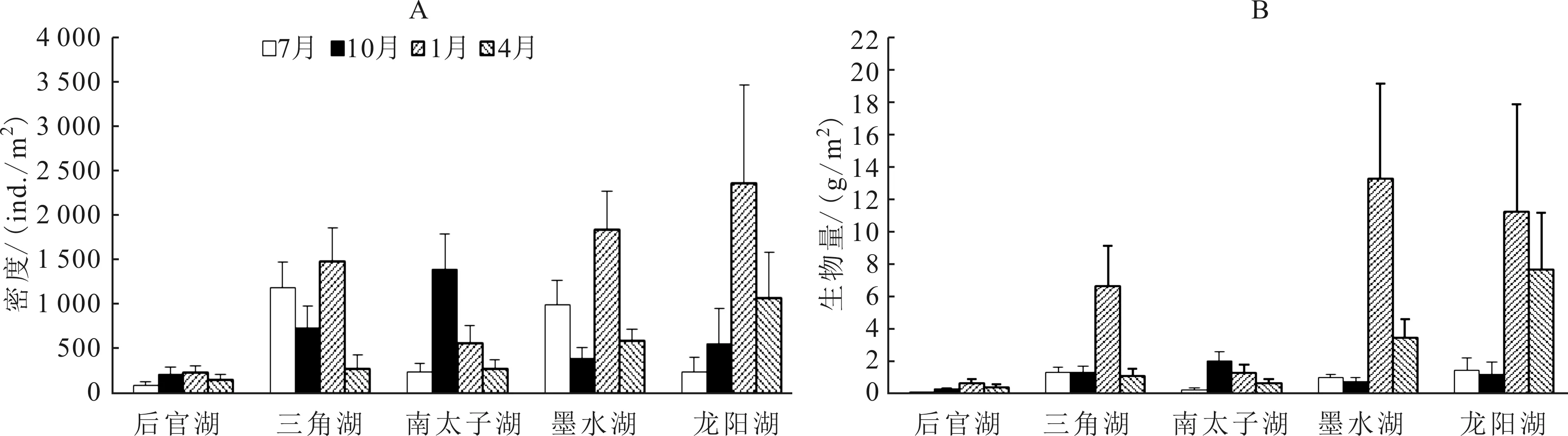
图2 武汉市汉阳5个湖泊摇蚊幼虫密度(A)和生物量(B)的季节变化Fig.2 Seasonal variations in density and biomass of chironomid larvae in the five lakes of Hanyang, Wuhan
2.3 优势度
中国长足摇蚊(Tanypuschinensis)是汉阳地区5个湖泊摇蚊幼虫群落的共同优势种(图3),优势度变化范围为26.8%~86.4%,平均优势度为55.2%。红裸须摇蚊(Propsilocerusakamusi)在1月占较大优势,优势度变化范围为3.6%~57.6%,平均优势度为35.1%。异腹鳃摇蚊为后官湖摇蚊幼虫第二优势种,年优势度变化范围为19.6%~56.0%,平均优势度为34.6%。除后官湖外,羽摇蚊在其它4个湖泊占一定优势,优势度范围为4.8%~69.0%,平均优势度为18.0%。南太子湖摇蚊幼虫优势种的优势度非常突出,仅中国长足摇蚊的优势度就达81.4%,表明其物种分布不均匀,群落结构简单,而后官湖各物种的分布最均匀。
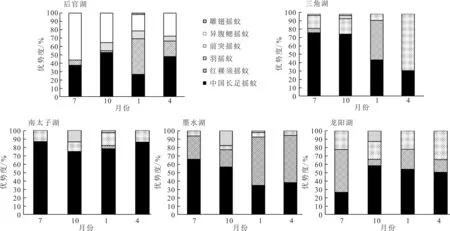
图3 武汉市汉阳5个湖泊摇蚊幼虫优势度Fig.3 Dominance of chironomid larvae in the five lakes of Hanyang, Wuhan
2.4 生物多样性指数
汉阳地区5个湖泊摇蚊幼虫Margalef指数平均值为0.38 ± 0.05,Shannon-Wiener指数平均值为0.72 ± 0.12。后官湖摇蚊幼虫多样性指数最高,Margalef指数为0.58 ± 0.12,Shannon-Wiener指数为1.03 ± 0.19;南太子湖多样性指数最低,Margalef指数为0.28 ±0.14,Shannon-Wiener指数为0.38 ± 0.13(图4)。后官湖Margalef指数和Shannon-Wiener指数季节变化趋势一致,1月份最高,7月份最低;其它湖泊2个指数的季节变化趋势不一致(图5)。
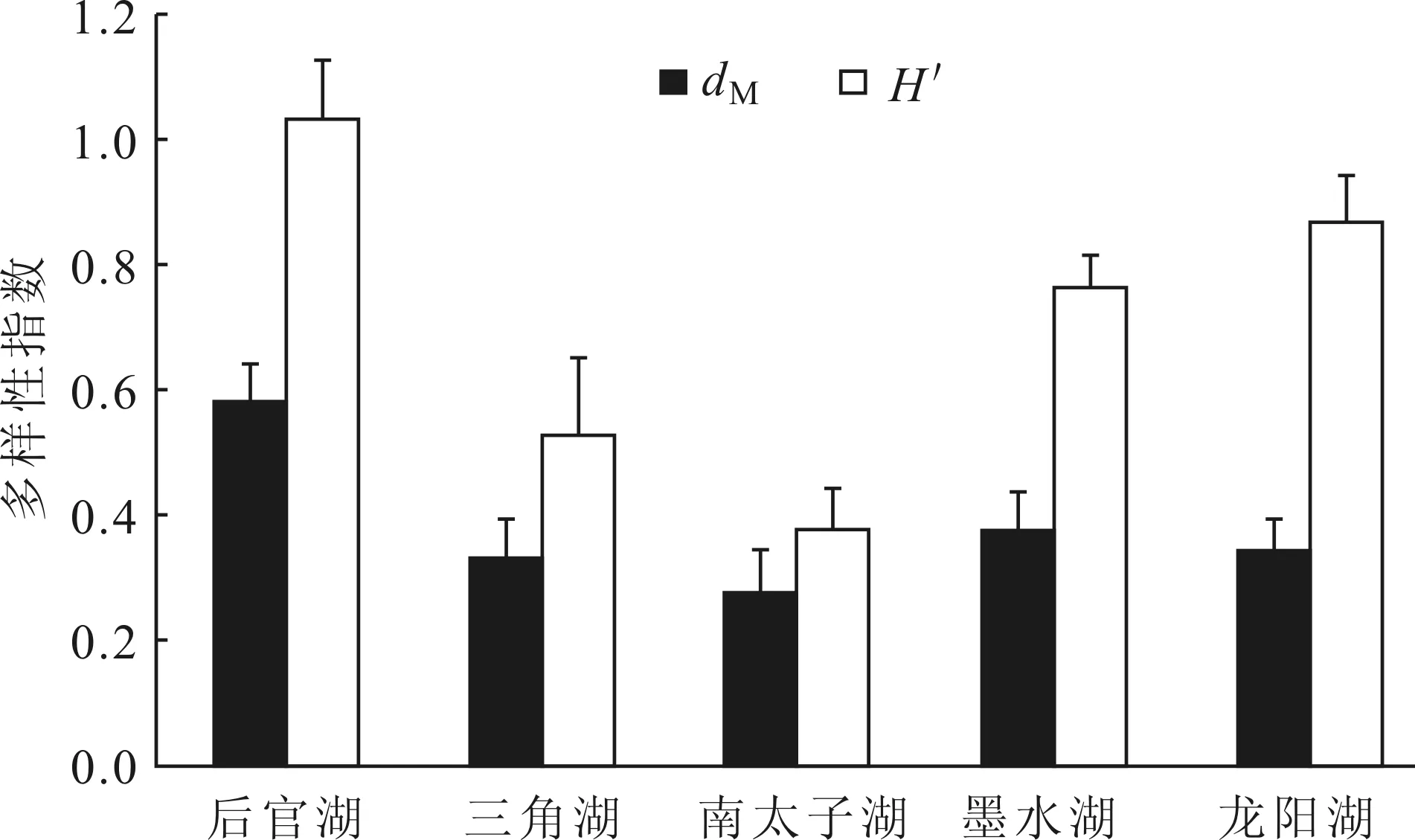
图4 武汉市汉阳5个湖泊摇蚊幼虫Margalef指数(dM)和Shannon-Wiener指数(H′)Fig. 4 Margalef index (dM) and Shannon-Wiener index (H′) of chironomid larvae community in the five lakes of Hanyang, Wuhan
2.5 摇蚊幼虫与环境因子的关系
后官湖水体总氮(TN)、总磷(TP)和叶绿素(Chl.a)等指标最低,透明度(SD)最高,而龙阳湖的TN、TP和Chl.a等指标明显高于其它湖泊,SD最低。后官湖综合营养状态指数最低(48 ± 2),为中营养,龙阳湖最高(84 ± 4),三角湖、南太子湖和墨水湖相近,分别为71±2,73±3和74±4,均为重度富营养。
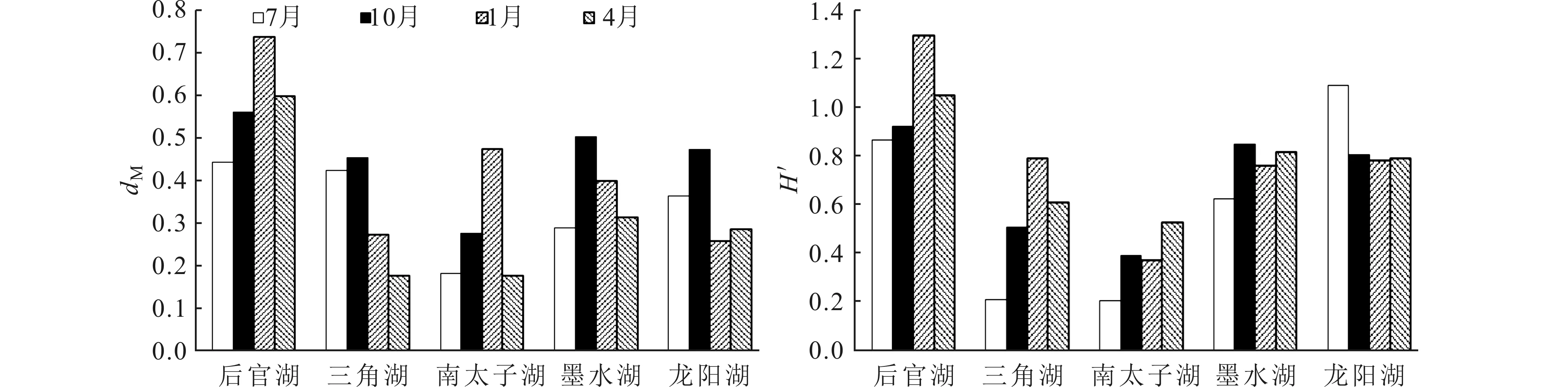
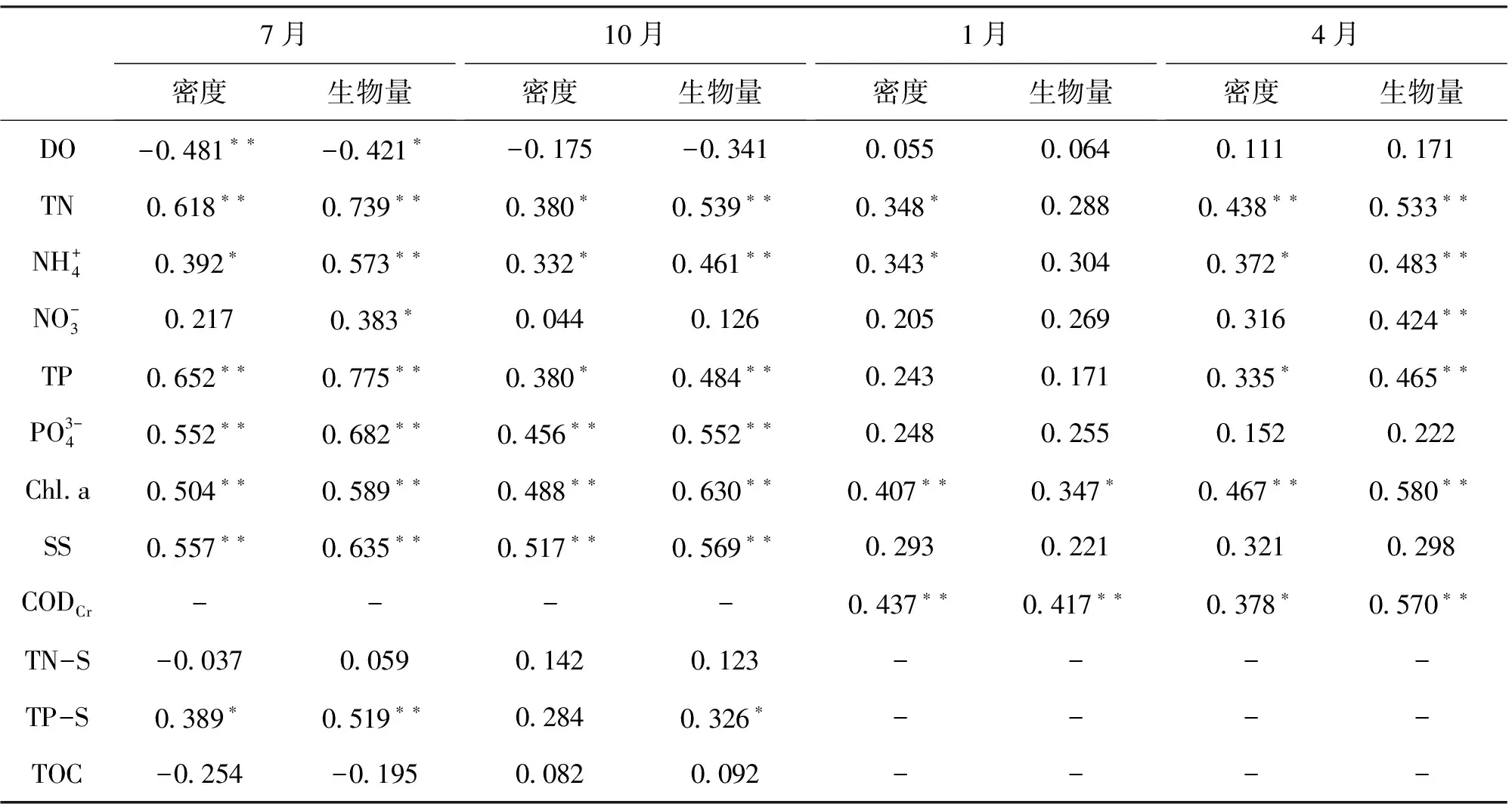
图5 武汉市汉阳5个湖泊摇蚊幼虫Margalef指数(dM)和Shannon-Wiener指数(H′)的季节变化Fig.5 Seasonal variations in Margalef index (dM) and Shannon-Wiener index (H′) of chironomid larvae in the five lakes of Hanyang, Wuhan 表2 摇蚊幼虫密度和生物量与环境因子的Pearson相关系数(n=46)Tab.2 Pearson correlation coefficients between chironomid larva density/biomass and environmental variables (n=46)
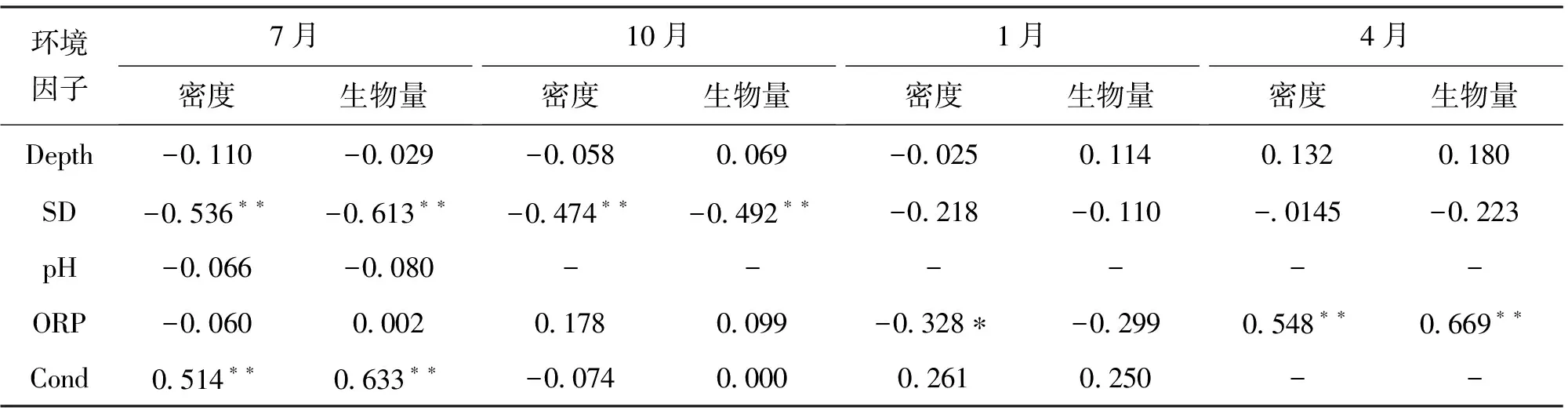
环境因子7月密度生物量10月密度生物量1月密度生物量4月密度生物量Depth-0110-0029-00580069-0025011401320180SD-0536∗∗-0613∗∗-0474∗∗-0492∗∗-0218-0110-0145-0223pH-0066-0080------ORP-0060000201780099-0328∗-02990548∗∗0669∗∗Cond0514∗∗0633∗∗-0074000002610250--
续表2
注:**P=0.01水平上显著相关;*P=0.05水平上显著相关;“-”表示数据缺失。
用约束排序法分析了汉阳湖泊摇蚊幼虫物种组成和环境的关系。DCA分析表明,各轴中最大的梯度长度为2.506,因此选择RDA来分析物种和环境的关系。结果显示,环境变量SD和TN通过了逐步选择的显著性检验(图6),表明SD和TN是影响汉阳湖泊摇蚊幼虫群落组成的主要环境因子。RDA图前两轴共解释了38.5%摇蚊幼虫物种数据的方差,解释了100%物种与环境关系的方差。第一轴代表了水体透明度梯度,第二轴代表了营养盐梯度。异腹鳃摇蚊主要分布在透明度高和总氮低的后官湖样点(H),而红裸须摇蚊对总氮浓度的耐受性要高于其它种类,在龙阳湖(L)和墨水湖(M)分布较多。
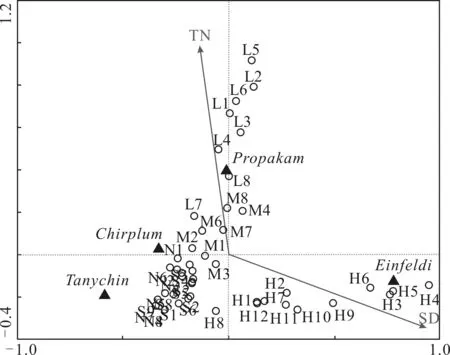
图6 摇蚊幼虫种类、筛选出的主要环境因子透明度(SD)和总氮(TN)和样点的RDA排序图Fig. 6 The chironomid species, environmental variables and samples triplot of RDA with environmental variables (SD and TN) selected by the forward selection procedure黑色三角形代表物种,Tanychin, Propakam, Chirplum, Einfeldi分别代表中国长足摇蚊,红裸须摇蚊,羽摇蚊和异腹鳃摇蚊。箭头代表环境因子,圆圈代表样点(H为后官湖、S为三角湖、N为南太子湖、M为墨水湖、L为龙阳湖)
3 讨论
3.1 摇蚊幼虫密度和多样性的影响因子
摇蚊幼虫密度还受摇蚊幼虫生物学特性影响[27]。红裸须摇蚊主要生长在冬季,当水温高于20℃时,幼虫开始钻到底泥深处休眠,等温度降低后才开始大量出现在表层沉积物中[28]。汉阳地区湖泊摇蚊幼虫密度在冬季最高,这与优势种红裸须摇蚊的季节动态有关,其1月份平均优势度高达35.1%,其它季节较低。另外,冬季水温偏低,减少了鱼类的捕食压力和摇蚊幼虫羽化现象的发生[29]。
生境异质性是影响底栖动物多样性的主要因素[30]。中营养型湖泊具有丰富的沉水植物分布和各种类型的底质条件等,能够适应更多物种的生存,具有较高的生物多样性[9,31]。胡成龙等[32]年在湖北省的27个面积大于10 km2的湖泊中采集摇蚊幼虫16种,发现底栖动物多样性和湖泊面积呈显著正相关。江苏滆湖面积约164 km2,有摇蚊幼虫12种[33]。湖泊面积越大,可提供的栖息生境也越多样性,从而可以支持更多的物种。本研究在汉阳地区湖泊共采集摇蚊幼虫6种,物种数与姜苹红等[13]调查结果一致,表明汉阳地区湖泊摇蚊幼虫群落结构比较单一,这与汉阳地区湖泊富营养化加剧,湖泊生境单一化有关。三角湖、南太子湖、墨水湖和龙阳湖均为面积小于3 km2的小型浅水湖泊,入湖污染增加和高密度的水产养殖活动加剧了其富营养化和生境退化。2007年的调查显示,三角湖曾分布有沉水植物7种[34],而本调查在上述湖泊中均未见沉水植物分布。后官湖面积最大,尚有沉水植物分布,富营养化程度较轻,在5个湖泊中摇蚊幼虫多样性指数最高。南太子湖摇蚊幼虫多样性最低,与中国长足摇蚊占绝对优势,物种分布不均匀有关。本研究表明,汉阳湖泊摇蚊幼虫Margalef指数和Shannon-Wiener指数与湖泊综合营养状态指数和水体营养盐指标相关关系不显著,表明湖泊摇蚊幼虫多样性的影响因子比较复杂,不只受水体营养盐的影响。南太子湖的水体氮、磷含量和绿素a含量并不是最高,但其固体悬浮物含量较高,年均值37.06 mg/L,1月份含量为5个湖泊中最高,高达52.21 mg/L。推测南太子湖的高浓度的悬浮物可能来自周围工厂的排污,悬浮物中的某些化学物质可能影响了摇蚊幼虫的生存,造成其多样性较低。
3.2 摇蚊幼虫对环境的指示
中国长足摇蚊是长江中下游湖泊的常见种类,具有较强的耐污能力[33,35],其密度与水体营养水平呈显著正相关[6]。本研究表明,中国长足摇蚊是汉阳湖泊摇蚊幼虫群落的第一优势种,其密度随湖泊营养水平增加而增加:在污染程度较低的后官湖,其平均密度为80 ind./m2,在污染程度居中的三角湖、南太子湖和墨水湖,平均密度为311~647 ind./m2,在污染最严重的龙阳湖,平均密度为719 ind./m2。2002-2005年的调查显示[13],中国长足摇蚊在后官湖未见分布,目前已发展成为第一优势种,平均优势度达41.3%,可能与后官湖的富营养化趋势加剧有关。后官湖总氮已由2008年的1.3 mg/L上升到目前的1.62 mg/L[36]。羽摇蚊和红裸须摇蚊是典型的湖泊富营养化指示种[8]。本研究表明羽摇蚊在污染相对较轻的后官湖未见分布,但在污染最严重的龙阳湖密度最高,平均密度为198 ind./m2,在其它湖泊的平均密度为19~100 ind./m2。红裸须摇蚊在后官湖的密度较小(25 ind./m2),而在三角湖、墨水湖和龙阳湖中的密度为143~372 ind./m2。异腹鳃摇蚊为后官湖的优势种之一,而在其它4个湖中未见分布,表明异腹鳃摇蚊倾向分布于污染较轻的水体。20世纪80年代异腹鳃摇蚊在滇池广泛分布,随着富营养化的加剧,逐渐被羽摇蚊和中国长足摇蚊等耐污种取代[26]。
本研究表明,汉阳湖泊摇蚊幼虫群落与营养水平关系密切,水体SD和TN是影响汉阳湖泊摇蚊幼虫物种组成的关键因子,因此可以用摇蚊幼虫群落来指示湖泊环境。生物多样性指数水质评价的标准为:Margalef指数(dM)为0~1时代表重污染,1~2为中污染,2~2.5为轻度污染,大于2.5为清洁;Shannon-Wiener指数(H′)为0~1时代表重污染,1~2为中污染,2~3为轻度污染,大于3为清洁[37]。据此,后官湖dM为0.58,H′为1.03,为中—重污染,其它4个湖泊dM为0.28~0.38,H′为0.38~0.87,为重污染。这与综合营养状态指数的评价结果基本一致。
[1] Armitage P, Cranston P S, Pinder LCV. The Chironomidae:Biology and Ecology of Non-biting Midges[M]. London:Chapman and Hall, 1995.
[2] 商景阁, 张 路, 张 波, 等. 中国长足摇蚊(Tanypuschinensis)幼虫底栖扰动对沉积物溶解氧特征及反硝化的影响[J]. 湖泊科学, 2010, 22(5):708-713.
[3] 陈天乙, 刘 孜. 摇蚊幼虫对底泥中氮、磷释放作用的研究[J]. 昆虫学报, 1995, 38(4):448-451.
[4] 王银东, 熊邦喜, 陈才保, 等. 环境因子对底栖动物生命活动的影响[J]. 浙江海洋学院学报(自然科学版), 2005, 24(3):253-258.
[5] 胡忠军, 刘其根, 陈立婧, 等. 上海崇明明珠湖摇蚊幼虫群落结构特征及其对水质的指示作用[J]. 应用生态学报, 2009, 20(4):929-936.
[6] 熊金林, 梅兴国, 胡传林. 不同污染程度湖泊底栖动物群落结构及多样性比较[J]. 湖泊科学, 2003, 15(2):160-168.
[7] 龚志军, 谢 平, 唐汇涓, 等. 水体富营养化对大型底栖动物群落结构及多样性的影响[J]. 水生生物学报, 2001, 25(3):210-216.
[8] 舒凤月, 孔 亮, 王赛迪, 等. 山东南四湖摇蚊幼虫群落结构及其对富营养化过程的指示[J]. 应用与环境生物学报, 2013, 19(1):141-146.
[9] 蔡永久, 龚志军, 秦伯强. 太湖大型底栖动物群落结构及多样性[J]. 生物多样性, 2010, 18(1):50-59.
[10] 阮柏野, 熊 飞, 刘红艳, 等. 汉阳湖群表层沉积物磷含量分布特征[J]. 水生态学杂志, 2012, 33(5):1-6.
[11] 刘耀彬, 陈红梅. 武汉市主城区湖泊发展的历史演变、问题及保护建议[J]. 湖北大学学报(自然科学版), 2003, 25(2):163-167.
[12] 黄 宇, 邓绪伟, 徐 军, 等. 武汉市后官湖水环境问题和污染防治对策分析[J]. 长江流域资源与环境, 2015, 24(6):1030-1037.
[13] 姜苹红, 崔永德, 王海军, 等. 汉阳湖群底栖动物群落及其对环境质量的指示[J]. 长江流域资源与环境, 2011, 20(5):525-533.
[14] Qin B Q, Gao G, Zhu G W, et al. Lake eutrophication and its ecosystem response[J]. China Science Bulletin, 2013, 58(9):961-970.
[15] 刘红艳, 熊 飞, 宋丽香, 等. 汉阳地区五个湖泊沉水植物分布及富营养化现状[J]. 淡水渔业, 2017, 47(1):107-112.
[16] 水和废水监测分析方法编委会. 水和废水监测分析方法(第4版) [M]. 北京:中国环境科学出版社, 2002.
[17] 王明翠, 刘雪芹, 张建辉. 湖泊富营养化评价方法及分级标准[J]. 中国环境监测, 2002, 18(5):47-49.
[18] 鲍士旦. 土壤农化分析(第3版) [M]. 北京:中国农业出版社, 2000.
[19] Morse J C, Yang L F, Tian L X. Aquatic Insects of China Useful for Monitoring Water Quality[M]. Nanjing:Hohai University Press, 1994.
[20] 王俊才, 王新华. 中国北方摇蚊幼虫[M]. 北京:中国言实出版社, 2011.
[21] 曹凑贵. 生态学概论(第2版) [M]. 北京:高等教育出版社, 2006.
[22] Margalef D R. Information theory in ecology[J]. Gen Syst, 1957, 3:36-37.
[23] Shannon C E. The mathematical theory of communication[J]. Bell Syst Tech J, 1948, 27:379-423.
[24] Leps J, Smilauer P. Multivariate Analysis of Ecological Data using CANOCO[M]. Cambridge:Cambridge University Press, 2003.
[25] 许 浩, 蔡永久, 汤祥明, 等. 太湖大型底栖动物群落结构与水环境生物评价[J]. 湖泊科学, 2015, 27(5):840-852.
[26] 王丑明, 谢志才, 宋立荣, 等. 滇池大型无脊椎动物的群落演变与成因分析[J]. 动物学研究, 2011, 32(2):212-221.
[27] 郭先武. 武汉南湖三种摇蚊幼虫生物学特性及其种群变动的研究[J]. 湖泊科学, 1995, 7(3):249-255.
[28] Hirabayashi K, Hanazato T, Nakamoto N. Population dynamics ofPropsilocerusakamusiandChironomusplumosus(Diptera:Chironomidae) in Lake Suwa in relation to changes in the lake’s environment[J]. Hydrobiologia, 2003, 506(1):381-388.
[29] Kajak Z. Role of invertebrate predator (mainlyProcladiussp.) in benthos[M]// Murray D A. Chironomidae:Ecology, Systematic, Cytology and Physiology. Oxford:Pergamon Press, 1980:339-347.
[30] Shostell J M, Williams B S. Habitat complexity as a determinate of benthic macroinvertebrate community structure in cypress tree reservoirs[J]. Hydrobiologia, 2007, 575(1):389-399.
[31] 闫云君, 李晓宇, 梁彦龄. 草型湖泊和藻型湖泊中大型底栖动物群落结构的比较[J]. 湖泊科学, 2005, 17(2):176-182.
[32] 胡成龙, 姜加虎, 陈宇炜, 等 久. 湖北省湖泊大型底栖动物群落结构及水质生物学评价[J]. 生态环境学报, 2014, 23(1):129-138.
[33] 熊春晖, 张瑞雷, 季高华, 等. 江苏滆湖大型底栖动物群落结构及其与环境因子的关系[J]. 应用生态学报, 2016, 27(3):927-936.
[34] 董元火, 曾长立, 吴 翠. 湖北省三角湖水生植物物种多样性研究[J]. 安徽农业科学, 2008, 36(6):2416-2418.
[35] 蔡永久, 刘劲松, 戴小琳, 等 军. 长荡湖大型底栖动物群落结构及水质生物学评价[J]. 生态学杂志, 2014, 33(5):1224-1232.
[36] 杨国胜, 叶 闽, 余秋梅, 等. 后官湖地区生态现状及其保护建议[J]. 人民长江, 2008, 39(23):94-96.
[37] 池仕运, 舒卫先, 胡菊香, 等. 基于大型底栖动物的沙颍河干流水质生物学评价——两种方法体系的比较分析[J]. 长江流域资源与环境, 2015, 24(S1):78-84.
(责任编辑:张潇峮)
Community structure of chironomid larvae and relationship withenvironmental factors from lakes in Hanyang, Wuhan
LIU Hong-yan, XIONG Fei, ZHANG Fan-rong, GUO Shuang
(SchoolofLifeSciences,JianghanUniversity,Wuhan430056,China)
To understand the community structure and diversity of chironomid larvae and relationship with eutrophication in the lakes of Hanyang, Wuhan, China, a seasonal survey on chironomid larvae and environmental variables was conducted in five lakes (Houguan Lake, Sanjiao Lake, Nantaizi Lake, Moshui Lake and Longyang Lake) during 2011-2012. Altogether 6 species, 6 genera of chironomid larvae were collected from the five lakes in Hanyang.Tanypuschinensisdominated the community of chironomid larvae in the five lakes, with the dominance ranging from 26.8% to 86.4%. The annual average density of chironomid larvae was (748 ± 162) ind./m2, and the annual average biomass was (2.77 ± 0.98) g/m2. The highest average density (171 ± 32)ind./m2and biomass (0.32 ± 0.12)g/m2occurred in Houguan Lake, while the lowest values occurred in Longyang Lake [(1 066 ± 468)ind./m2and (5.37 ± 2.48)g/m2]. The peak of density and biomass was observed in January. Average Margalef index (dM) and Shannon-Wiener index (H′) of the community of chironomid larvae from the five lakes in Hanyang were 0.38 ± 0.05 and 0.72 ± 0.12, respectively. The highest diversity (dM=0.58 ± 0.12,H′=1.03 ± 0.19) occurred in Hougan Lake, and the lowest diversity (dM= 0.28 ± 0.14,H′=0.38 ± 0.13) occurred in Nantaizi Lake. Significantly positive relationships were found between density/biomass and total nitrogen, ammonia nitrogen, total phosphorous and chlorophylla. Redundancy analysis (RDA) revealed that transparency of water (SD) and total nitrogen (TN) were the key environmental variables effecting the composition of chironomid larva community. It is concluded that dominant species, density, biomass and diversity index of chironomid larvae are good indicators for water quality of the lakes in Hanyang.
chironomid larvae; community structure; diversity; environmental variables; Hanyang
2016-10-08;
2016-12-29
国家自然科学基金项目(40901037);武汉市市属高校教研课题(2014007)
刘红艳(1978-),副教授,主要从事水生生物学研究。E-mail:lhy9603@126.com
熊 飞。E-mail:xf9603@163.com
Q178.5l
A
1000-6907-(2017)02-0003-08
