腹腔镜下微波消融治疗巨大肝血管瘤:附86例报告
2017-04-02张磊熊俊
张磊,熊俊
(华中科技大学同济医学院附属协和医院 1. 急诊外科 2. 肝胆外科,湖北 武汉 430022)
肝血管瘤(hepatic hemangioma)是临床常见的肝脏良性肿瘤之一,其发病率为0.4%~7.3%[1-2],多为单发,也可多发,约占10%,可发生于任何年龄段,女性多见[3]。大多数患者无自觉症状,多为常规体检行超声或CT检查中发现。本病发展缓慢,主要表现为良性过程,当病灶直径>5 cm,则称为巨大肝血管瘤(giant hemangioma)[3],部分患者可有腹部不适等症状[4]。肝血管瘤的治疗取决于肿瘤的大小、部位、生长速度及有无临床症状。目前,对于小的无症状的血管瘤一般不需治疗,但应每隔3~6个月行超声检查,动态观察肿瘤变化[3,5]。对于有症状或病灶呈进行性增大,排除其他引起症状的原因,多建议采取积极的治疗手段[6]。经典的治疗方法主要有以下几种:外科切除、肝动脉结扎术、经动脉介入栓塞术、放射治疗、类固醇治疗等[7-8]。特殊的肝血管瘤患者,甚至需要行肝移植治疗[9-12]。近年来,随着消融设备的更新及腹腔镜技术的开展,腹腔镜下血管瘤消融在临床中得到广泛应用[8,13-14]。本组自2015年1月—2015年12月对86例有症状或直径>5 cm的肝血管瘤行腹腔镜下微波消融治疗,疗效满意,现报告如下。
1 资料与方法
1.1 一般资料
本组86例,其中男35例,女51例;年龄21~67岁,平均年龄42岁。共135个病灶,其中1个病灶者58例,2个病灶者17例,≥3个病灶者11例;术前影像诊断为单发病灶,术中发现肝脏表面多发小病灶者7例;主要病灶位于右叶62例,左叶24例;病灶平均直径(取最大病灶横切面最大直径)7.3(5.2~18.7)cm。术前24例主诉右上腹隐痛不适,余无明显腹部症状。所有患者术前肝功能Child A级78例,Child B级8例,均无心肺肾等脏器疾病。全部患者经增强CT/MRI或超声造影检查符合肝血管瘤影像学标准[15-16](表1)。

表1 86例肝血管瘤患者的一般资料Table 1 The general data of the patients with hepatic hemangioma
1.2 仪器设备
⑴ 德国STORZ腹腔镜操作系统;⑵ 康友微波消融治疗仪(KY2000系列),频率2450 MHz;⑶ 一次性微波消融针(KY2450B),1.9 mm/14 G,有效工作长度200 mm;⑷ 丹麦BK超声系统(flex Focus 800),8820e腹腔镜超声探头。
1.3 手术方式
患者常规取平卧位,可根据病灶部位调整患者体位。全麻成功后,脐下打孔,置入10 mm Trocar建立人工气腹后,置入腹腔镜镜头,探查肝脏及血管瘤周边情况,可根据血管瘤部位于剑突下、左肋缘下或右肋缘下置入1个5 mm Trocar以简单游离并暴露血管瘤。一般于左或右锁骨中线置入1个12 mm Trocar行腹腔镜超声探查,进一步明确血管瘤周边血供情况及肝脏深部血管瘤位置。选择距病灶边缘0.5~1.0 cm正常肝组织处进针,并根据病灶大小选择布针策略。消融功率一般为60~65 W,消融时间据病灶大小及消融情况而定[8,17]。
1.4 围手术期处理
所有患者围手术期按常规进行术前准备,并留置尿管至术后24 h。术中注意患者尿液颜色变化情况,常规消融过程中滴注5%碳酸氢钠125 mL以碱化尿液。术后常规行心电监护,制动12 h,注意复查肝肾功能及血常规,注意引流管引流情况,常规留置引流管至术后24 h。术后12 h可进流质,嘱患者尽量多饮水,进一步促进排尿。
1.5 疗效评估及术后随访
所有患者术后1个月行超声复查,术后3个月行增强CT或MRI复查,观察病灶大小、密度及血流情况,原病灶区无强化即为完全消融,并计算病灶残瘤率[8]。
2 结 果
2.1 手术疗效及术后并发症
86例均手术成功,无中转开腹。术中消融时间10~45 min,平均(26.4±2.7)min;术后平均住院日(3.7±1.4)d;术中出血量10~50 mL,平均(27.6±5.2)mL;血红蛋白尿者20例[18];穿刺点周围皮肤灼伤者3例,经换药处理,术后1周痊愈;术后发热者11例,最高39.1℃,经对症处理后术后12 h内降至正常;术中气胸者1例,经术中处理,术后无特殊影响;所有患者术后ALT(66~321 IU/L)和AST(74~421 IU/L)均升高,经护肝治疗后,术后1周基本恢复术前水平;无术后出血、胆汁漏、邻近脏器损伤等严重并发症(表2)。
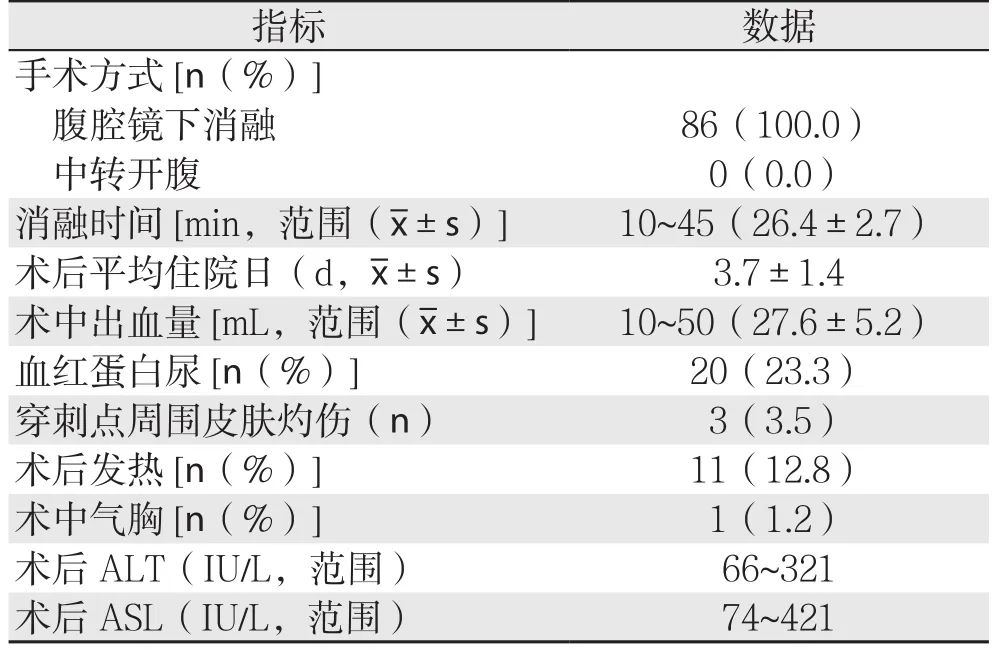
表2 患者术中及术后情况Table 2 The intra- and postoperative conditions of the patients
2.2 术后随访
患者术后随访6~12个月,平均7.8个月。所有患者均健康生存,无远期并发症。86例患者中,病灶残留<10%者82例(95.3%),病灶残留10%~15%者3例(3.5%),病灶残留>15%者1例(1.2%)。
3 讨 论
肝血管瘤是肝脏常见的良性肿瘤,目前对于肝血管瘤的手术适应症尚不明确,多数学者倾向于将瘤体直径>5 cm作为肝血管瘤的手术适应症[19-20]。以往开腹手术存在创伤大、术后恢复时间长、出血多、费用贵等缺点[21]。微波消融利用消融针周围产生的微波电场,使活体组织中的水、碳水化合物、蛋白质等极性分子产生偶极子加热,同时使细胞内外液中的钾、钠、氯等带电粒子在电磁力的作用下产生离子加热,使得被作用组织内部迅速产生大量热量,导致其凝固性坏死[11,13,22]。近年来,随着腹腔镜肝切除技术在临床中的大量开展,腹腔镜技术结合微波消融治疗肝血管瘤具有创伤小、恢复快、出血少、并发症少等优点,得到越来越多的医疗工作者及患者的认可[13,23]。
本组近年来开展腹腔镜下微波消融治疗肝血管瘤工作取得了较好的成效,但仍需注意在严格把握手术适应证的同时积极预防手术并发症的发生。以下经验供同仁分享:⑴ 穿刺点皮肤切开宽度一般为1.5~2倍针杆直径,约3~4 mm,避免过窄造成消融中针道调整困难或过宽造成不必要损伤;从肋间进针,注意进针尽量靠近肋骨上缘,避免损伤肋间血管或神经;消融间歇调整布针位置,注意缓慢退针,避免针杆余热灼伤皮肤或周围组织。⑵ 病灶直径>10 cm血管瘤消融策略:可根据病灶部位解剖第一肝门,暂时阻断肝左或肝右动脉;实施“先边缘,后中间”的多点布针策略;首先消融主要供血动脉区域;首次进针注意针道深度,实施“先深部,后浅部”的消融策略[8],尽量一次性将深部消融完全,再缓慢退针,消融浅部,提高效率,减少消融时间;术后可追加1次5%碳酸氢钠125 mL以碱化尿液[18];先深部,后浅部,一次性消融完全,超声下消融伪像影响再次进针对消融位置判断;消融深部可将血供阻断,提高消融效率,之后浅部可快速消融。⑶ 针对位于膈面或脏面间隙处血管瘤,可于膈下或肝下置入湿纱条并注入50~100 mL生理盐水,避免消融热辐射造成周围组织损伤。⑷ 气胸处理策略:多因行肋间隙穿刺进针,穿刺部位过高,误损伤膈肌所致,应立即停止消融,退出消融针,避免继续损伤膈肌,扩大损伤面积;同时腹腔镜手术腹内压高于胸腔压力,腹腔内CO2可压入胸腔,关闭气腹,降低腹腔压力,麻醉师配合行患者胸腔鼓肺,监测血氧饱和度,少量CO2可自行吸收;术后注意复查胸片;必要时行胸腔闭式引流,绝大多数不需要[24-25]。⑸ 目前有学者[22-23]主张位于胆囊旁血管瘤可先行胆囊切除再行血管瘤消融,本组8例位于胆囊旁血管瘤行腹腔镜下消融均未行胆囊切除,笔者的理由在于:胆囊本身有液体可降低热沉积效应;胆囊旁血管瘤供血区域位于远离胆囊侧,可采取先消融远离侧瘤体向胆囊侧推进的方式;胆囊本身具有少量活动性,可以翻转胆囊尽量使瘤体消融完全;消融远离胆囊侧血管瘤并固化供血血管后,贴近胆囊瘤体残留后期不会增大,部分可自行吸收;可采用低功率缓慢消融,边消融边浇注冰生理盐水降温的方式降低消融;注意保护胆囊三角,胆囊床无血供并不影响胆囊功能。
巨大肝血管瘤的治疗采用腹腔镜微波消融,可以提高消融效率,减少手术风险,具有创伤小、损毁彻底、术后恢复快等优点,值得在临床上推广和应用。
[1] Ishak KG, Rabin L. Benign tumors of the liver[J]. Med Clin North Am, 1975, 59(4):995–1013.
[2] Li K, Wang Z, Liu Y, et al. Fine clinical diあerences between patients with multifocal and diあuse hepatic hemangiomas[J]. J Pediatr Surg,2016, 51(12):2086–2090. doi: 10.1016/j.jpedsurg.2016.09.045.
[3] Hoekstra LT, Bieze M, Erdogan D, et al. Management of giant liver hemangiomas: an update[J]. Expert Rev Gastroenterol Hepatol,2013, 7(3):263–268. doi: 10.1586/egh.13.10.
[4] Bara T, Gurzu S, Jung I, et al. Giant Cavernous Hepatic Hemangioma Diagnosed Incidentally in a Perimenopausal Obese Female with Endometrial Adenocarcinoma: A Case Report[J].Anticancer Res, 2016, 36(2):769–72.
[5] Bhardwaj H, Stephens M, Bhatt M, et al. Prostate‐Specific Membrane Antigen PET/CT Findings for Hepatic Hemangioma[J].Clin Nucl Med, 2016, 41(12):968–969.
[6] Ji Y, Chen S, Xiang B, et al. Clinical features and management of multifocal hepatic hemangiomas in children: a retrospective study[J]. Sci Rep. 2016. 6: 31744. doi: 10.1038/srep31744.
[7] Kim SH, Kim KH, Kirchner VA, et al. Pure laparoscopic right hepatectomy for giant hemangioma using anterior approach[J]. Surg Endosc, 2017, 31(5):2338–2339. doi: 10.1007/s00464–016–5224–z.
[8] Gao J, Ji JS, Ding XM, et al. Laparoscopic Radiofrequency Ablation for Large Subcapsular Hepatic Hemangiomas: Technical and Clinical Outcomes[J]. PLoS One, 2016, 11(2):e0149755. doi:10.1371/journal.pone.0149755.
[9] Meguro M, Soejima Y, Taketomi A, et al. Living donor liver transplantation in a patient with giant hepatic hemangioma complicated by Kasabach‐Merritt syndrome: report of a case[J].Surg Today, 2008, 38(5):463–468. doi: 10.1007/s00595–007–3623–4.
[10] Lange UG, Bucher JN, Schoenberg MB, et al. Orthotopic liver transplantation for giant liver haemangioma: A case report[J]. World J Transplant, 2015, 5(4):354–359. doi: 10.5500/wjt.v5.i4.354.
[11] 刘勇峰, 梅乐园, 袁泉, 等. 微波消融与肝动脉栓塞治疗肝血管瘤的对照研究[J]. 中国普通外科杂志, 2013, 22(7):871–875.doi:10.7659/j.issn.1005–6947.2013.07.011.Liu YF, Mei LY, Yuan Q, et al. Microwave ablation versus hepatic arterial embolization for liver hemangioma[J]. Chinese Journal of General Surgery, 2013, 22(7):871–875. doi:10.7659/j.issn.1005–6947.2013.07.011.
[12] 王连江, 张雅敏, 邓永林, 等. 肝移植治疗肝脏良性肿瘤六例临床分析[J]. 中华医学杂志, 2016, 96(26):2091–2093. doi:10.3760/cma.j.issn.0376–2491.2016.26.011.Wang LJ, Zhang YM, Deng YL, et al. Liver transplantation for benign liver tumor: six cases report and literature review[J].National Medical Journal of China, 2016, 96(26):2091–2093.doi:10.3760/cma.j.issn.0376–2491.2016.26.011.
[13] Ziemlewicz TJ, Wells SA, Lubner MA, et al. Microwave ablation of giant hepatic cavernous hemangiomas[J]. Cardiovasc Intervent Radiol, 2014. 37(5):1299–305. doi: 10.1007/s00270–014–0934–x.
[14] 张磊, 何亮, 施申超, 等. 多途径联合消融治疗肝血管瘤的体会[J]. 临床外科杂志, 2016, 24(8):596–598. doi:10.3969/j.issn.1005–6483.2016.08.010.Zhang L, He L, Shi SC, et al. Comprehension of multi‐way ablation in the treatment of hepatic hemangioma[J]. Journal of Clinical Surgery, 2016, 24(8):596–598. doi:10.3969/j.issn.1005–6483.2016.08.010.
[15] Qian H, Li S, Ji M, et al. MRI characteristics for the differential diagnosis of benign and malignant small solitary hypovascular hepatic nodules[J]. Eur J Gastroenterol Hepatol, 2016, 28(7):749–756. doi: 10.1097/MEG.0000000000000642.
[16] Dong A, Dong H, Zuo C, et al. Diffuse Infantile Hepatic Hemangioendothelioma With Early Central Enhancement in an Adult: A Case Report of CT and MRI Findings[J].Medicine (Baltimore), 2015, 94(51):e2353. doi: 10.1097/MD.0000000000002353.
[17] 吴珍宝, 王苏丹, 汪长青, 等. 腹腔镜下微波消融治疗肝血管瘤的临床研究[J]. 中国普通外科杂志, 2015, 24(7):996–1000.doi:10.3978/j.issn.1005–6947.2015.07.014.Wu ZB, Wang SD, Wang CQ, et al. Clinical analysis of laparoscopic microwave ablation for hepatic hemangioma[J]. Chinese Journal of General Surgery, 2015, 24(7):996–1000. doi:10.3978/j.issn.1005–6947.2015.07.014.
[18] van Tilborg AAJM, Dresselaars HF, Scheあer HJ, et al. RF Ablation of Giant Hemangiomas Inducing Acute Renal Failure: A Report of Two Cases[J]. Cardiovasc Intervent Radiol, 2016, 39(11):1644–1648. doi: 10.1007/s00270–016–1415–1.
[19] Bajenaru N, Balaban V, Săvulescu F, et al. Hepatic hemangioma‐review‐[J]. J Med Life, 2015, 8 Spec Issue: 4–11.
[20] Strauss E, Ferreira AS, França AV, et al. Diagnosis and treatment of benign liver nodules: Brazilian Society of Hepatology (SBH)recommendations[J]. Arq Gastroenterol, 2015, 52(Suppl 1):47–54.doi: 10.1590/S0004–28032015000500003.
[21] Hoffmann K, Unsinn M, Hinz U, et al. Outcome after a liver resection of benign lesions[J]. HPB (Oxford), 2015, 17(11):994–1000. doi: 10.1111/hpb.12496.
[22] Zhang D, Liang P, Yu X, et al. The value of artificial pleural eあusion for percutaneous microwave ablation of liver tumour in the hepatic dome: a retrospective case‐control study[J]. Int J Hyperthermia,2013, 29(7):663–670. doi: 10.3109/02656736.2013.833347.
[23] Liu L, Li N. Feasibility and Advantages of Large Liver Hemangioma Treated with Laparoscopic Microwave Ablation[J].Hepatogastroenterology, 2014, 61(132):1068–1073.
[24] Nour‐Eldin NA, Exner S, Al‐Subhi M, et al. Ablation therapy of non‐colorectal cancer lung metastases: retrospective analysis of tumour response post‐laser‐induced interstitial thermotherapy (LITT), radiofrequency ablation (RFA) and microwave ablation (MWA) [J]. Int J Hyperthermia, 2017, doi:10.1080/02656736.2017.1306656. [Epub ahead of print]
[25] Lignieres M, Roux N, Giorgi R, et al. Persistent pathways after lung radiofrequency ablation as a risk factor of drain placement[J]. Int J Hyperthermia, 2017, doi: 10.1080/02656736.2017.1288931. [Epub ahead of print]
