肝癌患者CD8+CD28-Foxp3+调节性T细胞的变化及意义
2017-04-02方大正吴红伟武伦万光俊沈丰
方大正,吴红伟,武伦,万光俊,沈丰
(湖北医药学院附属东风医院 肝胆外科,湖北 十堰 442000)
调节性T细胞(regulatory T cells,Tregs)在T细胞亚群中具有重要免疫调节功能,它可以改变机体免疫内环境,和肿瘤细胞免疫逃逸与肿瘤形成密切相关[1]。目前,较为常用的特异性检测Tregs分子表面标记物的是CD8和CD28,基于CD8+CD28-Tregs的免疫活性调节,已成为目前肿瘤如黑色素瘤、胰腺癌、卵巢癌等免疫研究的热点[2-3]。但其在肝细胞癌(以下简称肝癌)临床分期、分化程度等方面报道不一[4]。叉状头/翼状螺旋转录因子(forkhead/winged helix transcription factor,Foxp3)在胸腺和外周血CD8+CD28-Tregs中特异性表达,抑制机体增殖与活化肿瘤特异性T效应细胞,与机体荷瘤时的免疫抑制状态有关[5]。在T细胞亚群中,CD4+CD25+Tregs具有免疫负调控功能,在原发性肝癌患者中已有研究[6]。而CD8+CD28-Foxp3+Tregs在肝癌患者外周血中和肿瘤组织中研究较少[7],本研究检测肝癌患者外周血和肿瘤组织中CD8+CD28-Foxp3+Tregs的水平,探讨其与肝癌的关系。基于上述认识,本研究应用流式细胞仪检测和分析肝癌患者外周血Treg细胞表面标记,观察肝癌和癌旁组织中CD8+CD28-Foxp3+Tregs的差异性,旨在为肝癌的免疫性治疗提供可能的实验基础。
1 材料与方法
1.1 研究对象外周血标本
72例肝癌标本均为湖北医药学院附属东风医院肝胆外科2014—2016年经术后病理确诊标本,术前均未经过放、化疗处理,术前取外周血;其中男51例,女21例;年龄41~72岁,平均(49.8±9.5)岁。72例肝癌标本按照国际抗癌联盟(International Union Against Cancer,IUCC)分期标准,高分化肝癌29例患者,中分化肝癌25例,低分化肝癌18例。22名正常对照者为同期我院健康体检中心志愿者外周血,其中男15例,女7例;年龄43~70岁,平均(48.6±9.2)岁,对照组均无急、慢性疾病史。两组均知情同意。
1.2 主要试剂和仪器
人调节性T细胞(T-reg)检测试剂盒包括:抗CD8-PE、CD28-FITC、Foxp3-PE、IgG1-PE、IgG1-FITC等购于美国BD公司;溶血素羊抗人Foxp3多克隆抗体购自美国Bioworld biotechnology公司(工作浓度1:200),即用型免疫组化兔抗羊二抗和3,3-二氨基联苯胺(DAB)试剂盒均购自北京中杉金桥生物科技有限公司;溶血仪、FACS流式细胞仪为美国BD公司产品。
1.3 流式细胞术检测外周血CD8+CD28-Fo xp3+Tregs
参照文献[8],抽取入院1 d肝癌患者和健康体检者(对照组)外周血1 mL,乙二胺四乙酸(EDTA)抗凝。取血标本100 μL,分别加入IgGl-FITC、IgGl-PE、CD8-FITC、CD28-APC、Foxp3-PE各10 μL,室温下静置避光孵育15 min后,加红细胞裂解液1 mL溶解红细胞,震荡数秒并静置5 min后,离心1500 r/min×5 min。选取淋巴细胞群设门流式细胞仪检测Tregs,分析CD8+CD28-Foxp3+Tregs与CD8+T细胞比值。Cell Quest软件获取和分析数据,每个样本检测1×104个/次。
1.4 免疫组化检测肝癌组织中和癌旁组织中Foxp3阳性细胞
采用免疫组织化学SP法检测肝癌组织中和癌旁组织中Foxp3阳性细胞,严格按照免疫组化试剂盒说明书步骤进行操作。组织切片处理如下:常规取肝癌组织和癌旁10 cm以上组织,10%甲醛溶液固定,梯度酒精脱水,二甲苯透明,石蜡包埋,厚5 μm切片,脱水透明,柠檬酸钠煮沸,微波抗原修复,山羊血清封闭,滴加一抗,羊抗人Foxp3多克隆抗体4 ºC冰箱孵育过夜,次日PBS缓冲液洗涤后,滴加兔抗羊二抗,37 ºC孵育30 min,PBS缓冲液洗涤,DAB显色,镜检观察染色程度,苏木精复染细胞核,自来水返蓝,梯度酒精脱水脱水,二甲苯透明,中性树胶封片。光镜下观察、摄片。Foxp3阳性细胞染色呈棕黄色或黄色颗粒,定位为胞质。每张切片任意选取高倍镜下5个视野,计数Foxp3阳性细胞,按照视场面积计算每mm3Foxp3阳性细胞数目。阳性细胞计数由与本研究无关的2位病理医师计算并确认取均值。
1.5 Western blot检测肝癌组织中和癌旁组织中Foxp3蛋白的表达
每例肝癌组织和相应癌旁正常肝组织约100 mg,加入1 mL组织细胞裂解液,冰上剪碎并研磨组织约30 min,研制成组织匀浆,放置于1.5 mL EP管中,4 ℃、离心12000 r/min ×30 min,取上清进行蛋白定量,蛋白浓度测定采取BCA法。100 ℃沸水煮沸变性5 min,取30 µg每个样本的总蛋白行SDS-PAGE电泳分离,转膜至PVDF膜上。5%脱脂奶粉室温封闭1 h,1:1000稀释的羊抗人Foxp3多克隆抗体4 ℃孵育过夜,PBS洗涤PVDF膜3次,室温下放入兔抗羊二抗(1:2000稀释)孵育2 h,ECL化学发光试剂显色曝光。以β-actin作为上样内参照,所得结果以灰度扫描并相对定量分析,用目的蛋白条带吸光度值/β-actin条带吸光度值表示Foxp3蛋白的相对表达强度。
1.6 统计学处理
实验所得数据采用SPSS 17.0软件处理,计量资料以均数±标准差(±s)表示,单因素方差分析和SNK-q检验进行多组数据比较,t检验比较两组均数,P<0.05为差异有统计学意义。
2 结 果
2.1 外周血CD8+CD28-Foxp3+Tregs/CD8+T细胞表达情况
流式细胞分析结果显示,外周血CD8+CD28-Foxp3+Tregs/CD8+T细胞表达在肝癌患者明显高于健康对照组(P<0.05,P<0.01),且随着肝癌患者分化级别的降低,CD8+CD28-Foxp3+Tregs/CD8+T细胞表达逐渐升高,但组间差异无统计学意义(图1)。

图1 肝癌患者和健康对照人群外周血CD8+CD28-Foxp3+Tregs/CD8+T检测结果 A:健康对照组;B:高分化肝癌组;C:中分化肝癌组;D:低分化肝癌组Figure 1 Detection of CD8+CD28–Foxp3+Tregs/CD8+T in peripheral blood of HCC patients and healthy population A: Healthy control group; B: Well diあerentiated HCC group; C: Moderately HCC group; D: Poorly diあerentiated HCC group
2.2 CD8+CD28-Foxp3+Tregs表达与肝癌患者临床病理因素的关系
流式细胞分析结果与肝癌患者临床病理因素比较显示,CD8+CD28-Fxop3+Tregs/CD8+T的表达与性别、年龄无关(均P>0.05),与TNM分期、有无淋巴结转移、肿瘤分化程度有关(P<0.05)(表1)。
表1 肝癌患者外周血CD8+CD28-Fxop3+Tregs/CD8+T与临床病理因素的关系(%,±s)Table 1 Relations of peripheral blood CD8+CD28–Fxop3+Tregs/CD8+T with clinicopathologic factors of HCC patients(%, ±s)
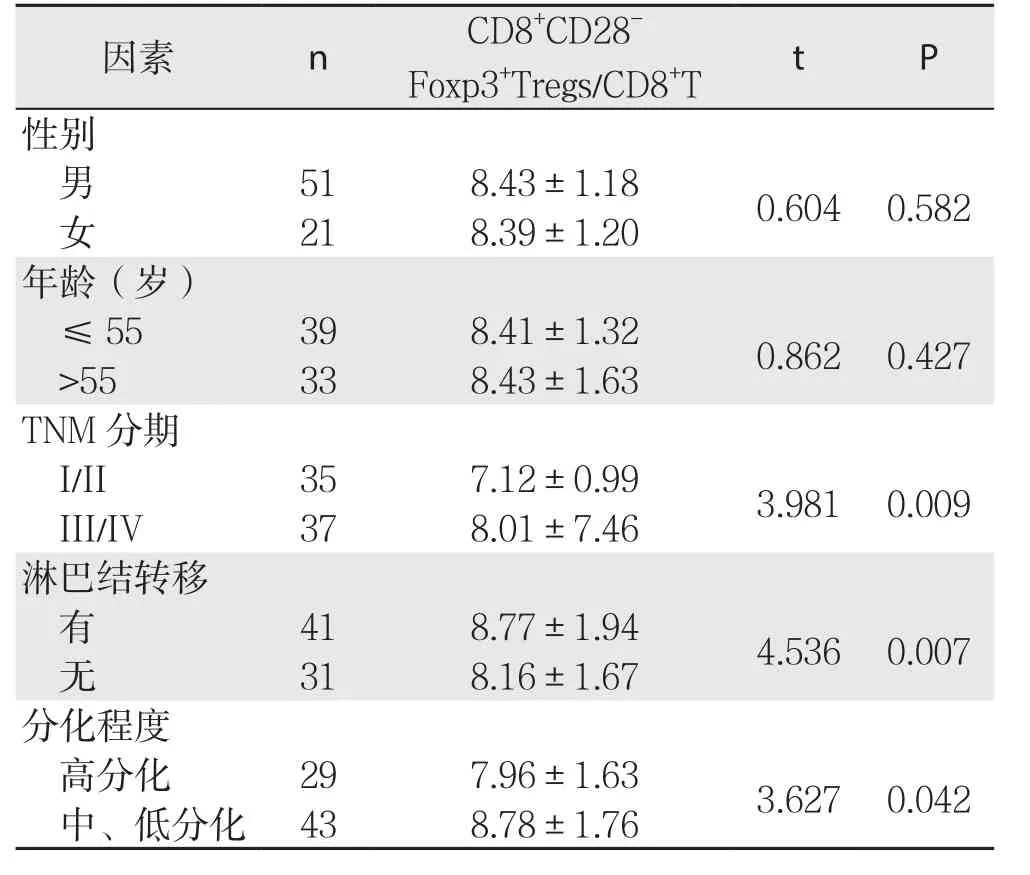
表1 肝癌患者外周血CD8+CD28-Fxop3+Tregs/CD8+T与临床病理因素的关系(%,±s)Table 1 Relations of peripheral blood CD8+CD28–Fxop3+Tregs/CD8+T with clinicopathologic factors of HCC patients(%, ±s)
因素 n C D 8+C D 28-F o x p 3+T r e g s/C D 8+T t P性别男51 8.43±1.18 0.604 0.582女21 8.39±1.20年龄(岁)≤55 39 8.41±1.32 0.862 0.427>55 33 8.43±1.63 T N M分期I/I I 35 7.12±0.99 3.981 0.009 I I I/I V 37 8.01±7.46淋巴结转移有41 8.77±1.94 4.536 0.007无31 8.16±1.67分化程度高分化 29 7.96±1.63 3.627 0.042中、低分化 43 8.78±1.76
2.3 肝癌患者病理组织Foxp3阳性细胞检测
在肝癌病理组织中有Foxp3阳性表达,位于肝癌或癌旁正常组织的细胞胞质中。癌旁组织中Foxp3平均阳性细胞数为(7.26±1.97)个/mm2,高分化肝癌平均阳性细胞数目为(26.02±8.34)个/mm2,中分化肝癌平均阳性数目为(28.05±8.86)个/mm2,低分化为(31.65±8.15)个/mm2;与癌旁正常组织中Foxp3阳性细胞比较,肝癌组织中Foxp3阳性细胞数明显升高,差异均有统计学意义(均P<0.05);但不同分化程度肝癌组织中Foxp3阳性细胞数比较差异无统计学意义(P>0.05)(图2)。
2.4 Foxp3蛋白在肝癌和癌旁组织中的表达
Foxp3蛋白在肝癌和癌旁组织中均有表达,但在肝癌细胞中的表达量明显高于癌旁细胞(图3)。由图像分析可知,与正常组Foxp3蛋白表达相比,肝癌组织中Foxp3蛋白的表达明显增强,差异有统计学意义(P<0.01);但不同分化程度的肝癌组织中Foxp蛋白表达间差异无统计学意义(P>0.05)(图3)。
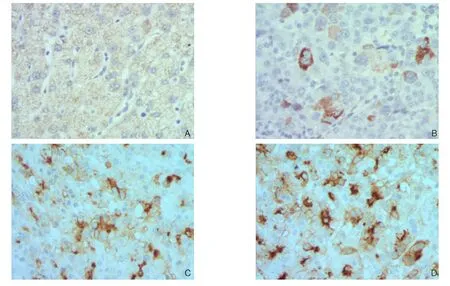
图2 免疫组化检测Foxp3阳性细胞(×400) A:癌旁组织(距肿瘤边缘5 cm);B:高分化肝癌组织;C:中分化肝癌组织;D:低分化肝癌组织Figure 2 Immunohistochemical staining for Foxp3 positive cells (×400) A: Tumor adjacent tissue (5 cm away from tumor tissue);B: Well diあerentiated HCC tissue; C: Moderately diあerentiated HCC tissue; D: Poorly diあerentiated HCC tissue
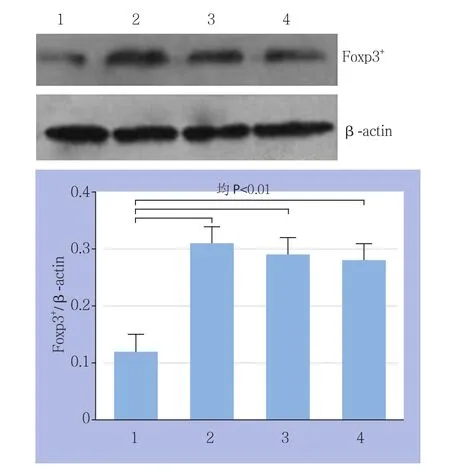
图3 Western blot检测Foxp3蛋白的表达 1:癌旁组织;2:低分化肝癌组织;3:中分化肝癌组织;4:高分化肝癌组织Figure 3 Western blot analysis of Foxp3 protein expression 1: Tumor adjacent tissue; 2: Well differentiated HCC tissue; 3: Moderately differentiated HCC tissue;4: Poorly differentiated HCC tissue
3 讨 论
Tregs是影响肿瘤患者预后的潜在因素之一,目前,在肿瘤、转移淋巴结、外周血、恶性腹水,胸腔积液中均有发现[2-3]。手术、放疗和化疗是传统的肿瘤治疗手段,随着医疗水平的发展,对肿瘤的发病机制认识不断深入,在临床中,调动患者机体主动免疫功能,进行免疫治疗已逐步开展,但其临床上对肝细胞癌的疗效并不确定,可能与患者肿瘤抗原中正常细胞较多,机体T细胞免疫系统对癌细胞免疫“豁免”有关[4]。Tregs的相关研究如Tregs/CD3、Tregs/CD4、Tregs/CD8等在原发瘤和转移瘤中的比率已见于很多研究[4-7]。建立Tregs与Foxp3基因或蛋白联系,使Tregs的研究有了进一步的进展[9]。CD8+CD28-Tregs在机体调节机制中有重要作用,可控制自身反应性T细胞,限制机体过度免疫应答或破坏自身组织的作用,使机体免疫平衡稳态得以维持[10-11]。Foxp3在胸腺和外周血CD8+CD28-Tregs中特异性表达,Foxp3基因编码该蛋白,阻止细胞因子分泌[12]。CD8+CD28-Tregs可抑制自身免疫性疾病的发生,参与调节肿瘤免疫。本研究表明,与对照组比较,肝癌患者外周血中CD8+CD28-Foxp3+Tregs的比率明显升高,且此改变与患者的年龄和性别比较差异无关,这与王徐等[13]研究T细胞群和性别无关相一致。本研究的肝癌患者中,Tregs的比率较正常健康对照组明显升高,且Tregs的比率在有淋巴结转移的肝癌患者外周血中明显升高,这与在消化道肿瘤中有淋巴结转移的Tregs显著增高相一致[14-17]。
目前,多数研究对Tregs的检测基于肿瘤患者外周血进行,对肿瘤病理组织同时进行对照研究较少[18-19]。本研究通过石蜡包埋免疫组化法和Western blot的研究发现肝癌患者肿瘤组织中Foxp3阳性细胞数及Foxp3蛋白表达水平显著高于癌旁组织,表明在肝癌患者中,Tregs可能通过某种途径向癌周渗透迁移浸润。Foxp3抑制机体增殖与活化肿瘤特异性T效应细胞,与机体荷瘤时的免疫耐受肿瘤抗原和相关抗原可能有关[20-21],有文献[22-25]报道Tregs通过趋化因子介导迁移至肿瘤微环境中。本实验中,由于肝癌样本量相对较少,不利于在单项TNM分期和肿瘤分化级别中做Tregs的统计分析,因此基于III/IV期与I/II期、中低分化与高分化肝癌患者Foxp3+Tregs的比率明显增高,提示Foxp3+Tregs可能在肝癌的发生、发展中起着重要作用。
综上,本实验通过对肝癌患者外周血进行检测,采用病理组织学和分子生物学的对照研究,更加直观和准确为临床检测Tregs提供参考。然而,收集远期的完整随访资料,术后检测早期外周血T细胞结果可能受到抗生素使用等多因素的影响,可能会改变淋巴细胞亚群,因此,本研究还需要扩大样本量以获取准确的研究结果。
[1] Serrels A, Lund T, Serrels B, et al. Nuclear FAK controls chemokine transcription,Tregs, and evasion of anti-tumorimmunity[J]. Cell,2015, 163(1):160–173.doi: 10.1016/j.cell.2015.09.001.
[2] Tao Q, Pan Y, Wang Y, et al. Regulatory T cells-derived IL-35 promotes the growth of adult acute myeloid leukemia blasts[J].Int J Cancer, 2015, 137(10):2384–2393.doi: 10.1002/ijc.29563.
[3] Ouyang Z, Wu H, Li L, et al. Regulatory T cells in the immunotherapy of melanoma[J].TumourBiol, 2016, 37(1):77–85.doi: 10.1007/s13277–015–4315–0.
[4] Yuan CH, Sun XM, Zhu CL, et al. Amphiregulin activates regulatory T lymphocytes and suppresses CD8+T cell-mediated anti-tumor response in hepatocellular carcinoma cells[J]. Oncotarget, 2015,6(31):32138–32153. doi: 10.18632/oncotarget.5171.
[5] Ichikawa A, Miyoshi H, Arakawa F, et al. Detection of Tax‐specific CTLs in lymph nodes of adult T-cell leukemia/lymphoma patients and its association with Foxp3 positivity of regulatory T-cell function[J].Oncol Lett, 2017, 13(6):4611–4618. doi: 10.3892/ol.2017.6067.
[6] Jóźwicki W, Brożyna AA, Siekiera J, et al. Frequency of CD4+CD25+Foxp3+cells in peripheral blood in relation to urinary bladder cancer malignancy indicators before and after surgical removal[J]. Oncotarget, 2016, 7(10):11450–11462. doi: 10.18632/oncotarget.7199.
[7] Mishra AK, Kadoishi T, Wang X, et al. Squamous cell carcinomas escape immune surveillance via inducing chronic activation and exhaustion of CD8+T cells co-expressing PD-1 and LAG-3 inhibitory receptors[J]. Oncotarget, 2016, 7(49):81341–81356. doi:10.18632/oncotarget.13228.
[8] 吉顺荣, 姚宛彤, 张波, 等. 胰腺癌患者外周血CD8+CD28+和CD8+CD28–T淋巴细胞亚群的分析[J]. 上海医学, 2012,35(4):316–319.Ji SR, Yao WT, Zhang B, et al. Expression of CD8+CD28+and CD8+CD28–in the peripheral blood of pancreatic cancer patients[J].Shanghai Medical Journal, 2012, 35(4):316–319.
[9] Hasanjani Roushan MR, Bayani M, Soleimani Amiri S, et al.Evaluation of CD4+CD25+FoxP3+regulatory T cells during treatment of patients with brucellosis[J]. J Biol Regul Homeost Agents, 2016, 30(3):675–682.
[10] Lexmond WS, Goettel JA, Lyons JJ, et al. FOXP3+Tregs require WASP to restrain Th2- mediated food allergy[J]. J Clin Invest,2016, 126(10):4030–4044. doi: 10.1172/JCI85129.
[11] Chen C, Chen D, Zhang Y, et al. Changes of CD4+CD25+FoxP3+and CD8+CD28–regulatory T cells in non-small cell lung cancer patients undergoing surgery[J]. Int Immunopharmacol, 2014,18(2):255–261. doi:10.1016/j.intimp.2013.12.004.
[12] Assadiasl S, Ahmadpoor P, Nafar M, et al. Regulatory T cell subtypes and TGF‐β1 gene expression in chronic allograft dysfunction[J]. Iran J Immunol, 2014, 11(3):139–152.doi:IJIv11i3A1.
[13] 王徐, 胡明华, 王小明. 原发性肝癌患者微环境中CD8+CD28–调节性T细胞表达变化及意义[J]. 中国普通外科杂志, 2014,23(7):976–979. doi:10.7659/j.issn.1005–6947.2014.07.022.Wang X, Hu MH, Wang XM. Change and significance of CD8+CD28–Treg cells expression in the patients suffering from primary hepatocellular carcinoma[J]. Chinese Journal of General Surgery, 2014, 23(7):976–979. doi:10.7659/j.issn.1005–6947.2014.07.022.
[14] Chan IH, Wu V, Bilardello M, et al. PEG-rIL-10 treatment decreases FoxP3(+) Tregs despite upregulation of intratumoral IDO[J].Oncoimmunology, 2016, 5(7):e1197458. doi:10.1080/2162402 X.2016.1197458.
[15] Cheng H, Luo G, Lu Y, et al. The combination of systemic inflammation-based marker NLR and circulating regulatory T cells predicts the prognosis of resectable pancreatic cancer patients[J]. Pancreatology, 2016, 16(6):1080–1084. doi: 10.1016/j.pan.2016.09.007.
[16] Beatty PL, van der Geest R, Hashash JG, et al. Immunobiology and immunosurveillance in patients with intraductal papillary mucinous neoplasms(IPMNs), premalignant precursors of pancreatic adenocarcinomas[J]. Cancer Immunol Immunother, 2016,65(7):771–778. doi: 10.1007/s00262–016–1838–1.
[17] Choi HS, Ha SY, Kim HM, et al. The prognostic eあects of tumor infiltrating regulatory T cells and myeloid derived suppressor cells assessed by multicolorflow cytometry in gastric cancer patients[J].Oncotarget, 2016, 7(7):7940–7951. doi: 10.18632/oncotarget.6958.
[18] 薛旦旦, 夏添松, 刘晓安, 等. 乳腺癌肿瘤微环境中CD8+T细胞和调节性T细胞的研究[J]. 中华实验外科杂志, 2014, 31(1):149–151.doi:10.3760/cma.j.issn.1001–9030.2014.01.052.Xue DD, Xia TS, Liu XA, et al. Infiltrating CD8 + T cells and regulatory T cells in breast cancer microenvironment[J]. Chinese Journal of Experimental Surgery, 2014, 31(1):149–151. doi:10.3760/cma.j.issn.1001–9030.2014.01.052.
[19] McCoy MJ, Hemmings C, Miller TJ, et al. Low stromal Foxp3+regulatory T-cell density is associated with complete response to neoadjuvant chemoradiotherapy in rectal cancer[J]. Br J Cancer,2015, 113(12):1677–186. doi: 10.1038/bjc.2015.427.
[20] 毛丽伟, 廖国清, 王红梅, 等. 胃癌患者不同区域淋巴结和外周血CD4+CD25+FoxP3+调节性T细胞的表达和临床意义[J]. 免疫学杂志, 2016, 32(11):1001–1004.Mao LW, Liao GQ, Wang HM, et al. The expression of CD4+CD25+FoxP3+regulated T cells in different regional lymph nodes of gastric carcinoma and its clinical significance[J].Immunological Journal, 2016, 32(11):1001–1004.
[21] Lee HE, Park DJ, Kim WH, et al. High FOXP3+regulatory T-cell density in the sentinel lymph node is associated with downstream non-sentinel lymph-node metastasis in gastric cancer[J]. Br J Cancer, 2011, 105(3):413–419. doi:10.1038/bjc.2011.248.
[22] 陈中, 倪家连, 刘鲁岳, 等. CD4+CD25+调节性T细胞在肝癌微环境中的分布状况与局部免疫状态的关系[J]. 中国普通外科杂志,2007, 16(7):690–692. doi:10.3969/j.issn.1005–6947.2007.07.022.Chen Z, Ni JL, Liu LY, et al. Relationship of the distribution and local immunology of CD4+CD25+ regulartory T cells in tumor microenvironment of hepatocellular carcinoma[J]. Chinese Journal of General Surgery, 2007, 16(7):690–692. doi:10.3969/j.issn.1005–6947.2007.07.022.
[23] Napoletano C, Bellati F, Ruscito I, et al. Immunological and clinical impact of cancer stem cells in vulvar cancer: Role of CD133/CD24/ABCG2-expressing cells[J]. Anticancer Res, 2016, 36(10):5109–5116. doi:10.21873/anticanres.11080.
[24] 王文斌, 刘三光, 刘兵, 等. 肝外胆管癌组织叉状头/翅膀状螺旋转录因子3阳性调节性T细胞浸润及其临床意义[J]. 中华实验外科杂志, 2015, 32(5):1156–1158. doi:10.3760/cma.j.issn.1001–9030.2015.05.075.Wang WB, Liu SG, Liu B, et al. Significance of forkhead/winged helix transcription factor P3 + regulatory T cells infiltration in extrahepatic cholangiocarcinoma[J]. Chinese Journal of Experimental Surgery, 2015, 32(5):1156–1158. doi:10.3760/cma.j.issn.1001–9030.2015.05.075.
[25] Wei R, Hu Y, Dong F, Xu X, et al. Hepatoma cell-derived leptin downregulates the immunosuppressive function of regulatory T-cells to enhance the anti-tumor activity of CD8+T-cells[J]. Immunol Cell Biol, 2016, 94(4):388–399. doi: 10.1038/icb.2015.110.
