肝癌细胞中miR-376c的表达及其与高迁移率族蛋白A2的关系
2017-04-02王宇锋刘志奎姚博文李青丁凌龙涂康生杨威
王宇锋,刘志奎,姚博文,李青,丁凌龙,涂康生,杨威
(西安交通大学第一附属医院 肝胆外科,陕西 西安 710061)
肝细胞癌(hepatocellular carcinoma,HCC)是世界上最常见的恶性肿瘤之一[1-4]。近年来随着诊疗手段的不断进步,HCC患者的预后已有一定的改善,但是HCC恶性程度高、易转移、易复发的特点使得HCC患者的预后仍不能令人满意[1-2,5-6]。因此,探究HCC细胞侵袭和转移的潜在机制,寻找新的临床有效的治疗靶点是当前提升HCC诊疗水平的主要任务之一[1,6-9]。微小RNA(microRNA,miRNA)是近年来在肿瘤领域研究的热点之一,它是一类长度约18~25个核苷酸序列的不编码蛋白质的单链RNA小分子[1,10]。miRNA作为癌基因或者抑癌基因,可以通过与下游靶基因的相互作用来调控肿瘤的发生发展[1,10-11]。miR-376c的长度为20~24个核苷酸序列,其可以通过参与调控基因的转录后翻译来影响基因的表达水平[12-13]。研究发现,miR-376c在多种肿瘤中的表达趋势不一,其在头颈部鳞状细胞癌[14]、胆管癌[15]及子宫颈癌[12]等肿瘤中表达下调,而在卵巢癌[16]中表达上调。并且在关于非小细胞肺癌的不同研究中,其在肿瘤组织中的表达趋势也不一致[17-18]。异常表达的miR-376c可以通过调控其下游靶基因的表达水平来影响肿瘤细胞的侵袭、迁移、增殖、凋亡以及对化疗药物的敏感性等生物学行为[12,17-19]。但是miR-376c在肝细胞癌中的表达情况及其具体作用目前尚罕有报道。高迁移率族蛋白A2(high mobility group A2,HMGA2)是由HMGA2基因编码的蛋白。研究[20-22]发现HMGA2在HCC中表达上调,可以受let-7、miR-107以及miR-663a等多种miRNA的调控从而促进HCC细胞的侵袭转移,但是其是否受miR-376c调控目前也尚未报道。本研究首先探讨了HCC组织中miR-376c的表达情况,然后分析miR-376c的临床意义,并进一步应用人工合成的miR-376c模拟物过表达HCC细胞中的miR-376c从而分析其对HCC细胞的作用。此外,还在HCC组织中分析了其与HMGA2表达的相关性。总之,本研究主要探究了miR-376c在HCC中的表达情况及其临床意义,并初步探究miR-376c对HCC细胞侵袭转移的影响及潜在机制,旨在为研发真正临床有效的HCC靶向治疗药物以及改善HCC的诊治水平提供一定的研究基础。
1 材料与方法
1.1 组织标本和细胞
收集并筛选83例HCC组织和对应的癌旁组织标本,所有标本均来自2012年7月―2013年12月在西安交通大学第一附属医院肝胆外科接受手术治疗的HCC患者,其中男68例,女15例;年龄30~74岁,中位年龄49岁。所有患者的肿瘤标本均经病理证实为HCC,对应的癌旁组织为距肿瘤边缘>2 cm 的肝组织,术前均未接受化疗、放疗等其他辅助治疗,所有组织取得后均尽快保存于液氮或者多聚甲醛(40 g/L)中。患者术后随访时间为36个月。本课题经西安交通大学第一附属医院伦理委员会审核批准并且实验获得患者知情同意后开展的。正常永生化人肝细胞L02与肝癌细胞株MHCC-97L、SMMC-7721、MHCC-97H、Hep-3B、HepG2均购自中科院上海生物化学与细胞生物学研究所。
1.2 实验试剂
miR-376c特异性引物、miRNA 内参U6引物、miR-376c过表达模拟物、阴性对照序列、miRNA逆转录试剂盒(All-in-One™ miRNA First-Strand cDNA Synthesis Kit)以及miRNA qPCR试剂盒(All-in-One™ miRNA qPCR Kit)均购自Genecopoeia公司。TRIzol试剂和脂质体(LipofectamineTM2000)均购自Invitrogen公司。胎牛血清(fetal bovine serum,FBS)购自Gibco公司,DMEM购自ThermoFisher Scientific公司;ECL发光剂购自Milipore公司;兔抗人HMGA2多克隆抗体购自Abcam公司;BCA蛋白定量试剂盒购自上海碧云天生物技术有限公司;Matrigel基质胶购自BD公司;RIPA裂解液(强)购自西安赫特生物科技有限公司;Transwell小室购自Becton Dickinson Labware公司;小鼠抗人β-actin单克隆抗体购自武汉博士德生物工程有限公司。
1.3 实验方法
1.3.1细胞培养与转染正常肝细胞L02与MHCC-97H、HepG2、MHCC-97L、Hep-3B、SMMC-7721细胞用含100 mL/L胎牛血清的DMEM培养基,置于50 mL/L CO2、37 ℃的恒温培养箱中进行培养。转染操作按照LipofectamineTM2000试剂说明书上的步骤进行。首先用6孔板将细胞培养至融合度为50%~70%时,然后将100 nmol miR-376c模拟物及100 nmol阴性对照序列分别加入6孔板中,用无双抗100 mL/L胎牛血清的DMEM培养液培养8 h后换成正常培养液继续培养,后续转染效果检测及相关功能实验在转染48 h后收取细胞进行。
1.3.2real-time PCR按TRIzol试剂说明书上的步骤提取组织或者细胞中的总RNA,并应用超微量核酸定量光谱仪(Thermo Nanodrop 1000)检测RNA的浓度和纯度。逆转录操作按照miRNA逆转录试剂盒说明书上的步骤进行。real-time PCR按照miRNA qPCR试剂盒说明书上的步骤进行,以U6为内参,2-△△Ct法计算miR-376c的相对表达量。独立重复实验3次。miR-376c正向引物:5′-AAC ATA GAG GAA ATT CCA CGT-3′;U6 snRNA 正向引物:5′-CGC AAG GAT GAC ACG CAA ATT C-3′。
1.3.3Transwell小室迁移及侵袭实验侵袭实验时,先按1:8的稀释比例将50 mg/L的Matrigel胶稀释后铺于小室底部;迁移实验时不铺胶 。收取转染48 h 后的各组MHCC-97H 细胞,离心、重悬将细胞浓度调整为1×106个/mL。24孔板下室加入600 μL含100 mL/L胎牛血清的完全培养基,取各组细胞悬液200 μL加入Transwell小室的上室。每组重复3个样本。24 h后取出小室,首先用PBS溶液将小室清洗3次,然后用棉签将小室的微孔膜上层的Matrigel 胶及细胞轻轻拭净,接着用多聚甲醛(40 g/L,15 min)固定,用结晶紫(1 g/L,5 min)染色,并用PBS溶液洗净,最后将小室置于倒置显微镜下进行观察计数,每个样本随机选取5个视野进行计数并求其平均数,以此评估细胞的侵袭迁移能力。
1.3.4细胞划痕实验用记号笔在培养板背面画3条横行平行线,间距约0.5 cm,定位划痕区域。将实验组、对照组细胞用胰酶消化、用培养基重悬后均匀种于6孔板中,细胞密度约1×106个/mL,于37 ℃、5% CO2的培养箱中常规培养。当细胞均匀铺满板底,且为单层细胞时,将无菌直尺置于培养板上,与标记线垂直,用200 μL枪头用力均匀沿直尺划线,与标记线存在交叉点。PBS清洗3次,去除悬浮细胞,加入无血清培养基,继续于37 ℃、5%CO2的培养箱中常规培养。于划痕后0、48 h在倒置显微镜下观察、拍照。
1.3.5免疫组化先将组织标本进行常规脱水、石蜡包埋,制作4 μm切片。取出切片置于60 ℃烘箱中20 min,常规二甲苯脱蜡,梯度酒精水化,3%H2O2阻断灭活内源性过氧化物酶(37 ℃,10 min),抗原修复(0.01 mmol/L枸橼酸缓冲液,96 ℃,15 min),滴加山羊血清液封闭(100 mL/L,37 ℃,10 min),滴加HMGA2抗体(1:200,4 ℃过夜),PBS洗涤后,滴加生物素标记的二抗(1:1000,37 ℃,60 min);滴加链霉亲和素-过氧化物酶(SP),37 ℃孵育40 min,DAB显色8 min,在显微镜下掌握染色程度,自来水冲洗10 min终止反应;苏木素复染2 min,自来水冲洗15 min;常规脱水、透明、干燥、封片。免疫组化评分= 染色强度评分×阳性细胞百分比评分,每张切片的最终评分为5个视野的平均分。染色强度评分:(-)为0分,(+)为1分,(++)为2分,(+++)为3分;阳性细胞(肿瘤细胞或肝细胞)百分比评分:0分为阳性细胞比例≤5%,1分为阳性细胞比例>5%~≤25%,2分为阳性细胞比例>25%~≤50%,3分为阳性细胞比例50%>~≤75%,4分为阳性细胞比例>75%。
1.3.6细胞蛋白抽提及Western blot实验细胞转染48 h后,用RIPA裂解液抽提细胞总蛋白,用BCA法进行蛋白定量。Western blot实验时,首先将待检测蛋白样品按30 μg/孔上样后行SDS-PAGE电泳,然后用湿转法将蛋白转移至PVDF 膜上,用5%脱牛奶粉液封闭2.0 h后,加入相应的HMGA2抗体(1:1000)或者β-actin抗体(1:1000),4 ℃孵育过夜。次日取出膜,在室温孵育30 min,用TBST溶液(TBS,1 mL/L Tween-20)洗膜3次,10 min/次,洗去残余的一抗;分别加HRP标记的抗兔或抗小鼠二抗(1:5000),室温孵育2 h。TBST(TBS,1 mL/L Tween-20)洗膜3 次,8 min/次,洗去残余的二抗后在暗室进行发光检测目的蛋白。
1.3.7miRNA靶基因的预测应用生物信息学软件TargetScanHuman预测miR-376c的靶基因。
1.4 统计学处理
应用SPSS 22.0等统计软件处理数据,计量资料以均数±标准差(±s)表示,使用的统计学方法包括t检验、Pearson χ2检验以及Pearman相关性检验等;用Graphpad Prism 6及Adobe PhotoShop CS5等作图软件进行图表的绘制。P<0.05为差异有统计学意义。
2 结 果
2.1 HCC组织中miR-376c的表达
real-time PCR结果显示,与在癌旁组织中的表达水平(3.4330±0.1202)比较,miR-376c在HCC组织中的表达水平(0.9667±0.1217)明显下调(P<0.01)(图1)。
2.2 HCC组织中miR-376c表达量的临床意义
以HCC组织中miR-376c的平均水平(0.9667±0.1217)为界,83例患者被分为miR-376c高表达组(44例)和miR-376c低表达组(39例)。分析miR-376c的表达与HCC患者的临床病理特征之间的关系,结果显示,miR-376c的表达水平与门静脉侵犯与否、TNM分期及Edmondson分级有关(均P<0.05),而与年龄、性别、肿瘤大小、甲胎蛋白、肿瘤个数无关(均P>0.05)(表1)。对两组患者的随访进行分析,结果显示,与miR-376c高表达组患者比较,miR-376c低表达组患者的3年总体生存率明显要低(P<0.01)(图2)。
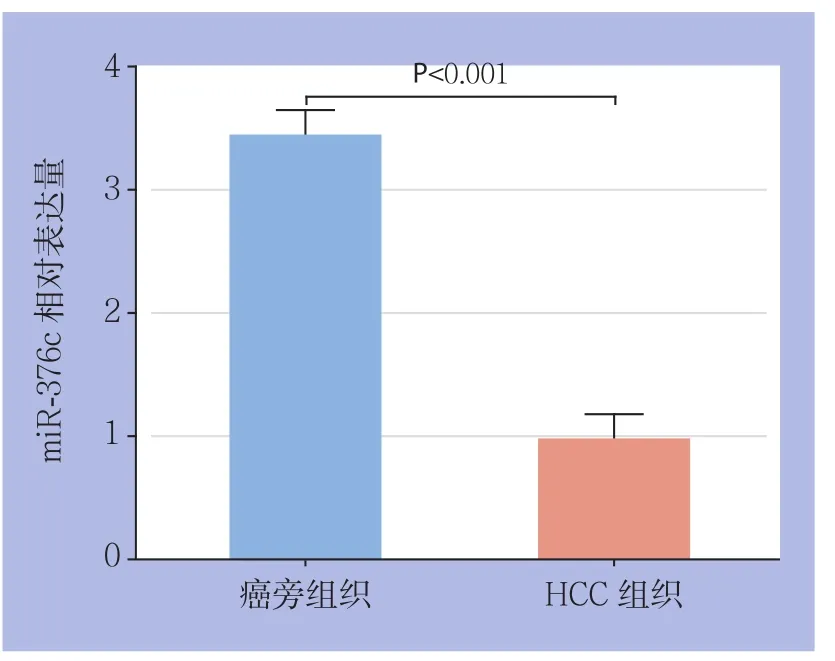
图1 癌旁组织和HCC组织中miR-376c的表达Figure 1 The miR-376c expressions in HCC tissues and adjacent normal tissues
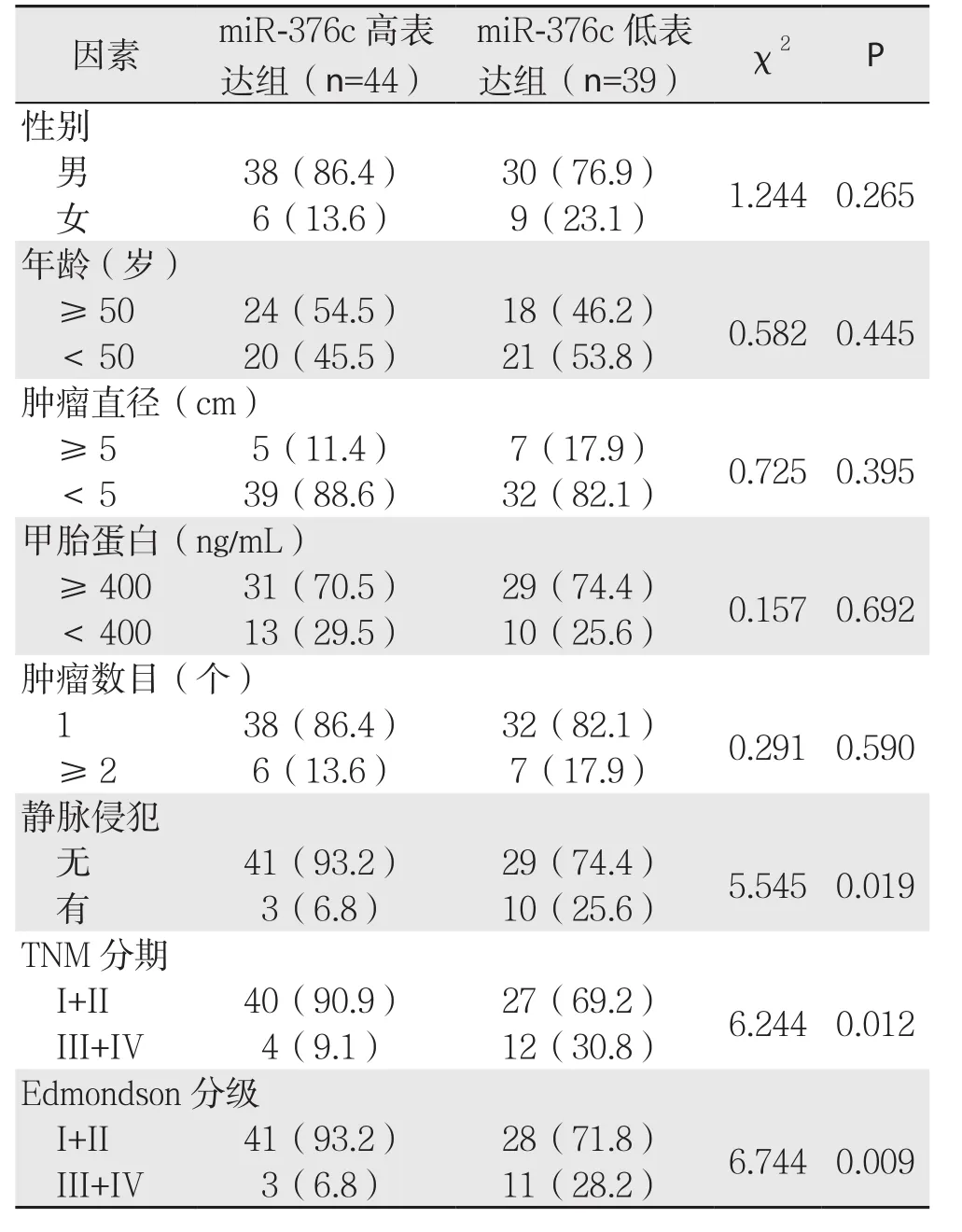
表1 HCC中miR-376c的表达量与临床病理因素的关系[n(%)]Table 1 Relations of miR-376c expression with clinicopathologic features of HCC [n (%)]
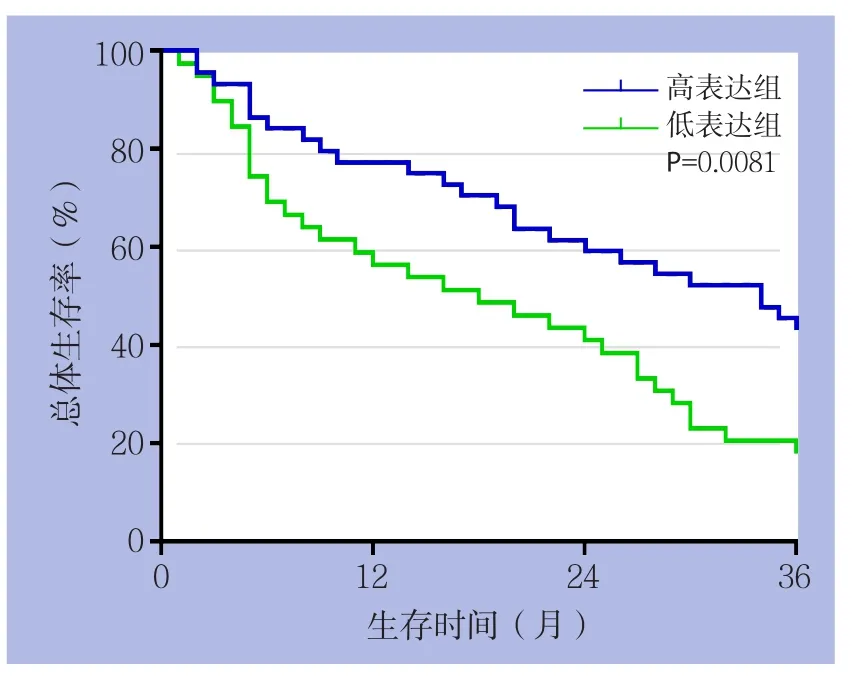
图2 miR-376c高表达与低表达患者3年总体生存率比较Figure 2 Comparison of the 3-year overall survival rates between HCC patients with high and low miR-376c expression
2.3 miR-376c在不同的HCC细胞系中的表达
应用real-time PCR检测正常永生化人肝细胞L02以及不同的HCC细胞系MHCC-97H、HepG2、MHCC-97L、Hep-3B、SMMC-7721中miR-376c的表达水平。结果显示,与在L02细胞中的表达相比,5种HCC细胞系中miR-376c的表达均明显下调,而与其他4种HCC细胞系相比,MHCC-97H细胞中的miR-376c的表达量为最低,差异均有统计学意义(均P<0.05)(图3)。
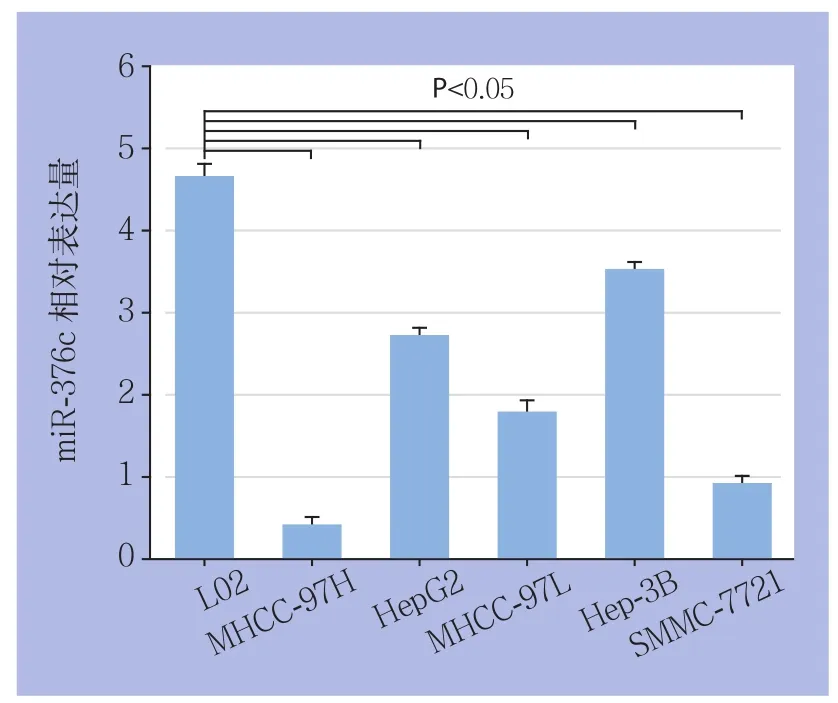
图3 miR-376c不同HCC细胞系与正常肝细胞中的表达Figure 3 The of miR-376c expressions in different HCC cell lines and normal hepatic cells
2.4 过表达miR-376c对HCC细胞的迁移与侵袭的影响
为探讨miR-376c对HCC细胞生物学行为的影响,用miR-376c模拟物上调MHCC-97H细胞中的miR-376c的表达水平,用real-time PCR检测转染效果,结果显示,过表达组中miR-376c的表达水平(0.4000±0.5774)明显高于阴性对照组(15.1700±0.4410),差异有统计学意义(P<0.01)(图4)。
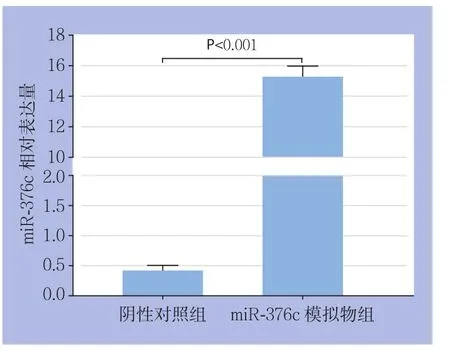
图4 转染效果检测Figure 4 Transfection eきciency determinations
Transwell迁移实验结果显示,过表达MHCC-97 H细胞的m i R-376 c后,迁移的细胞数目明显减少[(56.00±2.00)vs.(26.00±1.16),P<0.05](图5A-B);Transwell侵袭实验表明,相比对照组而言,过表达MHCC-97H细胞的miR-376c后,侵袭的细胞数目也明显被抑制[(45.33±1.88)vs.(18.33±1.87),P<0.01](图5C-D)。此外,划痕实验结果显示,过表达MHCC-97H细胞的miR-376c后,划痕的愈合率明显降低[(95.33±1.45)% vs.(60.00±2.08)%,P<0.01](图6)。
2.5 miR-376c可抑制HMGA2蛋白的表达
用生物信息学软件(TargetScanHuman)分析发现,HMGA2可能为miR-376c的潜在的靶点之一(图7A)。为了探讨miR-376c是否能调控HMGA2的表达,分别在MHCC-97H细胞中转染miR-376c模拟物和阴性对照序列,然后检测对应的细胞中HMGA2蛋白的表达变化,结果显示,模拟物组细胞中的HMGA2蛋白表达水平明显低于阴性对照组(P<0.05)(图7B)。
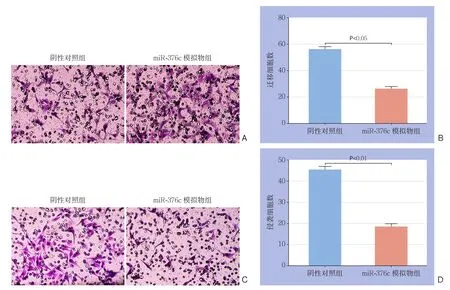
图5 miR-376c对MHCC-97H细胞的迁移和侵袭能力的影响 A:Transwell实验检测细胞的迁移能力(×100);B:迁移细胞数的统计图;C:Transwell实验检测细胞的侵袭能力(×100);D:侵袭细胞数的统计图Figure 5 Influence of miR-376c on migration and invasion abilities of MHCC-97H cells A: Cell migration ability measured by Transwell assay (×100); B: Statistical plot of number of migrating cells; C: Cell invasion ability measured by Transwell assay (×100);D: Statistical plot of numbers of invading cells

图6 划痕实验检测细胞的迁移能力Figure 6 Cell migration ability measured by wound scratch healing assay

图7 miR-376c对HMGA2表达的影响 A:生物信息学分析显示miR-376c可与HMGA2基因的3′非编码区结合;B:过表达miR-376c的MHCC-97H细胞中HMGA2蛋白水平降低Figure 7 Influence of miR-376c on HMGA2 expression A: Bioinformatics analysis showing that miR-376c binds to 3’-UTR site of HMGA2 gene; B: Overexpressed miR-376c decreasing HMGA2 protein expression in MHCC-97H cells
2.6 HCC组织中miR-376c表达水平与HMGA2蛋白表达水平的相关性
为了进一步证实miR-376c可调控HMGA2蛋白的表达,应用免疫组化法分别检测了miR-376c高表达组和低表达组的HCC组织中HMGA2的表达情况。结果发现,HMGA2在HCC组织中的染色为棕黄色或者棕褐色,主要着色部位为细胞核,有部分存在于细胞质或者细胞膜上(图8A-B)。并且,miR-376c高表达组中的HMGA2蛋白表达强度明显低于miR-376c低表达组[(1.00±0.12)vs.(6.50±0.13)],差异有统计学意义(P<0.01)(图8C)。
此外,为了进一步明确miR-376c和HMGA2的表达量之间的相关性,采用了Spearman相关分析法进行了统计分析,结果显示,在HCC组织中,miR-376c 与HMGA2的表达呈明显负相关(r=-0.541,P<0.01)(图8D)。
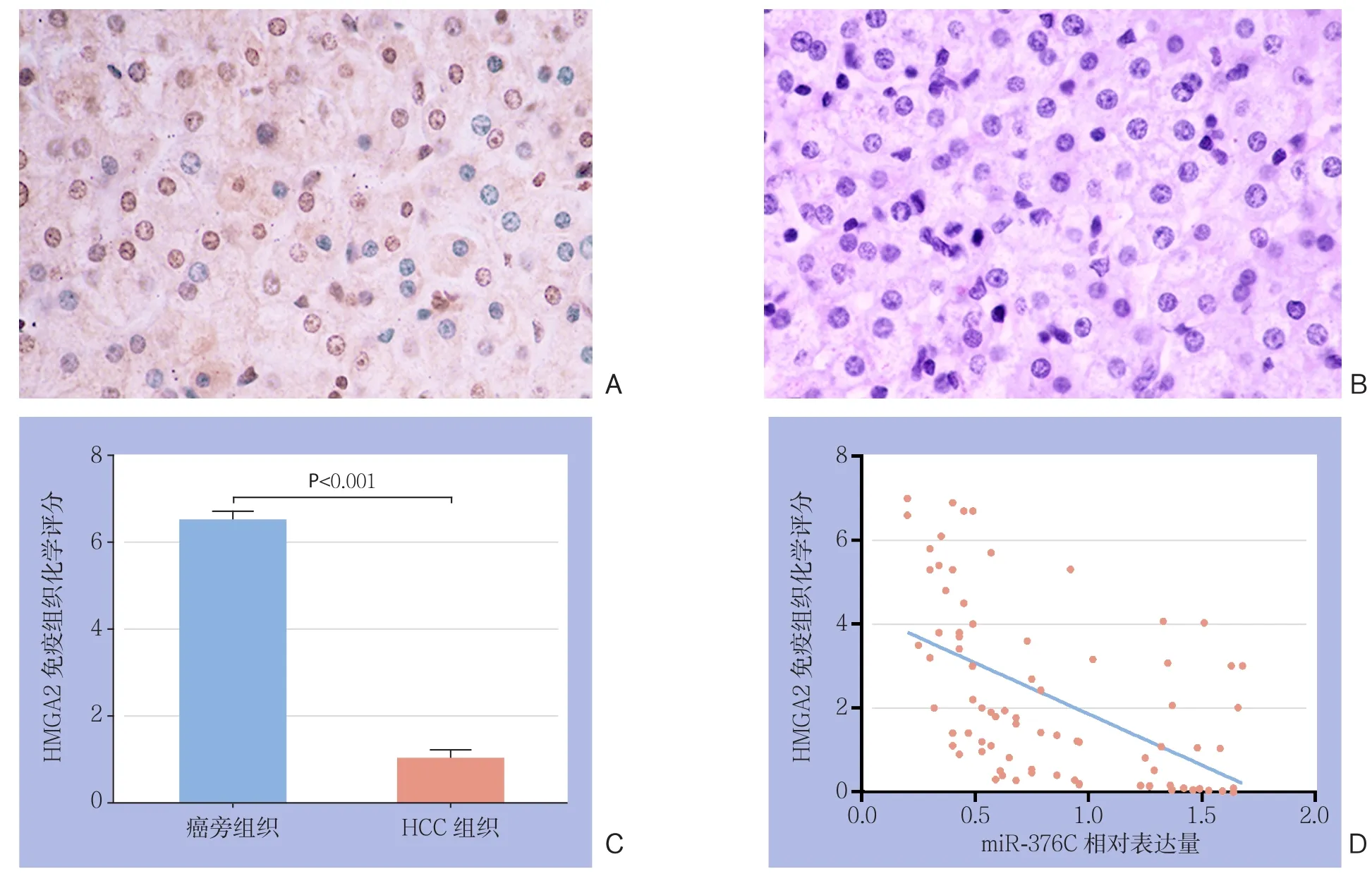
图8 HCC组织中miR-376c和HMGA2的表达量的相关性 A-B:miR-376C低表达和高表达HCC组织中HMGA2的表达检测(×400);C:HMGA2的免疫组化评分;D: Spearman法分析miR-376c与HMGA2表达量的相关性Figure 8 Correlation of miR-376c expression with HMGA2 expression in HCC tissues A–B: The HMGA2 expression in HCC tissues with low and high miR-376C expression (×400);C: Immunohistochemistry score for HMGA2; D: Spearman correlation analysis of correlation between miR-376c and HMGA2 expression
3 讨 论
HCC是最致命的肿瘤之一,尽管过去数十年HCC的治疗手段已经有了诸多改善,但是目前HCC患者的生存率仍然不容乐观[5,23]。因此,寻找新的治疗靶点,有效推动HCC靶向治疗的发展是目前需要迫切解决的问题[4,23]。miRNA是一类不编码蛋白质的RNA小分子,可在肿瘤中异常表达,从而调控肿瘤的发生发展[1,24-26]。系列研究发现,miR-376c在骨肉瘤、胆管癌、前列腺癌、宫颈癌、卵巢癌等肿瘤中均为异常表达,其作为抑癌基因或者癌基因可以参与调节肿瘤细胞的增殖、凋亡、侵袭、迁移以及化疗抵抗性等生物学行为[12,14-16,19,27]。Jin等[28]研究发现,miR-376c在骨肉瘤组织和细胞系中均为低表达,并且miR-376c可通过直接靶向作用于TGF-α来抑制骨肉瘤的生长和侵袭;Iwaki等[15]研究发现,miR-376c在胆管癌中为抑癌基因,能够抑制胆管癌细胞的侵袭和迁移;Ye等[16]研究发现,过表达卵巢癌细胞中的miR-376c可以促进肿瘤细胞的增殖,增加肿瘤细胞对化疗药物的抵抗性。而miR-376c在HCC中的表达情况及其对HCC细胞的作用及其机制目前尚罕有报道。
本研究发现,HCC组织中miR-376c的表达水平明显下调,且与HCC的门静脉侵犯与否、TNM分期及Edmondson分级显著相关,此外,miR-376c高表达组HCC患者预后较好。上述结果提示,在HCC中,miR-376c为抑癌基因,且可能对肿瘤细胞的侵袭、迁移具有抑制作用。为了探究miR-376c对HCC细胞的侵袭、迁移的影响,本研究首先检测了miR-376c在HCC细胞系中的表达情况。与在HCC组织标本中的表达情况一致,miR-376c在HCC细胞系中的表达与正常肝细胞相比明显下调。而Transwell迁移侵袭实验以及细胞划痕实验结果均表明,miR-376c可以抑制HCC细胞的迁移及侵袭能力,这和在胆管癌[15]、骨肉瘤[28]中的研究结果一致。上述结果表明,miR-376c为HCC的抑癌基因,可以通过抑制HCC细胞的侵袭迁移能力从而抑制肝癌的发生发展。
为进一步探讨miR-376c在HCC中的潜在作用机制,本研究首先应用生物信息学工具预测发现miR-376c在HCC中的可能的作用靶点之一为HMGA2。而据文献[21]报道,HMGA2在HCC中为过表达,可促进HCC细胞的侵袭、迁移、EMT及增殖,并且HMGA2可通过与miRNA相互作用,从而共同调节HCC的发生发展。例如,Huang等[20]研究发现,miR-603a可以抑制HCC细胞的增殖、迁移和侵袭,它可以通过直接作用于HMGA2来发挥其抑癌作用。因此,结合生物信息学资料和相关文献报道推测,在HCC中HMGA2可以受miR-376c的调控。实验结果显示,上调HCC细胞中的miR-376c的表达水平后HMGA2的蛋白水平相应下调。这提示miR-376c可能通过负向调控HMGA2的表达水平发挥作用。为了进一步证实上述结果,本研究分析了HCC组织中miR-376c的表达和miR-376c表达水平的相关性。首先应用免疫组化染色检测HMGA2蛋白在miR-376c高表达组和低表达组的HCC组织中的表达情况并进行Spearman相关分析。结果显示,HMGA2蛋白在miR-376c低表达组的HCC组织中HMGA2蛋白的表达明显要强;Spearman相关分析显示,HCC组织中的miR-376c和HMGA2的表达呈明显负相关关系。上述结果进一步说明了,HMGA2可能是miR-376c的下游直接作用靶点。但是在HCC中,miR-376c是否可通过负向调控HMGA2蛋白的表达发挥其抗HCC迁移与侵袭的作用,miR-376c的上游调控因子及机制如何,以及HMGA2是否是miR-376c的直接作用靶点和具体作用机制都有待进一步深入研究。
综上,HCC中miR-376c的表达下调,并且与患者的门静脉侵犯、TNM分期及Edmondson分级及预后密切相关。此外,miR-376c能抑制HCC细胞的侵袭与迁移,而HMGA2可能是miR-376c的下游直接作用靶点。因此,本研究可能为HCC靶向治疗的研究提供一定的实验基础。
[1] Xu J, Li J, Zheng TH, et al. MicroRNAs in the Occurrence and Development of Primary Hepatocellular Carcinoma[J]. Adv Clin Exp Med, 2016, 25(5):971–975. doi: 10.17219/acem/36460.
[2] Donadon M, Solbiati L, Dawson L, et al. Hepatocellular Carcinoma:The Role of Interventional Oncology[J]. Liver Cancer, 2016, 6(1):34–43.
[3] Frenette C. Surveillance for Hepatocellular Carcinoma[J].Gastroenterol Hepatol (N Y), 2016, 12(6):394–396.
[4] 郭之野, 黄飞舟. 中晚期肝细胞肝癌的靶向治疗:困境与希望[J]. 中国普通外科杂志, 2017, 26(1):109–115. doi:10.3978/j.issn.1005–6947.2017.01.018.Guo ZY, Huang FZ. Targeted therapy for hepatocellular carcinoma of middle and advanced stage: quandaries and prospects[J]. Chinese Journal of General Surgery, 2017, 26(1):109–115. doi:10.3978/j.issn.1005–6947.2017.01.018.
[5] 汪晋. 肝癌预后相关影响因素[J]. 中国普通外科杂志, 2015,24(2):270–274. doi:10.3978/j.issn.1005–6947.2015.02.022.Wang J. Prognostic factors in liver cancer[J]. Chinese Journal of General Surgery, 2015, 24(2):270–274. doi:10.3978/j.issn.1005–6947.2015.02.022.
[6] 王强凤, 史肖华. 肝细胞癌的新见解:从实验到临床[J]. 中国普通外科杂志, 2015, 24(1):1–9. doi:10.3978/j.issn. 1005–6947.2015.01.001.Wang QF, Shi XH. Samuele De Minicis, Marco Marzioni,Antonio Benedetti, Gianluca Svegliati-Baroni[J]. Chinese Journal of General Surgery, 2015, 24(1):1–9. doi:10.3978/j.issn.1005–6947.2015.01.001.
[7] Scortegagna E Jr, Karam AR, Sioshansi S, et al. Hepatocellular carcinoma recurrence pattern following liver transplantation and a suggested surveillance algorithm[J]. Clin Imaging, 2016,40(6):1131–1134. doi: 10.1016/j.clinimag.2016.07.002.
[8] 高鹏骥, 陈雷, 高杰, 等. 环状RNA在肝细胞癌中的差异表达研究[J]. 中国普通外科杂志, 2017, 26(1):65–69. doi:10.3978/j.issn.1005–6947.2017.01.011.Gai PJ, Chen L, Gai J, et al. Differentially expressed circular RNAs in human hepatocellular carcinoma[J]. Chinese Journal of General Surgery, 2017, 26(1):65–69. doi:10.3978/j.issn.1005–6947.2017.01.011.
[9] 何运, 陈攀, 罗嘉, 等. 长链非编码RNA在肝癌中的研究进展[J].中国普通外科杂志, 2016, 25(7):1069–1075. doi:10.3978/j.issn.1005–6947.2016.07.022.He Y, Chen P, Luo J, et al. Long noncoding RNAs in hepatocellular carcinoma:recent research progress[J]. Chinese Journal of General Surgery, 2016, 25(7):1069–1075. doi:10.3978/j.issn.1005–6947.2016.07.022.
[10] Dong Y, He D, Peng Z, et al. Circular RNAs in cancer: an emerging key player[J]. J Hematol Oncol, 2017, 10(1):2. doi: 10.1186/s13045–016–0370–2.
[11] He M, Zhou W, Li C, et al. MicroRNAs, DNA Damage Response,and Cancer Treatment[J]. Int J Mol Sci, 2016, 17(12). pii: E2087.
[12] Deng Y, Xiong Y, Liu Y. miR-376c inhibits cervical cancer cell proliferation and invasion by targeting BMI1[J]. Int J Exp Pathol,2016, 97(3):257–265. doi: 10.1111/iep.12177.
[13] Matsuda A, Yan IK, Foye C, et al. MicroRNAs as paracrine signaling mediators in cancers and metabolic diseases[J]. Best Pract Res Clin Endocrinol Metab, 2016, 30(5):577–590. doi: 10.1016/j.beem.2016.07.
[14] Chang WM, Lin YF, Su CY, et al. DDysregulation of RUNX2/Activin-A Axis upon miR-376c Downregulation Promotes Lymph Node Metastasis in Head and Neck Squamous Cell Carcinoma[J].Cancer Res, 2016, 76(24):7140–7150.
[15] Iwaki J, Kikuchi K, Mizuguchi Y, et al. MiR-376c down-regulation accelerates EGF-dependent migration by targeting GRB2 in the HuCCT1 human intrahepatic cholangiocarcinoma cell line[J]. PLoS One, 2013, 8(7):e69496. doi: 10.1371/journal.pone.0069496.
[16] Ye G, Fu G, Cui S, et al. MicroRNA 376c enhances ovarian cancer cell survival by targeting activin receptor-like kinase 7: implications for chemoresistance[J]. J Cell Sci, 2011, 124(Pt 3):359–368. doi:10.1242/jcs.072223.
[17] Jiang W, Tian Y, Jiang S, et al. MicroRNA-376c suppresses nonsmall-cell lung cancer cell growth and invasion by targeting LRH-1-mediated Wnt signaling pathway[J]. Biochem Biophys Res Commun, 2016, 473(4):980–986. oi: 10.1016/j.bbrc.2016.04.002.
[18] Lasithiotaki I, Tsitoura E, Koutsopoulos A, et al. Aberrant expression of miR-21, miR-376c and miR-145 and their target host genes in Merkel cell polyomavirus-positive non-small cell lung cancer[J]. Oncotarget, 2016, doi: 10.18632/oncotarget.11222. [Epub ahead of print]
[19] Vychytilova-Faltejskova P, Radova L, Sachlova M, et al. Serumbased microRNA signatures in early diagnosis and prognosis prediction of colon cancer[J]. Carcinogenesis, 2016, 37(10):941–950. doi: 10.1093/carcin/bgw078.
[20] Huang W, Li J, Guo X, et al. miR-663a inhibits hepatocellular carcinoma cell proliferation and invasion by targeting HMGA2[J].Biomed Pharmacother, 2016, 81:431–438. doi: 10.1016/j.biopha.2016.04.034.
[21] Luo Y, Li W, Liao H. HMGA2 induces epithelial-to-mesenchymal transition in human hepatocellular carcinoma cells[J]. Oncol Lett,2013, 5(4):1353–1356.
[22] Deng L, Yang SB, Xu FF, et al. Long noncoding RNA CCAT1 promotes hepatocellular carcinoma progression by functioning as let-7 sponge[J]. J Exp Clin Cancer Res, 2015, 34:18. doi: 10.1186/s13046–015–0136–7.
[23] Akamatsu N, Cillo U, Cucchetti A, et al. Surgery and Hepatocellular Carcinoma[J]. Liver Cancer, 2016, 6(1): 44–50.
[24] 梁治坤, 程凡天, 胡走肖, 等. miR-150–5p抑制肝癌细胞的迁移和侵袭及其机制[J]. 中国普通外科杂志, 2016, 25(8):1175–1179.doi:10.3978/j.issn.1005–6947.2016.08.015.Liang ZK, Cheng FT, Hu ZX, et al. Inhibitory effect of miR-150–5p on migration and invasion of hepatocellular carcinoma cells and its mechanism[J]. Chinese Journal of General Surgery, 2016,25(8):1175–1179. doi:10.3978/j.issn.1005–6947.2016.08.015.
[25] 王文耀, 张鸿飞, 唐淼, 等. miR-21在肝癌中的表达及其与PTEN的关系[J]. 中国普通外科杂志, 2017, 26(3):395–400. doi:10.3978/j.issn.1005–6947.2017.03.020.Wang WY, Zhang HF, Tang M, et al. Expression of miR-21 in hepatic cancer and its relationship with PTEN[J]. Chinese Journal of General Surgery, 2017, 26(3):395–400. doi:10.3978/j.issn.1005–6947.2017.03.020.
[26] 张立, 张迪, 李孝彬, 等. microRNA-616在肝癌中的表达及临床意义[J]. 中国普通外科杂志, 2016, 25(7):991–997. doi:10.3978/j.issn.1005–6947.2016.07.010.Zhang L, Zhang D, Li XB, et al. Expression of microRNA-616 in hepatocellular carcinoma and its clinical significance[J]. Chinese Journal of General Surgery, 2016, 25(7):991–997. doi:10.3978/j.issn.1005–6947.2016.07.010.
[27] Margaillan G, Lévesque É, Guillemette C. Epigenetic regulation of steroid inactivating UDP-glucuronosyltransferases by microRNAs in prostate cancer[J]. J Steroid Biochem Mol Biol, 2016, 155(Pt A):85–93. doi: 10.1016/j.jsbmb.2015.09.021.
[28] Jin Y, Peng D, Shen Y, et al. MicroRNA-376c inhibits cell proliferation and invasion in osteosarcoma by targeting to transforming growth factor-alpha[J]. DNA Cell Biol, 2013,32(6):302–309. doi: 10.1089/dna.2013.1977.
