肝癌肝切除手术后肝功能恢复的影响因素分析及风险预测模型建立
2017-04-02栗雪峰李建生马金良荚卫东刘文斌陈浩
栗雪峰,李建生,马金良,荚卫东,刘文斌,陈浩
(安徽医科大学附属省立医院 肝脏外科/肝胆胰外科安徽省重点实验室,安徽 合肥230001)
在我国恶性肿瘤的发病率中原发性肝癌(肝癌)一直居高不下,最为有效的治疗方法就是手术切除肿瘤[1]。正常肝脏的再生能力很强,即使手术后仅剩20%~30%的余肝体积,数周内肝功能仍可代偿[2],而肝癌、肝硬化等患有肝脏其他疾病的患者,即使手术后剩余高达70%~80%的余肝体积,也可能术后出现肝脏功能恢复不良或伴有其他的各种并发症甚至危及生命,所以手术前对较为准确评估患者的肝脏储备功能对于合并有肝硬化的肝癌患者来说显得尤为重要[3],在肝胆外科领域中,精准肝切除在近年来已然成了热门的研究方向[4],其中主要包括手术前精准的评估,术中精准的规划及操作,以及术后精准的管理,最为重要的要数手术前精准的评估[5]。肝脏CT影像解读分析系统(IQQA-LIVER)和吲哚氰绿(ICG)排泄试验,是患者手术前进行评估的重要方法。单电子发射型计算机断层显像(SPECT)对于评估肝脏储备功能也有着重要意义,在肝脏外科领域中越来越受到重视[6]。本研究通过术前的数字现代化信息模拟技术及术中精准切肝技术,尝试建立依赖于15 min ICG留率(ICGR l5)、术后剩余肝脏体积(RLV)和心脏清除指数(HH15)的风险评估模型。
1 资料与方法
1.1 材料
收集2015年2月—2016年9月在我院肝脏外科50例行半肝切除的肝癌患者在院期间的各种相关的临床数据及资料。50例患者中男44例(88.0%),女6例(12.0%);年龄32~76岁,中位年龄41岁,平均年龄(43±12)岁;所有患者手术前Child-Pugh分级均为A;手术过程中采用电刀联合超声刀切除病灶;术后病理证实肝细胞肝癌46例(92.0%)、胆管细胞癌4例(8.0%)、且均合并肝硬化;手术方式包括右半肝切除29例(58.0%)、左半肝切除16例(32.0%)、扩大左半肝切除3例(6.0%)、扩大右半肝切除2例(4.0%)。患者术后肝脏功能不全标准:肝切除术7 d后总胆红素仍>34 μmol/L;术后胆红素峰值>51 μmol/L[7-8]。患者术后肝功能衰竭标准:术后5 d更长时间的凝血酶原活动度(PT%)<50%及血清胆红素(BIL)>51 μmol/L[9];或术后BIL峰值>120 μmol/L[10]。
1.2 方法
1.2.1ICG测定按照0.5 mg/kg ICG体质量计算用量(ICG:购自沈阳济世制药有限公司),再用无菌注射用水稀释成溶液(稀释比例25 mg ICG/5 mL无菌注射用水),将DDG分析仪(DDG3300K,日本光电株式工业会社)的鼻感光探头正确夹住患者鼻翼部,打开DDG分析仪及数据分析软件,将患者的基本信息及相关数据输入主机软件内,将配制好的溶液选择一侧肘正中静脉注入,数据分析软件会将检测结果直接导入并进行处理,自动计算出患者术前的ICGR15[11]。
1.2.2肝脏体积测量术前应用美国GE公司Discovery750HD多排螺旋CT予患者完善上腹部平扫+三期增强薄层扫描,将患者的DICOM标准格式的CT肝脏影像文件导入我院所引进的美国EDDA公司的IQQA-Liver肝脏CT影像解读分析系统,进行读片、提取信息并重建出包括肝脏、肿瘤及血管胆管树的立体模型,通过三维重建及虚拟手术分割结果分析,测算出肝脏总体积(TLV)、肿瘤体积、拟切除肝脏体积及RLV,根据标准肝体积(SLV)计算公式(SLV=706.2×BSA+2.4)计算出患者的SLV,BSA为患者体表面积[12]。
1.2.3HH15测定手术前行SPECT核素扫描,99mTc-EHIDA 3.7×106Bq从肘静脉弹丸注射(二乙基乙酰苯胺亚氨二醋酸-EHIDA:购自江苏原子能研究所),同时通过e.camSPECT(德国西门子公司)扫描并采集数据。统计分析达到高峰时的时间(min)、峰值时的放射计数、HH15(15 min心脏ROI内放射性计数/5 min心脏ROI内放射性计数)、肝脏受体指数(LHL15)等[6]。
1.3 数据收集
搜集每个病例的详细资料,术前资料包括患者的年龄、性别、谷草转氨酶(AST)、谷丙转氨酶(ALT)、谷氨酰转肽酶(GGT)、总胆红素(TBIL)、白蛋白(ALB)、凝血酶原时间(PT)、ICGRl5、RLV/SLV及HH15,术中资料包括手术时间、术中出血量,术后资料包括评价肝功能的各种生化指标及各种并发症的发生情况等。
1.4 统计学处理
采用SPSS统计软件进行分析。计数资料的采用χ2检验进行比较;计量资料均采用平均数±标准差(±s)表示,数据间的比较采用t检验;P<0.05为差异有统计学意义。Logistic回归分析模型进行单因素、多因素风险分析,临界值(cutoff值)采用(receiver operating characteristic,ROC)曲线,P<0.05有统计学意义。
2 结 果
2.1 肝脏切除手术后患者肝脏功能恢复影响因素的单变量分析
根据患者术后恢复情况,是否出现肝脏功能不全,将50例行半肝切除的肝癌患者分成两组,其中有40例患者手术后肝脏功能恢复良好,无肝脏功能不全等表现,占总数的80.0%。其余10例患者术后不同程度的出现了肝功能不全及其他并发症,占总数的20.0%。
两组患者在年龄、术前AST、ALT、GGT、TBIL、ALB、PT、手术时间、术中出血量的比较,差异均无统计学意义(均P>0.05),而在术前ICGRl5、RLV/SLV及HH15的比较中,两组差异均具有统计学意义(均P<0.05)(表1)。左半肝和右半肝切除两种手术方式在术后恢复情况的差异无统计学意义(χ2=0.34,P=0.56)(表2)。
表1 两组患者各因素的变量分析(±s)Table 1 Uivariate analysis of each factor in the two groups of patients(±s)

表1 两组患者各因素的变量分析(±s)Table 1 Uivariate analysis of each factor in the two groups of patients(±s)
因素 恢复良好(n=40)恢复不良(n=10) t P年龄(岁) 44.10±13.47 42.30±10.40 0.393 0.696 A L T(I U/L) 28.4±7.0 29.7±7.7 0.525 0.602 A S T(I U/L) 39.7±10.4 33.9±11.9 1.535 0.131 G G T(I U/L) 49.3±11.8 52.0±13.1 0.631 0.531 T B I L(µm o l/L) 10.56±3.36 10.59±3.83 0.023 0.981 A L B(g/L) 41.87±3.98 41.85±3.05 0.002 0.999 P T(s) 11.56±1.97 12.59±0.79 1.633 0.109手术时间(m i n) 144.22±41.06141.50±49.62 0.180 0.858失血量(m L) 425.70±223.28535.30±160.481.456 0.152 H H 15 0.47±0.08 0.54±0.05 2.820 0.007 I C G R 15(%) 5.44±2.12 7.65±0.59 3.246 0.002 R L V/S L V 0.45±0.11 0.32±0.06 3.746 <0.001
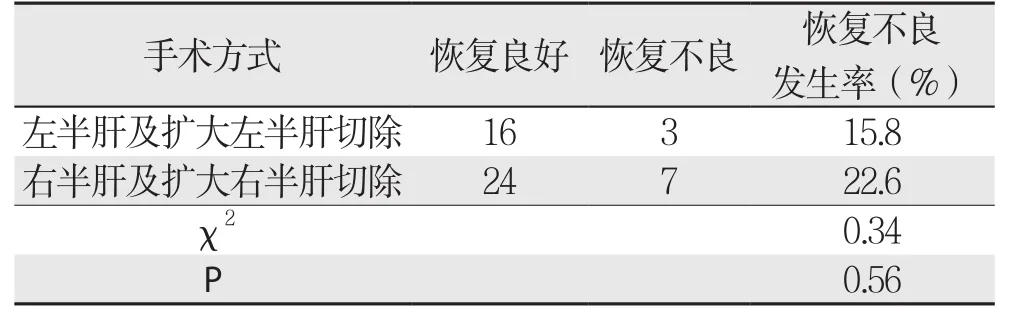
表2 左右半肝切除术后恢复情况比较(n)Table 2 Comparison of postoperative recovery between left and right hemihepatic resection (n)
2.2 肝脏切除手术后患者肝脏功能恢复影响因素的多变量分析
将有统计学差异的变量(ICG R15、RLV/SLV、HH15)进行二元Logistic回归,通过回归模型确定影响术后恢复情况的危险因子。二元Logistic回归分析结果如下,可见3个指标均纳入模型(P<0.05),均为患者术后肝脏功能恢复情况的影响因子(表3)。

表3 Logistic回归模型分析Table 3 Logistic regression model analysis
2.3 风险预测模型建立及准确性判断
将表3数据导入文献[5]公式得出预测模型:危险系数(R)=31.871×(RLV/SLV)-1.689×(ICGR15)-19.663×HH15。
对预测模型采用ROC曲线进行准确性判断,在R=0.90时候患者预测发生术后恢复不良的敏感度和特异度为97.5%和90%;ROC曲线下面积为0.96,标准误为0.025,95% CI为0.91~1.01(图1),根据是否R>0.90将患者分为两组,比较两组患者术后恢复情况是否有差异,结果如下表所示(表4),发现R>0.90的患者发生术后恢复不良的发生率明显小于R≤0.90的患者(χ2=19.324,P=0.005)。
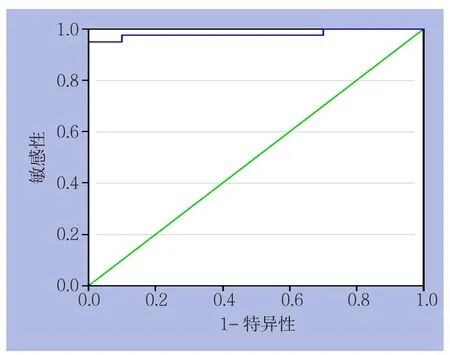
图1 ROC曲线图Figure 1 ROC curve
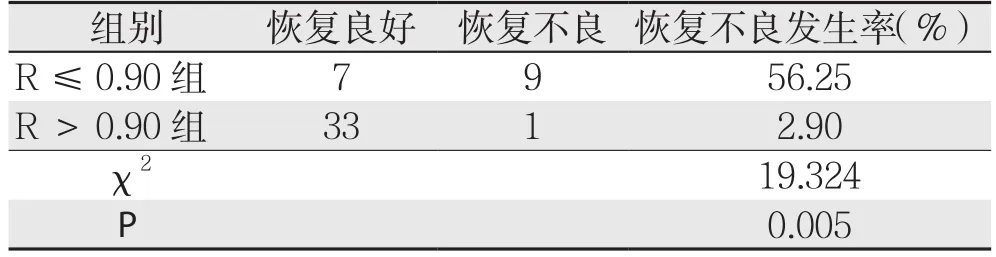
表4 不同R值患者术后恢复情况比较(n)Table 4 Comparison of postoperative recovery between patients with diあerent R-values (n)
3 讨 论
手术后因为肝功能衰竭导致围手术期患者死亡例数占肝脏切除手术后死亡总例数18%~75%[13]。在我国,肝癌患者大多数合并有肝硬变,本身肝脏储备功能就较差,再加上患者在围手术期前后可能出现的其他不利于肝脏功能恢复的影响因素,导致患者术后较容易出现肝脏功能恢复不良,无法代偿人体所需,乃至肝功能衰竭合并其他并发症进而危及生命。有关文献[14]报道,肝癌患者手术后出现肝功能衰竭的可能性在0.7%~9.1%,手术后剩余肝脏质地的好坏和RLV的大小,共同决定了术后肝脏功能代偿的能力。因此肝脏储备功能的术前准确评估对于拟行手术的肝癌患者来说是至关重要的,而肝硬化患者实际肝功能储备情况却很难通过手术前常规的体现肝功能的生化指标反应出来。
ICG清除试验主要是通过肝脏功能细胞数量和肝脏血流量来评估肝脏的储备功能[15]。由于ICG在肝外组织不会被吸收,且没有毒副作用,不参与肝肠循环,所以ICG最大清除率和ICGR15这两个指标在临床上较为常用[16]。目前国际上ICG试验虽然被认为是一种能灵敏而简便的评估肝脏储备功的方法[17-18],但该试验结果在胆汁排泄障碍、肝血流量减少等情况下会受到一定的影响。因此在针对于肝硬化患者来说,如果单纯采用ICG试验这一种方法来评估肝脏储备功能是存在一定局限性的。手术过程中肝脏切除的体积的控制也是预防术后肝脏功能恢复不良的重要方法之一,目前普遍认为正常的人体肝脏可耐受75%~80%肝实质切除[19]。通过将二维的CT资料导入三维重建软件,把肝脏影像学断层图像转变成三维立体模型,然后根据具体临床情况及手术需求计算出每一个感兴趣区段的肝脏物理体积,同时还可以立体树状方式将肝动脉,门静脉,胆管展现在三维立体模型中,对肝内外的血管及胆管分布情况从多角度、多层次进行观察,尽可能的在术中减少不必要的血管胆管损伤,使残余肝脏结果的完整性尽量得到保护[20-21]。另一方面国内外的部分学者[22-23]在80年代中期就对关于动态评估肝脏储备功能中99mTc-EHIDA相关应用方法,及99mTc-EHIDA能稳定准确将肝脏代谢功能情况体现出来的相关研究进行了报道[24],而且国内也有学者[6]报道HH15可作为较敏感指标预测术后肝功能不全的发生,这项检查方法对于预估肝脏切除手术剩余体积的最小安全值比单纯测量术后肝脏残余的物理体积意义更大,但在肝脏中99mTc-EHIDA排泄速度较快,存留时间较短,并且胆红素是99mTc-EHIDA的竞争性抑制剂,所以测量结果可能会受到一定的影响。目前,医学界正在开展各种研究来寻找并试验更为可靠的试剂(如99mTc-GSA)来进一步完善通过SPECT评估肝脏功能储备的研究[25]。
影响肝癌术后恢复情况的因素较为复杂且多样,国外学者[26]有报道肝硬度测量(LSM)可用于预测肝切除后肝功能衰竭和安全余肝体积的估计,术前营养状况包括前白蛋白对术后肝功能不全的发生也有着一定得影响[27],也本次研究仅选取了临床上较为广泛应用及操作相对简单的几种较为特殊的检测方法,并依据测量结果进行预测模型的研究,临床上左半肝切除相对右半肝切除风险较小,且术后恢复较好,此次研究中两者术后恢复情况差异无统计学意义,可能与病例数较少有关。目前通过SPECT方法来评估肝脏功能储备尚未完善,本研究采用的99mTc-EHIDA试剂通过HH15来定量评估肝脏储备功能较为简单,便于操作,但仍需大量的实验进一步提高此方法的敏感度及特异度,寻找更为有效且受其他因素影响更小的试剂。研究中可能由于病例收集较少,导致结果有所偏倚,之后将纳入更大的样本及长期随访的患者资料进行前瞻性探索和研究来对此模型进行相关的检验和修正。
通过本研究,可以发现在众多影响因素中,HH15、RLV/SLV及ICG Rl5在两组之间有统计学差异,且涵盖了功能和体积两个方面,反应了肝癌患者术前的肝脏功能储备。因此,本研究建立风险预测模型:R=31.871×(RLV/SLV)-1.689×(ICGR15)-19.663×HH15,根据ROC曲线得出R值临界点为0.90。将患者按照是否R>0.90分为两组,比较结果显示,R≤0.90的患者术后更容易出现发生肝脏功能恢复不良的现象。
概而论之,本风险预测模型在预测肝脏切除手术风险中有一定的价值,拥有相对较低的RLV/SLV,以及相对较高的ICG Rl5和HH15的患者在行肝脏切除术后出现肝功能不全的可能性会更大。在行半肝及更大范围的肝脏切除手术前进行ICGR15、RLV/SLV及HH15的检测能在一定程度上可以预测术后肝脏功能的恢复情况。
[1] 樊嘉,王征.原发性肝癌的手术切除[J].中华外科杂志, 2010,48(3):167–168. doi:10.3760/cma.j.issn.0529–5815.2010.03.003.Fan J, Wang Z. Hepatectomy for hepatocellular carcinoma[J].Chinese Journal of Surgery, 2010, 48(3):167–168. doi:10.3760/cma.j.issn.0529–5815.2010.03.003.
[2] Lin TY, Lee CS, Chen CC, et al. Regeneration of human liver after hepatic lobectomy studied by repeated liver scanning and repeated needle biopsy[J]. Ann Surg, 1979, 190(1):48–53.
[3] 徐峰, 杨甲梅, 严以群, 等. 肝癌肝切除术后并发症的处理(附592例报告)[J]. 中华肝胆外科杂志, 2002, 8(7):435–436.Xu F, Yang JM, Yan YQ, et al. Treatment of complications after hepatectomy for hepatocellular carcinoma (report of 592 cases) [J].Chinese Journal of Hepatobiliary Surgery, 2002, 8(7):435–436.
[4] 曹堃, 马金良, 许戈良, 等. 非接触分离技术在原发性肝细胞癌手术治疗中的应用[J]. 中国普通外科杂志, 2016, 25(1):25–31.doi:10.3978/j.issn.1005–6947.2016.01.005.Cao K, Ma JL, Xu GL, et al. Application of "no-touch" isolation technique in surgical treatment of hepatocellular carcinoma[J].Chinese Journal of General Surgery, 2016, 25(1):25–31.doi:10.3978/j.issn.1005–6947.2016.01.005.
[5] 董家鸿. 精准肝脏外科[J]. 中华消化外科杂志, 2014, 13(6):405–411. doi:10.3760/cma.j.issn.1673–9752.2014.06.002.Dong JH. Precision liver surgery[J]. Chinese Journal of Digestive Surgery, 2014, 13(6):405–411. doi:10.3760/cma.j.issn.1673–9752.2014.06.002.
[6] 孙永刚, 李建生, 荚卫东, 等. SPECT判断切肝量及其与肝癌术后肝功能不全的关系[J]. 实用肝脏病杂志, 2011, 14(2):135–137.doi:10.3969/j.issn.1672–5069.2011.02.019.Sun YG, Li JS, Jia WD, et al. Estimation of hepatic resection volume by SPECT in patients with primary liver cacer [J]. Journal of Clinical Hepatology, 2011, 14(2):135–137. doi:10.3969/j.issn.1672–5069.2011.02.019.
[7] Akita H, Sasaki Y, Yamada T, et al. Real-time intraoperative assessment of residual liver funtional reserve using pulsedye densitometry[J]. World J Surg, 2008, 32(12):2668–2674. doi:10.1007/s00268–008–9752–0.
[8] Okochi O, Kaneko T, Sugimoto H, et al. ICG pulse spectrophotometry for perioperative liver function in hepatectomy[J]. J Surg Res, 2002, 103(1):109–113.
[9] Balzan S, Belghiti J, Farges O, et al. The "50–50 criteria" on postoperative day 5: an accurate predictor of liver failure and death after hepatectomy[J]. Ann Surg, 2005, 242(6):824–828.
[10] Mullen T, Ribero D, Reddy SK, et al. Hepatic insufficiency and mortrality in 1,059 noncirrhotic patients undergoing major hepatectomy[J]. J Am Coll Surg, 2007, 204(5):854–862.
[11] Sakka SG, Meier-Hellmann A. Non-invasive liver function monitoring by indocyanine green plasma disappearance rate in critically ill patients[J]. Int J Intensive Care, 2002, 9(2):66–72.
[12] 朱云峰, 李建生, 马金良, 等. 三维重建技术在肝门部胆管癌术前评估中的价值[J]. 中国普通外科杂志, 2016, 25(2):175–180.doi:10.3978/j.issn.1005–6947.2016.02.003.Zhu YF, Li JS, Ma JL, et al. Value of three-dimensional reconstruction in preoperative assessment of hilar cholangiocarcinoma[J]. Chinese Journal of General Surgery, 2016,25(2):175–180. doi:10.3978/j.issn.1005–6947.2016.02.003.
[13] Garcea G, Maddern GJ. Liver failure after major hepatic resection[J]. J Hepatobiliary Pancreat Surg, 2009, 16(2):145–155.doi: 10.1007/s00534–008–0017–y.
[14] van den Broek MA, Olde Damink SW, Dejong CH, et a1. Liver failure after partial hepmic resection: definition, pathophysiology,risk factors and treatment[J]. Liver Int, 2008, 28(6):767–780. doi:10.1111/j.1478–3231.2008.01777.x.
[15] Morris-Stiff G, Gomez D, Prasad R. Quantitative assessment of hepatic function and its relevance to the liver surgeon[J]. J Gastrointest Surg, 2009, 13(2):374–385. doi: 10.1007/s11605–008–0564–1.
[16] 苏昭然, 荚卫东, 许戈良, 等. 肝切除术中吲哚青绿排泄试验预测术后肝功能不全的临床研究[J]. 中华普通外科杂志, 2011,26(7):618–620. doi:10.3760/cma.j.issn.1007–631X.2011.07.032.Su ZR, Jia WD, Xu GL, et al. Clinical study of indocyanine green excretion test for predicting postoperative hepatic insufficiency after liver resection[J]. Zhong Hua Pu Tong Wai Ke Za Zhi, 2011,26(7):618–620. doi:10.3760/cma.j.issn.1007–631X.2011.07.032.
[17] 姜涛, 张水军, 李捷, 等. ICGR15评估A级肝功能肝癌患者手术风险研究[J]. 中华实验外科杂志, 2011, 28(4):637. doi:10.3760/cma.j.issn.1001–9030.2011.04.055.Jiang T, Zhang SJ, Li J, et al. Risk of hepatocellular carcinoma in patients undergoing liver function ICGR15 A level assessment[J]. Chinese Journal of Experimental Surgery, 2011, 28(4):637.doi:10.3760/cma.j.issn.1001–9030.2011.04.055.
[18] Gupta S, Chawla Y, Kaur J, et al. Indocyanine green clearance test(using spectrophotometry) and its correlation with model for end stage liver disease (MELD) score in Indian patients with cirrhosis of liver[J]. Trop Gastroenterol, 2012, 33(2):129–134.
[19] Clavien PA, Petrewsky H, Deoliveim ML, et al. Strategies for safer liver surgery and partial liver transplantation[J]. N Engl J Med,2007, 356(15):1545–1559.
[20] Endo I, Matsuyama R, Mori R, et al. Imaging and surgical planning for perihilar cholangiocarcinoma[J]. J Hepatobiliary Pancreat Sci,2014, 21(8):525–532. doi: 10.1002/jhbp.75.
[21] 陈晓亮, 王川红, 宋志, 等. 肝血管成像三维重建联合区域血流阻断美蓝持久染色在精准肝切除手术中的应用[J].中国普通外科杂志, 2015, 24(7):1001–1006. doi:10.3978/j.issn.1005–6947.2015.07.015.Chen XL, Wang CH, Song Z, et al. Application of hepatic angiography with 3-D reconstruction plus regional blood flow occlusion and persistent methylene blue dyeing in precise hepatectomy[J]. Chinese Journal of General Surgery, 2015,24(7):1001–1006. doi:10.3978/j.issn.1005–6947.2015.07.015.
[22] Buchali K, Sydow K, Schürer M, et al. Kinetics of EHIDA clearance by the liver-requirements for a radiopharmaceutical for determining liver function[J]. Radiobiol Radiother (Berl), 1985,26(4):507–512.
[23] 周前, 蒋朱明, 杨梅芳, 等. 99mTc-EHIDA肝胆显像评价TPN时的肝胆功能[J]. 中华核医学杂志, 1988, 8(4):195–198.Zhou Q, Jiang ZM, Yang MF, et al. 99mTc-EHIDA hepatobiliary imaging for evaluating hepatobiliary function during TPN[J].Chinese Journal of Nuclear Medicine, 1988, 8(4):195–198.
[24] Cheng MH, Pan ZH, Ling YB, et al. Evaluation of hepatic perfusion and function with modified hepatobiliary scintigraphy[J].Comput Med Imaging Graph, 2009, 33(3):182–186. doi: 10.1016/j.compmedimag.2008.11.005.
[25] Yoshida M, Shiraishi S, Sakaguchi F, et al. Fused 99m-TcGSA SPECT/CT imaging for the preoperative evaluation of postoperative liver function: can the liver uptake index predict postoperative hepatic functional reserve?[J]. Jpn J Radiol, 2012, 30(3):255–262.doi: 10.1007/s11604–011–0041–8.
[26] Nishio T, Taura K, Koyama Y, et al. Prediction of posthepatectomy liver failure based on liver stiあness measurement in patients with hepatocellular carcinoma[J]. Surgery, 2016, 159(2):399–408. doi:10.1016/j.surg.2015.06.024.
[27] 朱倩, 李云, 段睿, 等. 血清前白蛋白水平对肝切除术后肝功能不全发生的影响[J]. 中国普通外科杂志, 2016, 25(1):109–114.doi:10.3978/j.issn.1005–6947.2016.01.017.Zhu Q, Li Y, Duan R, et al. The serum albumin level of liver resection liver dysfunction impact occurred[J]. Chinese Journal of General Surgery, 2016, 25(1):109–114. doi:10.3978/j.issn.1005–6947.2016.01.017.
