甜瓜果实相关性状QTL分析
2017-04-01栾非时矫士琦盛云燕朱子成
栾非时,矫士琦,盛云燕,朱子成
(1.农业部东北地区园艺作物生物学与种质创制重点实验室,哈尔滨 150030;2.东北农业大学大学园艺园林学院,哈尔滨 150030;3.黑龙江八一农垦大学园艺学院,黑龙江大庆 163319)
甜瓜果实相关性状QTL分析
栾非时1,2,矫士琦1,2,盛云燕3,朱子成1,2
(1.农业部东北地区园艺作物生物学与种质创制重点实验室,哈尔滨 150030;2.东北农业大学大学园艺园林学院,哈尔滨 150030;3.黑龙江八一农垦大学园艺学院,黑龙江大庆 163319)
以美国厚皮甜瓜品系ms-5为母本,中国薄皮甜瓜品系HM-1为父本,配置杂交组合,构建含有189个单株的F2:3群体,对两亲本高通量重测序开发CAPS标记,构建包含159个标记、12个连锁群的遗传连锁图谱,该图谱覆盖基因组长度为1 771.53 cM,标记间平均距离为11.35 cM。应用复合区间作图法对甜瓜果实单果重、果实长、宽、果形指数、果肉厚度作QTL分析,共检测到与果实性状相关QTL位点18个,分布在第2、4、5、6和7染色体上,LOD值为2.82~18.78,可解释2.68%~79.40%表型变异率。检测到7个与果形指数相关QTL位点,分别为FS2.1、FS4.1、FS6.1、FS6.2、FS7.1、FS7.2、FS7.3,果形指数QTL位点FS6.1位于B0610和E0623两个标记之间,两标记间遗传距离为0.27 cM,LOD值为6.14,解释5.72%表型变异率,通过基因序列比对QTL FS6.1位于甜瓜基因组scaffold00027上,基因注释结果发现,该区域有26个候选基因。
甜瓜;果实性状;CAPS;遗传连锁图谱;QTL
甜瓜(Cucumismelo L.,2n=2x=24)是重要园艺作物之一,20世纪90年代至今,我国甜瓜产量增加29%,种植面积增加8%[1]。现代市场要求甜瓜果实性状多元化,尤其果实性状影响消费者选择取向,其中甜瓜单果重、长、宽、果形指数等性状直接影响甜瓜果实性状。国内外学者在栽培措施[2-3]、生理变化[4]、遗传规律[5]等方面对甜瓜果实相关性状展开大量研究。结果表明,甜瓜果形易受环境影响,但甜瓜单果重、长、宽、果形指数及果皮厚度等性状主要受遗传因素影响[6-7]。甜瓜果实相关性状均为数量性状,受多个主效和微效基因控制,Diaz等利用长果形PI124112和椭圆形‘Pielde Sapo’为亲本构建F2群体,遗传图谱长度为1 437cM,标记间平均遗传距离为13.8cM,定位11个与果实有关的QTL位点,平均贡献率13.91%[8]。Wang等利用甜瓜“TARI-08874”和“Bai-li-gua”为亲本构建遗传连锁图谱,遗传图谱长度为626.1 cM,侧翼标记之间平均距离为8.3 cM,定位19个与果实有关的QTL位点,平均贡献率18.21%[9]。遗传图谱为研究遗传规律工具,研究者基于不同甜瓜基因型和不同类型分子标记构建多张遗传连锁图谱和整合遗传图谱[10-13],成功定位尺寸包括果实形状和尺寸,果皮颜色,果实质量和果实产量等多个QTL位点。但多为RFLP、SSR、AFLP等分子标记,多态性较低,许多重要性状定位遗传距离较远[14]。甜瓜果形相关性状研究目前尚不深入,遗传机理仍未明确。随着高通量测序技术快速发展,基于全基因组重测序开发的CAPS分子标记可提高基因定位精度,结合分子辅助选择育种技术有效改善传统田间表型选择育种,加快作物育种进程[15]。
本研究利用具有显著农艺性状差异的美国厚皮甜瓜品系ms-5和中国薄皮甜瓜品系HM-1为亲本构建F2:3群体,采用基于高通量测序开发的全基因组多态性CAPS分子标记构建甜瓜遗传连锁图谱,结合田间表型数据对甜瓜果实长、宽、果形指数等相关性状作QTL分析,探究甜瓜果实性状、遗传规律,以期为进一步开展甜瓜果实形状、果皮厚度等重要性状相关基因精细定位、基因克隆及分子标记辅助育种奠定基础。
1 材料与方法
1.1 材料
以美国农业部甜瓜病理研究员McCreight提供厚皮甜瓜品系ms-5为母本,以东北农业大学园艺园林学院西甜瓜分子遗传育种研究室提供中国薄皮甜瓜HM-1为父本材料,配制杂交组合,获得F1代,自交得到189个单株组成的F2群体,获得189个F2:3家系。
1.2 群体构建及田间试验设计
田间试验于2015年3月至2016年9月在东北农业大学向阳实验实习基地展开。2015年3~9月,播种父母本、F1代各30株,每个小区种植10株,3次重复。随机种植F2代群体200株,自交授粉,获得F3代种子。2016年3~9月,播种189个F2:3家系,每个家系5株,田间种植株距35 cm,行距75 cm,双蔓整枝,第13~15节子蔓留单果,采收果实和种子,用以田间表型数据调查及遗传分析。
1.3 果实性状及果皮厚度调查方法
对P1、P2、F1及F2:3代分离群体作农艺性状调查,参照《甜瓜种质资源描述规范和数据标准》[16],调查F2:3家系果实相关性状。
果实性状调查:天平测量单果重,精确到0.01 g。直尺测量果实长(果实纵径最长处)、宽(果实横径最长处)、果肉厚度(上、中、下部厚度平均数),精确到0.1mm,果形指数(果实长度与果实宽度比值)。每个果实单个性状重复测定3次,取平均值。
1.4 群体单株基因组提取及CAPS分子标记开发
1.4.1 群体单株基因组提取
试验材料定植2周后,田间采集亲本及F1、F2代单株2~3片幼嫩真叶,记录后保存在冰盒中,实验室-80℃保存。采用改良CTAB法从2 g样品中提取甜瓜基因组DNA,具体方法参考文献[17]。
1.4.2 CAPS分子标记开发
将双亲检测合格的总DNA送至百迈克生物科技有限公司(北京)作高通量基因组重测序,以两亲本材料基因组重测序质量合格数据为依据,使用GATK软件工具包在全基因组范围内检测两亲本间SNP位点,再利用东北农业大学园艺园林学院西甜瓜研究室自编Perl语言脚本提取SNP位点前后约500 bp碱基序列,SNP2CAPS软件以7种不同限制性内切酶(Eco R I,HindⅢ,Pst I,Bam HⅠ,XbaⅠ,XhoⅠ及Hin fⅠ)对序列作酶切位点分析,在酶切位点上下游100~500 bp设计引物,将相应SNP位点转化为CAPS分子标记。并用下列PCR扩增和酶切体系分析标记多态性筛选和F2群体单株基因型。PCR扩增体系,2μL模板DNA,2μL引物(上下游各1μL),0.1μL Taq酶,0.15μL dNTPs,1μL Taq Buffer,6.75μL超纯水。扩增程序采用降落PCR扩增:94℃预变性7min,94℃变性1min,60℃退火30 s,72℃延伸90 s,30个循环,每个循环降0.5℃,94℃变性1min,45℃退火30 s,72℃延伸90 s,72℃终止延伸7min。酶切体系为:1μL限制性内切酶缓冲液,0.5μL限制性内切酶(10 U·μL-1,THERMO),9μL超纯水,PCR扩增产物5μL,37℃水浴2 h[18]。酶切产物用1%琼脂糖凝胶电泳检测。
1.5 遗传图谱构建和QTL分析
利用IciMapping V3.3对具有多态性且应用到F2代基因分型的CAPS分子标记构建遗传图谱,采用复合区间作图法构建遗传连锁图谱。Microsoft Excel 2003与SPSS软件作数据记录、整理及分析。Win QTLCart软件对F2:3群体作QTL分析,以1.0 cM步行速度在全基因组内扫描。以性状英文缩写、连锁群编号和QTL编号为依据命名QTL位点。
2 结果与分析
2.1 群体田间性状分析
各性状在双亲间存在不同程度差异,母本单果重、果实长度、果实宽度和果肉厚度均大于父本,仅果形指数小于父本,如表1所示F1群体果实宽度、果形指数、果肉厚度均介于双亲之间,单果重及果实长度存在超亲分离现象。在F2:3分离群体中,189个家系各性状数值介于双亲之间,存在超亲分离现象,群体均表现广泛变异且变异幅度较大,各性状均基本符合正态分布(见图1),可初步判定各性状受主效与多个微效基因共同调控。相关性分析结果显示(见表2)甜瓜果实宽度与单果重、果肉厚度呈极显著正相关,与果形指数呈极显著负相关。果肉厚度与单果重、果实长度、果实宽度呈极显著正相关,与果形指数呈极显著负相关。
2.2 亲本重测序与CAPS标记开发
对“HM-1”和“ms-5”作全基因组重测序后,获得高质量读段(Clean reads)数目分别为40 448 037和43 837 370个,Q30均大于85%,其中比对到甜瓜参考基因组的reads百分比分别为86.8%与87.9%,分别覆盖参考基因组96.3%和97.3%,平均覆盖深度为20×和21×。经SNP位点挖掘与分析,结果表明1到12号染色体共检测出2 065 652个SNP位点。

表1 甜瓜果实相关性状双亲值及在F2∶3群体中分布Table1 Parentsvaluesof traits related to fruitofmelon and distribution in F2:3population

表2 甜瓜果实性状相关性分析Table2 Correlation analysisof Fruit traits inmelon

图1 F2∶3群体果实相关性状频次直方图Fig.1 Histogram for the fruit traitsof F2∶3popu lation
在甜瓜12号染色体上共开发4 934个CAPS标记位点,选取均匀分布在全基因组上的CAPS引物,并用“ms-5”“HM-1”和F1筛选CAPS引物多态性,获得159对多态引物,引物命名原则为限制内切酶英文缩写+酶切位点所在染色体号+引物编号。
2.3 甜瓜遗传图谱构建
运用QTL IciMappingV3.3软件对159个多态性标记作连锁分析。如图2所示,构建包含159个CAPS标记、12个连锁群(分别对应于甜瓜12条染色体)的甜瓜遗传连锁图谱,覆盖基因组长度为1 771.53 cM,标记间平均遗传距离11.35 cM,连锁群长度72.60 cM(chr.4)~246.89 cM(chr.2)。
2.4 果实相关QTL位点分析
检测出与单果重相关QTL位点4个(见表3)(AFW2.1、AFW6.1、AFW6.2、AFW8.1),AFW2.1和AFW8.1分别位于第2、8号染色体,可解释表型变异均大于70%,为主效QTL位点。AFW6.1、AFW6.2分布于第6号染色体上,AFW6.1位于B0610和E0623两个标记之间,与两侧翼标记遗传距离分别为0.03和2.19 cM,可解释表型变异为13.28%。AFW6.2位于E0615和HD0616两个标记之间,与两侧翼标记遗传距离分别为2.03和1.6 cM,可解释表型变异为9.18%。

图2 遗传连锁图谱构建与甜瓜果实相关性状QTL分析Fig.2 QTL analysis formelon fruit traitson genetic linkagem ap
共检测出与果实长度相关QTL位点1个(FL2.1),位于第2号染色体,加性效应为0.7684,表现为负向加性效应。该位点位于E0214和XB0202两个标记之间,可解释表型变异为15.69%,为主效QTL位点(见表3)。
与果实宽度相关QTL位点3个(FW6.1、FW6.2、FW7.1),其中FW6.1、FW6.2分布于第6号染色体上,FW6.1位于B0610和E0623两个标记之间,与两侧翼标记的遗传距离分别为1.03 cM和1.19 cM,可解释表型变异为9.05%。FW6.2位于B0613和E0615两个标记之间,与两侧翼标记的遗传距离分别为2.03和2.57 cM,可解释表型变异为8.48%,此位点位置与单果重QTL位点AFW6.2位置一致。由表1可知,果实宽度和单果重相关性极显著,可能存在一因多效现象。FW7.1位于第7条染色体,贡献率为5.16%,属于微效QTL位点。三个位点均起负向加性效应。
与果肉厚度相关QTL位点3个(FT2.1、FT2.2、FT7.1),FT2.1贡献率为71.68%,为主效QTL位点,但与两翼距离较远。FT2.2与FT7.1贡献率均小于15%,为微效QTL位点。FT2.1与FT2.2为负向加性效应,FT7.1为正向加性效应。
2.5 果形指数QTL精细定位
本研究检测出与果形指数相关QTL位点7个(FS2.1、FS4.1、FS6.1、FS6.2、FS7.1、FS7.2、FS7.3)(见表3),其中FS7.1、FS7.2、FS7.3均在7号染色体上,依次位于标记HD0714和P0711、HD0710和H0712、B0706和P0705之间,遗传距离分别为1.89、3.41、6.42 cM。贡献率为24.92%、26.69%、28.72%,以上三个位点均为正向加性效应。FS2.1、FS4.1、FS6.1、FS6.2贡献率均低于10%,属于微效QTL位点,FS2.1、FS4.1为负向加性效应。

表3 甜瓜果实相关性状QTL及其效应分析Table3 QTL lociand theeffectsof the fruit traits inmelon

图3 果形指数预测候选基因在甜瓜6号染色体上分布Fig.3 Distribution of predicted candidategenes for fruit shapeonmelon chromosome6
研究结果表明甜瓜果形指数QTL FS6.1位于标记E0623和E0611之间,二者之间遗传距离为0.27 cM,物理距离为1.25 Mb(chr6:18286683-17038163),结合甜瓜参考基因组注释信息,发现在该区域中共有26个预测候选基因(见表4),在染色体上分布见图3。
这些注释基因功能主要有:转运蛋白、MYB转录因子、碳水化合物代谢过程激酶、参与细胞和生物形成过程、催化线粒体内膜活性蛋白激酶等。
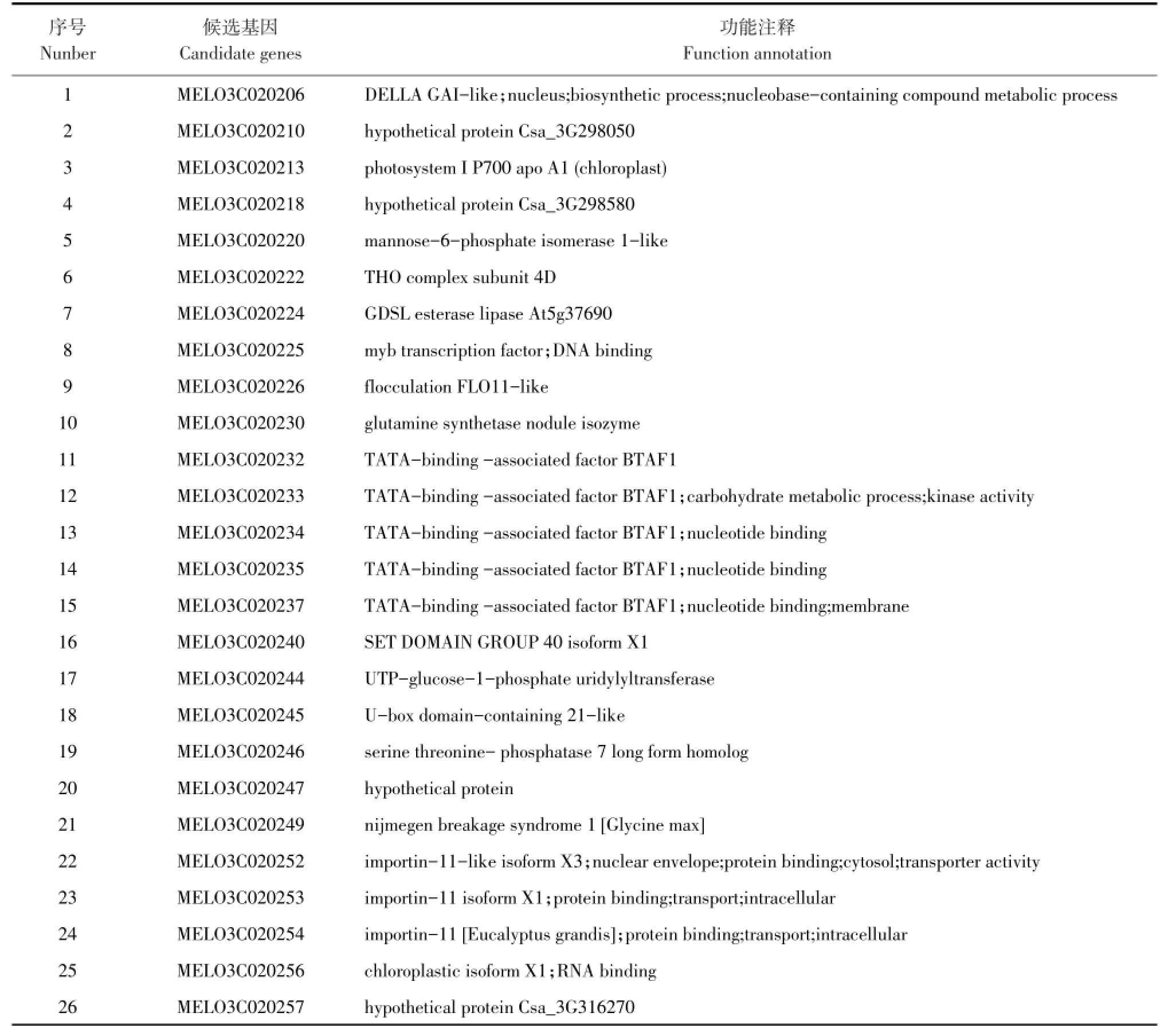
表4 果形指数候选基因的功能注释Table4 Functionalannotation of candidategenes for fruit shape index
3 讨论与结论
3.1 基于重测序分子标记开发
本研究利用生物信息学软件分析亲本重测序数据,共发掘亲本间多态性SNP位点352 483个,利用7种限制性内切酶分析,找到可转化为CAPS标记的位点220 355个。共筛选159对多态性引物,利用薄皮甜瓜和厚皮甜瓜杂交获得F2:3群体,构建包含159个CAPS标记的遗传图谱,部分染色体上标记出现单交换现象,标记E0302与XH0301在遗传图谱第3号染色体上位置交换,说明在亲本中存在频繁交换区段。第10号染色体覆盖率低,图谱上相邻标记间物理距离较远,原因可能是标记空缺区段或测序结果染色体部分缺失,尚需进一步增加筛选密度,通过新标记或其他标记方法完善构建图谱。
3.2 果实相关性状分析及QTL定位
试验共检测到18个果实相关性状QTL,解释表型变异从2.68%(果形指数QTL FS6.6)到79.4%(果肉厚度QTL AFW2.1)。其中果实性状在染色体上分布不均,较多聚集在第6、7号染色体上。研究表明甜瓜单果重、长、宽、果形指数、果肉厚度受多基因控制,为数量性状。Ramamurthy等利用蛇瓜和厚皮甜瓜构建含有200个单株F2群体,在第8号染色体上检测到2个和单果重有关位点,贡献率分别为20.6%和12.8%[19],盛云燕等采用植物数量性状主基因-多基因混合模型对甜瓜果实果肉厚度等作遗传分析表明,单果重受2对加性-显性多基因模型控制;果肉厚度受1对主基因控制[20]。本试验共发现4个与单果重有关位点(AFW2.1、AFW6.1、AFW6.2、AFW8.1),分别位于第2、6、6、8号染色体上,贡献率分别为79.4%、5.12%、5.16%和78.24%,说明单果重受两个主效基因多个微效基因控制,其中AFW6.1、AFW6.2、AFW8.1所在染色体及位置与Diaz和Ramamurthy等研究结果一致[8,19]。本研究共定位与果肉厚度相关位点QTL位点3个,分别位于2、2、7号染色体上,贡献率分别为71.68%、11.26%、4.8%,表明果肉厚度由一个主效基因多个微效基因控制。与盛云燕等果肉厚度受一对主效基因控制的研究结果一致[20],表明果肉厚度由一对主效基因控制,受环境影响不大。Wang等用不同基因型亲本构建两个F2群体遗传连锁图谱,检测到2个与果实宽度有关位点,分别定位到第5、11号染色体,可解释遗传变异均小于15%,属于微效QTL位点,检测到4个果实长度有关位点,分别定位到第2、7、7、8号染色体,可解释遗传变异均小于15%,属于微效QTL位点[9]。栾非时等利用甜瓜F2群体检测与果实宽度相关位点2个,位于第5、6号染色体上,定位与果形指数相关QTL位点7个,分别位于连锁群LG1、LG2、LG4、LG7、LG9和LG10[21]。其中贡献率为17.9684%主效QTL位于连锁群LG7上。果形指数是果实长度与果实宽度比值,为复合性状。在本研究中果实长度QTL位点FL2.1与果形指数FS2.1位置相似,果实宽度QTL位点FW6.1、FW6.2、FW7.1与果形指数QTL位点FS6.1、FS7.1、 FS7.2、FS7.3在染色体上位置相似,FW6.2与FS6.2两个位点同时定位在标记E0615和HD0616之间,相关性分析结果表明甜瓜果实长宽与果形指数间极显著相关(P<0.01),果形指数位点与果实长、宽位点位置相近。本研究中两亲本果实长度差别较小,果实宽度差别较大,表明影响果肉宽度基因为果形指数主要贡献者。第6、7号染色体上QTL位点成簇出现,且该区间内可能存在一因多效现象。
3.3 果形指数精细定位
本研究果形指数有关位点FS6.1位于标记E0611与E0623之间,两标记遗传距离0.27cM,与已公布甜瓜基因组信息比对,且两标记均位于scaffold00027上,共发现26对候选基因,5个基因与蛋白合成有关,3个与碳水化合物有关,2个与细胞合成过程有关,8个与催化核苷酸和线粒体活性有关,1个是MYB转录因子,7个基因未见报导。本研究定位区域较大,候选基因较多,尚无法确定与果形指数相关基因。甜瓜果形指数一直是育种工作者关注重点,在基因定位领域研究较多,但相关精细定位基因及遗传机理尚不明确,可能存在其他基因控制或互作影响。
[1]王志丹.中国甜瓜产业经济发展研究[D].北京:中国农业科学院,2014.
[2]Verzera A,Dima G,TripodiG,etal.Aroma and sensory quality of honeydewmelon fruits(Cucumismelo,L.subsp.melo,var.inodorus H.Jacq.)in relation to different rootstocks[J].Scientia Horticulturae,2014,169(11):118-124.
[3]Dantas D D C,Medeiros JF D,Freire A G.Yield and quality of the melon fruit grown with plastic films in response to irrigation depth[J].Revista Ciencia Agronomica,2011,42(3):652-661.
[4]李静援,焦自高,于贤昌,等.日光温室厚皮甜瓜果实发育中后期植株生理特性[J].中国蔬菜,2006(10):13-16.
[5]于翠香,韩忠才,王占海,等.甜瓜果实性状遗传规律的研究进展[J].东北农业科学,2016(3):91-94.
[6]乔军,刘富中,陈钰辉,等.园艺作物果形遗传研究进展[J].园艺学报,2011,38(7):1385-1396.
[7]张宁.甜瓜远缘群体果实主要性状遗传分析及遗传图谱构建[D].杨凌:西北农林科技大学.2014.
[8]Diaz A,Fergany M,Formisano G,etal.A consensus linkagemap for molecular markers and quantitative trait lociassociated with economically important traits inmelon(Cucumismelo L.)[J].BMC PlantBiol,2011,11(1):121-136.
[9]Wang Y H,Wu D H,Huang JH,etal.Mapping quantitative trait loci for fruit traits and powderymildew resistance inmelon(Cucumismelo)[J].Botanical Studies,2016,57(1):19.
[10]BaudraccoarnasS,PitratM.A geneticmap ofmelon(Cucumismelo L.)with RFLP,RAPD,isozyme,disease resistance and morphologicalmarkers[J].Theoretical and Applied Genetics,1996,93 (1):57-64.
[11]Périn C,Hagen S,De C V,etal.A referencemap of Cucumismelo based on two recombinant inbred line populations[J].Theoretical and Applied Genetics,2002,104(6):1017-1034.
[12]Cuevas H E,Staub JE,Simon PW,et al.A consensus linkage map identifies genomic regions controlling fruitmaturity and beta-carotene associated flesh color inmelon(Cucumismelo L.)[J]. Theor ApplGenet,2009,119(4):741-756.
[13]Fukino N,Ohara T,Sugiyama M,et al.Mapping of a gene that confers short lateral branching(slb)in melon(Cucumismelo L.)[J]. Euphytica,2012,187:133-143.
[14]王贤磊,高兴旺,李冠,等.甜瓜遗传图谱的构建及果实与种子QTL分析[J].遗传,2011,33(12):1398-1408.
[15]Yan T,Nimmakayala P,LeviA,etal.Map-basedmolecular diversity,linkage disequilibrium and associationmapping of fruit traits inmelon[J].Molecular Breeding,2013,31(4):829-841.
[16]马双武,刘君璞.甜瓜种质资源描述规范和数据标准[M].北京:中国农业出版社.2006.
[17]Luan F,Delannay I,Staub JE.Chinesemelon(Cucumismelo,L.) diversity analyses provide strategies for germplasm curation,genetic improvement,and evidentiary supportof domestication patterns[J].Euphytica,2008,164(2):445-461.
[18]束永俊,李勇,吴娜拉胡,等.大豆EST-SNP的挖掘、鉴定及其CAPS标记的开发[J].作物学报,2010,36(4):574-579.
[19]Ramamurthy R K,Waters B M.Identification of fruit quality and morphology QTLs inmelon(Cucumismelo)using a population derived from flexuosus,and cantalupensis,botanical groups[J].Euphytica,2015,204(1):163-177.
[20]盛云燕,陈克农,矫士琦,等,甜瓜F2代群体果实性状的遗传分析[J].北方园艺,2016(7):9-12.
[21]栾非时,卢丙洋,周慧文,等.甜瓜遗传连锁图谱构建及果实相关性状QTL定位[J].东北农业大学学报,2016,47(8):9-20.
Mapping of QTL for fruit traits in melon
LUANFeishi1,2,JIAOShiqi1,2,SHENG Yunyan3,ZHU Zicheng1,2
(1. Ministry of Agriculture Key Laboratory of Biology and GermplasmEnhancement of Horticultural Crops in Northeast China, Harbin 150030, China; 2. School ofHorticulture and Landscape Architecture, Northeast Agricultural University, Harbin 150030, China; 3.School of Horticulture, Heilongjiang Bayi Agricultrual University, Daqing Heilongjiang, 163319, China)
F2:3 population consisted of 189 individuals was constructed by the crossing of two parental materials, the American melon line ms-5 and the Chinese melon line HM-1. The parental materials were resequenced for CAPS markers development. A genetic linkage map consisting of 159 CAPS markers and 12linkage groups covering the genome length of 1 771.53 cM with the average distance between two markers was 11.35 cM. The QTLs of fruit weight, fruit length, width, fruit shape index and fruit thickness were analyzed by composite interval mapping method, and totally 18 QTLs associated with the above fruit traits were detected which distributed among 7 chromosomes. The LOD values ranged from 2.82 to 18.78, which could explain the phenotypic variability of 2.68%- 79.40%. Seven QTLs were detected for FS2.1, FS4.1,FS6.1, FS6.2, FS7.1, FS7.2 and FS7.3, and the fruit shape index QTL (FS 6.1) was located between CAPSmarker B0610 And E0623, the genetic distance between the two markers was 0.27 cM with the LOD valueof 6.14, which explained 5.72% of the phenotypic variation. By gene alignment, QTL FS6.1 was located in the Scaffold00027 of the melon genome and 26 candidate genes were detected in this region.
melon; fruit traits; CAPS; genetic linkage map; QTL
S652
A
1005-9369(2017)03-0001-09
时间2017-3-21 14:03:00[URL]http://kns.cnki.net/kcms/detail/23.1391.S.20170321.1403.008.htm l
栾非时,矫士琦,盛云燕,等.甜瓜果实相关性状QTL分析[J].东北农业大学学报,2017,48(3):1-9.
Luan Feishi, Jiao Shiqi, Sheng Yunyan, et al. Mapping of QTL for fruit traits in melon[J]. Journal of Northeast AgriculturalUniversity, 2017, 48(3): 1-9. (in Chinese with English abstract)
2016-02-20
国家西甜瓜产业技术体系-分子育种岗位专家项目(CARS-26-02),国家自然科学基金青年项目(31401892)
栾非时(1964-),女,教授,博士,研究方向为西瓜甜瓜遗传育种。E-mail:luanfeishi@sina.com
