原发灶肿瘤体积对局部进展期直肠癌新辅助放化疗后病理完全反应的预测价值
2017-03-31李玉强裴谦裴海平
李玉强,裴谦,裴海平
(中南大学湘雅医院 胃肠外科,湖南 长沙 410008)
结直肠癌(colorectal cancer,CRC)是世界第三大恶性肿瘤[1],其中直肠癌约占30%[2-3]。过去几十年中直肠癌的疗效不断提高[4]。目前,新辅助放化疗(nCRT)后行全直肠系膜切除术(total mesorectal excision,TME)已经成为局部进展期直肠癌(locally advanced rectal cancer,LARC)的标准治疗方案[5-6]。患者对新辅助放化疗的敏感程度存在个体化差异,约20%可达到病理完全缓解(pCR,ypT0N0M0),而有30%的患者无反应甚至出现疾病进展[7]。达到pCR后可有效控制原发灶、降低复发转移率、延长无病生存期及总生存期[8-9]。因此,Angelita Habr-Gama提出“观察等待”策略,针对达到临床完全缓解(clinical complete response,cCR)的患者予以观察而非手术治疗[10],目前cCR是临床上pCR的替代指标[4]。研究[11-12]表明肿瘤大小可作为一个强有力的临床预测因素,目前衡量肿瘤大小多采用一维测量瘤体直径,其能否反映瘤体三维结构及实际大小存在争议。因而有研究[13-14]提出原发灶大体肿瘤体积(GTV)更为可靠。原发灶GTV与放疗敏感性明显相关,其相关机制可能与肿瘤干细胞数量有关[15-16]。本研究旨在比较三维GTV与一维最大肿瘤直径预测pCR的有效性,寻找更精确的临床预测pCR的因素。同时分析GTV与直肠癌干细胞相关性,进而对GTV与放疗敏感性相关机制进行探讨。CD133作为结直肠癌干细胞的经典分子标记物[15-16],可用于评估直肠癌干细胞表达情况。
1 资料与方法
1.1 病例资料
回顾性分析中南大学湘雅医院胃肠外科于2009年3月—2015年12月收治的行nCRT后予以根治性切除的LRAC患者共107例。采用直肠指检。胸部X片。腹盆和/或胸部平扫增强CT、盆腔MRI、SPECT和/或内镜超声(ERUS)评估证实临床分期为T3~4或N+(cII~III),并确定无远处转移。排除标准包括:同时性多发肿瘤,仅短程放射治疗,盆腔放疗史。本研究经本院伦理委员会批准。
1.2 GTV测量标准
根据nCRT前2周内完成的CT扫描进行肿瘤靶区的勾画,通过在CT每一扫描层面上的各方向轴进行绘制并计算出靶区体积。我院的CT扫描厚度存在时间差异,2013年12月前为5 mm,之后为3 mm。临床III期直肠癌GTV包括肿瘤原发灶GTV以及区域淋巴结GTV。所有GTV均经2名肿瘤科医生及1名放射科医生共同审查确定。通过Varian Treatment Planning System计算原发灶GTV的三维数据(Eclipse®External Beam Planning System,Version 11.03.1,PRO 11.03.1,AAA 11.03.1 Varian Medical Systems)。通过Varian system计算肿瘤最大径及肿瘤沿肠管纵轴最大长度。
1.3 治疗方案
放疗方案:整个盆腔野进行46~50 Gy的剂量照射,以23~25个分割完成(2 Gy/分割,1周连续5 d),肿瘤原发灶再进行6~8 Gy的补加照射,以3~4个分割完成。整个放疗疗程不超过6周。所有患者均在CT模拟下进行三维适形调强放疗(IMRT),采用三野放射方案,即前后野进行6-MV光子束照射,双侧野进行15-MV照射。
化疗方案:口服希罗达(825 mg/m2,2次/d,与放疗同步)或静滴5-FU化疗,每个周期400 mg/(m2·d),5 d,放疗第1周及最后1周各行1个周期。联合化疗方案:CapeOX方案(奥沙利铂和卡培他滨)、mFolfox6方案(奥沙利铂、亚叶酸钙和氟尿嘧啶)。
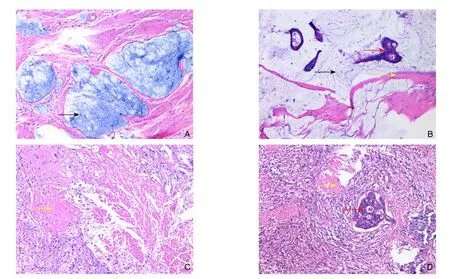
图1 nCRT后肿瘤病理反应(×100) A:原发灶pCR,黏液湖(黑色箭头)中未检测到肿瘤细胞;B:原发灶非pCR,黏液湖(黑色箭头)中见玻璃样变性(黄色箭头)和肿瘤细胞(红色箭头);C:淋巴结pCR,玻璃样变性(黄色箭头处),未检测到肿瘤细胞;d:淋巴结非pCR,玻璃样变性(黄色箭头),可检测到肿瘤细胞(红色箭头)Figure 1 Tumor pathologic response to nCRT (×100) A: Primary tumor pCR, where no detectable tumor cells in the mucous lake(black arrow); B: Primary tumor non-pCR, where hyaline degeneration (yellow arrow) and tumor cells (red arrow) presenting in the mucous lake (black arrow); C: Nodal pCR, which showing hyaline degeneration (yellow arrow) without detectable tumor cells;D: Nodal non-pCR, which showing hyaline degeneration (yellow arrow) and tumor cells (red arrow)
nCRT后至少4周再行直肠癌根治术,术式包括:Dixon、Miles、Hartmann、Dixon+回结肠保护性造口。
1.4 肿瘤放疗反应评价标准
手术切除直肠癌标本经病理科常规处理后切片(4 mm厚),显微镜下评判CRT敏感度。pCR定义为肠壁(T分期)及区域淋巴结(N分期)内均无活性肿瘤细胞残留(ypT0N0),即相当于肿瘤退缩分级(TRG)中的4级(完全退缩):仅见纤维化、玻璃样变或黏液湖,而无活性肿瘤细胞。而所有其他的病理反应情况,包括TRG 0~3级(肿瘤无退缩、少量退缩、中等退缩、接近完全退缩)均定义为非pCR[7](图1)。
1.5 数据收集
收集以下与直肠癌新辅助放化疗疗效可能相关数据:患者性别、年龄、体质量指数、临床TNM分期,肿瘤最大径、肿瘤体积、肿瘤最大长度,肿瘤距肛门距离、组织学类型、新辅助放化疗前后癌胚抗原(CEA)、糖链抗原(CA19-9、CA242)、同步化疗方案、放疗手术间期等。
临床T期分级通过盆腔MRI、CT和/或ERUS进行评估。临床N分期通过盆腔MRI或CT评估,区域淋巴结最短径≥5 mm定义为阳性[17]。肿瘤距肛缘距离主要通过直肠指检及肠镜评估,并选取其中的较小值。本研究中采用肿瘤原发灶GTV代表肿瘤体积。根据第七版AJCC标准进行TNM分期[18]。nCRT前血清肿瘤标记物水平获自患者nCRT前2周内的外周血,nCRT后血清肿瘤标记物水平获自根治手术之前3~10 d内,患者均为空腹抽血。
1.6 免疫组化染色
主要试剂:CD133兔抗人多克隆抗体购自武汉三鹰,二抗购自Dako公司。实验步骤:标本均经10%中性甲醛固定,常规石蜡包埋,徕卡切片机连续切片(厚5 μm),分别进行苏木精-伊红染色和免疫组化染色。免疫组化染色采用Envision二步法,染色过程中设阳性及阴性对照,常规脱蜡、水化、常温阻断、枸橼酸盐抗原热修复,DAB显色,苏木精复染,封片观察。石蜡切片免疫组化结果判读:CD133阳性表达为棕黄色,超过10%的肿瘤细胞阳性表达即判读为CD133阳性。
1.7 统计学处理
使用IBM SPSS 22.0软件统计分析,根据数据的性质,组间比较分析使用Pearson检验、确切概率法、Mann-Whitney U检验或t检验。GTV与CD133表达之间的关系采用χ2检验,原发肿瘤GTV和肿瘤直径之间的关系采用Pearson相关分析。构建Logistic回归模型,对所有单变量分析中P<0.15的独立变量纳入模型进行回归分析。P<0.05为差异有统计学意义。
2 结 果
2.1 LARC患者资料及临床因素与pCR的关系
107例患者的年龄中位数为53(19~78)岁,其中男65例(60.75%),女42例(39.25%)。共25例(23.36%)达到pCR,82例(76.64%)为非pCR。pCR组肿瘤原发灶GTV明显小于非pCR组患者(P=0.024)、nCRT前血清CEA水平明细低于非pCR组(P=0.020),联合化疗比例高于非pCR组(P=0.05),而两组患者间性别、年龄、体质量指数、临床T分期、N分期、肿瘤最大径、肿瘤体积、肿瘤肠管纵轴最大长度、肿瘤距肛门距离、组织学类型、nCRT后血清CEA水平、nCRT前后糖链抗原(CAl9-9、CA242)均无统计学差异(均P>0.05)(表1)。

表1 LARC患者临床因素与pCR关系的单变量分析Table 1 Univariate analysis of relations of clinical factors with pCR in LARC patients
2.2 相关性分析
Pearson相关分析显示,原发灶GTV与肿瘤延肠管纵轴长度(r=0.580,P<0.001)及肿瘤最大径(r=0.608,P<0.001)成正相关(图2),其中与肿瘤最大径相关性更大。但本研究同时显示,原发灶GTV与肿瘤最大径不能完全等同。肿瘤体积相近,肿瘤最大径可有明显差异;肿瘤最大径相近,肿瘤体积有明显差异。

图2 原发灶GTV与肿瘤一维长度的相关性Figure 2 Correlation between primary GTV and unidimensional length of the tumor
2.3 原发灶GTV截点值的选择
原发灶GTV与肿瘤反应作为变量生成的ROC曲线确定最佳原发灶GTV截点值。ROC曲线中采用最大Youden指数(灵敏度与特异度之和减去1)计算截点值[19]。本研究中最大Youden指数为0.335(敏感性92.0%、特异性41.5%),对应的原发灶GTV值为70.29 cm3(图3)。所以采用70 cm3作为原发灶GTV截点值。
2.4 Logistic回归分析
Logistic回归分析显示,相对小的原发灶GTV(P=0.019)以及联合化疗方案(P=0.032)是pCR的独立预测因素(表2)。

图3 原发灶GTV以肿瘤反应作为变量的ROC曲线Figure 3 ROC curve of primary GTV using tumor response as test variable
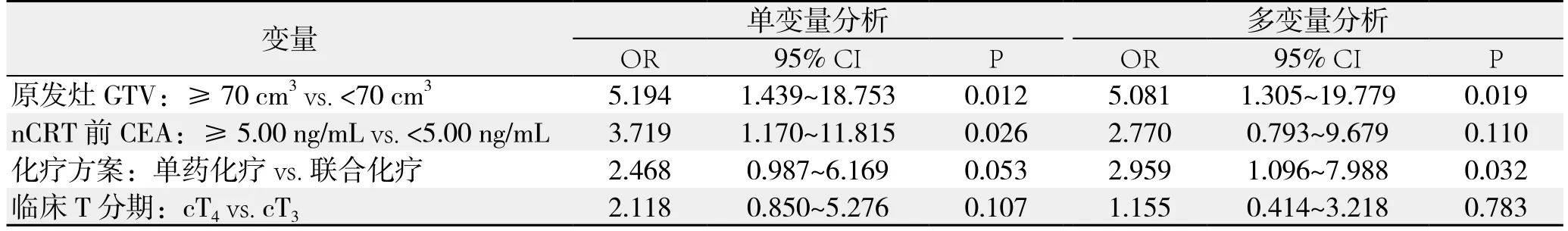
表2 LARC患者临床因素与pCR关系的Logistic回归分析Table 2 Logistic regression analysis of relations of clinical factors with pCR in LARC patients
2.5 免疫组化结果分析
GTV<70 cm3者中,CD133表达阳性为13例(39.4%),CD133表达阴性为20例(60.6),而在GTV≥70 cm3者中,CD133表达阳性为14例(73.7),CD133表达阴性为5例(26.3)。两者差异有统计学意义(P=0.017)(图4)(表3)。

图4 原发灶GTV勾勒结果与肿瘤组织CD133表达 A:CD133阴性LARC患者原发灶GTV;B:CD133阳性LARC患者原发灶GTV;C:CD133阴性(×200);D:CD133阳性(×200)Figure 4 Outline of the primary GTV and CD133 expressions in tumor tissues A: The primary GTV in LARC patient with negative CD133 expression; B: The primary GTV in LARC patient with positive CD133 expression; C: Negative CD133 expression (×200);D: Positive CD133 expression (×200)

表3 原发灶GTV与CD133表达的关系[n(%)]Table 3 Relationship between primary GVT and CD133 expression [n (%)]
3 讨 论
3.1 研究pCR预测因素的临床意义
大量数据显示LARC行nCRT达到pCR可有效控制局部病灶、降低远处转移率、延长生存期[8-9],更是促进了临床治疗策略的改变,如“观察等待”策略的出现。避免手术治疗甚至永久性造瘘[10]。遗憾的是达到pCR的几率不甚满意,约20%(8%~40%),本研究中pCR率(23.36%)在此范围内。临床工作主要集中于如何提高pCR率,提高临床疗效。为避免过度的侵入性治疗,研究pCR预测因素也具有重要临床意义,且临床指标获取方便、应用广泛的特性,应予以重视。虽然目前没有明确的临床指标预测nCRT后pCR率,一些潜在的临床预测因素值得研究。
3.2 肿瘤大小作为pCR临床预测因素的局限性
肿瘤大小可作为临床预测因素候选指标之一,其与pCR率成负相关性[21]。De Felice等[11]、Bitterman等[20]、Garland等[12]以及Probst等[21]研究表明肿瘤大小是pCR率的独立预测因素。在这4个研究中,肿瘤大小的测量采用直肠指检以及肠镜测量,暴露了诸多问题。首先,无论是直肠指检还是应用结肠镜测量肿瘤大小均过于主观,易产生严重的误差。其次,结肠镜仅仅能反映肿瘤肠腔内最大长度以及周长,并不能准确反应肿瘤最大径,更无法体现肿瘤真实体积[22]。再者在直肠管腔狭窄甚至梗阻的情况下,肠镜无法通过病灶并准确测量肿瘤大小。目前采用的一维测量如肿瘤直径能否反映肿瘤的三维体积,也值得深思。本研究选用原发灶GTV作为衡量肿瘤体积的指标,同时应用软件测出原发灶肿瘤最大径以及肠管内最大长度,比较三者关系并分析。结果显示原发灶GTV与肿瘤肠腔内长度以及肿瘤最大径有显著相关性。但是只有原发灶GTV与pCR有显著相关性,而肿瘤肠腔内长度及肿瘤最大径并没有明显相关性。一定程度上本研究解释了一些研究未能显示肿瘤大小(采用一维方式测量)与nCRT后pCR率具有相关性的原因。同样,Sorensen等[13]的研究得出相同的结论,采用一维测量方法不利于预测肿瘤对治疗的敏感度。
3.3 原发灶GTV作为pCR临床预测因素的优势
原发灶GTV作为一种更为精准的测量方式,同时有助于肿瘤精确放疗。尤其应用于IMRT,原发灶GTV是放射治疗尤其是IMRT时,实际接受射线照射的肿瘤体积。因此,理论上说,原发灶GTV与肿瘤的放疗敏感性相关。目前大量临床研究[23-28]证实,对于不同类型的肿瘤(如头颈部肿瘤、非小细胞肺癌、宫颈癌、乳腺癌),GTV可影响其接受放疗的敏感度及预后。有研究[14,29]甚至认为GTV可作为一个预后指标,影响肿瘤分期。本研究认为,相对肿瘤最大径、cT、cN,原发灶GTV能更准确反应肿瘤真实体积,并与LARC患者行nCRT的敏感度成明显相关性。
LARC患者行nCRT未能达到pCR的可能原因为肿瘤干细胞(cancer stem cells,CSCs)对放化疗存在抵抗性。肿瘤干细胞为肿瘤组织中具有干细胞特征的细胞亚群,有关研究证实多种实体肿瘤中存在肿瘤干细胞,包括卵巢癌[30]、前列腺癌[31]、乳癌[32]、脑肿瘤[33]以及结直肠癌[34]等。尽管肿瘤干细胞在肿瘤组织中含量极少量,但其具有无限增殖潜能、可产生异质性肿瘤细胞并具有自我更新的能力,与肿瘤的发生发展、侵袭转移以及放化疗敏感性密切相关。LARC患者实施nCRT可杀灭大量肿瘤细胞,抑制肿瘤生长,有效控制肿瘤局部。然而nCRT无法完全杀灭处于静止期的肿瘤干细胞。甚至nCRT结束后,肿瘤干细胞可再度活跃导致肿瘤复发转移。相关机制可能包括:肿瘤干细胞处于低氧环境中[35],低氧可降低肿瘤干细胞DNA损伤的几率,同时放疗因缺氧杀伤力大为减弱;肿瘤干细胞通常处于静止期[36],有利于其躲避放化疗的杀伤;肿瘤干细胞的DNA损伤修复基因表达上调,激活DNA损伤修复相关蛋白[37]。
肿瘤干细胞可维持肿瘤细胞数目增长,因此认为肿瘤局部控制与肿瘤干细胞的数量密切相关。研究[28,38]表明肿瘤体积与肿瘤干细胞的数量成直线相关性。Withers等[39]认为肿瘤体积是肿瘤中活细胞和残留死细胞体积的总和。因此,肿瘤体积和肿瘤干细胞数之间的相关性必然强烈依赖于死亡肿瘤细胞的清除率。Denekamp[40]通过测量各种接受射线照射后缩小的癌肿和肉瘤,发现癌肿在前24 h内收缩,而肉瘤通常没有收缩。因为相较于肉瘤,癌肿具有更明确的血管结构,因此癌肿本身具有较高的细胞损失率[41],可能机制为癌症可通过自溶或吞噬作用有效去除死亡肿瘤细胞[40-41]。具有低细胞损失率的肿瘤(如肉瘤或淋巴瘤[42])可能不会呈现出肿瘤体积和肿瘤干细胞之间的相关性;而具有高细胞损失率的肿瘤(如支气管癌,结肠直肠癌和头颈部鳞状细胞癌)会表现出这种相关性。
本研究采用CD133作为直肠癌肿瘤干细胞的分子标记,有研究[15-16]报道从结直肠癌分离出的CD133阳性细胞可表现出自我更新和高致瘤潜力的肿瘤起始细胞(cancer-initiating cell,C-IC)特性。O'Brien等[15]利用免疫缺陷型NOD/SCID小鼠中来鉴定人结肠癌起始细胞(CC-IC),该研究发现所有的CC-IC均为CD133阳性,而占大部分肿瘤的CD133阴性细胞不能启动肿瘤生长;通过有限稀释分析,262个CD133阳性细胞中存在1个CC-IC,而5.7×104个未分化肿瘤细胞中才存在1个CC-IC。Ricci-Vitiani等[16]的研究通过给免疫缺陷型NOD/SCID小鼠皮下接种CD133阳性的结直肠癌细胞并将肿瘤连续移植数代,检测小鼠体内形成的肿瘤,结果显示新形成肿瘤与亲代肿瘤生物学特征相同,并且随着传代的进行该肿瘤生长速度逐快以及致瘤能力逐渐加强;与CD133阴性细胞不同,将CD133阳性结直肠癌细胞在无血清培养基培养,可呈指数级增长超过1年,并保持与原始肿瘤相同的形态学和免疫学特征,因此可以认为结直肠癌是由少量未分化的高致瘤性CD133阳性细胞增生产生的,也就是说CD133阳性的结直肠癌细胞具有结直肠癌肿瘤干细胞特性。本研究结果显示CD133表达水平与肿瘤体积明显相关,即GTV越大,其肿瘤组织中干细胞表达越高。因此肿瘤体积越大,治疗应越积极。采用更高放射剂量可消灭更多肿瘤干细胞[38,43]。其他的肿瘤体积相关机制可能对CRT敏感性也有一定影响,如克隆分数、组织缺氧、克隆抗辐射性、细胞间通讯[44]。
肿瘤干细胞理论同样支持本研究的其他结论,如联合化疗(5-FU+奥沙利铂)可明显提高pCR率。因个体耐受的放疗剂量有限,放疗的同时进行化疗无疑可更有效的杀灭肿瘤干细胞在内的肿瘤细胞。5-FU是细胞周期特异性药物,在细胞分裂S期干扰DNA合成,可能对部分肿瘤细胞无效。奥沙利铂是细胞周期非特异性药物,与5-FU合用具有高效互补性。但是联合化疗对于nCRT患者是否获益需要更多的临床研究,目前仅有少量研究认为以5-FU为基础的联合化疗可有效提高pCR率[45]。
3.4 其他临床因素作为pCR预测因素
一些研究[47]表明nCRT前CEA水平、放疗手术间期、肿瘤距肛缘距离[48]可作为pCR的预测因素。本研究中仅在单变量分析中显示CRT前CEA水平与pCR率相关,在多变量分析无明显相关性。放疗手术间期和肿瘤距肛缘距离与pCR率无明显相关性(具体数据文中未提供)。本研究中还分析了血清中CA19-9及CA242水平与pCR的相关性,但无统计学意义。
相对较小的样本量和单一机构研究的回顾性数据是本研究的局限性,需要进一步的大样本前瞻性随机试验来加强研究结果,促进LARC患者的个体化治疗。
本研究病例中局部进展期直肠癌pCR率为23.36%。肿瘤原发灶GTV相对于肿瘤最大直径或肿瘤长度更有效地反映肿瘤大小,是一个更准确的pCR独立预测因素。CD133作为结肠癌肿瘤干细胞经典分子标记物,其表达与GTV呈正相关,因此GTV越大,其肿瘤组织中干细胞表达越高,相应的治疗应越积极。
[1] Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J].CA Cancer J Clin, 2015, 65(2):87–108. doi: 10.3322/caac.21262.
[2] Meza R, Jeon J, Renehan AG, et al. Colorectal cancer incidence trends in the United States and United kingdom: evidence of rightto left-sided biological gradients with implications for screening[J].Cancer Res, 2010, 70(13):5419–5429. doi: 10.1158/0008–5472.CAN–09–4417.
[3] Caldarella A, Crocetti E, Messerini L, et al. Trends in colorectal incidence by anatomic subsite from 1985 to 2005: a populationbased study[J]. Int J Colorectal Dis, 2013, 28(5):637–641. doi:10.1007/s00384–013–1672–2.
[4] Torok JA, Palta M, Willett CG, et al. Nonoperative management of rectal cancer[J]. Cancer, 2016, 122(1):34–41. doi: 10.1002/cncr.29735.
[5] Watanabe T, Itabashi M, Shimada Y, et al. Japanese Society for Cancer of the Colon and Rectum (JSCCR) Guidelines 2014 for treatment of colorectal cancer[J]. Int J Clin Oncol, 2015, 20(2):207–239. doi: 10.1007/s10147–015–0801–z.
[6] Monson JR, Weiser MR, Buie WD, et al. Practice parameters for the management of rectal cancer (revised) [J]. Dis Colon Rectum, 2013,56(5):535–550. doi: 10.1097/DCR.0b013e31828cb66c.
[7] Yeo SG, Kim DY, Kim TH, et al. Pathologic complete response of primary tumor following preoperative chemoradiotherapy for locally advanced rectal cancer: long-term outcomes and prognostic significance of pathologic nodal status (KROG 09–01)[J]. Ann Surg,2010, 252(6):998–1004. doi: 10.1097/SLA.0b013e3181f3f1b1.
[8] Martin ST, Heneghan HM, Winter DC. Systematic review and metaanalysis of outcomes following pathological complete response to neoadjuvant chemoradiotherapy for rectal cancer[J]. Br J Surg,2012, 99(7):918–928. doi: 10.1002/bjs.8702.
[9] Maas M, Nelemans PJ, Valentini V, et al. Long-term outcome in patients with a pathological complete response after chemoradiation for rectal cancer: a pooled analysis of individual patient data[J].Lancet Oncol, 2010, 11(9):835–844. doi: 10.1016/S1470–2045(10)70172–8.
[10] Perez RO. Complete clinical response in rectal cancer: a turning tide[J]. Lancet Oncol, 2016, 17(2):125–126. doi: 10.1016/S1470–2045(15)00487–8.
[11] De Felice F, Izzo L, Musio D, et al. Clinical predictive factors of pathologic complete response in locally advanced rectal cancer[J]. Oncotarget, 2016, 7(22):33374–33380. doi: 10.18632/oncotarget.8133.
[12] Garland ML, Vather R, Bunkley N, et al. Clinical tumour size and nodal status predict pathologic complete response following neoadjuvant chemoradiotherapy for rectal cancer[J]. Int J Colorectal Dis, 2014, 29(3):301–307. doi: 10.1007/s00384–013–1821–7.
[13] Sorensen AG, Patel S, Harmath C, et al. Comparison of diameter and perimeter methods for tumor volume calculation[J]. J Clin Oncol, 2001, 19(2):551–557.
[14] Studer G, Lütolf UM, El-Bassiouni M, et al. Volumetric staging(VS) is superior to TNM and AJCC staging in predicting outcome of head and neck cancer treated with IMRT[J]. Acta Oncol, 2007,46(3):386–394.
[15] O’Brien CA, Pollett A, Gallinger S, et a1. A human colon cancer cell capable of initiating tumour growth in immunodeficient mice[J]. Nature, 2007, 445(7123):106–110.
[16] Ricci-Vitiani L, Lotabardi DG, Pilozzi E, et a1.Identification and expansion of human colon-cancer-initiating cells[J]. Nature, 2007,445(7123):111–115.
[17] Al-Sukhni E, Milot L, Fruitman M, et al. Diagnostic accuracy of MRI for assessment of T category, lymph node metastases, and circumferential resection margin involvement in patients with rectal cancer: a systematic review and meta-analysis[J]. Ann Surg Oncol,2012, 19(7):2212–2223. doi: 10.1245/s10434–011–2210–5.
[18] Edge SB, Compton CC. The American Joint Committee on Cancer:the 7th edition of the AJCC cancer staging manual and the future of TNM[J]. Ann Surg Oncol, 2010, 17(6):1471–1474. doi: 10.1245/s10434–010–0985–4.
[19] Park JW, Lim SB, Kim DY, et al. Carcinoembryonic antigen as a predictor of pathologic response and a prognostic factor in locally advanced rectal cancer patients treated with preoperative chemoradiotherapy and surgery[J]. Int J Radiat Oncol Biol Phys,2009, 74(3):810–817. doi: 10.1016/j.ijrobp.2008.08.057.
[20] Bitterman DS, Resende Salgado L, Moore HG, et al. Predictors of Complete Response and Disease Recurrence Following Chemoradiation for Rectal Cancer[J]. Front Oncol, 2015, 5:286.doi: 10.3389/fonc.2015.00286.
[21] Probst CP, Becerra AZ, Aquina CT, et al. Extended Intervals after Neoadjuvant Therapy in Locally Advanced Rectal Cancer:The Key to Improved Tumor Response and Potential Organ Preservation[J]. J Am Coll Surg, 2015, 221(2):430–440. doi:10.1016/j.jamcollsurg.2015.04.010.
[22] Tirkes T, Hollar MA, Tann M, et al. Response criteria in oncologic imaging: review of traditional and new criteria[J]. Radiographics,2013, 33(5):1323–1341. doi: 10.1148/rg.335125214.
[23] Studer G, Rordorf T, Glanzmann C. Impact of tumor volume and systemic therapy on outcome in patients undergoing IMRT for large volume head neck cancer[J]. Radiat Oncol, 2011, 6:120. 6:120. doi:10.1186/1748–717X–6–120.
[24] Strongin A, Yovino S, Taylor R, et al. Primary tumor volume is an important predictor of clinical outcomes among patients with locally advanced squamous cell cancer of the head and neck treated with definitive chemoradiotherapy[J]. Int J Radiat Oncol Biol Phys,2012, 82(5):1823–1830. doi: 10.1016/j.ijrobp.2010.10.053.
[25] Basaki K, Abe Y, Aoki M, et al. Prognostic factors for survival in stage III non-small-cell lung cancer treated with definitive radiation therapy: impact of tumor volume[J]. Int J Radiat Oncol Biol Phys,2006, 64(2):449–54.
[26] Bradley JD, Ieumwananonthachai N, Purdy JA, et al. Gross tumor volume, critical prognostic factor in patients treated with threedimensional conformal radiation therapy for non-small-cell lung carcinoma[J]. Int J Radiat Oncol Biol Phys, 2002, 52(1):49–57.
[27] Narayan K, Fisher R, Bernshaw D. Significance of tumor volume and corpus uteri invasion in cervical cancer patients treated by radiotherapy[J]. Int J Gynecol Cancer, 2006, 16(2):623–630.
[28] Dubben HH, Thames HD, Beck-Bornholdt HP. Tumor volume: a basic and specific response predictor in radiotherapy[J]. Radiother Oncol, 1998, 47(2):167–174.
[29] Studer G, Glanzmann C. Volumetric stratification of cT4 stage head and neck cancer[J]. Strahlenther Onkol, 2013, 189(10):867–873.doi: 10.1007/s00066–013–0413–3.
[30] Kryczek I, Liu S, Roh M, et al. Expression of aldehyde dehydrogenase and CD133 defines ovarian cancer stem cells[J]. Int J Cancer, 2012, 130(1):29–39. doi: 10.1002/ijc.25967.
[31] Sharpe B, Beresford M, Bowen R, et al. Searching for prostate cancer stem cells: markers and methods[J]. Stem Cell Rev, 2013,9(5):721–730. doi: 10.1007/s12015–013–9453–4.
[32] Velasco-Velázquez MA, Homsi N, De La Fuente M, et al. Breast cancer stem cells[J]. Int J Biochem Cell Biol, 2012, 44(4):573–577.doi: 10.1016/j.biocel.2011.12.020.
[33] Singh SK, Clarke ID, Terasaki M, et al. Identification of a cancer stem cell in human brain tumors[J]. Cancer Res., 2003,63(18):5821–5828.
[34] Merlos-Suárez A, Barriga FM, Jung P, et al. The intestinal stem cell signature identifies colorectal cancer stem cells and predicts disease relapse[J]. Cell stem cell, 2011, 8(5):511–524. doi: 10.1016/j.stem.2011.02.020.
[35] Meijer TW, Kaanders JH, Span PN, et al. Targeting hypoxia, HIF-1,and tumor glucose metabolism to improve radiotherapy efficacy[J].Clin Cancer Res, 2012, 18(20):5585–5594. doi: 10.1158/1078–0432.CCR–12–0858.
[36] Moncharmont C, Levy A, Gilormini M, et al. Targeting a cornerstone of radiation resistance: cancer stem cell[J]. Cancer Lett,2012, 322(2):139–147. doi: 10.1016/j.canlet.2012.03.024.
[37] Hittelman WN, Liao Y, Wang L, et al. Are cancer stem cells radioresistant?[J]. Future Oncol, 2010, 6(10):1563–1576. doi:10.2217/fon.10.121.
[38] Brenner DJ. Dose, volume, and tumor-control predictions in radiotherapy[J]. Int J Radiat Oncol Biol Phys, 1993, 26(1):171–179.
[39] Withers HR, Peters LJ. Biologic aspects of radiation therapy. In:Gilbert GH. Textbook of radiotherapy[M]. Philadelphia: Lea and Febinger, 1980:103–180.
[40] Denekamp J. The relationship between the “cell loss factor” and the immediate response to radiation in animal tumours[J]. Eur J Cancer, 1972, 8(3):335–340.
[41] Steel GG. Growth kinetics of tumours[M]. Oxford: Clarendon Press, 1977.
[42] Steel GG. Cell proliferation kinetics in tumors. In: Steel GG, Adams GE, Horwich A, eds. The biological basis of radiotherapy, 2nd edition[M]. Amsterdam: Elsevier, 1989:77–88.
[43] Knegjens JL, Hauptmann M, Pameijer FA, et al. Tumor volume as prognostic factor in chemoradiation for advanced head and neck cancer[J]. Head Neck, 2011, 33(3):375–382. doi: 10.1002/hed.21459.
[44] Bentzen SM, Thames HD. Tumor volume and local control probability: clinical data and radiobiological interpretations[J]. Int J Radiat Oncol Biol Phys, 1996, 36(1):247–251.
[45] Rödel C, Graeven U, Fietkau R, et al. Oxaliplatin added to fluorouracil-based preoperative chemoradiotherapy and postoperative chemotherapy of locally advanced rectal cancer (the German CAO/ARO/AIO-04 study): final results of the multicentre,open-label, randomised, phase 3 trial[J]. Lancet Oncol, 2015,16(8):979–989. doi: 10.1016/S1470–2045(15)00159–X.
[46] Lee JH, Kim SH, Jang HS, et al. Preoperative elevation of carcinoembryonic antigen predicts poor tumor response and frequent distant recurrence for patients with rectal cancer who receive preoperative chemoradiotherapy and total mesorectal excision: a multi-institutional analysis in an Asian population[J]. Int J Colorectal Dis, 2013, 28(4):511–517. doi: 10.1007/s00384–012–1584–6.
[47] Garcia-Aguilar J, Smith DD, Avila K, et al. Optimal timing of surgery after chemoradiation for advanced rectal cancer:preliminary results of a multicenter, nonrandomized phase II prospective trial[J]. Ann Surg, 2011, 254(1):97–102. doi: 10.1097/SLA.0b013e3182196e1f.
[48] Restivo A, Zorcolo L, Cocco IM, et al. Elevated CEA levels and low distance of the tumor from the anal verge are predictors of incomplete response to chemoradiation in patients with rectal cancer[J]. Ann Surg Oncol, 2013, 20(3):864–871. doi: 10.1245/s10434–012–2669–8.
