胃癌患者血清中miR-204水平变化及与幽门螺杆菌感染的关系
2017-03-31周保贞王大广郑雷振徐越超
周保贞,王大广,郑雷振,徐越超
(吉林大学白求恩第一医院,吉林 长春130021)
*通讯作者
胃癌患者血清中miR-204水平变化及与幽门螺杆菌感染的关系
周保贞,王大广,郑雷振,徐越超*
(吉林大学白求恩第一医院,吉林 长春130021)
幽门螺杆菌(Hp)感染已经被国际癌症研究机构列为第一类癌病致病原[1]。目前大量研究已证实Hp感染与胃癌发生、发展密切相关,但具体机制尚不清楚。微小RNA(miRNA)是一种单链RNA,目前研究认为其具有非编码性和高度保守性[2]。Calin[3]研究发现有超过半数的miRNA的基因所在区域与肿瘤有关,诸如杂合子缺失的微小区域、扩增的微小区域和普通断裂点,这些miRNA参与了肿瘤的发生与发展过程。microRNA-204(miR-204)在不同肿瘤组织中存在异常表达,并与肿瘤的增殖、侵袭、转移、化疗抵抗及不良预后密切相关[4,5]。此次研究拟通过检测胃癌患者血清中miR-204表达水平,探讨miR-204与胃癌发生、发展的关系,并观察其与Hp感染的关系。
1 资料与方法
1.1 一般资料 选取自吉林大学白求恩第一医院胃结直肠外科2015年1月至2016年1月收治的94例胃癌患者作为观察组,男53例,女41例,平均年龄(63.3±9.5)岁;100例慢性浅表性胃炎患者作为对照组,男55例,女45例,平均年龄(58.9±13.1)岁。两组性别比例、平均年龄无显著差异(P>0.05)。根据是否合并Hp感染将两组分别分为胃癌-Hp感染亚组(GC-Hp亚组)、胃癌-Hp未感染组(GC-nonHp)亚组、对照-Hp感染亚组(C-Hp亚组)和对照-Hp未感染组(C-nonHp亚组)。观察组纳入标准:(1)均经胃镜病理证实为胃腺癌,且均为首次诊断为胃癌;(2)近3个月未规律服用过抑酸药、胃黏膜保护剂、非甾体类抗炎药、抗生素[6];(3)均行手术治疗。排除标准:(1)合并其它器官原发肿瘤;(2)合并免疫系统疾病;(3)重要器官(肝、肾等)功能不全;(4)有恶性肿瘤家族遗传史;(5)接受过放疗、化疗、生物治疗等。对照组纳入标准:(1)均经胃镜病理证实为慢性浅表性胃炎;(2)近3个月未规律服用过抑酸药、胃黏膜保护剂、非甾体类抗炎药、抗生素。排除标准:(1)处于炎症反应急性期[7];(2)有恶性肿瘤家族遗传史;(3)合并免疫系统疾病;(4)重要器官(肝、肾等)功能不全。两组及各亚组受试者基本资料无显著差异(P>0.05)。此次研究通过吉林大学白求恩第一医院伦理委员会讨论通过,实验前均向受试者告知实验过程,并签署知情同意书1份。
1.2 实验方法
1.2.1 血清标本采集 观察组受试者于术前1天,对照组患者于行胃镜检查后3日清晨空腹用EDTA抗凝管取外周静脉血5 ml,于2小时内送检。所有标本经1 200 g(3 000 r/min)离心15 min后,取上层清液3 ml作为标本,置于-80℃冰箱中保存。
1.2.2 血清miR-204水平检测 按照试剂盒说明书提取标本中的总RNA,并用分光光度计测量提取物在260 nm与280 nm处的吸光值,并以其比值(A260/A280)来衡量总RNA纯度,当A260/A280=2.0±0.1认为纯度满意[8]。按照反转录试剂盒说明书配置总体积为20 μl的反应体系,此次研究选择U6作为内参,miR-204与U6的反转录引物序列分别为:miR-204:5’-GTCGTATCCAGTGCGTGTCGTGGAGTCGGCAATTGCACTGGATACG-
ACAGGCATA-3’;U6:5’-CGCTTCACGAATTTGCGTGTCAT-3’。将反应体系按照:42℃ 1 h,85℃孵育5 min,合成cDNA。将cDNA用双蒸水稀释4倍后,应用Light Cycler 2.0 实时定量PCR仪(购自Roche公司)进行PCR扩增,20 μl反应体系为:稀释后的cDNA 2 μl,Maxima SYBR Green qPCR Master Mix(2×) 10 μl,上、下游引物各0.5 μl,去RNA酶水7 μl。U6上游引物序列:5’-CTCGCTTCGGCAGCACA-3’,下游引物序列:5’-AACGCTTCACGAATTTGCTT-3’;miR-204上游引物序列:5’-GCGGCGGTAGCTTATCAGACTG-3’,下游引物序列:5’-ATCCAGTGCAGGGTCCGAGG-3’。反应条件:95℃预变性180 s,95℃变性15 s,60℃退火35 s,此为1个循环,共进行40个循环。应用相对定量法计算miR-204的相对表达量:2-ΔCT,ΔCT=CTmiR-204—ΔCTU6。CT为荧光信号达到阈值时的循环数。
1.2.3 Hp感染检测方法 应用C-13呼气试验,受试者空腹或禁食3 h以上,口服13C尿素胶囊30 min后进行呼气试验。应用红外能谱仪对呼出气13C原子峰进行检测,规定超出基线5%为Hp感染阳性。
1.3 统计学方法
采用SPSS 20.0软件对实验所得数据进行处理,对计数资料用χ2检验,对计量资料用t检验,所得数据均以均数±标准差(x—±s)的形式表示,应用受试者工作曲线(ROC曲线)评价miR-204对胃癌的诊断价值,P<0.05有显著差异。
2 结果
2.1 Hp感染检测结果 观察组94例患者中,Hp检查结果阳性者71例,占75.53%,对照组100例患者中,Hp检查结果阳性者43例,占43.00%。观察组Hp感染率显著高于对照组(P<0.05)。
2.2 各组miR-204相对表达水平 观察组血清miR-204相对水平为(0.424±0.127),显著低于对照组(1.306±0.271)(P<0.05)。GC-Hp亚组血清miR-204相对水平为(0.163±0.037),显著低于GC- nonHp亚组(0.619±0.264)(P<0.05)。C-Hp亚组血清miR-204相对水平为(0.899±0.158)显著低于C-nonHp亚组(1.594±0.376)(P<0.05)。
2.3 胃癌患者血清miR-204水平与临床资料的关系 胃癌患者血清中miR-204水平与淋巴结转移、远处转移和TNM分期有关(P<0.05),而与性别、年龄、肿瘤大小和组织学分级无关(P>0.05)。见表1。
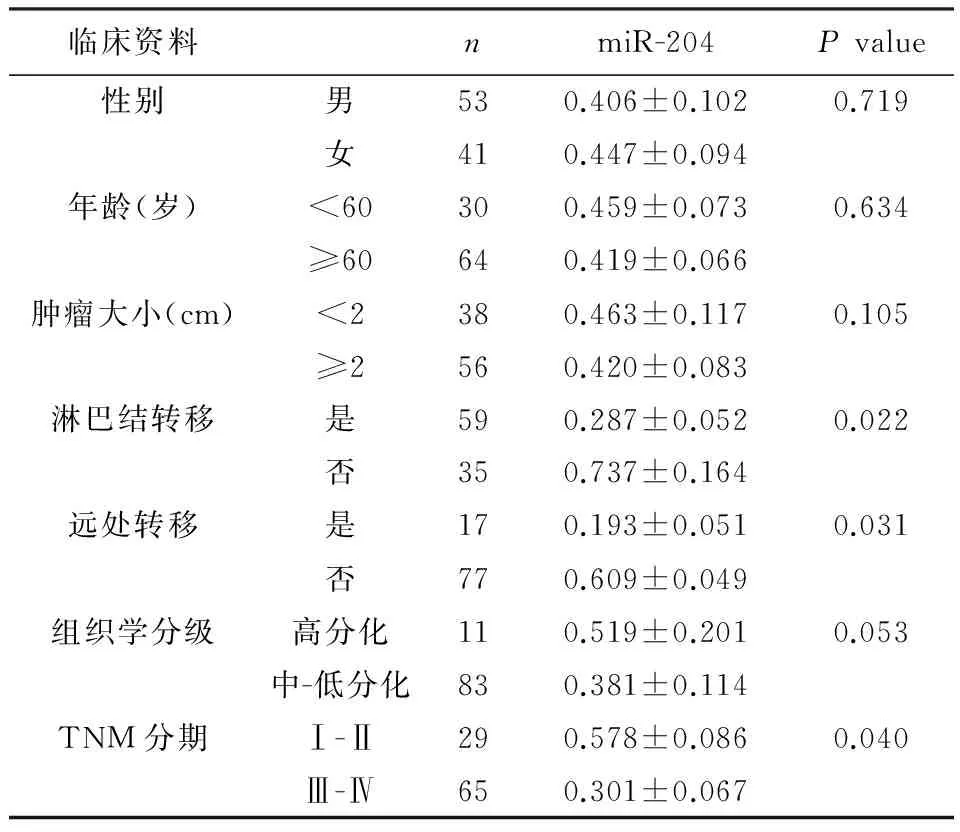
表1 胃癌患者血清miR-204水平与临床资料的关系
2.4 血清miR-204水平对胃癌的诊断价值 应用受试者工作曲线对观察组与对照组受试者血清miR-204水平进行比较,得到miR-204诊断胃癌的ROC曲线。当miR-204相对表达量为0.455时,曲线下面积(AUC)最大为0.839(95%CI:0.759-0.912),灵敏度和特异度分别为73.4%与82.6%。见图1。
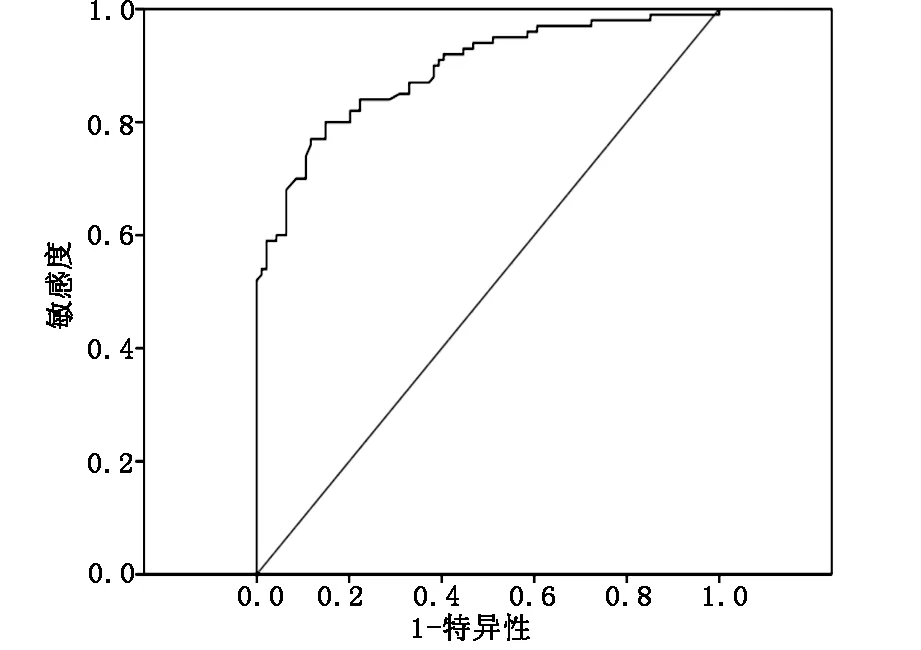
图1 血清miR-204表达水平ROC曲线
3 讨论
幽门螺杆菌感染是慢性胃炎和萎缩性胃炎发病的危险因素这一观点目前已被绝大多数学者认同。有研究发现,高水平Hp感染是由慢性-非萎缩性胃炎向慢性-萎缩性胃炎转变,进而发展为胃癌的促进因素之一,但其具体机制尚不完全清楚。此次研究结果发现,胃癌患者Hp感染率(75.53%)显著高于慢性浅表性胃炎患者(43%)(P<0.05)。蒋晓玲等人[9]在研究中发现,我国Hp感染率在40%-90%,与此次研究结果相似,这提示临床工作中要注重对Hp感染的控制,而胃癌患者具有较高的Hp感染率,控制Hp感染是预防胃癌发生的重要环节。
微小RNA是具有调节基因表达功能的RNA,目前研究认为miRNA的功能表达与细胞分化、增殖以及胞内物质能量代谢具有关联[10]。Stik认为[11],miRNA与相应的靶基因mRNA可以形成发卡样结构,从而抑制靶基因的表达。此次研究结果发现,胃癌患者血清miR-204水平显著低于慢性浅表性胃炎患者,且GC-Hp亚组与C-Hp亚组受试者血清miR-204水平分别显著低于GC-nonHp亚组与C-nonHp亚组(P<0.05)。这提示胃癌患者血清miR-204表达受到抑制。miR-204目前已探明具有抑癌作用[12],而伴有Hp感染患者血清miR-204水平显著降低,结合此次研究结果,提示Hp感染可能会抑制miR-204的表达,具体机制尚不清楚,可能与Hp分泌尿素酶、细胞空泡毒素等物质[13],刺激胃黏膜组织产生炎症反应,激活免疫系统,抑制了miR-204的表达有关。此次研究表明,伴有淋巴结转移、肿瘤发生远处转移和Ⅲ-Ⅳ期胃癌患者血清miR-204水平显著降低,这与刘洪建[14]、Zhang[15]等人的研究结果相似,这提示miR-204在胃癌的发展过程中起到重要的调控作用。
此次研究还应用ROC曲线对血清中miR-204水平对胃癌的诊断价值进行了评价,结果发现当血清中miR-204相对表达量为0.455时,其AUC最大,此时灵敏度为73.4%,特异度为82.6%。这提示血清miR-204水平对诊断胃癌具有一定的价值,但灵敏度较低,可以联合其他检查方法共同诊断。
[1]张雪梅.胃癌患者幽门螺杆菌的感染情况分析及耐药性分析[J].中国病原生物学杂志,2016,11(04):362.
[2]GC Santini,C Potrich,L Lunelli,et al.Innovative microRNA purification based on surface properties modulation[J].Colloids and Surfaces.Biointerfaces,2014,116:160.
[3]Calin GA,Sevignani C,Dumitru CD,et al.Human microRNA genes are frequently located at fragile sites and genomic regions involved in cancers [J].Proc Natl Acad Sci USA,2004,101(9):2999.
[4]Deng X,Wu M.Down- regulation of miRNA -204 by LMP-1 enhances CDC42 activity and facilitates invasion of EBV-associated nasopharyngeal carcinoma cells[J].FEBS Let,2014,588(9):1562.
[5]Ryan J,Tivnan A,Fay J,et al.microRNA - 204 increases sensitivity of neuroblastoma cells to cisplatin and is associated with a favourable clinical outcome[J].Br J Cancer,2012,107(6):967.
[6]李立平,梁晓峰,吴炜景,等.胃窦溃疡患者幽门螺杆菌感染率与miR-21相关性研究[J].实用医学杂志,2013,29(10):1588.
[7]Sahin IH,Hassan MM,Garrett CR,et al.Impact of non-steroidal anti-inflammatory drugs on gastrointestinal cancers:Current state-of-the science[J].Cancer letters,2014,345(2):249.
[8]黄婵娟,霍 妍,陈 琛,等.miR-30b对大鼠糖氧剥夺性视网膜神经节细胞损伤的保护作用[J].中华实验眼科杂志,2016,34(5):396.
[9]蒋晓玲,袁蕙芸.我国幽门螺杆菌感染处理共识推荐的铋剂四联方案根除率分析[J].胃肠病学,2014,(9):531.
[10]Yin H,Wang M,Zhou Y,et al.Photoelectrochemical biosensing platform for microRNA detection based on in situ producing electron donor from apoferritin-encapsulated ascorbic acid[J].Biosens Bioelectron,2014,53:175.
[11]Stik G,Muylkens B,Coupeau D,et al.Small RNA cloning and sequencing strategy affects host and viral microRNA expression signatures[J].Journal of Biotechnology,2014,181:35.
[12]吴恺明,何裕隆,李广华,等.线粒体转录因子A相关的微小RNA在结肠癌中的表达和增殖调控研究[J].中华胃肠外科杂志,2015,(10):1041.
[13]何剑琴,史少凤,莫绮华.产毒株幽门螺杆菌感染与结肠腺瘤性息肉关系的探讨[J].中华医院感染学杂志,2011,21(12):2489.
[14]刘洪建,张敬敬,王玉波,等.食管鳞状细胞癌组织MiR-204表达生物学意义研究[J].中华肿瘤防治杂志,2015,22(17):1382.
[15]Zhang BB,Yin Y,Hu YL,et al.MicroRNA-204-5p inhibits gastric cancer cell proliferation by downregulating USP47 and RAB22A[J].Medical oncology,2015,32(1):331.
1007-4287(2017)03-0485-03
2016-05-28)
