头颈部鳞状细胞癌相关基因的生物信息学分析
2017-03-31宫美恒尹万忠
向 琳,宫美恒,王 苹,尹万忠,杜 波
(吉林大学第一医院 耳鼻咽喉头颈外科,吉林 长春130021)
头颈部鳞状细胞癌相关基因的生物信息学分析
向 琳,宫美恒,王 苹,尹万忠,杜 波*
(吉林大学第一医院 耳鼻咽喉头颈外科,吉林 长春130021)
目的 从基因和分子水平探讨头颈部鳞状细胞癌(head and neck squamous cell carcinoma,HNSCC)的发生机制。方法 从GEO数据库下载人HNSCC相关基因芯片数据,使用BRB-Array Tools软件筛选差异表达基因,采用DAVID、 ToppGene、STRING、Cytoscape工具进行生物信息学分析。结果 BRB分析共筛选出263条差异表达基因,其中上调基因134个,下调基因共129个,对其进行生物信息学分析发现COL1A1、MMP9、COL1A2、COL3A1、MMP1等基因调节HNSCC细胞外基质受体相互作用、小细胞肺癌、肿瘤通路等,影响肿瘤的发生发展。结论 利用生物信息学分析能有效挖掘基因芯片内在数据,为进一步探讨HNSCC的发生机制提供理论参考。
头颈部鳞状细胞癌;差异表达基因;基因芯片;生物信息学
(ChinJLabDiagn,2017,21:0381)
头颈部鳞状细胞癌(head and neck squamous cell carcinoma,HNSCC)全球每年大约有500,000例新发患者[1],新发病例死亡率约为20%[2],尤其是鼻咽癌和下咽癌的死亡率更高[3]。HNSCC给患者及其家庭带来沉重的生活负担[4]。目前,头颈部鳞状细胞癌的分子机制仍不清楚,从基因水平研究HNSCC的发生发展,对其预防和治疗具有重要意义。分子生物技术、多学科评估和准确分期可能在未来诊断和治疗HNSCC方面发挥重要作用[5]。生物信息学是一门交叉学科,通过聚类分析、通路分析等各种方法筛选大规模基因芯片数据,挖掘出潜在的重要分子,理论上探讨疾病的发病机制。本文采用BRB-Array Tools软件筛选HNSCC差异表达基因,联合其他生物信息学分析工具和数据库,从基因和分子水平探讨头颈部鳞状细胞癌的发生机制。
1 材料与方法
1.1 材料 人头颈部鳞状细胞癌和正常组织基因芯片数据来源于GEO database数据库(http://www.ncbi.nlm.nih.gov/gds/),登录号为GSE29330和GSE6631。GSE29330由Demokan等[6]提交,研究中包括13例HNSCC标本和5例正常组织标本,芯片平台采用Affymetrix GPL570(HG-U133_Plus_2)。GSE6631由Kuriakose等[7]提交,采用Affymetrix GPL8300(HG_U95Av2)芯片平台,研究包括22例HNSCC标本并配对22例正常组织标本。
1.2 数据筛选与过滤 使用BRB-Array Tools(v4.5.0 stable)软件(http://linus.nci.nih.gov/BRB-ArrayTools/download.html)的MAS5.0解析方法进行数据处理。点样筛选的排除标准为直径小于10的点样,数据标准化采用中位值法,基因筛选排除标准为:样本表达中位值至少改变3倍以上,并且这种改变不少于20%样本数,数据缺失不超过50%。
1.3 统计学方法 相同实验对象基因差异表达分析采用配对t检验(随机方差模型),不同试验对象基因差异表达分析采用独立样本t检验,显著性水平为0.001,假阳性率为10%。
1.4 GO分析和KEGG通路分析 采用DAVID(v6.7)(https://david.ncifcrf.gov/home.jsp)在线工具对差异表达基因进行GO本体分析和KEGG通路分析,显著性水平为0.01。
1.5 共表达分析 使用ToppGene(https://toppgene.cchmc.org/)在线工具对差异表达基因进行共表达分析,显著性水平为0.01。
1.6 蛋白互作用网络 采用STRING(v10.0)(http://string-db.org/)在线分析工具绘制差异表达基因编码蛋白质互作用网络,将数据导入Cytoscape(v3.3.0)软件计算网络拓扑特性。
2 结果
2.1 差异表达基因筛选 采用BRB-Array Tools对GSE29330和GSE6631进行分析后结果显示:GSE29330数据中共筛选出258 个差异表达基因,其中上调144个,下调114个(表1)。其中31条基因注释不完整,利用现有数据库http://www.genecards.org/、http://www.ebi.ac.uk/和http://www.ncbi.nlm.nih.gov/gene/搜索相关基因信息后,对21条基因进行了重新注释,另外10条基因注释未知,基因符合未能确定。GSE6631数据中共 93个差异表达基因,其中上调46个,下调47个(表1)。Venny工具去除重复和注释未知的基因后共获得263条差异表达基因,其中上调134个,下调129个。
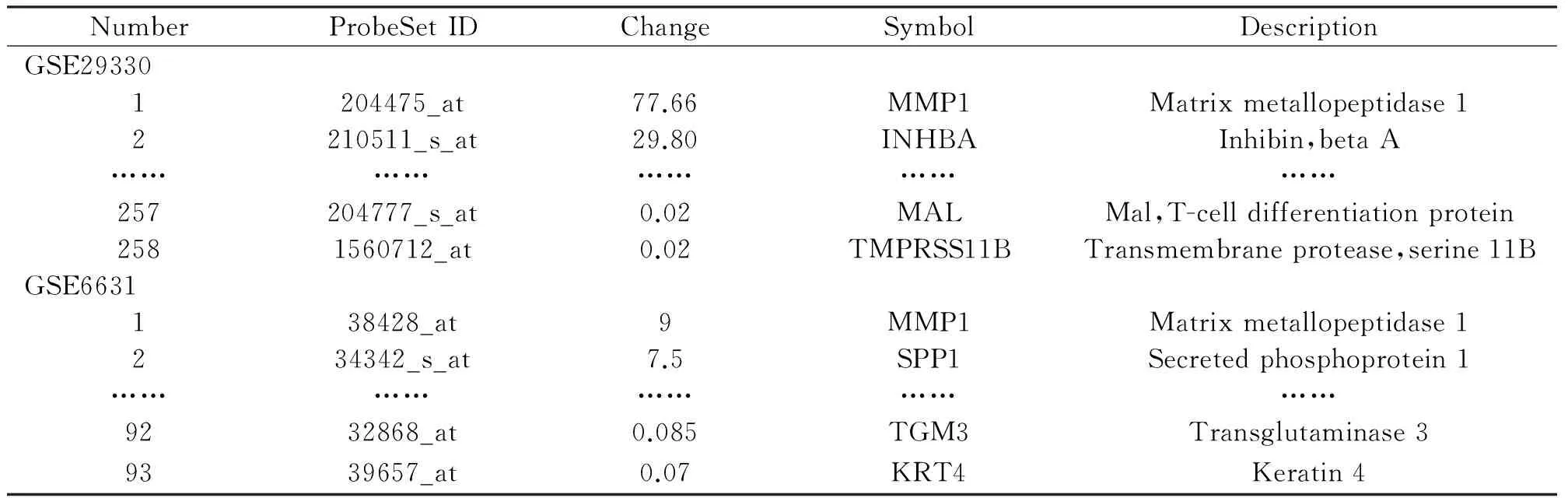
表1 人头颈部鳞状细胞癌差异表达基因(部分)
2.2 GO分析 采用DAVID对263条差异表达基因进行GO分析,结果显示差异表达的基因主要分布在细胞外、质膜,参与多细胞生物过程、发育过程,发挥蛋白结合、钙离子结合、受体结合、结构活性分子等功能(表2)。
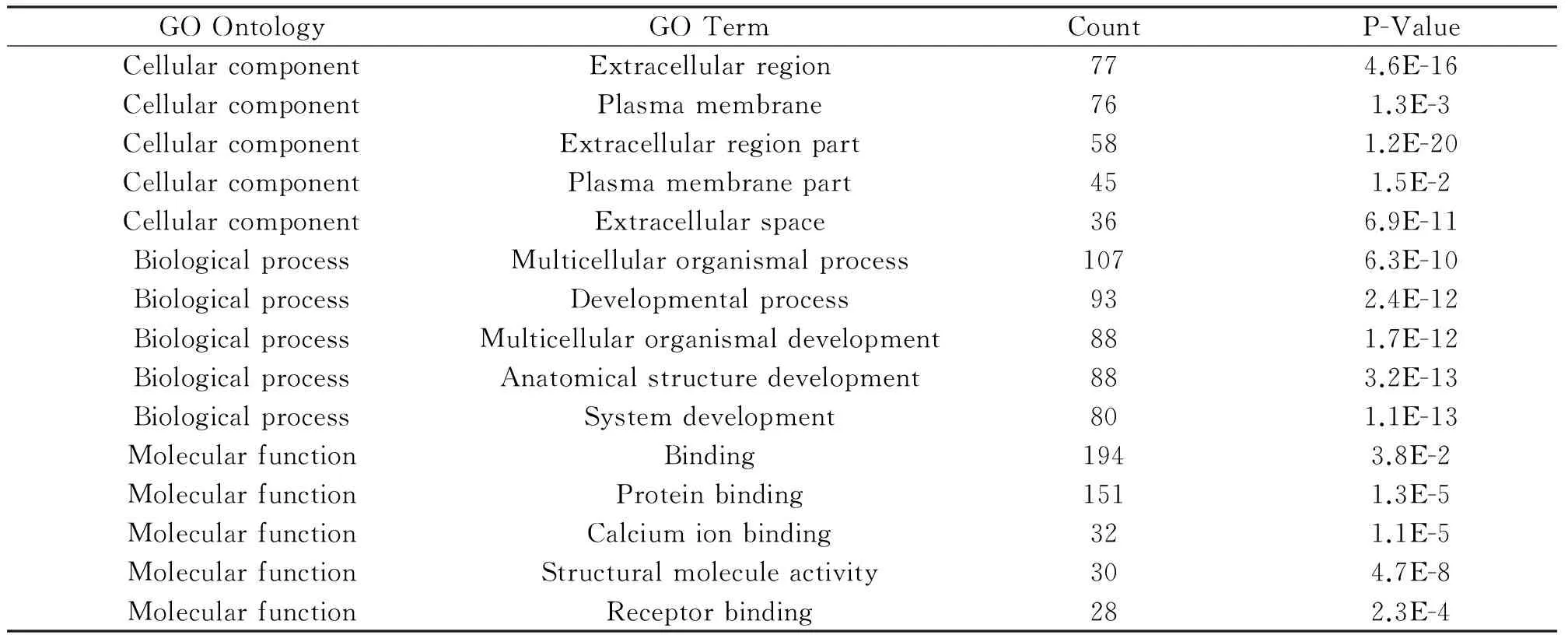
表2 差异表达基因的GO分析
2.3 KEGG通路分析 采用DAVID对263条差异表达基因进行KEGG通路分析,差异表达基因主要参与细胞外基质受体相互作用、黏合斑、小细胞肺癌、肿瘤通路、细胞因子-细胞因子受体相互作用、细胞色素P450外源性物质代谢、药物代谢、视黄醇代谢和糖酵解途径等通路(表3)。
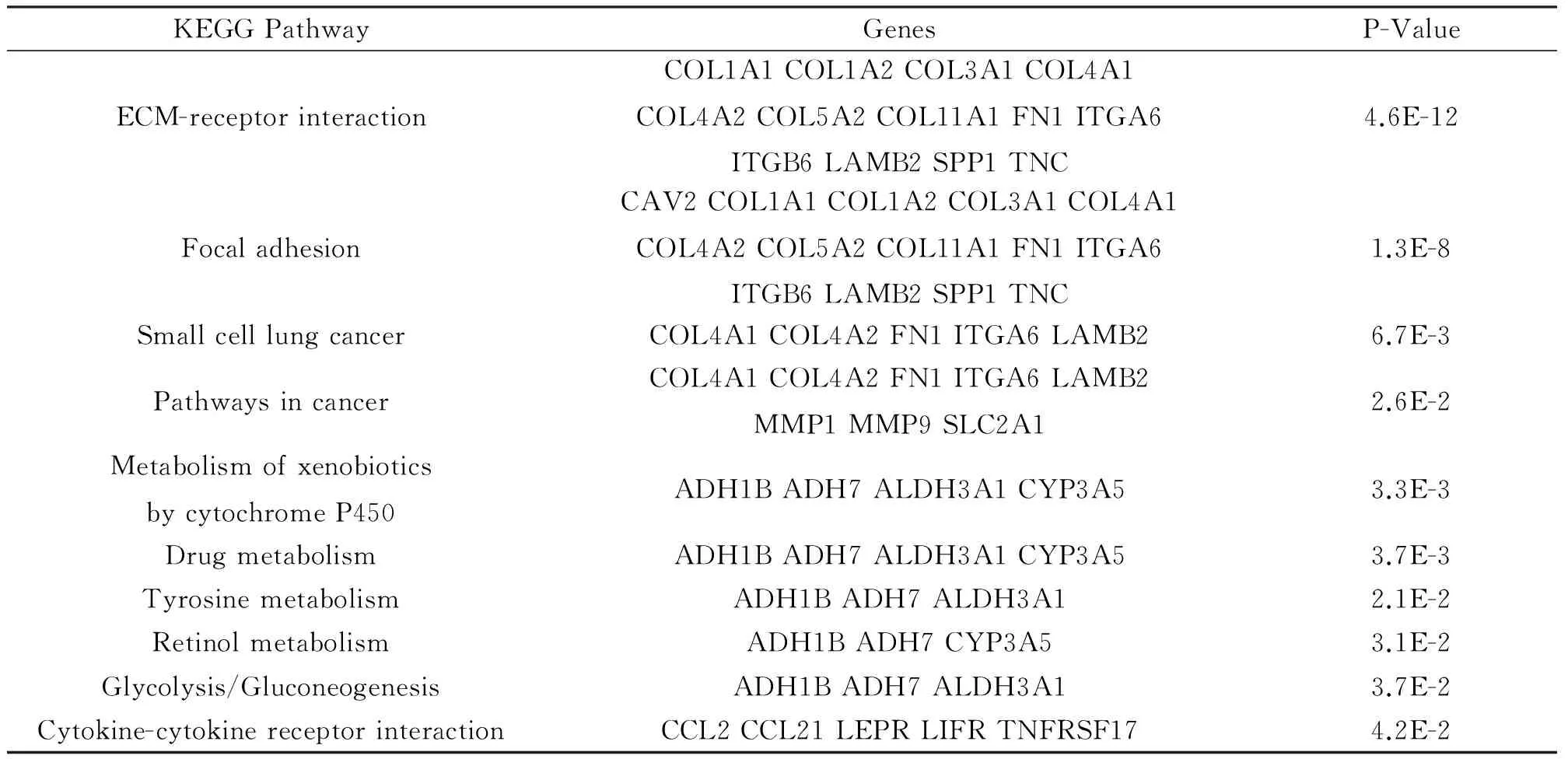
表3 差异表达基因的KEGG通路分析
2.4 共表达分析 使用ToppGene在线工具对差异表达基因进行共表达分析,结果显示这些差异表达基因主要集中在早期人头颈部鳞状细胞癌上调和下调功能基因中(表4)。
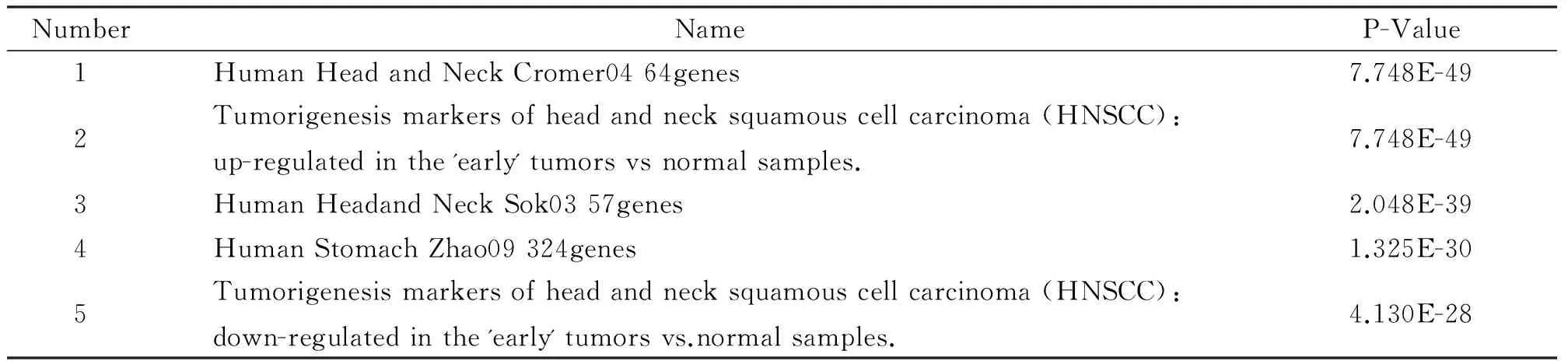
表4 差异表达基因的共表达分析
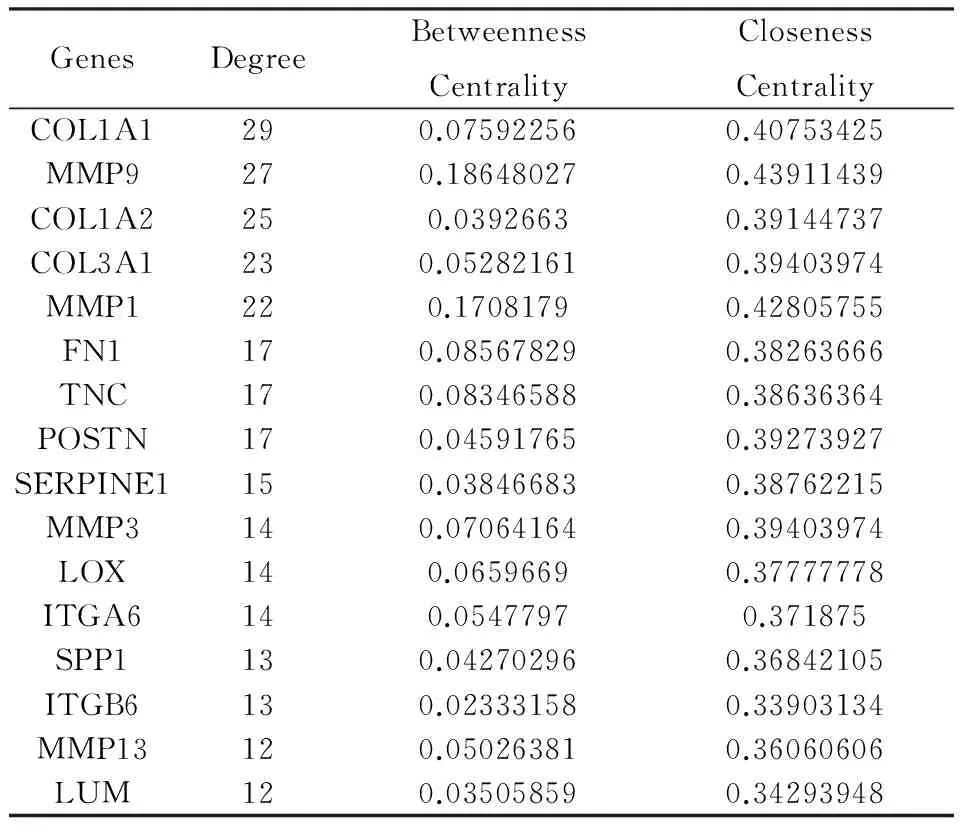
2.5 蛋白互作用图 使用STRING在线软件绘制差异表达基因蛋白质互作用图,可见COL1A1、MMP9、COL1A2、COL3A1等处于中心地位,删除这些关键节点后,蛋白互作用网络结构涣散(图1)。将STRING绘制的蛋白质互作用数据导入Cytoscape软件中,去除连接涣散的部分节点后,利用network analysis计算网络拓扑特性。结果显示互作用网络中共有120个节点,320条边;最小度值为1,最大度值29,平均度值5.333±6.067;平均中介中间性为0.023,平均接近中心性为0.287。按照度值≥均数+1SD,中介中间性≥其平均值,接近中心性≥其平均值筛选核心节点,共筛选出COL1A1、MMP9、COL1A2等16个核心蛋白(图2,表5)。
3 讨论
头颈部肿瘤约占所有恶性肿瘤的3%,其中90%是鳞状细胞癌[4]。目前HNSCC的发病机制仍不清楚,涉及多个基因、多条通路,呈现出复杂的生物学行为。基因芯片由于其高通量、快速检测的特点在基因表达谱分析、基因测序、疾病诊断等方面发挥着重要作用,生物信息学就是通过各种分析处理数据的方法,挖掘基因芯片数据的内在信息。
本研究通过生物信息学方法对基因芯片数据进行挖掘,发现263条差异表达基因,涉及多条作用通路,参与HNSCC的上调和下调。共发现16个关键作用基因,其中关于COL3A1的研究较少,最新一篇发表在PLoS One的研究证实PDGFRβ是口腔鳞状细胞癌新的肿瘤标志物。胶原相关基因COL1A1、COL1A2和COL3A1在口腔鳞状细胞癌相关成纤维细胞中高表达[8]。COL1A1、COL1A2和COL3A1参与细胞外基质受体相互作用通路和黏合斑。研究发现ECM受体相互作用和黏合斑在口腔鳞状细胞癌被显著激活[9]。细胞粘附是二者发挥作用的基础[10],细胞和细胞外基质粘附在肿瘤的发生中起到显著作用[11]。通过细胞粘附细胞与细胞外基质相互作用促进肿瘤的发生发展。ITGA2 是一种I型胶原受体,它通过激活NF-κB配体表达明显抑制细胞粘附,抑制细胞凋亡,促进头颈部鳞状细胞癌发生[12]。NF-κB配体激活诱导HNSCC上皮间质转化和血管生成,与肿瘤分化程度相关[13]。I型胶原可能通过NF-κB促进肿瘤细胞生成。本研究发现FN1涉及细胞外基质受体相互作用、黏合斑、小细胞肺癌、肿瘤通路4条通路。Yen等[14]研究发现FN1可能是评价口腔鳞状细胞癌预后的标志物,其灵敏度/特异性可达80%/84%。FN1能使FAK磷酸化导致VEGF-C高表达,通过下游信号分子活化口腔鳞状细胞癌淋巴结转移[15]。本研究发现COL4A1在HNSCC组织中高表达,Tanaka等[16]研究发现COL4A1的差异表达还与癌细胞侵袭能力相关。Kwon等[17]研究发现上调ITGA6的表达能促进肿瘤细胞增殖、侵袭和集落形成。本研究中,相关基因上调激活细胞外基质受体相互作用等细胞通路,促进肿瘤的发生发展。
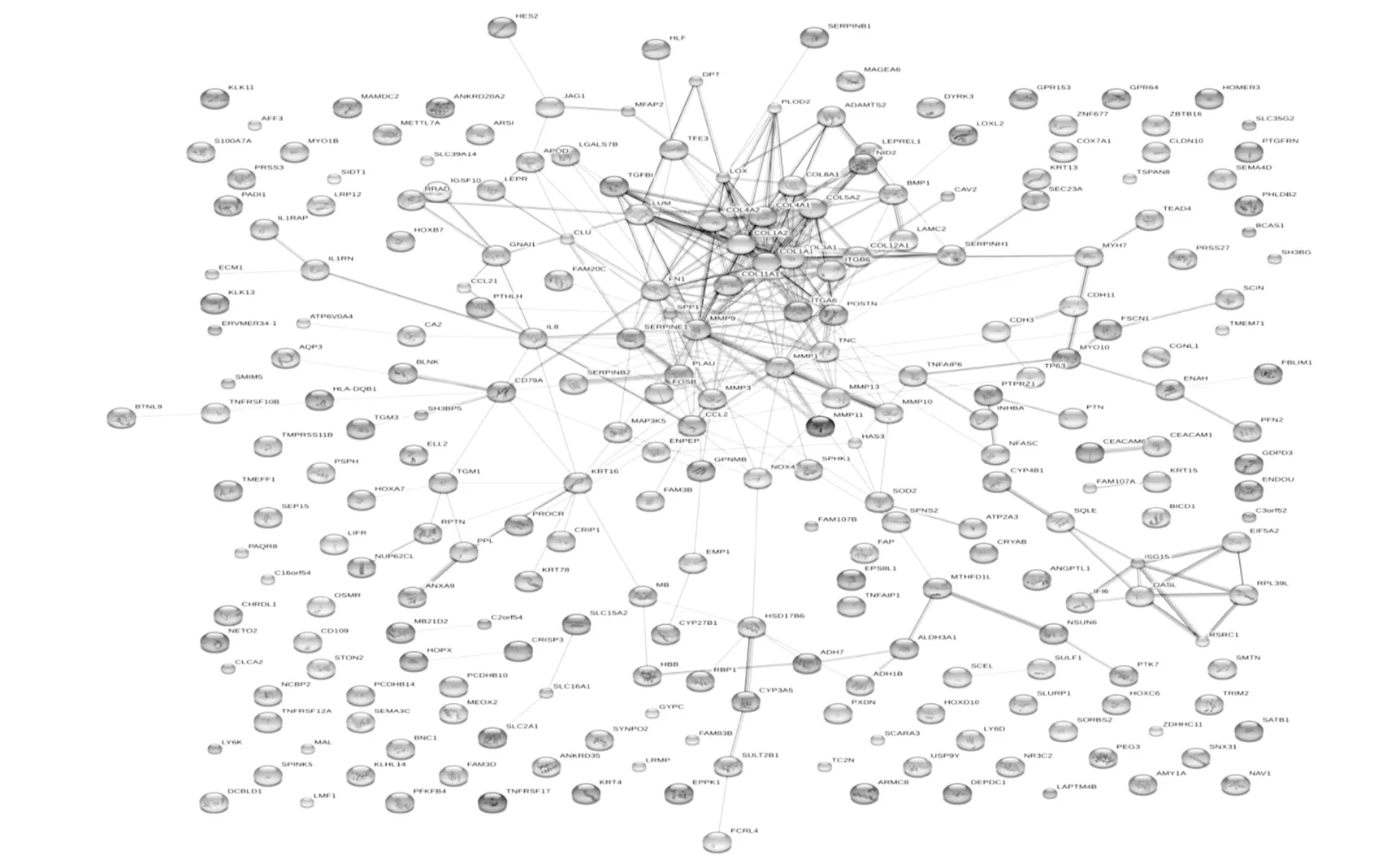
图1 差异表达基因蛋白互作用图

图2 蛋白互作用图中的核心节点
表5 核心蛋白列表
GenesDegreeBetweennessCentralityClosenessCentralityCOL1A1290.075922560.40753425MMP9270.186480270.43911439COL1A2250.03926630.39144737COL3A1230.052821610.39403974MMP1220.17081790.42805755FN1170.085678290.38263666TNC170.083465880.38636364POSTN170.045917650.39273927SERPINE1150.038466830.38762215MMP3140.070641640.39403974LOX140.06596690.37777778ITGA6140.05477970.371875SPP1130.042702960.36842105ITGB6130.023331580.33903134MMP13120.050263810.36060606LUM120.035058590.34293948
本研究中下调基因主要参与细胞因子-细胞因子受体相互作用、细胞色素P450外源性物质代谢、药物代谢等通路,CYP3A5显著富集在细胞色素P450外源性物质代谢、药物代谢通路。Scheer等[18]敲除小鼠CYP3A5基因后发现小鼠肝脏的解毒能力明显下降。烟草影响CYP3A5和谷胱甘肽-S-转移酶活性,导致不同个体头颈部鳞状细胞癌发展的风险,这可能与降低细胞色素P450外源性物质代谢通路和药物代谢通路活性有关[19]。
共表达分析中,所有差异表达基因主要集中在早期头颈部鳞状细胞癌上调或下调基因集中,GO分析发现这些差异表达基因主要分布在细胞外、质膜,主要参与细胞的生长发育过程,这些差异表达基因能促进或抑制HNSCC的增殖、侵袭。因此,探讨HNSCC差异表达基因的作用通路,了解HNSCC发病的分子机制,可为肿瘤诊断与治疗找到一些标志分子。蛋白-蛋白互作用网络中,COL1A1、MMP9、COL1A2占据最核心位置。MMP9可能通过上皮-间质特异性炎症通路介导鳞状细胞癌的侵袭,与高TNM分期相关[20]。MMP9水平与肿瘤临床病理特征相关,但是并不能作为诊断预后的标志物[21]。因此,还需要进一步的研究寻找相关肿瘤标志物。总之,利用生物信息学分析能有效挖掘基因芯片内在数据,为进一步探讨头颈部鳞状细胞癌的发生机制提供理论参考。
[1]Torre LA,Bray F,Siegel RL,et al.Global cancer statistics,2012[J].CA Cancer J Clin,2015,65(2):87.
[2]Siegel RL,Miller KD,Jemal A.Cancer statistics,2015[J].CA Cancer J Clin,2015,65(1):5.
[3]Baxi SS,Pinheiro LC,Patil SM,et al.Causes of death in long-term survivors of head and neck cancer[J].Cancer,2014,120(10):1507.
[4]Rigoni L,Bruhn RF,De Cicco R,et al.Quality of life impairment in patients with head and neck cancer and their caregivers:a comparative study[J].Braz J Otorhinolaryngol,2016,82(6):680.
[5]Marur S,Forastiere AA.Head and Neck Squamous Cell Carcinoma:Update on Epidemiology,Diagnosis,and Treatment[J].Mayo Clin Proc,2016,91(3):386.
[6]Demokan S,Chuang AY,Chang X,et al.Identification of guanine nucleotide-binding protein gamma-7 as an epigenetically silenced gene in head and neck cancer by gene expression profiling[J].Int J Oncol,2013,42(4):1427.
[7]Kuriakose MA,Chen WT,He ZM,et al.Selection and validation of differentially expressed genes in head and neck cancer[J].Cell Mol Life Sci,2004,61(11):1372.
[8]Kartha VK,Stawski L,Han R,et al.PDGFRbeta Is a Novel Marker of Stromal Activation in Oral Squamous Cell Carcinomas[J].PloS one,2016,11(4):e0154645.
[9]He Y,Shao F,Pi W,et al.Largescale Transcriptomics Analysis Suggests Over-Expression of BGH3,MMP9 and PDIA3 in Oral Squamous Cell Carcinoma[J].PloS one,2016,11(1):e0146530.
[10]Gumbiner BM.Cell adhesion:the molecular basis of tissue architecture and morphogenesis[J].Cell,1996,84(3):345.
[11]Tamkun JW,DeSimone DW,Fonda D,et al.Structure of integrin,a glycoprotein involved in the transmembrane linkage between fibronectin and actin[J].Cell,1986,46(2):271.
[12]Yamada T,Tsuda M,Wagatsuma T,et al.Receptor activator of NF-kappaB ligand induces cell adhesion and integrin alpha2 expression via NF-kappaB in head and neck cancers[J].Scientific reports,2016,(23):545.
[13]Yamada T,Tsuda M,Takahashi T,et al.RANKL expression specifically observed in vivo promotes epithelial mesenchymal transition and tumor progression [J].Am J Pathol,2011,178(6):2845.
[14]Yen CY,Huang CY,Hou MF,et al.Evaluating the performance of fibronectin 1 (FN1),integrin alpha4beta1 (ITGA4),syndecan-2 (SDC2),and glycoprotein CD44 as the potential biomarkers of oral squamous cell carcinoma (OSCC) [J].Biomarkers,2013,18(1):63.
[15]Morita Y,Hata K,Nakanishi M,et al.Cellular fibronectin 1 promotes VEGF-C expression,lymphangiogenesis and lymph node metastasis associated with human oral squamous cell carcinoma[J].Clinical & experimental metastasis,2015,32(7):739.
[16]Tanaka K,Iyama K,Kitaoka M,et al.Differential expression of alpha 1(IV),alpha 2(IV),alpha 5(IV) and alpha 6(IV) collagen chains in the basement membrane of basal cell carcinoma[J].Histochem J,1997,29(7):563.
[17]Kwon J,Lee TS,Lee HW,et al.Integrin alpha 6:a novel therapeutic target in esophageal squamous cell carcinoma[J].Int J Oncol,2013,43(5):1523.
[18]Scheer N,McLaughlin LA,Rode A,et al.Deletion of 30 murine cytochrome p450 genes results in viable mice with compromised drug metabolism[J].Drug metabolism and disposition,2014,42(6):1022.
[19]Ali S,El-Rayes BF,Heilbrun LK,et al.Cytochrome p450 and glutathione transferase expression in squamous cell cancer[J].Clinical cancer research,2004,10(13):4412.
[20]Papadas TA,Naxakis SS,Mastronikolis NS,et al.Determination of matrix metalloproteinase 9 (MMP-9) protein expression in laryngeal squamous cell carcinomas based on digital image analysis[J].J BUON,2013,18(4):977.
[21]Kalfert D,Ludvikova M,Topolcan O,et al.Analysis of preoperative serum levels of MMP1,-2,and -9 in patients with site-specific head and neck squamous cell cancer[J].Anticancer research,2014,34(12):7431.
Bioinformatics analysis of head and neck squamous cell carcinoma
XIANGLin,GONGMei-heng,WANGPing,etal.
(DepartmentofOtorhinolaryngologyHeadandNeckSurgery,TheFirstHospitalofJinlinUniversity,Changchun130021,China)
Objective To investigate the mechanism of head and neck squamous cell carcinoma (HNSCC) from the gene and molecular level.Methods Download HNSCC related genes microarray data from GEO database,Screening differentially expressed genes using BRB-Array Tools software.Bioinformatics analysis was carried out using DAVID,ToppGene,STRING and Cytoscape tools.Results Two hundred and sixty-three differentially expressed genes,134 up-regulated and 129 down-regulated,were screened out by BRB.The COL1A1,MMP9,COL1A2,COL3A1,MMP1 gene,etc regulated ECM-receptor interaction,small cell lung cancer and pathways in cancer.Conclusion The use of bioinformatics to analyze microarray data can provide theoretical reference for in order to further explore the mechanism of HNSCC.
head and neck squamous cell carcinoma;differentially expressed genes;gene chip;bioinformatics
国家自然科学基金子课题(81372900)
1007-4287(2017)03-0381-05
R739.91
A
2016-12-23)
*通讯作者
