不同剂量阿托伐他汀治疗慢性硬膜下血肿研究
2017-03-31杨晓清曾上飞王朝晖
杨晓清 曾上飞 王朝晖
[摘要] 目的 观察不同剂量阿托伐他汀治疗慢性硬膜下血肿的作用。 方法 選择2015年1月~2016年3月瑞安市人民医院住院或门诊治疗的40例慢性硬膜下血肿患者,均经头颅CT检查确诊,随机将患者分为实验组A 15例,实验组B 15例,对照组10例,实验组A给予10 mg阿托伐他汀口服3个月,实验组B给予20 mg阿托伐他汀口服3个月,对照组未给予阿托伐他汀。治疗结束后,比较三组患者1个月后、2个月后、3个月后头颅CT变化及临床症状变化。 结果 30例实验组中有效25例,无效5例,其中2例因临床症状加重改用手术治疗,1例因药物不良反应停药治疗,实验组各组之间临床疗效无明显差异。10例对照组中无效8例,其中6例手术治疗。 结论 不同剂量阿托伐他汀保守治疗慢性硬膜下血肿安全有效。
[关键词] 慢性硬膜下血肿;阿托伐他汀;剂量; 药物治疗;保守治疗
[中图分类号] R651.15 [文献标识码] B [文章编号] 1673-9701(2017)01-0080-04
慢性硬膜下血肿(chronic subdural haematoma,CSDH)是神经外科常见的一种疾病,好发于老年颅脑创伤史患者,约占颅内血肿10%[1]。随着中国老龄化的逐渐进展,CSDH已经严重影响老年人身体健康与生活质量。目前对于治疗CSDH,外科治疗方式有钻孔引流术、骨窗开颅血肿清除术、微创穿刺术等,虽然各种方法尤其是钻孔引流术能够取得不错的疗效,但是对于高龄患者,术后仍有较多并发症,且术后仍有一部分患者复发,复发率2.3%~33.9%[2],需要再次手术治疗,难以根除。因此CSDH 的药物治疗逐渐受到关注。
他汀类药物目前被广泛应用于临床各科室中,除了有明确降血脂作用之外[3],还有抑制炎症反应、促进颅脑损伤后血管生成的作用。国内文献发现他汀类药物治疗慢性硬膜下血肿可以有效地改善患者临床症状,提高患者的生活质量,降低并发症与复发的风险[4,5]。但是大小剂量的区分尚未统一。本文选择2015年1月~2016年3月瑞安市人民医院住院或门诊治疗的40例慢性硬膜下血肿患者,其中30例给予不同剂量阿托伐他汀,取得良好的临床效果,现报道如下。
1资料与方法
1.1一般资料
选取2015年1月~2016年3月就诊瑞安市人民医院的慢性硬膜下血肿患者40例。影像学检查:全组病例均行头颅CT平扫或增强检查确诊。纳入标准:(1)18~80岁,性别不限,确诊为慢性硬膜下血肿的Markwalder's分级为0~Ⅱ级患者;(2)CT检查明确病变位于幕上的单侧或双侧CSDH患者,以主治医生判断短时间内不会发生脑疝,无立即手术处理必要,而实施保守治疗的CSDH患者。排除标准:(1)已知对本研究药物成分过敏及有他汀类药物过敏史患者;(2)随时可能发生脑疝;(3)血肿引起脑疝或者高度怀疑引起脑疝,非外科手术不能排除危险者;(4)肝功能异常;(5)凝血功能障碍;(6)有长期口服他汀史的患者。
本研究组患者中男23例,女17例;年龄24~78岁,平均(67.5±6.9)岁。双侧血肿8例,单侧32例,明确颅脑外伤史31例,颅脑外伤史不详5例,明确无颅脑外伤史4例。在头颅CT平扫或增强图像上,依据多田公式计算慢性硬膜下血肿量,血肿量9~41 mL,平均血肿量(25.0±3.9)mL。所有患者均获得医院伦理委员会批准并签订知情同意书,随机将患者分为实验组A 15例,A组男8例,女7例,平均年龄(66.8±6.7)岁,实验组B 15例,男9例,女6例,平均年龄(67.3±7.1)岁,对照组10例,A男6例,女4例,平均年龄(66.2±6.5)岁。三组对象年龄、性别等一般资料无显著差异(P>0.05),具有可比性。
1.2 方法
1.2.1治疗方法 所有患者入院后均行凝血功能、肝肾功能等检查进行综合评估后,实验组A给予10 mg阿托伐他汀(立普妥,20 mg/粒,国药准字J20070061)qn连续口服3个月;实验组B给予20 mg阿托伐他汀qn连续口服3个月;对照组未给予阿托伐他汀口服。分别于用药1个月后、2个月后、3个月后进行临床神经症状和体征评价,同时进行头颅CT平扫,必要时行头颅CT增强。口服药物治疗期间,如果疾病进展,随时中断实验,进行手术治疗,如复查CT提示颅内血肿基本吸收(血肿量小于5 mL)或消失,临床症状明显好转,则停止服药;停药后条件许可门诊继续随访3个月。
1.2.2 治疗效果判定 治疗效果分为有效和无效。有效指CT扫描上血肿量吸收和(或)临床症状明显好转,甚至痊愈。临床症状评定指治疗结束后日常生活自理能力Barthel指数评分(ADL-BI指数评分)。无效:CT扫描上血肿量变化不大(服用3个月),或临床症状加重,或药物严重不良反应等原因不能继续口服药物治疗。
CT血肿量变化(血肿量计算方式:按照多田公式计算血肿量)。无效:治疗结束后影像学检查时,发现血肿减少少于50%(包括50%),或者治疗过程中发现临床神经症状与体征加重合并或不合并血肿持续扩大,需要手术;有效:良好效果:血肿较治疗前减少51%~89%者;显著疗效:血肿较治疗前减少≥90%者;痊愈:血肿完全消失。
1.3统计学分析
数据分析用SPSS17.0软件包处理,计量资料以均数±标准差(x±s)表示,组间两两比较采用t检验,三组间比较用单因素方差分析,以α=0.05作为检验水准,P<0.05为差异有统计学意义。
2 结果
2.1 随访结果
本实验40例患者,对照组10例患者中2例未见血肿增多或者临床症状恶化,8例患者出现血肿增多或者临床症状恶化,为无效,其中6例手术治疗。实验组有效25例,无效5例,实验A组:有效12例(80.0%),无效3例(20.0%),1例(6.7%)因临床症状加重改用手术治疗;实验B组:有效13例(86.7%),无效2例(13.3%),1例(6.7%)因临床症状加重改用手术治疗,1例(6.7%)患者因药物治疗后严重肝功能损害(阿托伐他汀不良反应)停药。
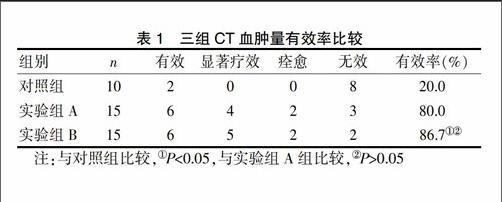
2.2 三组CT血肿量有效率比较
实验组A、B患者CT血肿量吸收变化均明显高于对照组,差异有统计学意义(P<0.05),实验组A及B组间差异比较无统计学意义。见表1。
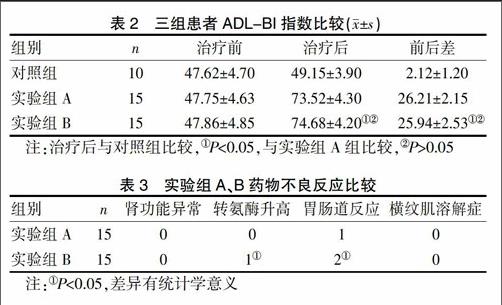
2.3三组患者ADL-BI指数比较
治疗前,三组间ADL-BI指数差异无统计学意义(P>0.05),治疗后实验组A、B的ADL-BI指数明显上升,与对照组相比,差异有统计学意义(P<0.05),实验组A和B之间差异无统计学意义(P>0.05),见表2。
2.4 实验组A、B药物不良反应比较
两组药物转氨酶升高、胃肠道反应比较差异有统计学意义(P<0.05)。见表3。
3讨论
CSDH好发于老年患者,一般有明确的创伤病史,创伤程度一般较轻,有少部分患者往往缺乏明确的头部外伤史。由于初期临床症状不明显,仅表现为轻微头痛,头部不适,而大多数患者没有及时就诊,等到来院就诊时往往病情有所加重,颅内血肿较多,临床症状较重[6],常表现为呕吐、头晕、进行性痴呆、记忆力下降、肢体偏瘫等,严重影响患者身体健康和预后。CSDH发病机制可能是由于老年人脑萎缩致蛛网膜下腔扩大形成空隙,脑脊液通过裂隙积聚在硬脑膜下腔。外伤致桥静脉破裂出血,引起硬膜下血肿凝血机制异常,从而导致硬膜下腔血肿不断渗漏、增多[7]。
目前慢性硬膜下血肿首选钻孔引流手术[8],而文献报道手术死亡率1.5%~8.0%,复发率2.3%~33.9%[2,9]。临床发现部分高龄患者,临床症状表现不明显,预计短期内并无急性脑疝表现,甚至因为医患方面原因无法行手术治疗的患者,可以根据患者要求,采取保守治疗,采用非手术方法,尤其应用药物进行保守治疗,同时必须密切观察临床症状变化,及时行动态影像学观察。
临床有必要通过对慢性硬膜下血肿发病机制研究,探讨药物治疗成功可能性。近期有研究发现慢性硬膜下血肿是一种局限性炎症反应,表现为慢性硬膜下血肿腔内的各种促炎因子以及炎症因子水平大幅度升高[10-13]。CSDH患者局部硬膜下血肿液中血管内皮生长因子VEGF(vascular endothelial growth factor)含量明显增高,是血清中的几十甚至上百倍[14,15]。
眾所周知,VEGF是最重要的血管生成因子及内皮细胞特异性有丝分裂原,在血管内皮细胞增殖中发挥重要作用,一方面能够促进血管形成和增加血管通透性,另一方面去抑制血管成熟,致使血肿包膜新生血管不成熟,容易造成再次出血,解释为什么临床中慢性硬膜下血肿很难自行吸收、消退,往往需要通过药物或者手术进行干预,才能促进血肿吸收或者引流。
阿托伐他汀属于3-羟基-3-甲基二酰辅酶A还原酶抑制剂,在胆固醇合成途径中,通过减少肝脏对胆固醇的合成,增加肝细胞表面低密度脂蛋白受体活性,从而发挥调脂作用。在心血管系统已广泛应用,有很好的安全性和疗效性[16]。
最近的研究表明,他汀类药物具有抗炎、抗氧化应激、改善内皮功能紊乱的作用[17,18]。Tu Q等[19]研究发现在脑缺血再灌注动物模型中脑组织炎症相关指标E-选择素和过氧化物酶上调,氧化应激标记物脂质过氧化物和SOD活性在脑组织中下调,而应用阿托伐他汀有效抑制了这种病理变化,因此推测阿托伐他汀通过抗炎和抗氧化应激在脑缺血再灌注损伤中发挥脑保护作用。
基于前面研究,国内外多名学者报道,应用阿托伐他汀类药物治疗慢性硬膜下血肿取得了一定的疗效[20],但具体剂量尚未统一。国内前期已有学者Wang D等[21]应用20 mg阿托伐他汀治疗23例CSDH 的治疗研究,绝大部分患者症状完全改善,血肿消失。阿托伐他汀发挥抗炎作用剂量10~80 mg/d,但未进行阿托伐他汀10 mg研究。国外Parlato C等[22]报道了保守治疗24例慢性硬膜下血肿,其中19例(79.2%)无效,说明该病自愈率偏低,需要进行药物或者手术干预,这与本组对照组实验研究结果基本相符。
本实验组中有30例应用阿托伐他汀保守治疗慢性硬膜下血肿,其中有效25例(83.3%),无效5例(16.7%),大部分患者临床症状改善明显,影像学检查提示血肿消失或者大部分吸收,取得了良好的疗效,可以证明应用阿托伐他汀治疗慢性硬膜下血肿是有效而且安全的。
通过与手术治疗相比,药物保守治疗总体费用低,但是其治疗周期相对较长,因此需密切关注阿托伐他汀药物不良反应,在临床上偶有报道常规剂量阿托伐他汀出现严重副作用。常见药物副作用表现为肝功能异常,转氨酶增高,严重且少见并发症横纹肌溶解综合征,目前,他汀类药物引起肝酶异常的原因尚无定论,多数认为肝酶升高可能由于肝内脂质下降引起,属阿托伐他汀药动学效应,与药物剂量相关,在老年患者中表现的尤为明显。
本组研究中有1例老年患者服用阿托伐他汀20 mg后出现肝功能损害,谷丙转氨酶明显升高,经停药,积极护肝降酶治疗后好转,而小剂量阿托伐他汀10 mg口服,并无一例出现明显药物不良反应,说明小剂量阿托伐他汀耐受性更好,药物不良反应较小。本组研究小剂量阿托伐他汀10 mg与20 mg治疗慢性硬膜下血肿,相比剂量减少,费用减少,副作用明显减少,并没有出现严重肝功能异常,血肿吸收和临床效果并没有显著性差异。对于高龄患者,应注意定期监测肝功能,及时调整药物或停药。
综上所述,随着我国老年化逐渐提高,对于不愿手术或者不能耐受手术高龄患者,小剂量阿托伐他汀治疗CSDH是安全有效的,小剂量阿托伐他汀临床症状改善明显,且药物副作用降低,能使高龄患者获益,值得临床上进一步推广和应用。
[参考文献]
[1] Tsai TH,Lieu AS,Hwang SL,et al. A comparative study of the patients with bilateral or unilateral chronic subdural hematoma:Precipitating factors and postoperative outcomes[J]. Journal of Trauma,2010,68(3):571-575.
[2] 马成鑫,秦尚振. 慢性硬膜下血肿的研究进展[J]. 中国临床神经外科杂志,2014,19(8):507-509.
[3] 金有豫. 他汀类调脂药的药理学基础[J]. 临床药物治疗杂志,2005,3(3):1-4.
[4] 肖爵贤,程世奇,邹轶群,等. 阿托伐他汀治疗慢性硬膜下血肿的疗效分析[J]. 临床外科杂志,2015,(2):159-160.
[5] 刘东华,吴亮,张庆华. 阿托伐他汀治疗老年慢性硬膜下血肿的效果分析[J]. 宁夏医学杂志,2015,37(12):1123-1125.
[6] Sundstr?觟m N,Djerf L,Olivecrona Z,et al. Postural stability in patients with chronic subdural hematoma[J]. Acta Neurochirurgica,2016,158(8):1479-1485.
[7] Kurokawa Y,Ishizaki E,Inaba K. Bilateral chronic subdural hematoma cases showing rapid and progressive aggravation[J]. Surg Neurol,2005,64(5):444-449.
[8] 肖益安,罗湘辉,何佳宏,等. 慢性硬膜下血肿钻孔冲洗引流术疗效分析[J]. 中国现代医生,2013,51(9):150-151.
[9] Weigel R,Schlickum L,Weisser G,et al. Treatment concept of chronic subdural haematoma according to an algorithm using evidence-based medicine-derived key factors:A prospective controlled study[J]. British Journal of Neurosurgery,2015,29(4):538-543.
[10] Wada T,Kuroda K,Yoshida Y,et al. Local elevation of the anti-inflammatory interleukin-10 in the pathogenesis of chronic subdural hematoma[J]. Neurosurg Rev,2006, 29(3):242-245.
[11] Stanisic M,Lyngstadaas SP,Pripp AH,et al. Chemokines as markers of local inflammation and angiogenesis in patients with chronic subdural hematoma:A prospective study[J]. Acta Neurochirurgica,2012,154(1):113-120.
[12] Hong HJ,Kim YJ,Yi HJ,et al. Role of angiogenic growth factors and inflammatory cytokine on recurrence of chronic subdural hematoma[J]. Surgical Neurology,2009, 71(2):165-166.
[13] Pripp AH,Stani?觢i■ M. The correlation between pro-and anti-inflammatory cytokines in chronic subdural hema-toma patients assessed with factor analysis[J]. Plos One,2014,9(2):e90149.
[14] 華杰,傅小君,许信龙,等. VEGF、纤维蛋白原及D-二聚体在慢性硬膜下血肿中的作用及临床意义[J]. 浙江创伤外科,2012,17(4):433-435.
[15] 程玉,蔺友志,李国忠,等. VEGF 在慢性硬膜下血肿液及其外膜中的表达[J]. 中华神经外科疾病研究杂志,2007,6(5):420-423.
[16] 孙宇,阚志生. 慢性硬膜下血肿术后死亡的危险因素分析[J]. 中华神经外科疾病研究杂志,2014,13(6):531-535.
[17] Wood WG,M ller WE,Eckert GP. Statins and neuroprotection:Basic pharmacology needed[J]. Mol Neurobiol,2014,50(1):214-220.
[18] Zheng X,Chopp M,Lu Y,et al. Atorvastatin reduces functional deficits caused by photodynamic therapy in rats[J]. International Journal of Oncology,2011,39(39):1133-1141.
[19] Tu Q,Cao H,Zhong W,et al. Atorvastatin protects against cerebral ischemia reperfusion injury through anti-inflammatory and antioxidant effects[J]. Neural Rege Res,2014, 9(3):268-275.
[20] Thotakura AK,Marabathina NR. Nonsurgical treatment of chronic subdural hematoma with steroids[J]. World Neurosurgery,2015,84(6):1968-1972.
[21] Wang D,Li T,Tian Y,et al. Effects of atorvastatin on chronic subdural hematoma:A preliminary report from three medical centers[J]. J Neurol Sci,2014,336(1-2):23-24.
[22] Parlato C,Guarracino A,Moraci A. Spontaneous resolution of chronic subdural hematoma[J]. Surgical Neurology,2000,53(4):315-317.
(收稿日期:2016-10-27)
