Wnt7a在红藻氨酸致痫大鼠颞叶癫痫形成过程中的变化
2017-03-30邱文娟徐向平
邱文娟 徐向平
癫痫(epilepsy)是儿科神经系统常见疾病,其中近30%的患者通过规范的药物治疗不能有效控制发作,成为难治性癫痫,颞叶癫痫(temporal lobe epilepsy, TLE)是难治性癫痫的最常见类型[1]。海马是与颞叶癫痫形成密切相关的脑区,有研究提示海马与神经发生有关,越来越多的证据显示,成年海马在生理或病理状态下都存在着神经发生过程[2]。
Wnts是一组分泌性糖蛋白,它们参与调节神经发育,被认为是干细胞生物学主要的生理调节因子[3]。Wnt蛋白介导的Wnt信号通路对海马神经发生起着重要作用,它调控着神经干细胞(neural stem cells, NSCs)早期增殖和晚期成熟分化等重要的发育过程,阻断Wnt信号通路可以消除齿状回海马神经发生[4]。在调控海马神经发生的众多Wnt蛋白中,Wnt7a能通过Wnt信号通路调节NSCs增殖分化、促进神经前体细胞成熟,还能调节海马神经元突触囊泡周期和突触传导[5],但其调控海马神经发生的确切机制尚不清楚。为明确Wnt7a是否调控颞叶癫痫大鼠的海马神经发生,参与颞叶癫痫的形成,本文将利用KA点燃颞叶癫痫动物模型模拟颞叶癫痫的形成过程,并检测不同时期Wnt7a mRNA和蛋白的表达。
材料和方法
一、材料
1.实验动物分组:实验动物按观察处理时间分为KA点燃1周组、4周组和8周组,每个时间点分为两组,即红藻氨酸(KA)组和生理盐水NS对照组,每组动物各6只。
2.红藻氨酸点燃癫痫模型的制备:生后30 d的雄性SD大鼠(哈尔滨医科大学附属第二医院动物室提供),体重85~100 g,按12 mg/kg体重皮下注射KA(生产单位:Sigma公司,),此剂量足以诱发动物出现癫痫持续状态以及自发性再发抽搐[6]。在KA点燃后60 min可出现Racine描述的不同等级的癫痫行为[7],本研究所有动物均出现Racine描述的Ⅳ以上癫痫行为,说明癫痫模型制备成功。对照组动物皮下注射相同剂量的生理盐水。
3.实验动物处理:各实验组动物处理当日均正常进食水,各组动物分别在相应的观察处理时间结束时,经10%的水合氯醛按400 mg/kg腹腔注射麻醉,断头取脑,快速分离双侧海马,迅速放入液氮中, 后转入-80℃冰箱备用。
二、方法
1. Real-time PCR检测Wnt7a mRNA:利用Trizol法提取各组动物海马组织总RNA,采用紫外分光光度计根据260/280比值测RNA浓度和纯度。采用cDNA反转录试剂盒(RocketScript RT Premix; Bioneer; South Korea),进行cDNA反转录,实验操作按产品说明书进行。采用扩增试剂盒进行PCR扩增,以β-actin作内参。扩增程序包括95℃10 min,95℃ 20sec×40个循环,55℃退火和延伸1 min,预期获得1 078bp片段。引物序列(博仕生物公司)如下,即
Wnt7a上游5′- CTCAAGCTTCGAATTCGCCACC ATGACCCGGAAAGCGCG-3′
下游5′- CCATGGTGGCGAATTCCTTGCACGTA TACATCTCTGTGC-3′
β-actin:上游 5′-TGGAATCCTGTGGCATCCATG AAAC-3′
下游5′-TAAAACGCAGCTCAGTAACAGTC CG-3′
采用2-△△CT法对数据进行定量分析。
2.Western blot检测 Wnt7a 蛋白:预冷RIPA蛋白抽提试剂(中国海门市碧云天生物技术研究所),加入蛋白酶抑制剂提取海马组织蛋白,采用BCA法进行蛋白定量,将蛋白终浓度调整为4 mg/ml。根据目的蛋白的分子量,配制12%的分离胶,浓缩胶浓度为5%,待检测蛋白以20 微克/孔进行电泳,用湿转法转移到NC膜上,将膜完全浸没3%BSA-TBST中室温轻摇30 min封闭。用3%BSA-TBST稀释一抗(兔多克隆抗体,1:500,美国santa cruz公司),室温孵育10 min,放4℃过夜。第二天把膜放在室温孵育30 min,TBST洗膜5次,每次3 min。用5%脱脂奶粉-TBST稀释二抗(山羊抗兔第二抗体,1:10000,北京天德悦生物科技有限责任公司),室温轻摇 40 min,TBST洗膜6次,每次3 min。ECL(美国Millipore公司)加到膜上后反应3~5 min,胶片曝光20 s,显影2 min,定影30 s,冲洗胶片。用Quantity One 软件4.6.2版本(美国Bio-Rad)对各反应条带进行数据分析,并用β-actin作内参将数据标准化。
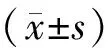
结 果
一、Wnt7a mRNA 在颞叶癫痫形成中的时间变化过程
研究结果显示KA致痫后在颞叶癫痫形成过程中,各时期KA组动物海马组织Wnt7a mRNA的表达同相应时期NS组相比,在急性期显著下降,在自发性反复癫痫形成初期增高且差异有显著性,在慢性癫痫稳定形成期增高,两组同时期差异均有统计学意义。KA组各时期的动物海马组织Wnt7a mRNA的表达相比较,癫痫形成初期及慢性期均较急性期显著增高,差异有统计学意义;慢性期较癫痫形成初期增高但差异无统计学意义。见表1、图1。

表1 大鼠海马组织Wnt7a mRNA在癫痫形成过程中的表达
注:与相应时期NS组相比,*P<0.05

图1 大鼠海马组织Wnt7a mRNA在癫痫形成过程中的表达及比较
二、Wnt 7a 蛋白在颞叶癫痫形成中的时间变化过程
KA致痫后在颞叶癫痫形成过程中,大鼠海马组织中Wnt7a 蛋白的表达(见图2)无论在时间上还是在组别间差异均无统计学意义。见表2、图3。

图2 Western blot检测Wnt7a 蛋白的表达

组别急性期1周例数自发性反复癫痫形成初期4周例数慢性癫痫稳定形成期8周例数NS0 066±0 04060 071±0 02460 099±0 0256KA0 053±0 02660 095±0 02560 083±0 0346

图3 大鼠海马组织Wnt7a 蛋白在癫痫形成过程中的表达
讨 论
癫痫是儿科神经系统的常见疾病之一,是一种以脑神经元异常放电引起反复痫性发作为特征的慢性短暂的脑功能失调综合征,有近30%的患者通过规范的药物治疗仍不能有效控制发作,成为难治性癫痫。颞叶癫痫是难治性癫痫的最常见类型,目前癫痫发病的确切机制尚不清楚。海马作为与颞叶癫痫形成密切相关的脑区,越来越多的证据显示,成年海马在生理或病理状态下(如中风、癫痫发作等)都存在着神经发生过程。从结构上,海马可分为海马回和齿状回(dentate gyrus,DG)两部分,其中海马回包括CA1、CA2和CA3,主要由一些锥体细胞组成,而齿状回主要由颗粒细胞组成。成年海马的神经发生主要位于齿状回,齿状回的颗粒下层细胞(subgranular zone, SGZ)产生新神经元的前体细胞,大部分迁移到颗粒细胞层,分化为颗粒细胞[8],产生轴突、树突,其发出的树突进入海马的分子层,轴突则成为苔藓纤维通路的一部分,与CA3区靶神经元的树突形成功能性突触联系,整合到海马功能的神经环路中[9]。癫痫动物海马病理改变主要指海马CA1、CA3区锥体细胞和海马门的中间神经元的死亡(或称为缺失)以及胶质细胞增生和苔藓纤维发芽。致痫性损害在导致齿状回门区神经元死亡后,苔藓纤维末梢会出现发芽,芽生侧枝会回返性进入颗粒细胞层支配颗粒细胞,形成可产生自发性动作电位的异常通路,这种异常通路与慢性癫痫动物模型的自发性癫痫发作有关[8]。研究发现[10],在颞叶癫痫形成的急性期,海马神经发生增加。当进入慢性期,动物出现大量自发性惊厥时,海马神经发生则显著下降,而且动物出现自发性惊厥的频率与海马神经发生的程度成反比。因此,阻止急性癫痫发作引起的异常海马神经发生,有望阻止慢性癫痫的形成,但是颞叶癫痫形成过程中海马神经发生的的分子调控机制尚未明确[11]。
Wnts是由一组分泌性糖蛋白组成的大家族,Wnt信号通路是发育过程中高度保守的信号通路[12]。Wnt蛋白通过自分泌或旁分泌作用与位于细胞膜上的受体相结合,激活胞内的各级信号传导分子,调节靶基因的表达,在胚胎发育过程中对细胞的增殖、分化、极性、迁徙和凋亡均起到重要的作用[13]。目前,大量研究证实Wnt信号分子参与海马神经发生的调控,阻断Wnt信号通路可以消除齿状回海马神经发生。人Wnt7a基因定位于染色体3p25,其编码的Wnt7a蛋白是Wnt蛋白家族中最小的,人和鼠来源的Wnt7a含有349个氨基酸,它们约98%的氨基酸相同,在胎脑、成人脑、胎肺、子宫、睾丸、肾、胎盘均可检测到Wnt7a的表达[14]。Wnt7a除通过Wnt信号通路调节NSCs增殖分化、促进神经前体细胞的成熟以外,还可调节海马神经元突触囊泡周期和突触传递。
红藻氨酸点燃颞叶癫痫动物模型是目前国际公认的颞叶癫痫动物模型,在癫痫的产生、扩散以及痫样放电所致的病理损伤等研究领域中发挥着重要作用。红藻氨酸是从海草中分离出的一种化学物质,它是活性极强的谷氨酸类似物,具有强烈的兴奋作用。静脉或皮下注射KA建立癫痫动物模型后,根据动物癫痫行为按Racine分级法进行分级,即0级:正常行为;Ⅰ级:面部肌肉痉挛表现为咀嚼运动、眨眼、动须等,湿狗样颤动(wet dogshaked);Ⅱ级:颈部肌肉痉挛表现为点头运动;Ⅲ级:一侧前肢阵挛;Ⅳ级:站立伴双前肢阵挛;Ⅴ级:在四级的基础上身体向后倒下失去平衡,四肢抽动。
本研究结果显示在KA点燃颞叶癫痫形成过程中,急性期KA组动物海马组织Wnt7a mRNA的表达同NS对照组相比显著下降,这可能与KA致痫后1周海马组织细胞坏死,导致海马神经元大量缺失有关[15]。针对KA致痫颞叶癫痫模型的研究发现,注射KA6 h之后,注射KA侧海马CA1、CA3区及海马门区神经元会出现变性及坏死,且以CA3区最为显著[16]。在自发性反复癫痫形成初期,KA组Wnt7a mRNA在海马组织中的表达较NS组增高且差异显著,而且较急性期KA组升高且差异有统计学意义。这与致痫的急性触发因素造成神经元损伤后,海马神经发生增加有关[8,17]。Wnt7a作为影响神经发生的调节因素,它表达的增加可能是为了促进海马神经发生。也有研究显示,正常大鼠的神经发生有年龄依赖性,随日龄增加,齿状回颗粒细胞增生逐渐减慢,反复性癫痫发作对大鼠不同时期影响不同,会导致大鼠早期神经发生减少,而后期神经发生增加[18]。
当慢性癫痫稳定形成后,动物出现大量反复自发性惊厥,海马神经发生则显著下降,针对颞叶癫痫患者海马组织的研究发现,进入慢性期海马神经发生明显降低[19],这与KA点燃颞叶癫痫动物模型的海马病理学变化相符。虽然关于颞叶癫痫慢性期海马神经发生减低的确切机制尚不清楚,但有研究表明,神经发生减低与新生细胞的神经分化能力显著降低有关[20]。本实验研究结果显示,在慢性癫痫稳定形成期KA组Wnt7a mRNA的表达较急性期显著增高,较慢性癫痫形成初期增高但差异无统计学意义。反复的痫性发作必然会导致海马神经元的损伤,海马神经发生能力可以持续终生,所以神经元损伤后神经发生必然存在,而Wnt7a作为调控海马神经发生的信号分子也可能持续增加,或者可能通过负反馈机制增加。
本研究同时检测KA致痫后大鼠海马组织中Wnt7a蛋白的表达,结果显示在癫痫形成的不同阶段KA组与NS组及KA各组之间比较,差异均无统计学意义。但从Wnt7a蛋白的变化趋势上来看,在急性期KA组较NS组表达下降,可能和急性期海马神经细胞破坏有关。在自发性反复癫痫形成初期,KA组Wnt7a蛋白的表达较急性期增高,且高于NS组,可能跟海马神经发生增加有关。Wnt7a蛋白的前两期变化趋势与Wnt7a mRNA相同,但无统计学意义,这与蛋白的表达滞后于mRNA表达有关,同时提示可以增加Wnt7a蛋白检测的时间窗,如在KA致痫后2周和6周检测Wnt7a蛋白的表达,可能更有利于阐述Wnt7a与海马神经发生的关系。在癫痫稳定形成期,Wnt7a蛋白的表达下降,与Wnt7a mRNA的变化趋势相反,这可能与慢性癫痫稳定形成后海马硬化,神经元变性、有活性的神经元数量减少有关,有待今后进一步研究。
1 Panchin Y,Kelmanson I,Matz M,et al.A ubiquitous family of putative gap junction molecules.Curr Biol,2000,10:R473-474.
2 Ming GL.Adult neurogenesis in the mammalian brain:significant answers and significant questions.Neuron,2011,70:687-702.
3 Michaelidis TM,Lie DC.Wnt signaling and neural stem cells:caught in the Wnt web.Cell Tissue Res,2008,331:193-210.
4 Inestrosa NC,Varela-Nallar L.Wnt signaling in neuronal differentiation and development.Cell Tissue Res,2015,359:215-223.
5 Yoneyama M,Fujita T.Function of RIG-I-like receptors in antiviral innate immunity.J Biol Chem,2007,282:15315-15318.
6 Stafstrom CE,Chronopoulos A,Thurber S,et al.Age-dependent cognitive and behavioral deficits after kainic acid seizures.Epilepsia,1993,34:420-432.
7 Racine RJ.Modification of seizure activity by electrical stimulation.II.Motor seizure.Electroencephalogr Clin Neurophysiol,1972,32:281-294.
8 Siebzehnrubl FA.Neurogenesis in the human hippocampus and its relevance to temporal lobe epilepsies.Epilepsia,2008,49:55-65.
9 Toni N,Teng EM,Bushong EA.Synapse formation on neurons born in the adult hippocampus.Nat Neurosci,2007,10:727-734.
10 Hattiangady B,Rao MS,Shetty AK.Chronic temporal lobe epilepsy is associated with severely declined dentate neurogenesis in the adult hippocampus.Neurobiol Dis,2004,17:473-490.
11 Parent JM,Elliott RC,Pleasure SJ,et al.Aberrant seizure-induced neurogenesis in experimental temporal lobe epilepsy.Ann Neurol,2006,59:81-91.
12 Huang H,He X.Wnt/beta-catenin signaling:new (and old) players and new insights.Curr Opin Cell Biol,2008,20:119-125.
13 Zhang L,Yang X,Yang S.The wnt/ beta-catenin signaling pathway in the adult neurogenesis.Eur J Neurosci,2011,33:1-8.
14 Ikegawa S,Kumano Y,Okui K et al.Isolation,characterization and chromosomal assignment of the human WNT7A gene.Cytogenet Cell Genet.1996,74:149-52.
15 Sperk G,Lassmann H,Baran H,et al.Kainic acid induced seizures:neurochemical and histopathological changes.Neuroscience,1983,10:1301-1315.
16 Dunleavy M,Shinoda S,Schindler C,et al.Experimental neonatal status epilepticus and the development of temporal lobe epilepsy with unilateral hippocampal sclerosis.Am J Pathol,2010,176:330-342.
17 Porter BE.Neurogenesis and epilepsy in the developing brain.Epilepsia,2008,49:50-54.
18 石秀玉,等.新生期大鼠反复痫性发作对海马神经发生的影响.中华儿科杂志,2006; 44:289.
19 Fahrner A,Kann G,Flubacher A,et al.Granule cell dispersion is not accompanied by enhanced neurogenesis in temporal lobe epilepsy patients.Exp Neurol,2007,203:320-332.
20 Kuruba R,Hattigangady B,Shetty AK.Hippocampal neurogenesis and neural stem cells in temporal lobe epilepsy.Epilepsy Behav,2009,14:65-73.
