数形结合在化学平衡图像中的应用
2017-03-30吕文卓
吕文卓


新高考对学生的能力提出了更高的要求,在每年的理综化学试题中非文本信息题在逐步增加,要求考生能迅速将图标、实验信息进行转化,利用所学的知识经验去解决实际的化学实际问题,从而体现化学为人类社会生产、生活服务的思想.
一、化学平衡图像的类型
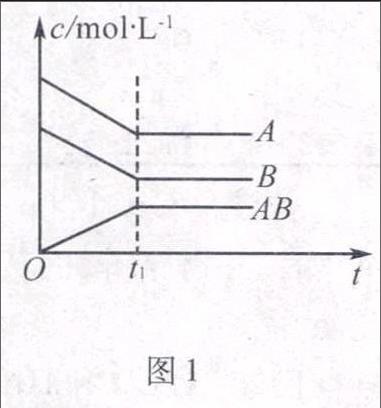
1.浓度—时间关系图像
图1此类图像能说明平衡体系中各组分在反应过程中的浓度变化情况,既有定量的变化,也有定性的体现.如A+BAB反应情况如图1所示,解该类图像题要注意各物质定量转化关系,由于曲线出现折点(达到平衡)的时刻是一样的,因此各物质浓度变化量比例符合化学方程式中的化学计量数关系的比例关系,由此可书写相应的化学方程式及把握定量反应关系.
2.速率—时间关系图像
如活泼金属与足量酸(非氧化性酸)的反应,反应速率随时图2间的变化出现如图2所示的情况,原因与分析:在反应过程中,两种因素影响化学反应的速率,即温度与浓度.AB段(v渐增),是因为温度的影响是主要的,反应放热,随反应的进行,温度渐高,导致反应速率增大;BC段(v渐小),是因为浓度的因素是主要的,随反应的进行,溶液中c(H+)逐渐减小,反应速率减小.
3.各种含量—时间—温度(压强)的图像(如图3所示)
百分含量往往是某一组分的物质的量的百分含量或气体体积的百分含量.
(a用催化剂,b不用催化剂)
该类图的纵坐标为物质的平衡浓度(c)或反应物的转化率(α),横坐标为温度(T)或压强(p),常见类型如图4所示.
5.其他关系图像
如图5所示曲线是其他条件不变时,某反应物的最大转化率(α)与温度(T)的关系曲线, 1、2、3、4四个点,可根据平衡与否去比较正逆反应的速率关系,表示v正>v逆的点是3,表示v正 二、用数形结合解决化学平衡问题的步骤 三、解题技巧与分析 1.正确找准平衡点 在含量(转化率)—时间曲线中,首先出现平衡点的先达到平衡,说明在该反应中该曲线反应速率快,因此温度较高、使用催化剂、所处压强较大等. 2.基于不变量去找变量 如果图像中有较多量时,先确定一个量不变,然后再讨论另外两个量的变量关系,作辅助线会有很好的体现. 3.变化趋势分析法 首先注意看反应速率是增大还是减小;然后看v正、v逆的相对大小,去判断平衡的移动方向;最后看化学平衡移动的方向是否一致. 四、经典例题解析 例1 已知NO2和N2O4可以相互转化:2NO2(g)N2O4(g) ΔH<0.现将一定量NO2和N2O4的混合气体通入一体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图6所示,回答下列问题: 1.前10 min内用NO2表示的化学反应速率v(NO2)=____mol·L-1·min-1;反应进行至25 min时,曲线发生变化的原因是___. 2.若要达到与最后相同的化学平衡状态,在25 min时还可以采取的措施是___. A.加入催化剂 B.缩小容器体积 C.升高温度 D.加入一定量的N2O4 解析 1.NO2在0~10 min达到平衡时浓度变化了0.4 mol·L-1,所以用NO2表示的反应速率为0.04 mol·L-1·min-1;而在25 min时,NO2的浓度由0.6 mol·L-1突变为1.0 mol·L-1,而N2O4的浓度在25 min时没有发生改变,所以可得此时改变的条件是向容器中加入了0.4 mol NO2. 2.加入NO2后平衡正向移动,所以若要达到与最后相同的化学平衡状态,还可通过增大压强(缩小容器体积),使平衡也同样正向移动;或者采取降低温度的方法,使平衡正向移动;也可以向容器中充入一定量N2O4,因为这样相当于增大容器中气体的压强,使得NO2的转化率提高,即达到与最后的平衡相同的平衡状态. 答案:1.0.04 加入了0.4 mol NO2(或加入NO2) 2.BD图7 例2 密闭容器中进行的可逆反应:aA(g)+bB(g) cC(g)在不同温度(T1和T2)及压强(p1和p2)下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图7所示.下列判断正确的是( ). A.T1 B.T1>T2,p1 C.T1 D.T1>T2,p1>p2,a+b>c,正反应为放热反应 解析 当图像中有三个变量时,先确定一个量不变,再讨论另外两个量的关系,这叫做“定一议二”.解答该题要综合运用“定一议二”和“先拐先平”的原则.由(T1,p1)和(T1,p2)两条曲线可以看出:①温度相同(T1),但压强为p2时达到平衡所需的时间短,即反应速率大,所以p2>p1;②压强较大(即压强为p2)时对应的w(B)较大,说明增大压强平衡逆向移动,则a+b 答案:B 例3 有一化学平衡mA(g)+nB(g)pC(g)+qD(g),如图8表示的是A的转化率与压强、温度的关系.下列叙述正确的是( ). A.正反应是放热反应;m+n>p+q B.正反应是吸热反应;m+n C.正反应是放热反应;m+n D.正反应是吸热反应;m+n>p+q 解析 圖像中有三个量,应定一个量来分别讨论另外两个量之间的关系.定压强,讨论T与A的转化率的关系:同一压强下,温度越高,A的转化率越高,说明正反应是吸热反应;定温度,讨论压强与A的转化率的关系:同一温度下,压强越大,A的转化率越高,说明正反应是体积缩小的反应,即m+n>p+q. 答案:D 例4 下面是某化学研究小组探究外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是( ). A.①是其他条件一定时,反应速率随温度变化的图像,正反应ΔH<0 B.②是在平衡体系的溶液中溶入少量KCl晶体后化学反应速率随时间变化的图像 C.③是在有无催化剂存在下建立的平衡过程图像,a是使用催化剂时的曲线 D.④是一定条件下,向含有一定量A的容器中逐渐加入B时的图像,压强p1>p2 解析 根据图像①,升高温度,平衡正向移动,正反应ΔH>0,A错;②反应实质是Fe3++3SCN-Fe(SCN)3,K+和Cl-不参加化学反应,KCl浓度增大不影响化学平衡,B错;③使用催化剂,反应速率加快,先达到平衡,C正确;④此反应为反应前后气体物质的量不变的化学反应,改变压强不影响平衡状态,即不影响A的转化率,且由于不断加入B,A的转化率增大,D错. 答案:C 总之,数形结合使平衡移动的图像问题更加具体明了,更能够体现不同学科之间的交融,学科思想的互补,更好的去解决化学问题.
