猪伪狂犬病诊断技术的研究进展
2017-03-29川北医学院实验动物中心杨国淋李阳友
■文/川北医学院 实验动物中心 杨国淋 李阳友
四川农业大学动物医学院 猪病研究中心与基因芯片实验室 文心田
猪伪狂犬病诊断技术的研究进展
■文/川北医学院 实验动物中心 杨国淋 李阳友
四川农业大学动物医学院 猪病研究中心与基因芯片实验室 文心田
猪伪狂犬病是严重危害养猪业的重要疫病之一。随着养猪业规模化、产业化和集约化的发展,该病在我国多个省市均有报道。近年猪伪狂犬病在多个种猪场呈流行暴发趋势,使我国养殖业受到巨大的经济损失,打击了养殖户的积极性。国内外众学者对其进行了大量研究,建立了多种诊断与鉴别诊断方法,为猪伪狂犬病的防治提供了相关依据。本文对猪伪狂犬病的病原学、临床症状、流行以及诊断方法进行了相关论述,其中主要对诊断方法进行了介绍,可以对该病的防治提供相关理论依据。
猪伪狂犬病;诊断方法;进展
猪伪犬病是由伪狂犬病病毒(Pseudorabies virus,PRV)引起的急性传染病,可以使多种野生动物和家畜动物感染,又称为奥叶基氏病[1]。猪是该病的主要宿主以及传染源,一旦发病呈暴发性流行,主要通过交配、精液、胎盘垂直传播,引起妊娠母猪流产、木乃伊胎、死胎和产弱仔;由于胎盘屏障的作用不能免疫仔猪,所以当病毒通过胎盘传递给胎儿时,感染率和死亡率可达100%,对胎儿来说是致命的;成年猪由于免疫抵抗力较强,感染一般只出现上呼吸道卡他性症状,不表现典型症状。长期携带毒病呈隐性感染,成为猪群养殖的健康隐患。本病分布很广,而且常常和猪瘟呈混合感染趋势[2]。20世纪,该病曾出现大规模的流行,后来由于基因缺失疫苗的成功研制,该病的防控取得了很好的效果。近年来有关猪伪狂犬病的报道又明显增多,猪场中PRV的阳性比例也开始增加,成为养殖过程中普遍存在的问题,也成为众多兽医专家的研究热点。
1 病原学特征
PRV属于疱疹病毒科,只有一种血清型,但不同毒株在生物学和毒力等方面存在一定差异。完整病毒粒子为圆形,是双链DNA病毒,有囊膜,囊膜表面呈放射状排列的纤突[3]。病毒对高温抵抗力强,在80℃下,3min病毒才能被杀灭;在低温潮湿环境下,病毒能稳定存活。PRV对氯仿、乙醚和福尔马林等有机化学消毒剂和紫外线较敏感,在污染的猪舍能存活1个多月。PRV基因组为线状双链DNA,全长约为180kb,G+C含量高,可编码70多种蛋白,目前命名的有gB、gC、gD、gE等11种糖蛋白,在病毒诱导免疫应答时起到重要作用。伪狂犬病毒的毒力是由几种基因协同调控,主要有TK、gE、gD、gI基因,其中PRV最主要的毒力基因是TK[4]。缺失一种或几种毒力基因,可使伪狂犬病毒毒力下降,但仍保持免疫原性,成为研究基因工程缺失苗的疫苗株。
2 临床症状和病理变化
猪伪狂犬病毒株临床症状主要表现为发热、奇痒、角弓反张,仔猪出现划水样、转圈等神经症状,后期昏迷死亡(图1)。病毒极易感染哺乳期内的仔猪,发病急、死亡率高;成年猪一般不发生死亡,多呈隐形感染,临床表现为发热、呼吸困难,偶有神经症状。母猪主要出现繁殖障碍,表现为流产、死胎、木乃伊胎等,发情母猪感染伪狂犬病是返情率增高,屡配不孕;公猪感染病毒后主要表现为精子质量下降、睾丸发生肿胀、最后萎缩,丧失种用能力[5]。
PRV感染的猪剖解主要表现为上呼吸道和胃肠黏膜,以及扁桃体发生出血水肿和炎症。脑膜充血、出血、水肿发生脑脊髓炎导致神经症状。染病动物一般可见肺有充血、水肿和坏死灶,脾脏和肝脏有灰白色坏死灶(图2、图3),扁桃体水肿并有坏死灶(图4),胃黏膜有卡他性炎症。慢性病例可表现为育肥猪发生肺炎,其他动物均为非化脓性脑炎。在显微镜下可见清晰的血管套及胶质细胞坏死(图5)。

图1 仔猪临床症状

图2 脾脏病变
3 诊断技术
猪伪狂犬病与猪繁殖与呼吸综合征、猪细小病、猪布氏杆菌病、猪瘟等猪繁殖障碍病临床症状相似,难以区分。根据该病的典型临床症状及病理变化特点,只能做初步诊断,为了能确诊猪伪狂犬病还需进行实验室检查。目前实验室常用的诊断该病的方法有病原学的病毒分离与鉴定、血清学试验、分子生物学技术等。
3.1 病毒分离与鉴定
病毒分离鉴定是诊断伪狂犬病最可靠的方法,但是比较耗时耗力,对材料的要求高,脑组织和扁桃体常作为分离病毒检样的最佳材料,经处理后接种到健康的动物或细胞培养物进行感染。一般病毒接种后3日龄左右出现典型的细胞病变,染色镜检后,可在细胞核内发现酸性包涵体。电镜下可以观察到伪狂犬的病毒粒子是二十面体对称的圆形或椭圆形,其直径大小为110~150nm左右,位于胞浆内,为成熟的病毒粒子,一般带有囊膜的病毒粒子,直径大小为150~180nm左右,囊膜外有呈放射状排列的纤突。唐婕[6]应用电镜观察伪狂犬病毒的外形,发现具有子弹状形态特点,能与鹅红细胞产生凝集反应,且附着在鹅红细胞表面易于辨认。该方法对病毒的检测直观、形象、快速,但对病毒滴度要求高,并需要熟练的技术人员。

图3 肝脏病变
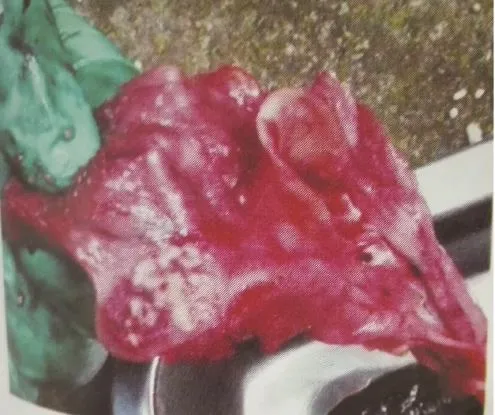
图4 扁桃体发病
3.2 血清学试验
血清学方法是利用抗体诊断技术进行诊断,在临床上是伪狂犬病诊断常见的方法,主要包括酶联免疫吸附试验(ELISA)、血清中和试验(SNT)、免疫荧光技术(FA)、乳胶凝集试验(LAT)、以及琼脂扩散试验(AGID)等。3.2.1 免疫荧光抗体试验 免疫荧光技术是用荧光标记抗原或抗体,用来跟踪检测目标物,该方法特异性强,可以在荧光显微镜下观察。Allan等[7]首次对人工感染猪伪狂犬病毒的猪和自然状态下感染猪伪狂犬病毒猪的脑组织和咽喉组织进行压印片,然后利用间接免疫荧光试验进行检测,该方法能检测的灵敏度为101.3TCID50/g,在实验过程中不需要进行细胞培养和冷冻切片等复杂步骤,在2h内便得出试验结果。魏凤等[8]采用PCR技术和间接免疫荧光技术从山东某猪场分离到一株猪伪狂犬病毒,与NCBI中收录的病毒基因组同源序列为96%~98%。3.2.2 血清中和试验 血清中和试验试管是利用抗原与抗体特异性反应,进行疾病诊断的一种血清方法。高俊峰等[9]从临床中分离到一株伪狂犬病毒株,用该毒株与标准毒株进行中和试验,确定该毒株可以作为候选疫苗毒株;TQ等[10]从6省市15个猪场采集临床样品,分离到猪伪狂犬的变异毒株,用中和试验的方法测定猪伪狂犬Bartha-K61疫苗株的效价,结果发现该疫苗对传统毒株的免疫保护力为100%,但是对变异毒株的保护力仅为50%,不能作为猪伪狂犬的保护疫苗。3.2.3 酶联免疫吸附试验 ELISA是诊断猪伪狂犬病最常用的方法之一。van Oirschot等[11]利用抗原抗体能特异结合的原理,抗原用感染后的单层细胞,抗体用抗gE表位的单克隆,建立了可以检测猪伪狂犬病毒的gE抗体ELISA。Morenkov等[12]构建了亲和层析gE-ELISA和gE-ELISA两种血清检测方法,这两种方法能够区分野毒感染和疫苗免疫的动物,特异性和敏感性都较好。谭春萍等[13]采用ELISA对广西部分地区伪狂犬病的流行情况进行了调查和分析,得出不同地区和不同规模的猪场伪狂犬病的感染率不同的结论;曹三杰等[14]构建的伪狂犬病毒斑点ELISA,能够特异敏感地检测IgG的病毒含量。目前哈尔滨兽医研究所研制的Dot-ELISA试剂盒已投入使用,且临床检测效果好。
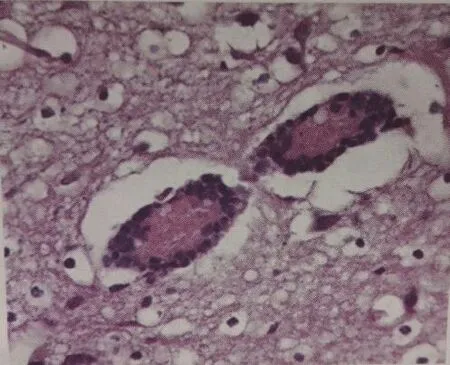
图5 胶质细胞病变
3.2.4 乳胶凝集试验 乳胶凝集试验(LAT)和血清学试验的原理相似,也是利用抗体和抗原特异性结合原理,首先用乳胶包被抗原,然后与血清反应后通过凝集现象来判断结果。如两者发生凝集现象,便可诊断为有PRV感染,几分钟内即可得出结果。乳胶凝集试验最大的特点是能够检测IgM抗体,从而来判断早期感染。舒银辉等[15]采用乳胶凝集试验和中和试验研究所制备灭活苗的免疫原性,试验结果分析所制备灭活疫苗的免疫效价都很高,具有良好的免疫效果。吴斌等[16]通过比较乳胶凝集试验和血清中和试验间的差异,结果发现两种方法在统计学上没有明显的差别。
3.3 分子生物学技术
3.3.1 核酸探针技术 猪伪狂犬病由于大多呈隐形感染,病毒基因潜伏在组织器官中,不表现临床症状。探针核酸技术能在基因水平上对伪狂犬病毒进行诊断,Maes等[17]首先分离伪狂犬病毒,然后用地高辛和生物素标记的探针,诊断出猪伪狂犬DNA后,对组织切片进行原位杂交,检出单细胞水平上潜伏感染的病毒DNA。史喜菊等[18]采用探针核酸技术能够对流感病毒(SIV)、伪狂犬病病毒(PRV)、口蹄疫病毒(FMDV)、猪传染性胃肠炎(TGEV)和猪繁殖与呼吸综合征病毒(PRRSV)同时进行诊断。
3.3.2 PCR技术 PCR技术是20世纪80年代建立起来的一种体外扩增DNA的分子生物学技术,该方法具有快速、灵敏度高、节约时间、特异性强等优点,在猪伪狂犬病的检测中得到广泛应用。Harding等[19]针对伪狂犬gD基因设计引物,建立能区分动物间的不同疱疹病毒的PCR方法。余秋颖等[20]采用PCR技术对分离的猪伪狂犬病毒的gE、TK、gD基因进行扩增,克隆、测序分析,与参考毒株进行对比分析亲缘关系。Zhang等[21]根据病毒的不同基因进行设计引物,建立多重PCR诊断技术可以将疫苗株和野毒株区分开来。Cao等[22]建立了检测猪伪狂犬病等几种常见猪繁殖障碍病的多重PCR方法,检测了多例多系统衰竭综合征仔猪,该法灵敏度高,特异性好,能应用于临床检测,并可用于诊断野毒感染病例。吴旭锦等[23]在常规PCR技术的基础上,通过优化体系和反应条件建立了套式PCR技术,能够对猪伪狂犬病毒进行特异性的检测。
3.3.3 荧光定量PCR技术 实时荧光定量PCR与普通PCR技术相比较具有更高的敏感性和特异性。Wu等[24]采用实时荧光定量PCR技术对建立了可同时检测猪圆环病毒2型、猪蓝耳病、猪伪狂犬病、猪瘟、猪细小病毒和猪乙脑6种常见的感染疾病的诊断方法,可检测10 copies/μL的病毒含量。郑敏等[25]根据猪伪狂犬病病毒gE基因序列,建立了可区别基因缺失疫苗株和野毒株的荧光定量PCR检测方法,并对30份疑似病料进行临床检测,灵敏度可达2.23×10拷贝/μL,比常规PCR检测方法高100倍。
3.4 基因芯片技术
基因芯片技术是近年来发展起来的一项新技术,具有特异性好,灵敏度高,高通量一次试验可以检测多种病原,具有其他技术无法比拟的优点。目前被用于基因分型、疾病诊断、基因表达谱测定的各个生命科学领域。Paulus等[26]采用昂飞公司的基因芯片分析宿主在感染猪伪狂犬的中央神经系统基因的表达量,结果显示感染后的表达量大大增加,有的比未感染的组织高达100倍。常晓霞[27]在结合链霉亲和素与生物素的特异性结合,利用酶与底物显色放大原理,构建了可以同时检测猪伪狂犬、猪细小病毒和猪圆环病毒2型联合共检可视化基因芯片,构建的芯片灵明度高,能够特异的检测出三种病原。
4 防控
虽然诊断伪狂犬病的方法很多,但是每种方法都有各自的优缺点,遇到不同情况采取不同的措施。诊断时可首先根据临床病变的特征和流行病学调查,对病原进行初步诊断,然后要采取实验室手段进行确诊,制定相应的防控措施。目前多数猪场都存在该病毒的隐性感染,临床上不发病,但长期带毒,是重要的传染源,难以根除。建立一种能区分野毒感染和疫苗免疫毒株的诊断方法,对于净化猪场起到是十分重要的[28]。
疫苗接种是该病最有效的防控措施,目前使用的猪伪狂犬疫苗有弱毒疫苗、重组病毒疫苗、灭活疫苗、基因缺失苗。猪只在流通过程中很容易造成PRV的传播和该病的流行,因此在引种时要严格监控,避免携带病毒的猪;加强生物安全管理,定期消毒、灭鼠;在饲养密度方面实行“小产房”、“小保育”、“低密度”、“分阶段饲养”的饲养模式,加强猪群的日常饲养管理和保健预防。本病一旦确诊,应该根据国家相关规定采用隔离、消毒等措施,尽快扑灭。总之,对于伪狂犬病的防控应遵循“以防为主”的原则,在平时的日常饲养管理过程中做好生物安全工作,一旦发现该病要及时处理,争取在发病初期就将病原消灭。■
[1] 甘孟候,杨汉春.中国猪病学[M].北京:中国农业出版社, 2005.
[2] 吴忆春.某猪场猪伪狂犬病病毒与猪瘟病毒混合感染的诊断[J].动物医学进展,2014(6):171~174.
[3] 殷震,刘景华.动物病毒学[M].北京:科学出版社,1985.
[4] Liu W, Yi Y, Mei M, et al. Molecular Cloning, Bioinformatics Analysis of gL Gene of Pseudorrabies Virus Wild Strain SL[J].International Conference on Bioinformatics & Biomedical Engineering,2011:1~6.
[5] Ghanem A, Conzelmann K K. G gene-def i cient single-round rabies viruses for neuronal circuit analysis[J]. Virus Research, 2015, 216:41~54.
[6] 唐婕.狂犬病毒的电镜检测及其糖蛋白基因的克隆与序列分析[D].长沙:湖南农业大学,2007.
[7] Allan G, Mcnulty M, Mccracken R, et al. Rapid diagnosis of Aujeszky's disease in pigs by immunof l uorescence [J]. Research in veterinary science, 1984, 36(2): 235~239.
[8] 魏凤,张文通,郭广君,等.一株猪伪狂犬病病毒的分离鉴定[J].黑龙江畜牧兽医,2015(21):183~184.
[9] 高俊锋,赖志,舒银辉,等.猪伪狂犬病毒C株的分离鉴定[J].上海农业学报,2015(1):32~36.
[10] An T Q, Peng J M, Tian Z J, et al. Pseudorabies virus variant in Bartha-K61-vaccinated pigs, China, 2012.[J]. Emerging Infectious Diseases, 2013, 19(11):1749~55.
[11] J.T van Oirschot, M.J Kaashoek, M.A Maris-Veldhuis ,et al. Strains of bovine herpesvirus 1 that do not express an epitope on glycoprotein E in cell culture still induce antibodies that can be detected in a gE-blocking ELISA [J]. Veterinary Microbiology,1999,65(2):103~113.
[12] O.S. Morenkov, Yu.A. Sobko, O.A. Panchenko.Glycoprotein gE blocking ELISAs to differentiate between Aujeszky's disease-vaccinated and infected animalsOriginal Research Article[J].Journal of Virological Methods, 1997, 65(1): 83~94.
[13] 谭春萍,黄福标,于冬玲,等.广西部分地区猪伪狂犬病流行情况调查与分析[J].黑龙江畜牧兽医,2016(12):122~123.
[14] 曹三杰,文心田.Dot-PPA-ELISA检测猪血清伪狂犬病抗体的研究[J].中国预防兽医学报,2004, 26(3): 213~215.
[15] 舒银辉,杨雷,黄文辉,等.猪伪狂犬病不同佐剂灭活疫苗对兔免疫原性初探[J].中国兽药杂志,2011,45(12):19~22.
[16] 吴斌,陈焕春,何启盖,等.应用乳胶凝集试验进行猪传染性萎缩性鼻炎血清流行病学调查[J].中国兽医科技,2001,31(6):21~22.
[17] Maes R K, Sussman M D, Vilnis A, et al. Recent developments in latency and recombination of Aujeszky's disease (pseudorabies) virus [J]. Veterinarymicrobiology, 1997, 55(1): 13~27.
[18] 史喜菊,马贵平,乔彩霞,等.多重连接探针扩增(MLPA)技术同时检测五种病毒的研究[J]. 农业生物技术学报,2013,21(6):745~752.
[19] Huang C, Hung J-J, Wu C-Y, et al. Multiplex PCR for rapid detection of pseudorabies virus, porcine parvovirus and porcine circoviruses [J]. Veterinary microbiology, 2004, 101(3): 209~214.
[20] 余秋颖,常洪涛,陈文定,等.2012~2013年新流行猪伪狂犬病病毒的分离鉴定及其gE、TK、gD基因序列分析[J].中国兽医学报,2014,34(10):1573~1578.
[21] Chaolin Zhang, Linghua Guo, Xiangrui Jia ,et al. Construction of a triple gene-deleted Chinese Pseudorabies virus variant and its eff i cacy study as a vaccine candidate on suckling piglets[J].Vaccine, 2015,33(21): 2432~2437.
[22] Cao S, Chen H, Zhao J, et al. Detection of porcine circovirus type 2, porcine parvovirus and porcine pseudorabies virus from pigs with postweaning multisystemic wasting syndrome by multiplex PCR [J]. Veterinary research communications, 2005, 29(3): 263~269.
[23] 吴旭锦,朱小甫.猪伪狂犬病病毒套式PCR检测方法的建立与应用[J].动物医学进展,2016,37(6):18~21.
[24] Wu H, Rao P, Jiang Y, et al. A sensitive multiplex real-time PCR panel for rapid diagnosis of viruses associated with porcine respiratory and reproductive disorders.[J]. Molecular & Cellular Probes, 2014,28(5~6):264~270.
[25] 郑敏,毛凝,黄梅清,等.猪伪狂犬病毒Taqman-MGB荧光定量PCR检测方法的建立及应用[J].中国农学通报,2013,17:37~41.
[26] Paulus C, Sollars P J, Pickard G E, et al. Transcriptome Signature of Virulent and Attenuated Pseudorabies Virus-Infected Rodent Brain[J]. Journal of Virology, 2006, 80(4):1773~86.
[27] 常晓霞.猪伪狂犬病毒、猪细小病毒和猪圆环病毒2型联合共检可视化基因芯片检测技术研究[D].淮安:四川农业大学,2015.
[28] 刘萍,郝立建.猪伪狂犬病防治[J].四川畜牧兽医,2014,41(4):51~52.
