多重PCR检测籽用西葫芦种子带毒及热处理脱毒效果分析
2017-03-29任琛荣周登攀都业娟向本春
任琛荣, 周登攀, 都业娟, 向本春
(石河子大学农学院, 新疆绿洲农业病虫害治理与植保资源利用自治区普通高校重点实验室, 石河子 832003)
实验方法与技术
多重PCR检测籽用西葫芦种子带毒及热处理脱毒效果分析
任琛荣, 周登攀, 都业娟, 向本春*
(石河子大学农学院, 新疆绿洲农业病虫害治理与植保资源利用自治区普通高校重点实验室, 石河子 832003)
为了明确籽用西葫芦种子携带病毒的情况,以籽用西葫芦种子为材料,采用多重PCR技术检测种子带毒率。同时为了筛选出有效脱除病毒的方法,通过相对定量法分析了不同温度湿热和干热处理对种子携带病毒的钝化效果。结果表明,从7个籽用西葫芦品种种子幼苗中均可检测到CMV、ZYMV及WMV,其检出率分别为67.1%、50.0%和72.3%,多个病毒的复合检出率为66%。不同品种种子幼苗的病毒检出率有明显差异,其中‘粒丰9号’种子幼苗的病毒检出率最低,为60%,而‘京丰9号’,‘瑞丰9号’,‘绿丰9号’及‘金葫360’的病毒检出率均为100%。8种处理均能不同程度降低籽用西葫芦种子幼苗的带毒率,其中干热60、70、75℃,湿热75℃处理同时脱除WMV、CMV和ZYMV的效果最好。
籽用西葫芦; 种子; 带毒率; 种子处理
籽用西葫芦籽粒营养价值高,口感好,广受国内外人们的喜爱,成为近年来在新疆发展较快的新兴产业之一,且种植面积逐步扩大。近期调查发现,病毒病是籽用西葫芦生产种植中普遍发生的病害,引起植株叶片畸形,果实畸形坏死,产籽量低,甚至落花,落果,造成严重的经济损失,成为制约籽用西葫芦产业发展的重要障碍[1]。籽用西葫芦属葫芦科作物。已报道的葫芦科作物种传病毒共有11种[2], 如黄瓜花叶病毒Cucumbermosaicvirus(CMV)[3]、西瓜花叶病毒Watermelonmosaicvirus(WMV)[4]、小西葫芦黄花叶病毒Zucchiniyellowmosaicvirus(ZYMV)[3]、番木瓜环斑病毒西瓜株系Papayaringspotvirus-watermelon(PRSV-W)[5]及黄瓜绿斑驳花叶病毒Cucumbergreenmottlemosaicvirus(CGMMV)[6]等。其中CMV是雀麦花叶病毒科Bromoviridae黄瓜花叶病毒属Cucumovirus的典型种,寄主范围广泛,能侵染85科1 000多种植物[7]。而WMV、ZYMV及PRSV-W均是马铃薯Y病毒属Potyvirus的成员,这4种病毒主要由瓜蚜、桃蚜等75种蚜虫传播,也可通过机械、种子等传播。目前,有关籽用西葫芦种子是否带毒,带何种病毒以及在何种热处理条件下能有效脱除种子携带的病毒等研究尚未见报道。加强种子带毒率检测,从源头阻断病毒病害的流行,蔓延,对籽用西葫芦产业的发展具有重要的意义。
1 材料和方法
1.1 试验材料
种子样品来自石河子市面上农资公司所售的籽用西葫芦种子,品种分别为:‘芳新源’、‘京丰9号’、‘瑞丰9号’、‘粒丰5号’、‘粒丰9号’、‘绿丰9号’、‘金葫360’。mRT-PCR所用的阳性对照为本实验室保存的同时携带ZYMV、 CMV、 WMV、PRSV-W的西葫芦叶片。大肠杆菌DH5α菌株为本实验室保存。
1.2 试验试剂
RNA提取试剂TRIzol购自TaKaRa公司;反转录试剂盒购自Thermo公司;TaqDNA聚合酶、dNTPs、TaqPCR Mix、琼脂糖凝胶回收试剂盒等购自北京康为世纪生物科技有限公司;2000 bp DNA marker购自全式金生物;荧光定量SYBR GreenⅠ购自Invitrogen生物技术有限公司;其他化学试剂均为国产分析纯。
1.3 试验方法
1.3.1 建立多重PCR反应体系
1.3.1.1 引物的设计和合成
根据GenBank上登录的各病毒序列,用 Primer Premier 5.0引物设计软件分别设计以18S rRNA为内标的多重PCR引物和以β-actin为内参的荧光定量特异性引物。表1中扩增长度为242、372、449和571 bp 的引物分别为扩增WMV、CMV、PRSV-W和ZYMV的特异引物;将这4对引物和长度为1 036 bp的18S rRNA内标引物混合用于多重PCR;长度为115、151、115 bp的引物和 92 bp的β-actin引物用于WMV、CMV和ZYMV的相对表达量测定。PCR引物由北京华大科技有限公司合成。
表1 扩增病毒和内标片段的特异性引物
Table 1 Specific primers for amplifying segments of ZYMV, PRSV-W, CMV, WMV and 18S rRNA

病毒和内标Virusandinternalcontrol编号Codeno.序列(5'-3')Sequence(5'-3')扩增长度/bpProductlengthWMV5'端引物3'端引物5'端引物3'端引物GGATGGGGAAGAGCAAGTTGAGCTTCTCTTGCCCTGTTTGGTGTGAGTTTGGGTGATGATGGATGGGTCTGCTGCGTCTGAGAAATGGTG242115CMV5'端引物3'端引物5'端引物3'端引物ATCAACCAGTGCTGGTCGTAACGGAACTTTACGGACTGTCACCCCGGATGCTAACTTTAGAGTCTTGTCGGTGGCTTTAGGGTAATAGATGTG372151PRSV-W5'端引物3'端引物GTCAATGTTGGGACCAGTGGAACGCGGCATGTATCTCTCAGTAG449ZYMV5'端引物3'端引物5'端引物3'端引物AACAGTAGCAGCTGTCACGAAGGCGGGCTCTTTCAGGAGTTTTAACGGTTGTTGTGAATCAGTGTCTGAGTTTTGTGGTTTATCCCCTTT57111518SrRNA5'端引物3'端引物CTGAGAAACGGCTACCACATCTGTTATTGCCTCAAACTTCC1036β-actin5'端引物3'端引物AATCCACGAAACTACCTACAACTCCTTGAACCACCACTGAGGACGATG92
1.3.1.2 优化多重PCR反应体系
针对影响多重PCR扩增效果的退火温度、TaqDNA聚合酶浓度、dNTPs浓度,在反转录条件不变的情况下,进行多重PCR反应体系的优化。优化某一因素时,其他因素不变。退火温度:设50、52、54、56、58、60、62、64℃ 8个处理;TaqDNA聚合酶浓度:设0、0.5、1.0、1.5、2、2.5、3、4 U/μL 8个处理;dNTPs浓度:设0、0.1、0.2、0.3、0.4、0.6、0.8、1.0 mmol/L 8个处理。
1.3.1.3 检测多重PCR的灵敏度
用蛋白核酸仪测定CMV、ZYMV、WMV和PRSV-W的核酸浓度,并用超纯水以30、3-1、3-2、3-3、 3-4、3-5、3-6的稀释倍数进行病毒RNA的稀释,各浓度取1 μL进行单重及多重PCR反应,检测其灵敏度。
1.3.2 籽用西葫芦种子带毒检测
1.3.2.1 籽用西葫芦幼苗的培育
从市面上随机抽取7个籽用西葫芦品种,每个品种取50粒种子,分别播于经180℃, 8 h高温灭菌的土中,室温下培养。待长至四叶期,每个品种随机取30株幼苗进行病毒检测。
1.3.2.2 多重PCR检测
采用RNAiso Plus试剂盒用改良TRIzol法提取植株总RNA。
cDNA第一链的合成:将5 μL总RNA模板,1 μL oligo(dT)18引物与6 μL无核酸酶的高纯水轻轻混匀,短暂离心,65℃孵育5 min,冰上冷却,离心后加4 μL 5×第一链反应缓冲液,1 μL RiboLockTMRNA酶抑制剂,2 μL 10 mmol/L dNTPs Mix, 1 μL Revert AidTMM-MnLV逆转录酶,轻轻混匀,离心,42℃孵育60 min,70℃加热5 min终止反应,-60℃保存备用。
采用多重PCR,以18S rRNA为内标检测种子所带病毒[9-11]。多重PCR反应:以cDNA第一链为模板进行PCR。25 μL反应体系:cDNA 3 μL, 10 μmol/L特异性引物,包括18S rRNA 0.5 μL、WMV 0.8 μL、CMV 1 μL、ZYMV 0.8 μL和PRSV-W 1 μL,10×PCR buffer(含Mg2+)2.5 μL,dNTPs(10 mmol/L)1 μL,TaqDNA聚合酶(5 U/μL)0.3 μL,加ddH2O至终体积为25 μL。PCR扩增条件:94℃预变性3 min;94℃变性30 s,62℃退火30 s,72℃延伸1 min,35个循环;后72℃延伸10 min,4℃保存。反应结束后,PCR产物用1%琼脂糖凝胶电泳,用凝胶成像系统观察结果并照相,统计检出率。检出率(%)=(检出病毒种子数/抽检种子总数)×100。
1.3.2.3 PCR产物的克隆及测序
用凝胶回收试剂盒纯化目的片段,在4℃连接至pMD18-T载体,转化到大肠杆菌感受态细胞中,经红白斑筛选,挑取阳性克隆,送至北京华大公司测序。
1.3.3 籽用西葫芦种子的热处理
1.3.3.1 热处理方法
湿热法:将120粒‘京丰9号’种子平均分为4份,每份30粒,分别在60、65、70和75℃热水中处理10 min,再放入灭菌水中浸泡24 h,沥出晾干备用;
干热法:将120粒‘京丰9号’种子平均分为4份,每份30粒,先用烘箱40℃加热24 h,再将每份种子样品分别用60、65、70和75℃加热72 h,待种子温度降至室温备用。
将每种处理后的种子分别播于装有经过180℃,8 h高温灭菌土的试验钵中,室温下培养。同时以室温,灭菌水浸泡的种子为对照处理。
1.3.3.2 分析热处理效果的方法
以多重PCR检测种子的热处理效果,方法同种子带毒检测,并统计脱毒效率。脱毒效率(%)=(1-处理后的带毒率/对照带毒率)×100 。
以β-actin为内参,用荧光定量PCR确定种子热处理后病毒的相对表达量。以未经热处理,室温灭菌水浸泡的种子为对照。每处理取10粒种子,重复3次,每个重复再重复3次上机检测。荧光定量PCR反应体系为10 μL,其中SYBR premixExTaqTM5 μL,cDNA 1 μL,上、下游引物(10 μmol/L)各0.5 μL,加ddH2O至终体积为10 μL。荧光定量PCR扩增条件为:94℃预变性3 min;94℃变性30 s,54℃退火30 s,72℃延伸1 min,35个循环;后72℃延伸10 min,4℃保存。
荧光定量数据用Sigma Plot 12.5软件分析,并用SPSS软件分析其差异显著性。
2 结果与分析
2.1 多重PCR反应体系的建立
2.1.1 多重PCR的特异性
以经鉴定同时携带CMV、ZYMV、WMV和PRSV-W的籽用西葫芦叶片为阳性对照,无毒苗为阴性对照,分别进行单重和多重PCR,结果(图1)表明,分别以各病毒的特异引物进行单重PCR扩增,阳性对照可分别得到大小为242、372、449、571 bp的WMV、CMV、PRSV-W、ZYMV的目的条带,而将这4种病毒的特异引物和18s rRNA引物混合后进行多重PCR,阳性对照仍可得到预期的目的条带,且条带的亮度及清晰度均较好,而阴性对照只扩增得到1 036 bp的18S rRNA。用同一RNA进行mRT-PCR反应,得到的目的条带与sRT-PCR扩增条带大小一致,说明mRT-PCR能同时检测这4种病毒。
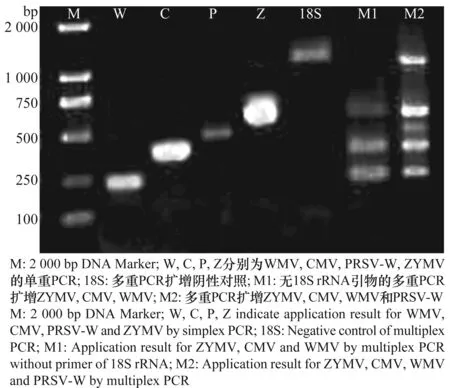
图1 单重及多重PCR的特异性比较Fig.1 Comparison of specificity for multiplexPCR and simplex PCR
2.1.2 多重PCR反应体系的优化
退火温度优化结果(图2a)显示,54~64℃均可扩增出5条带,且退火温度在58~64℃范围内目的条带较清晰,其中62℃的目的条带最清晰,明亮,效果最好,因此本试验选62℃为最佳退火温度。
TaqDNA聚合酶量优化结果(图2b)显示,TaqDNA聚合酶量在0、0.5、1.0、1.5、2、2.5和3 U/μL时均可扩增出5条目的条带,但TaqDNA聚合酶量为1.5 U/μL时扩出的5条带比1.0 U/μL清晰,且随着酶量的增加,条带再没有明显变化,因此本试验选1.5 U/μL为最佳TaqDNA聚合酶量。
dNTPs浓度优化结果见图2c,dNTPs浓度在0.6 、0.8和1.0 mmol/L时,扩增出各条带较好,且0.8 mmol/L的dNTPs浓度较0.6 mmol/L扩增的条带清晰,与1.0 mmol/L扩增的条带没有明显变化,因此选0.8 mmol/L为本试验的dNTPs浓度。
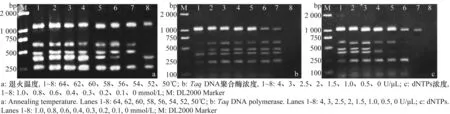
图2 多重PCR主要参数的优化Fig.2 Optimization for the three main parameters of mRT-PCR
2.1.3 多重PCR的灵敏度
以1 μL稀释30、3-1、3-2、3-3、3-4、3-5、3-6倍的RNA为模板分别进行单重和多重RT-PCR。进行单重PCR时,WMV、CMV、PRSV-W和ZYMV的灵敏度分别为3-5、3-4、3-2和3-6,与多重PCR的扩增结果基本相符合(图3)。说明多重PCR与单重PCR的灵敏度相同。
2.2 籽用西葫芦种子带毒检测
选取7个籽用西葫芦品种,每个品种取50粒种子育苗至4叶期,用多重PCR技术检测样品的带毒率及复合带毒率。结果(表2)表明,从新疆石河子市面上所售的7个籽用西葫芦品种的种子中均检测出CMV、WMV及ZYMV,且均未检测出PRSV-W。不同品种种子病毒的检出率不同,7个品种中有4个品种种子的病毒检出率均为100%,检出率最低的品种为‘粒丰9号’,为60%。不同品种种子所带的主要病毒不同,CMV检出率最高的品种为‘绿丰9号’,达92%,而‘粒丰9号’的检出率只有50%;ZYMV检出率最高的品种是‘瑞丰9号’,为80%,最低检出率是‘粒丰5号’,为22%; CMV、ZYMV和WMV的复合检出率在‘瑞丰9号’中最高,为60%,在‘粒丰5号’中最低,为0。所有种子病毒的平均检出率为86%,其中CMV检出率为67.1%,ZYMV检出率为50%,WMV检出率为72.3%,而2种病毒复合检出率为28%,3种病毒复合检出率为38%。95.62%检测为阳性的植株不表现任何病毒症状,只有个别植株表现叶片畸形,褪绿斑点症状。
2.3 温度处理对籽用西葫芦种子的影响
2.3.1 热处理对籽用西葫芦种子脱毒的影响
多重PCR检测结果表明,不同温度湿热和干热处理都具有脱毒作用,但干热处理比湿热处理效果更好,其中,65℃湿热处理脱毒效果最差,75℃干热处理脱毒效果最好,可达96%。

图3 多重PCR灵敏度的测定Fig.3 Detection of mRT-PCR sensitivity

品种Variety总检出率/%Totaldetectionrate各病毒检出率/%VirusdetectionrateCMVZYMVWMV复合检出率/%CompositedetectionrateCMV+ZYMVZYMV+WMVCMV+WMVCMV+ZYMV+WMV芳新源 Fangxinyuan74.064.068.064.08.06.0054.0京丰9号 Jingfeng-9100.078.056.0100.00022.056.0瑞丰9号 Ruifeng-9100.070.080.0100.0020.010.060.0粒丰5号 Lifeng-568.056.022.012.012.0012.00粒丰9号 Lifeng-960.050.040.050.00020.030.0绿丰9号 Lvfeng-9100.092.054.090.00046.046.0金葫360 Jinhu360100.060.030.090.0010.030.020.0均值 Averagevalue86.067.150.072.32.95.120.038.0
相对荧光定量PCR结果显示,从脱除病毒种类来看,8种处理均能不同程度脱除种子携带的CMV、ZYMV以及WMV。差异显著性分析结果表明:在P<0.05时,热处理对WMV脱毒效果最为显著,对CMV的脱毒效果较差;在8种处理下,CMV的相对表达量均显著下降;ZYMV除65℃湿热处理外,其他温度处理后病毒相对表达量均显著降低;WMV相对表达量也显著降低,其中干热60、70、75℃以及湿热75℃处理和常温处理的对照相比差异最为显著(图4)。
2.3.2 温度处理对种子发芽率及发芽势的影响
8种处理均不同程度地降低籽用西葫芦种子的发芽率和发芽势,其中对发芽势的影响明显大于发芽率(图5)。从发芽率看,播种15 d后,对照种子发芽率为98%,60、65、70、75℃干热和湿热处理的种子发芽率分别为96%、95%、93%、92%和97%、96%、94%、93%。可看出,随温度的升高,发芽率依次下降,干热75℃处理较对照下降6%。
从发芽势来说,播种10 d后,对照种子发芽势为96%,60、65、70、75℃干热处理的发芽势为92%、86%、72%、65%,60、65、70、75℃湿热处理种子的发芽势为94%、90%、82%、73%。温度处理对发芽势的影响明显大于发芽率,其中75℃干热处理对发芽势的影响最大,较对照处理下降31%。
3 讨论
目前,多重PCR技术已广泛应用于食品[12]、医学[13]等领域。而用多重PCR检测葫芦科病毒的研究较少,特别是关于籽用西葫芦种子携带病毒的研究尚未见报道。籽用西葫芦病毒病在其种植区均发生严重,尤其是在石河子等地,ZYMV、CMV、WMV及PRSV-W是侵染籽用西葫芦的主要病毒[1]。由于籽用西葫芦种子较难提取RNA,本试验用灭过菌的土壤种植籽用西葫芦,待其长至四叶期进行病毒检测。由于种子至幼苗的成长周期中,土壤等都经过灭菌处理,因此,从幼苗中检测到的病毒基本可认为是种子中所带的病毒。本试验对多重PCR反应体系进行了优化,确定了最佳退火温度为62℃,TaqDNA聚合酶浓度为1.5 U/μL,dNTPs浓度为0.8 mmol/L,并且验证了多重PCR的灵敏度,建立了可靠的检测籽用西葫芦ZYMV、CMV、WMV及PRSV-W的多重PCR体系。可为生产中检测籽用西葫芦病毒病提供一套简单、快速、有效的方法。
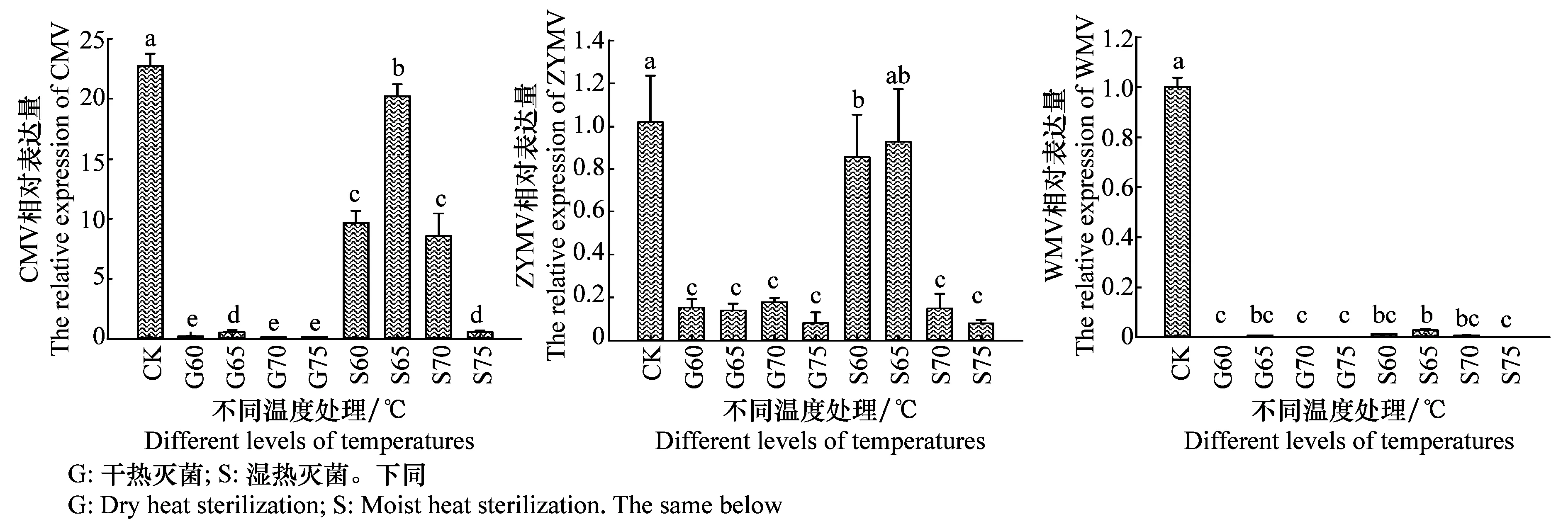
图4 经不同温度处理后的种子中CMV,ZYMV和WMV的相对表达量(P<0.05)Fig.4 Relative expression level of CMV, ZYMV and WMV after seed treatment with different temperatures(P<0.05)

图5 不同处理对种子发芽率及发芽势的影响Fig.5 The effect of different treatments on germinationrate and germination energy of seeds
葫芦科植物种传病毒种类虽不多,但大多数具有很高的检疫重要性。葫芦科种子一旦带毒率过高,通过种子贸易及远距离调运等,在适宜的温湿度下可引起葫芦科病毒病的大暴发,最终造成严重的经济损失,因此加强种子带毒检测,从源头控制病毒病害的蔓延,对籽用西葫芦产业的安全生产具有重要意义。本试验采用建立的多重PCR技术,在7种籽用西葫芦种子中成功检测到其携带的CMV、ZYMV和WMV。其中‘京丰9号’、‘瑞丰9号’、‘绿丰9号’和‘金葫360’ 这4个品种的种子带毒率均为100%,而‘粒丰9号’种子的带毒率仅60%。说明不同品种种子的带毒率不同。
由于生产实践中种子使用量大,实际操作人员专业技术有限,对种子直接进行脱毒处理是钝化病毒最简单有效的方法[8, 14]。日本和韩国针对黄瓜绿斑驳花叶病毒采取以干热处理为主的综合防治措施,卓有成效[15]。本试验采用60、65、70和75℃ 4个温度梯度干热和湿热处理籽用西葫芦种子,再用荧光定量PCR技术检测热处理后的种子中CMV、ZYMV及WMV的相对表达量。结果表明,在40℃处理24 h,70℃干热处理72 h条件下脱除CMV效果最好,ZYMV在75℃湿热处理10 min,冷水处理24 h下的脱毒效果最好,而WMV则在40℃处理24 h,60℃干热处理72 h条件下脱毒效果最好。本研究利用热处理可有效脱除籽用西葫芦种子携带的病毒,从源头阻断病毒的发生,研究方法可为籽用西葫芦病毒病的防治提供一定参考。
[1] 任琛荣, 郝小军, 都业娟, 等. 新疆石河子及新湖籽用西葫芦病毒病分子检测[J]. 北方园艺, 2016(1): 102-106.
[2] 林石明, 廖富荣, 陈青, 等. 葫芦科作物种传病毒及其检疫重要性[J]. 植物检疫, 2012, 26(1): 52-61.
[3] Zitter T A, Hopkins D L, Thomas C E. Compendium of cucurbit diseases [M]. St Paul, MN: The American Phytopathological Society, 1996.
[4] Fletcher J D, Wallace A R, Rogers B T.Potyvirusesin New Zealand buttercup squash(CucurbitsmaximaDuch.): Yield and quality effects of ZYMV and WMV 2 virus infections [J]. New Zealand Journal of Crop and Horticultural Science, 2000, 28(1): 17-26.
[5] Ranebennur H. Diagnosis and management ofPapayaringspotvirusin cucurbits [D]. Dharwad: College of Agriculture, Dharwad University of Agricultural Sciences, 2005.
[6] 吴会杰, 秦碧霞, 陈红运, 等. 黄瓜绿斑驳花叶病毒西瓜、甜瓜种子的带毒率和传毒率[J].中国农业科学, 2011, 44(7): 1527-1532.
[7] Roossinck M J. Pathogen profileCucumbermosaicvirus, a model for RNA virus evolution [J]. Molecular Plant Pathology, 2001,2(2): 59-63.
[8] Kim D H, Lee J M. Seed treatment forCucumbergreenmottlemosaicvirus(CGMMV) in gourd (Lagenariasiceraria) seeds and its detection [J]. Journal of the Korean Society for Horticultural Science, 2000, 41(1): 1-6.
[9] 王冲, 陈集双, 洪健, 等. 以18S rRNA 为内参照的多重RT-PCR检测 3种百合病毒[J]. 植物病理学报, 2006, 36(3): 204-211.
[10]牛建新, 马兵钢, 何梅, 等. 库尔勒香梨主要病毒多重RT-PCR 检测技术研究[J]. 植物病理学报, 2006, 36(1): 12-21.
[11]赵丽, 古勤生, 陈红运, 等. 葫芦科作物3种主要病毒的多重RT-PCR方法的建立[J]. 果树学报, 2008, 25(5): 703-707.
[12]何玮玲, 张驰, 杨静, 等. 食品中4种肉类成分多重PCR的快速鉴别方法[J]. 中国农业科学, 2012, 45(9): 1873-1880.
[13]李瑾, 毛乃颖, 秦萌, 等. GeXP多重PCR技术同时检测12种常见呼吸道病毒[J]. 病毒学报, 2011,27(6): 526-532.
[14]Dawson W O, Kuhn C W. Kinetics of multiplication, inactivation, and particle-breakdown ofCowpeachloroticmottlevirusin cowpea [J]. Phytopathology, 1974, 64(7): 951-957.
[15]蔡明, 李明福, 江东. 日本、韩国黄瓜绿斑驳花叶病毒发生及防控策略[J]. 植物检疫, 2010, 24(4): 65-68.
(责任编辑:杨明丽)
Detection of viruses in seeds of seed-zucchini and evaluation of heat treatment on virus elimination
Ren Chenrong, Zhou Dengpan, Du Yejuan, Xiang Benchun
(KeyLaboratoryatUniversitiesofXinjiangUygurAutonomousRegionforOasisAgriculturalPestManagementandPlantProtectionResourceUtilization,CollegeofAgriculture,ShiheziUniversity,Shihezi832003,China)
To determine whether seeds of seed-zucchini are infected by viruses and screen the efficient elimination method, the seed-borne virus rate was detected by multiplex RT-PCR, and virus elimination efficiency was evaluated by fluorescence real-time RT-PCR after moist and dry heat treatments under different temperatures. The result showed that CMV, ZYMV and WMV were detected from seedling of seed-zucchini, with the detection rates of 67.1%, 50.0% and 72.3%, respectively, while the composite detection rate was 66%. Different varieties of seed-zucchini seedling had different virus detection rates, the lowest ratio was 60% (‘Lifeng-9’) and the highest rate was 100% (‘Jingfeng-9’, ‘Ruifeng-9’, ‘Lvfeng-9’and ‘Jinhu360’). Wet and dry heat treatments had some influence on seed-borne virus rate. Dry heat treatments had the highest virus elimination rate for WMV, CMV and ZYMV at 60, 70 and 75℃, so did the wet heat treatment for the three viruses at 75℃.
seed-zucchini; seeds; seed-borne virus rate; seed treatment
2016-04-04
2016-06-03
兵团农作物病害安全防控创新团队(2101802CX7155)
S 436.3
A
10.3969/j.issn.0529-1542.2017.02.020
ExperimentalMethod&Technology
* 通信作者 E-mail: XBC@shzu.edu.cn
