蒙药益肾散的质量标准研究Δ
2017-03-29王美丽海祺山戴丽丽白玉霞内蒙古民族大学蒙医药学院内蒙古通辽0800通辽市科左中旗蒙医医院内蒙古通辽0900江西中医药大学药学院南昌0004
王美丽,海祺山,戴丽丽,田 香,白玉霞#(.内蒙古民族大学蒙医药学院,内蒙古通辽 0800;.通辽市科左中旗蒙医医院,内蒙古通辽 0900;.江西中医药大学药学院,南昌 0004)
蒙药益肾散的质量标准研究Δ
王美丽1*,海祺山2,戴丽丽1,田 香3,白玉霞1#(1.内蒙古民族大学蒙医药学院,内蒙古通辽 028300;2.通辽市科左中旗蒙医医院,内蒙古通辽 029300;3.江西中医药大学药学院,南昌 330004)
目的:建立蒙药益肾散的质量标准。方法:采用薄层色谱法(TLC)对制剂中大黄、诃子进行定性鉴别;采用高效液相色谱法测定制剂中芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚的含量:色谱柱为Inertsil C18,流动相为甲醇-0.1%磷酸溶液(梯度洗脱),流速为1.0 mL/min,检测波长为254 nm,柱温为35℃,进样量为10 μL。结果:大黄、诃子的TLC图斑点清晰,分离度好。芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚检测进样量线性范围分别为23.55~117.75 ng(r=0.999 9)、44.72~223.62 ng(r=0.999 8)、43.18~215.90 ng(r=0.999 7)、77.41~387.12 ng(r=0.999 9)、46.02~230.10 ng(r=0.999 7);精密度、稳定性、重复性试验的RSD<2.0%;加样回收率分别为95.80%~99.66%(RSD=1.21%,n=6)、95.01%~98.07%(RSD=0.92%,n=6)、95.06%~97.84%(RSD=0.50%,n=6)、95.19%~97.66%(RSD=1.07%,n=6)、95.07%~98.20%(RSD=0.95%,n=6)。结论:该研究所建标准可用于蒙药益肾散的质量控制。
蒙药益肾散;薄层色谱法;高效液相色谱法;含量测定
蒙药益肾散是内蒙古通辽市科左中旗蒙医医院肾病科专家海祺山的传统经验方,主要由诃子、大黄、方海等蒙药组成。该药已在临床应用40余年,主要用于急慢性肾炎、肾病综合征、肾功能不全等症的治疗。多年来运用该药每年治疗患者量达3 000人次,治愈率达85%。
为更好地控制该制剂质量,保证临床用药安全、有效,笔者对其进行了质量标准研究,采用薄层色谱法(TLC)对制剂中的主药大黄、诃子进行了定性鉴别,并以高效液相色谱法(HPLC)测定其中芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚的含量。
1 材料
1.1 仪器
LC-20ATvp型HPLC仪(包括SPD-M20Avp型检测器、SHIMADZU-VP色谱工作站)、AUW220型电子分析天平(日本Shimadzu公司);KQ-600DB型超声波清洗器(昆山市超声仪器有限公司,功率:250 W,频率:40 kHz);AUY120型电子分析天平(广州市新英电器有限公司);ZF-I型三用紫外分析仪(上海顾村电光仪器厂);JY02S型紫外分析仪(北京君意东方电泳设备有限公司)。
1.2 药品与试剂
益肾散(通辽市科左中旗蒙医医院自制,批号:20110207、20110406、20110711,规格:25 g);大黄酸对照品(批号:110757-201206,纯度:≥98%)、大黄素对照品(批号:110756-201210,纯度:≥98%)、大黄酚对照品(批号:110796-201209,纯度:≥98%)、大黄素甲醚对照品(批号:758-201206,纯度:≥98%)、芦荟大黄素对照品(批号:14031201,纯度:≥98%)、没食子酸对照品(批号:110831-200302,纯度:≥98%)、大黄对照药材(批号:20120823)、诃子对照药材(批号:20131106)均购自中国食品药品检定研究院;硅胶G(青岛海洋化工有限公司分厂);羧甲基纤维素钠(国药集团化学试剂有限公司);甲醇为色谱醇,其余试剂均为分析纯,水为纯化水。
2 方法与结果
2.1 定性鉴别
2.1.1 大黄 取样品2.0 g,加甲醇20 mL浸泡1 h,滤过,取滤液5 mL,蒸干;残渣加水10 mL使溶解,再加盐酸1 mL,加热回流30 min,立即冷却,用乙醚分2次振摇提取,每次20 mL,合并乙醚液,蒸干,残渣加三氯甲烷3 mL使溶解,经微孔滤膜(0.45µm)滤过,取续滤液,即得供试品溶液[12]。另取芦荟大黄素、大黄酸、大黄素、大黄酚对照品适量,加甲醇制成质量浓度均为1 mg/mL的单一对照品溶液。再取大黄对照药材1 g,按供试品溶液制备方法制成对照药材溶液。按TLC法[2015年版《中国药典》(四部)][2]试验,吸取上述6种溶液各4~8 μL,分别点于同一以羧甲基纤维素钠为黏合剂的硅胶G薄层板上,以环己烷-乙酸乙酯-甲酸(12∶8∶1,V/V/V)为展开剂,预饱和20 min,展开,取出,晾干,置紫外光灯(365 nm)下检视。结果,供试品色谱中,在与对照药材和对照品色谱相应位置上显相同颜色的斑点,详见图1。
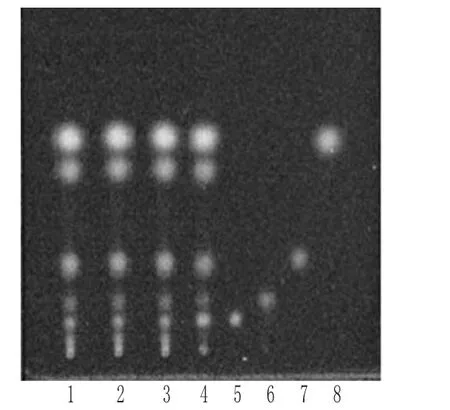
图1 大黄的薄层色谱图Fig 1 TLC of Rheum palmatum
2.1.2 诃子 取样品2.0 g,加甲醇15 mL,超声处理30 min,滤过,经微孔滤膜(0.45 μm)滤过,取续滤液,即得供试品溶液[3-4]。另取没食子酸对照品适量,以甲醇为溶剂制成1 mL含1.5 mg的对照品溶液。再取诃子对照药材1 g,按供试品溶液制备方法制成对照药材溶液。吸取上述3种溶液各4~8 μL,分别点于同一以羧甲基纤维素钠为黏合剂的硅胶G薄层板上,以氯仿-乙酸乙酯-甲酸(6∶4∶1,V/V/V)为展开剂,预饱和20 min,展开,取出,晾干,喷以2%三氯化铁乙醇溶液,105℃加热至斑点显色清晰,置日光下检视。结果,供试品色谱中,在与对照药材和对照品色谱相应位置上显相同颜色的斑点,详见图2。
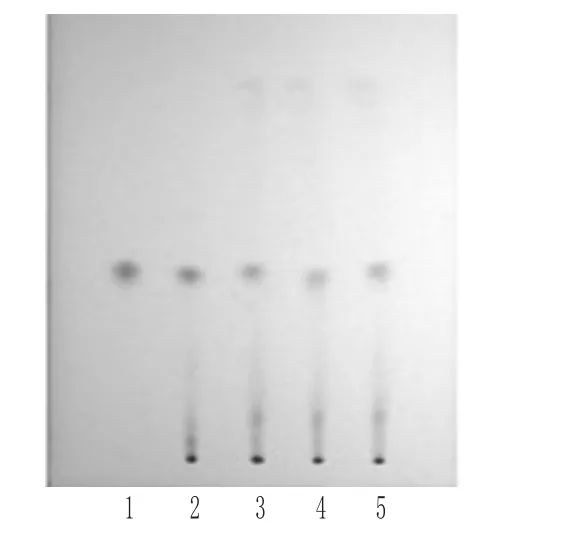
图2 诃子的薄层色谱图Fig 2 TLC of Terminalia chebula
2.2 含量测定
2.2.1 色谱条件 色谱柱:Inertsil C18(150 mm×4.6 mm,5 μm);流动相:甲醇(A)-0.1%磷酸溶液(B),梯度洗脱(0.01~15 min,58%→60%A;15~40 min,60%→82%A;40~50 min,82%→70%A;50~55 min,70%→58%A);流速:1.0 mL/mim;检测波长:254 nm;柱温:35℃;进样量:10 μL[5-8]。
2.2.2 混合对照品溶液 分别精密称取芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚7.85、8.98、7.22、7.74、7.67 mg,各置于50 mL量瓶中,加甲醇制成芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚质量浓度分别为157.0、179.6、144.4、154.8、153.4µg/mL的单一对照品贮备液。精密吸取上述单一对照品贮备液适量,置于同一10 mL量瓶中,加甲醇定容,制成芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚质量浓度分别为47.1、89.45、86.4、154.8、92.04µg/mL的混合对照品溶液。
2.2.3 供试品溶液 取样品1 g,精密称定,置于具塞锥形瓶中,精密加甲醇25 mL,称定质量,加热回流1 h,放冷,再次称定质量,用甲醇补足减失的质量,摇匀,滤过;挥干溶剂,残渣加8%盐酸溶液10 mL,超声处理2 min,再加三氯甲烷10 mL,加热回流1 h,冷却,置于分液漏斗中,用少量三氯甲烷洗涤容器,并入分液漏斗中;分取三氯甲烷层,酸液再用三氯甲烷提取4次,每次10 mL,合并三氯甲烷液,减压回收溶剂至干,残渣加甲醇使溶解,转移至10 mL量瓶中,加甲醇定容,摇匀,经微孔滤膜(0.45µm)滤过,取续滤液,即得。
2.2.4 系统适用性试验 取“2.2.2”“2.2.3”项下混合对照品溶液、供试品溶液适量,按“2.2.1”项下色谱条件进样测定,记录色谱,详见图3。结果,供试品溶液与混合对照品溶液均在相同保留时间处出现芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚吸收峰,且与其他组分峰达到基线分离,分离度均>1.5;理论板数以大黄素峰计>3 000。

图3 高效液相色谱图Fig 3 HPLC chromatograms
2.2.5 线性关系考察 分别精密量取“2.2.2”项下混合对照品溶液2.5、5、7.5、10、12.5 μL,按“2.2.1”项下色谱条件进样测定,记录峰面积。以待测成分进样量(x,ng)为横坐标、峰面积(y)为纵坐标进行线性回归,得回归方程与线性范围,详见表1。
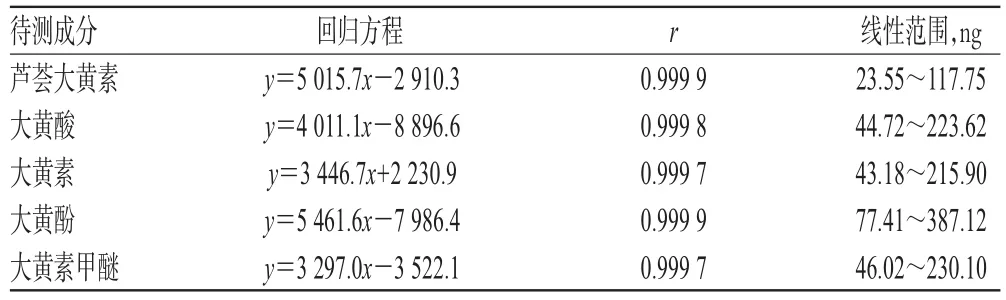
表1 回归方程与线性范围Tab 1 Regression equation and linear ranges
2.2.6 精密度试验 取“2.2.2”项下混合对照品溶液适量,按“2.2.1”项下色谱条件连续进样测定6次,记录峰面积。结果,芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚峰面积的RSD分别为0.85%、1.25%、0.88%、0.92%、1.20%(n=6),表明仪器精密度良好。
2.2.7 稳定性试验 取“2.2.3”项下供试品溶液(批号:20110207)适量,分别于室温下放置0、2、4、6、8、10、12 h时按“2.2.1”项下色谱条件进样测定,记录峰面积。结果,芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚峰面积的RSD分别为1.41%、1.60%、1.38%、1.63%、1.31%(n=7),表明供试品溶液在室温放置12 h内基本稳定。
2.2.8 重复性试验 精密称取同一批样品(批号:20110207)适量,按“2.2.3”项下方法制备供试品溶液,共6份,再按“2.2.1”项下色谱条件进样测定,记录峰面积并计算含量。结果,芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚平均含量分别为0.48、0.66、0.85、1.48、0.53 mg/g,RSD分别为0.41%、0.60%、0.78%、0.74%、0.66%(n=6),表明本方法重复性良好。
2.2.9 加样回收率试验 取已知含量样品(批号:20110207)适量,共6份,分别加入一定质量待测成分对照品,按“2.2.3”项下方法制备供试品溶液,再按“2.2.1”项下色谱条件进样测定,记录峰面积并计算加样回收率,结果见表2。

表2 加样回收率试验结果(n=6)Tab 2 Results of recovery tests(n=6)
2.2.10 样品含量测定 取3批样品各适量,分别按“2.2.3”项下方法制备供试品溶液,再按“2.2.1”项下色谱条件进样测定,记录峰面积并计算样品含量,结果见表3。

表3 样品含量测定结果(n=3,mg/g)Tab 3 Results of contents determination of samples(n=3,mg/g)
3 讨论
制剂中大黄、诃子的TLC鉴别借鉴了2015年版《中国药典》方法,展开剂比例作了适当调整,结果均能达到良好分离,斑点清晰,重复性好。
笔者采用HPLC测定制剂中5种蒽醌类成分的含量时,流动相的磷酸溶液设置范围为0.1%~0.4%。结果,磷酸溶液体积分数为0.1%时色谱峰的对称度较好。笔者曾比较了不同比例的乙腈-水、甲醇-水、甲醇-水-磷酸等多种溶剂系统作为流动相,结果以甲醇-0.1%磷酸溶液作为流动相时,色谱峰形好,保留时间适宜,分离效果较好。
综上所述,本研究所建标准可用于蒙药益肾散的质量控制。
[1] 任伟光,王琦,黄林芳.大黄类药材的质量评价进展[J].中南药学,2014,12(4):354-356.
[2] 国家药典委员会.中华人民共和国药典:四部[S].2015年版.北京:中国医药科技出版社,2015:57-57.
[3] 张幸福,才毛,骆桂法,等.藏药十味诃子丸的质量控制[J].中国实验方剂学杂志,2014,20(9):51-53.
[4] 李洋,吴剑坤,黄健,等.清肺丸显微与薄层色谱鉴别研究[J].北京中医药,2013,32(6):457-460.
[5] 杜连平,袁发荣.藏成药青鹏胶囊质量标准研究[J].中成药,2010,32(8):1450-1452.
[6] 魏艳婷,张静宜,张华潭.HPLC法同时测定三黄滴丸中5种蒽醌类成分的含量[J].中国药房,2015,26(27):3867-3869.
[7] 白玉霞,散丹,吴双英.HPLC法测定蒙药给喜古讷-6中大黄酸、大黄素及大黄酚的含量[C]//世界中医药联合会中药化学专业委员会.第二届学术年会暨胡杨林论坛论文集,2013:178-180.
[8] 许乾丽,茅向军,宋晓宁,等.HPLC法同时测定六味安消胶囊中芦荟大黄素、大黄酸、大黄素、大黄酚和大黄素甲醚的含量[J].药物分析杂志,2010,30(10):1841-1843.
Study on the Quality Standard for Mongolian Medicine Yishen Powder
WANG Meili1,HAI Qishan2,DAI Lili1,TIAN Xiang3,BAI Yuxia1(1.College of Mongolian Medicine,Inner Mongolia University for the Nationalities,Inner Mongolia Tongliao 028300,China;2.Tongliao Kezuozhongqi Mongolian Hospital,Inner Mongolia Tongliao 029300,China;3.School of Pharmacy,Jiangxi University of Traditional Chinese Medicine,Nanchang 330004,China)
OBJECTIVE:To establish the quality standard for Mongolian medicine Yishen powder.METHODS:TLC was used for the qualitative identification of Rheum palmatum and Terminalia chebula in the preparation;HPLC was used for the contents determination of aloe emodin,rhein,emodin,chrysophanol and physcion:the column was Inertsil C18with mobile phase of methanol-0.1%phosphoric acid(gradient elution)at a flow rate of 1.0 mL/min,detection wavelength was 254 nm,column temperature was 35℃ and the injection volume was 10 μL.RESULTS:The TLC pots of R.palmatum and T.chebula were clear and well-separated,negative control without interference.The linear range was 23.55-117.75 ng for aloe emodin(r=0.999 9),44.72-223.62 ng for rhein(r=0.999 8),43.18-215.90 ng for emodin(r=0.999 7),77.41-387.12 ng for chrysophanol(r=0.999 9)and 46.02-230.10 ng for physcion(r=0.999 7);RSDs of precision,stability and reproducibility tests were lower than 2.0%;recoveries were 95.80%-99.66%(RSD=1.21%,n=6),95.01%-98.07%(RSD=0.92%,n=6),95.06%-97.84%(RSD=0.5%,n=6),95.19%-97.66 %(RSD=1.07%,n=6)and 95.07%-98.20%(RSD=0.95%,n=6).CONCLUSIONS:The established standard can be used for the quality control of Mongolian medicine Yishen powder.
Mongolian medicine Yishen powder;TLC;HPLC;Content determination
R917;R927
A
1001-0408(2017)06-0823-04
2016-02-23
2016-05-08)
(编辑:张 静)
通辽市与内蒙古民族大学科技合作项目(No. SXZD2012011)
*硕士研究生。研究方向:蒙药及复方制剂质量标准。电话:0475-8314242
#通信作者:教授,硕士生导师,博士。研究方向:蒙药材及蒙药制剂质量标准。E-mail:byx6088@163.com
DOI10.6039/j.issn.1001-0408.2017.06.28
