剪凝法肝切除初步经验
2017-03-29肖亮周乐杜王志明
肖亮,周乐杜,王志明
(中南大学湘雅医院 普通外科,湖南 长沙 410008)
手术时间长和术中大量出血是增加肝切除术后患者病死率和并发症发生率的重要因素之一[1-3]。而且,出血和随后的大量输血还可能升高术后肝癌复发率,降低患者的总生存率[4-7]。术中出血主要集中在肝实质离断过程中,目前的血流控制方法(例如肝门部血流阻断,术中低中心静脉压等)在减少出血的同时也会使肝脏受到缺血再灌注损伤[8-10],因此,优化肝实质离断技术被认为是减少术中出血的关键[11-12]。
自上世纪70年代“钳夹法”[13]问世以来,许多高科技手术器械例如超声刀、超声吸引刀(CUSA)、水刀、氩气刀等已被用于临床。然而,它们均有各自的缺点。例如“钳夹法”有一定的盲目性,可能导致严重出血;超声刀不具备分离肝内脉管系统的功能;CUSA和水刀没有电凝止血的功能,且分离速度较慢,尤其是当患者肝硬化明显时;氩气刀主要用于肝创面的止血[14]。另外,除“钳夹法”外,上述器械的使用收费都比较贵,加重了患者经济负担。
目前已有3篇Meta分析发现使用这些器械的术中出血量与“钳夹法”无显著差异[15-17],因此,外科医生仍根据个人喜好选择使用各种不同的断肝方法。在过去的外科实践中,笔者发现单纯使用组织剪和双极电凝就可以简便而迅速离断肝实质,清晰暴露肝内脉管系统,而术中出血量少,断肝时间和患者住院时间均较短。笔者将上述方法称为剪凝法(snip-electrocoagulation technique,SET),本研究的主要目的是介绍此方法在肝实质离断方面的技术特点,评估其安全性和有效性。
1 资料与方法
1.1 临床资料
分析2015年6月―2016年2月间在中南大学湘雅医院普通外科行肝切除术的30例肝肿瘤患者(表1)的临床资料。由同一组医生使用剪凝法完成手术。手术范围(术式)见表2。

表1 30例患者的疾病类型Table 1 Types of diseases of the 30 patients

表2 肝切除的术式(切除范围)Table 2 Procedures of liver resection (surgical scopes)
1.2 凝剪法
1.2.1手术器械 普通组织剪与双极电凝镊,电凝功率选择70 W,使用时给镊尖滴水降温,以防结痂(图1)。
1.2.2手术方法 根据肿块的位置和大小选择肋沿下反L或Y型腹部切口,分离镰状韧带等肝周韧带,充分游离肿块;使用Pringle方法间歇性阻断第一肝门(每阻断15 min放开5 min);肿块比较大时,预置肝上、肝下下腔静脉阻断带以备出血时阻断血流用;用电刀在肝表面划出预切线,必要时使用术中超声定位肿块。切线两旁的肝实质用7号丝线U型缝合数针以作牵引,并在整个切除过程中保持适当张力(注意勿暴力牵拉撕裂肝实质导致出血)。肝脏离断时间和术中出血量从断肝的开始计算至断肝结束。
剪凝法手术要点:⑴ 剪,对距肝表面2cm以内的肝组织用组织剪由浅入深,由前向后锐性剪开(图2A);⑵ 推,对较深在的肝组织则以组织剪平行推开肝实质以显露Glission鞘或肝静脉(图2B);⑶ 凝,行程中配合双极电凝凝固肝实质止血(图1B),对1 mm直径以下的Glission系统和2 mm直径以下的肝静脉直接电凝后剪断(图2A);⑷ 扎,遇直径较大的脉管,用组织剪推开肝实质暴露出5 mm左右行程,再予2-0/3-0丝线结扎后离断(图2C)。肝静脉主干或二、三级肝蒂加用缝扎,避免丝线滑脱。对肝静脉上的小破口,用4-0或5-0 prolene线缝合止血。如此直至肝脏肿块切除,肝断面用双极电凝彻底止血,再用白纱布印压,确证无胆汁渗漏后,结束手术,无需褥式缝合肝断面(图2D)。肝断面周围或右膈下放置28号腹腔引流管1根。术后常规抗感染,护肝等治疗,必要时补充白蛋白。
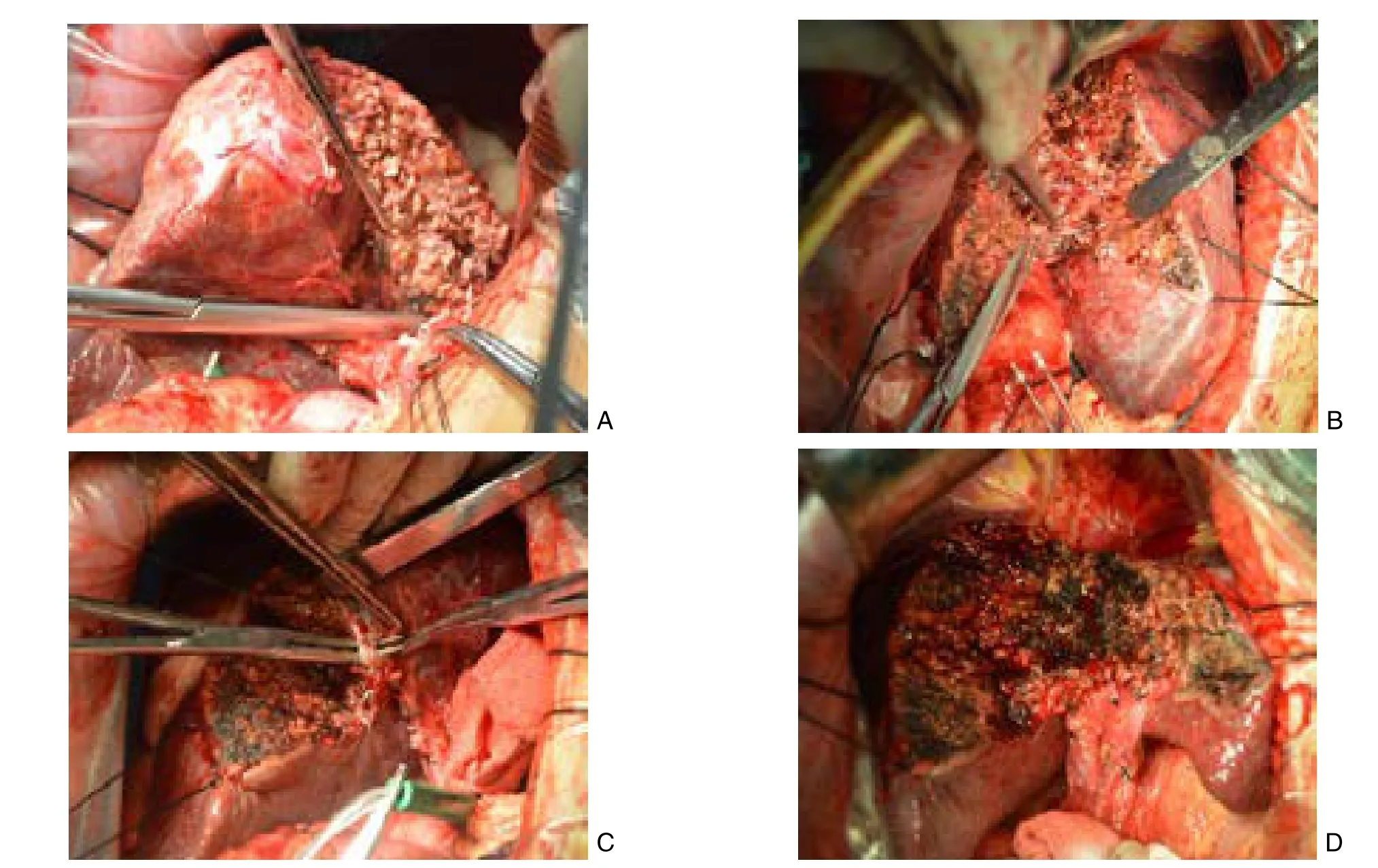
图2 剪凝法肝切除 A:剪刀剪开距肝表面2cm内的肝实质,直径1 mm以下的Glission鞘,2 mm以下的肝静脉分支直接电凝止血;B:较深的肝实质用剪刀推开以暴露肝内管道;C:对于直径较大的管道结构,暴露约5 mm的行程,2-0/3-0丝线结扎后离断;D:肝断面继续双极电凝止血,再用白纱布按压以确认有无出血和胆汁漏(肝断面一般不须褥式缝合)Figure 2 Snip-electrocoagulation technique in hepatectomy A: Snipping the liver parenchyma confined within 2cm from the surface of the liver with scissors, and directly coagulating the Glission’s sheath with a diameter no more than 1 mm and hepatic vein branches with a diameter no more than 2 mm with electrocoagulation; B: Separating the deeper liver parenchyma with scissors to expose the intrahepatic ducts; C: For ducts with larger diameters, exposing approximately 5 mm of their lengths, and then dividing them after ligation with 2-0/3-0 suture; D: Coagulating the cutting surface of the liver with bipolar electrocoagulation for hemostasis, then compressing with a white gauze for confirmation of the absence of bleeding or bile leakage (mattress-type suture usually not required for the cutting surface of the liver)

图1 剪凝法中使用的器械 A:组织剪;B:双极电凝Figure 1 Devices for snip-electrocoagulation method A: Tissue scissors; B: Bipolar electrocoagulation scalpel
1.3 统计学处理
两组数据比较先采用Shapiro-Wilk法结合直方图检验数据是否正态分布,数据以均数±标准差(±s)或中位数(范围)[M(范围)]表示。采用Levene法检验方差齐性。对满足正态分布和方差齐性的采用独立样本t检验,对不满足正态分布或方差齐性的数据采用非参检验中的Kruskal-Wallis和Mann-Whitney法比较组间差异[18]。检验水准α=0.05,P<0.05为差异具有统计学意义。
2 结 果
2.1 患者一般资料及分组
本组男22例,女8例;合并症包括高血压8例,糖尿病5例,冠心病2例,慢性阻塞性肺疾病1例。因乙肝肝硬化导致的肝癌24例,另外,不伴有肝硬化的血管瘤4例,局灶性结节性增生1例,肝囊腺瘤1例(表1)。所有患者肝功能为Child A级,ICG-R15平均为8.9%(6.3%~17.7%),残肝体积使用XP-Liver Myrian软件计算,平均为50.2%(40.3%~87.7%)。
按照肝切除范围,将患者分为3组,A组:10例患者接受1个肝段切除;B组:12例患者接受2个肝段切除;C组:8例患者接受半肝切除,包括3例左半肝,2例右半肝,另外3例非解剖性半肝切除(表2)。按照是否有肝硬化,将患者分为D组(24例有肝硬化)和E组(6例无有肝硬化)。
2.2 手术相关指标比较
患者平均年龄、断肝时间、手术时间、术中出血量和住院时间分别为49.9(31~69)岁、19.8(12~38)min、129.3(80~180)min、207.5(60~600)mL、7.1(5~14)d。A组患者的断肝时间、手术时间和术中出血量略少于B组(P>0.05),但明显少于C组(P<0.05);A、B、C组患者的住院时间接近。另外,D组和E组的断肝时间,手术时间差异不大,但前者的术中出血量明显较少(P<0.05)(表3)。所有患者均未输血。

表3 不同肝切除范围及有无肝硬化患者的临床指标比较Table 3 Comparison of the clinical variables among patients undergoing different resection scopes or between patients with and without liver cirrhosis
2.3 术后处理及并发症
术后腹腔引流液<100 mL/d,引流管于术后3~5 d拔除,胆红素和转氨酶1周内基本恢复正常。术后第3天的白蛋白,总胆红素,谷丙转氨酶和凝血酶原时间分别为(36.2±2.2)g/L、(27.9±11.1)μmol/L、(261.6±127.4)U/L、(15.9±0.9)s。
4例患者发生6次并发症:4例肝癌患者出现胸腹水,其住院时间7~12 d,通过补充白蛋白,利尿,胸腔置管引流等治愈。伴有慢性阻塞性肺病的1例患者发生肺炎,经抗感染治疗治愈。1例接受左半肝切除的肝癌患者发生胆汁漏,平均引流量约60 mL/d,通过保守治疗,于术后第7天停止。术后1个月无再出血或死亡病例。
2.4 随访
本组患者随访时间10~18个月,24例肝癌患者复发5例,其中2例死于肿瘤恶病质,多器官功能衰竭,3例行复发性肝癌射频消融术,其余患者生存状态良好。
3 讨 论
肝脏是人体最大的实质性脏器,在肝内,Glission系统和肝静脉系统纵横交错,解剖复杂,使肝切除术在很长一段时间内成为普外科的一个难点。自Langenbuch于1888年完成第1例左肝外叶切除以来,经过几代外科医生的不懈努力,肝脏外科已经取得长足进步。尤其是1940年以后,伴随着抗生素,输血技术,麻醉技术,和对肝脏解剖的系统研究,到1950年以后,外科医生已经能够完成复杂的右肝切除,甚至肝移植手术。
20世纪90年代出现的“损伤控制外科”认为低温,酸中毒和凝血功能障碍是严重威胁患者的“致死三联症”:手术时间越长,患者的体温越低,将导致酸中毒,影响凝血因子活性,加重出血和低体温,从而形成恶性循环。另一方面,手术时间长,术中大量出血、输血,会增加肝脏手术患者的病死率和并发症发生率[1-6]。而肝实质离断技术的优劣直接影响术中出血量和输血量的多少[4-6,19]。21世纪出现的“精准肝切除”[20]是一个全新的肝脏外科理论和实践体系,强调通过最小的创伤达到切除病灶,最大程度保护肝脏的目的。中南大学湘雅医院肝脏外科在实践中充分应用这一先进理念,术前通过ICG-R15检查和三维手术计划系统制定“个体化”手术方案,不断改进断肝技术,使患者得到最大获益[21]。
目前,断肝技术经过“指折法”,“钳夹法”,“刮吸法”等阶段,已经日趋成熟。近年来,随着一些高科技手术器械,例如超声刀、CUSA、水射刀、氩气刀、彭氏多功能手术分离器[14]的应用,极大简化并促进了肝切除术的普及。作为华中地区最大的肝脏外科中心之一,笔者感受到,由于肝内解剖的复杂性,上述器械均各有优缺点。例如:⑴ 钳夹法具有一定的盲目性,操作时过于粗暴可能损伤肝内血管,导致大出血。小的血管或胆管可能在钳夹过程中被损伤,或在大块结扎组织时滑脱,导致出血或胆汁漏。⑵ 超声刀可凝固浅表肝实质及小的管道,但并不具备分离肝内管道的能力,操作过程中亦可能损伤血管导致出血。⑶ CUSA和水刀通过高频超声震荡或高压水流分离肝实质,以显露肝内脉管系统,使其方便结扎离断。但是,它们均无凝固肝实质止血的功能,并且价格昂贵。另外,CUSA和水刀分离速度较慢,尤其是当患者的肝硬化比较明显时。另有报道[22]其在使用时产生的飞沫可能传播乙肝病毒。⑷ 氩气刀主要用于肝断面渗血的处理,它同样不具备分离肝内管道的能力。⑷ 彭淑牖教授发明的彭氏多功能手术分离器可用于肝内管道的分离,同时吸走肝组织碎片及渗血。它集吸引,电凝,切割及分离4种功能于一体,不必频繁更换手术器械,在缩短手术时间,减少术中出血,提高手术质量方面具有积极作用[14,23-24]。但当患者肝硬化比较明显时,不易掌握刮耙力度,从而降低了手术效率。
在长期的外科实践中,随着手术技巧的提高,笔者发现,使用剪刀和双极电凝就可快速而简便地分离肝实质,暴露肝内管道(包括白色厚壁的Glission系统和蓝色薄壁的肝静脉系统),减少勿损伤及出血,特别是当患者肝硬化较明显时效果更好。不像“钳夹法”,经常需要对肝断面出血点进行缝扎止血,经上述方法获得的肝断面在肝门阻断间隙几乎不出血,手术视野清晰(图2D)。由于切除范围不同,本组接受一个肝段切除的患者手术时间和术中出血量显著少于行半肝切除的患者,这一点不难理解。值得注意的是,本组有肝硬化的患者术中出血量少于无肝硬化的患者。笔者体会可能与下列因素有关:发生纤维化的肝实质具有一定的韧性,肝门阻断后,在手术牵拉、推剪过程中,不容易出血;一些小的血管不易发生撕脱出血,使用双极电凝的止血效果好。而本组非肝硬化的患者绝大部分(4/6)为肝血管瘤,肝实质质地脆,肿瘤周围血供丰富,分离过程中易渗血,增加了术中出血量。笔者将该断肝方法命名为剪凝法,它符合“精准肝切除”的原则。对比Chen等[12]的前瞻性研究,其接受传统“钳夹法”患者的断肝时间、手术时间、术中出血量和术后住院时间分别为(25.5±12.2)min、(175.7±62.8)min、(376.7±303.7)mL、(8.7±2.0)d;本研究显示剪凝法在以上几方面更有优势,且术后仅4例(13.3%)患者发生6次并发症(4例胸腹水,1例肺炎,1例胆汁漏),通过保守治疗均治愈。术后1个月无再出血或死亡病例。说明剪凝法应用于肝切除是安全有效的。
总之,剪凝法具有如下优势:⑴ 对手术器械的要求简单(组织剪和双极电凝)、经济,有利于降低患者住院费用,适合在各级医院推广。⑵ 它简化了肝实质的离断,术野清晰,特别适合于肝硬化较明显,或者肿块靠近肝内大血管,需要精细解剖的病例。⑶ 在肝实质离断同时,双极电凝对肝断面进行止血,可节约手术时间,减少术中出血量。⑷ 术后患者恢复快,住院时间短。⑸ 有利于对肝内解剖的认识,提高手术技巧。然而,剪凝法的顺利实施有赖于主刀与助手的良好配合,否则,可能加重出血,尤其当患者没有肝硬化时。相信随着熟练程度的提高,上述缺点可以被克服。本文不足之处在于仅行队列内对照,未涉及与传统断肝方法的比较。还需继续扩大样本量,通过前瞻性临床对照研究,进一步验证剪凝法相对于其他断肝方法的优势,探讨其与其他外科器械联用的价值。
[1] Al-Alem F, Mattar RE, Fadl OA, et al. Morbidity and mortality and predictors of outcome following hepatectomy at a Saudi tertiary care center[J]. Ann Saudi Med, 2016, 36(6):414–421.
[2] Harimoto N, Shirabe K, Ikegami T, et al. Postoperative complications are predictive of poor prognosis in hepatocellular carcinoma[J]. J Surg Res, 2015, 199(2):470–477. doi: 10.1016/j.jss.2015.06.012.
[3] Felekouras E, Petrou A, Neofytou K, et al. Combined ultrasonic aspiration and saline-linked radiofrequency precoagulation: a step toward bloodless liver resection without the need of liver inflow occlusion: analysis of 313 consecutive patients[J]. World J Surg Oncol, 2014, 12: 357. doi: 10.1186/1477–7819-12–357.
[4] Schiergens TS, Rentsch M, Kasparek MS, et al. Impact of perioperative allogeneic red blood cell transfusion on recurrence and overall survival after resection of colorectal liver metastases[J]. Dis Colon Rectum, 2015, 58(1):74–82. doi: 10.1097/DCR.0000000000000233.
[5] Chen JS, Huang JQ, Chen XL, et al. Risk Factors Associated with Intraoperative Major Blood Loss during Resection of Hepatocellular Carcinoma[J]. Hepatogastroenterology, 2015, 62(140):790–793.
[6] Wahab MA, Shehta A, Hamed H, et al. Predictors of recurrence in hepatitis C virus related hepatocellular carcinoma after hepatic resection: a retrospective cohort study[J]. Eurasian J Med, 2014,46(1):36–41. doi: 10.5152/eajm.2014.07.
[7] Franssen B, Jibara G, Tabrizian P, et al. Actual 10-year survival following hepatectomy for hepatocellular carcinoma[J]. HPB(Oxford), 2014, 16(9):830–835. doi: 10.1111/hpb.12206.
[8] Ni JS, Lau WY, Yang Y, et al. A prospective randomized controlled trial to compare pringle manoeuvre with hemi-hepatic vascular inflow occlusion in liver resection for hepatocellular carcinoma with cirrhosis[J]. J Gastrointest Surg, 2013, 17(8):1414–1421. doi:10.1007/s11605–013-2236-z.
[9] Ukere A, Meisner S, Greiwe G, et al. The influence of PEEP and positioning on central venous pressure and venous hepatic hemodynamics in patients undergoing liver resection[J]. J Clin Monit Comput, 2016, doi: 10.1007/s10877–016-9970–1. [Epub ahead of print]
[10] Maurer CA, Walensi M, Käser SA, et al. Liver resections can be performed safely without Pringle maneuver: A prospective study[J].World J Hepatol, 2016, 8(24):1038–1046. doi: 10.4254/wjh.v8.i24.1038.
[11] Bucur P, Bekheit M, Audebert C, et al. Simplified technique for 75% and 90% hepatic resection with hemodynamic monitoring in a large white swine model[J]. J Surg Res, 2016, 209:122–130. doi:10.1016/j.jss.2016.09.018.
[12] Chen JM, Geng W, Zhang S, et al. Randomized clinical trial of BiClamp® forceps versus clamp-crushing technique in open liver resection[J]. J Hepatobiliary Pancreat Sci, 2016, doi: 10.1002/jhbp.424. [Epub ahead of print]
[13] Lin TY. Results in 107 hepatic lobectomies with a preliminary report on the use of a clamp to reduce blood loss[J]. Ann Surg,1973, 177(4):413–321.
[14] Peng SY, Li JT. “Curettage and aspiration dissection technique”using PMOD for liver resection[J]. HPB (Oxford),2008, 10(4): 285–288. doi: 10.1080/13651820802167151.
[15] Gurusamy KS, Pamecha V, Sharma D, et al. Techniques for liver parenchymal transection in liver resection[J]. Cochrane Database Syst Rev, 2009, 21(1):CD006880. doi: 10.1002/14651858.CD006880.pub2.
[16] Rahbari NN, Koch M, Schmidt T, et al. Meta-Analysis of the Clamp-Crushing Technique for Transection of the Parenchyma in Elective Hepatic Resection: Back to Where We Started?[J]. Ann Surg Oncol, 2009, 16(3):630–639. doi: 10.1245/s10434–008-0266–7.
[17] Moggia E, Rouse B, Simillis C, et al. Methods to decrease blood loss during liver resection: a network meta-analysis[J]. Cochrane Database Syst Rev, 2016, 10:CD010683.
[18] Kramer JM, Kochinke K, Oortveld MA, et al. Epigenetic regulation of learning and memory by Drosophila EHMT/G9a[J]. PLoS Biol,2011, 9(1):e1000569. doi: 10.1371/journal.pbio.1000569.
[19] Muratore A, Mellano A, Tarantino G, et al. Radiofrequency vessel-sealing system versus the clamp-crushing technique in liver transection: results of a prospective randomized study on 100 consecutive patients[J]. HPB (Oxford), 2014, 16(8):707–712. doi:10.1111/hpb.12207.
[20] Qian NS, Liao YH, Cai SW, et al. Comprehensive application of modern technologies in precise liver resection[J]. Hepatobiliary Pancreat Dis Int, 2013, 12(3):244–250.
[21] 王志明, 陶一明, 黄云, 等. 联合肝脏离断和门静脉切断二步肝切除术在肝炎后肝硬化肝癌中的应用[J]. 中国普通外科杂志,2014, 23(7):867–872. doi: 10.7659/j.issn.1005–6947.2014.07.001.Wang ZM, Tao YM, Huang Y, et al. Associating liver partition and portal vein ligation for staged hepatectomy procedure in treatment of hepatocellular carcinoma with post-hepatitic cirrhosis[J]. Chinese Journal of General Surgery, 2014, 23(7):867–872. doi: 10.7659/j.issn.1005–6947.2014.07.001.
[22] Matsumata T, Kanematsu T, Okodme K, et al. Possible transmission of serum hepatitis in liver surgry with the ultrasonic dissector[J].Surgery, 1991, 109(3 Pt 1):284–285.
[23] Peng SY. Surgical Instrument and Dissection Technique[A].In: Hepatic Caudate Lobe Resection[M]. Hangzhou: Zhejiang University Press, 2010:15–19.
[24] Peng SY , Li JT , Tan ZJ. Open Hepatic Transection Using PMOD[M]. Springer Milan, 2012:23–28.
