血清钾、钠水平在闭合性肝损伤分级及治疗中的指导意义
2017-03-29黄超张坤江艺
黄超,张坤,江艺
(福建医科大学福总临床医学院/南京军区福州总医院 肝胆外科,福建 福州350025)
肝脏血供及神经纤维丰富,质地较脆易损伤,是较常见的腹部实质脏器损伤, 在各种腹部外伤中约占20~30%,发病率仅次于脾破裂,位居第二[1]。肝脏损伤若得不到及时、有效的救治,病死率高达55% ~75% 。因此,对肝脏损伤早期及时的诊断、损伤程度的准确判断以及合理的治疗是降低病死率、减少并发症的关键。机体创伤后低血钾有较高的发生率,尤其出现在年轻的、严重创伤的患者[2]。CT检查对肝损伤的诊断及分级具有高度的特异性、敏感性和准确性,能够清晰地显示病变的范围及部位,为选择治疗方案提供重要依据,但需搬动患者,因此仅适用于病情稳定而又需明确诊断者[3]。近年来,有研究[4]提出,闭合性肝损伤后血清K+的监测有重要意义,在严重肝损伤中血清K+水平会显著降低。因此,为了判断血清K+、Na+水平与患者肝损伤的相关性,笔者对此类患者血清K+、Na+的值进行分析,旨在探讨血清K+、Na+水平在闭合性肝损伤分级中的应用价值。
1 资料与方法
1.1 一般资料
回顾性分析2003年 9月—2016年1月我院收治的129例腹部闭合性损伤患者的临床资料,排除经外院治疗后转入我科、合并腹腔其他脏器损伤、腹部穿透伤、肝癌或血管瘤破裂出血及存在引起低钾的基础疾病:如醛固酮增多症、高血压长期服用利尿剂、服用β受体药物、甲亢等患者,根据有无肝损伤分为肝损伤和非肝损伤两组。按照美国创伤外科学会-器官损伤分级(AAST-OIS)及影像学Becker分级[5]。I、II级为轻度肝损伤,III、IV、Ⅴ级为严重肝损伤,损伤程度分级根据外科手术或CT检查来确定。肝损伤组102例,男71例,女31例;包括I级20例,II级37例,III级21例,IV级24例。非肝损伤组27例,男23例,女4例。平均年龄(38±20)岁。高空坠落伤13例,车祸伤59例,撞击伤14例,挤压伤12例,摔伤31例。各级肝损伤组及非肝外伤组间年龄(P=0.90)及性别(P=0.053)、致伤原因(P=0.30)差异无统计学意义(表1)。均为急诊初入我院 ,患者受伤至入院时间为0.5~12 h,入院后即急查肝功、生化。检验均采用日本全自动生化分析仪OLYMPUS AU2700检验仪器进行,试剂均由仪器厂家配套提供。我院检验数据的参考值范围:K+3.7~5.4 mmol/L,Na+136~145 mmol/L。
1.2 肝破裂分级
美国创伤外科学会-器官损伤分级(AASTOIS)肝破裂分级。I级:血肿位于被膜下,<10%肝表面积;被膜撕裂,实质裂伤深度<1cm。II级:血肿位于被膜下,10%~50%肝表面积;实质内血肿直径<10cm;实质裂伤深度1~3cm,长度<10cm。III级:血肿位于被膜下,>50%肝表面积或仍在继续扩大;被膜下或实质部血肿破裂,实质内血肿>10cm或仍在继续扩大;裂伤深度>3cm。IV级:裂伤实质破裂累及25%~75%的肝叶或在单一肝叶内有1~3个Couinaud肝段受累。Ⅴ级:裂伤实质破裂超过75%肝叶或在单一肝叶内超过3个Couinaud肝段受累;近肝静脉损伤,即肝后下腔静脉/肝静脉主支。Ⅵ级:血管肝撕脱。
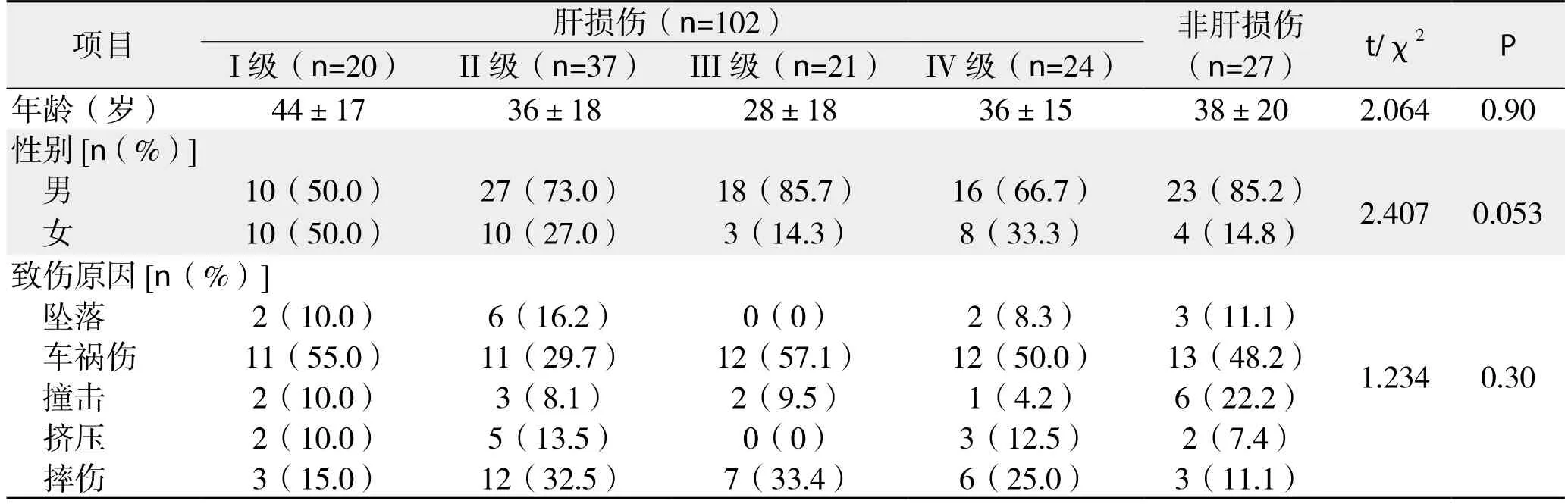
表1 腹部闭合性损伤患者的一般特征(n=129)
1.3 统计学处理
采用SPSS18.0统计软件进行分析,用单样本K-S检验进行数据的正态性检验;定量资料若服从正态分布采用均数±标准差(±s)描述,否则,以中位数(M)及四分位数间距(IQR)描述。正态分布且方差齐,均值比较采用单因素方差分析。两组间均数的比较若服从正态分布则采用独立样本t检验,否则采用非参数检验中的Mann-Whitney U检验。并通过绘制ROC曲线确定严重肝损伤血清钾及钠的阈值。运用Pearson积差相关系数分析血清K+和Na+的相关性,P<0.05为差异有统计学意义。
2 结 果
2.1 肝损伤患者的一般现状
本研究中102例肝损伤患者,I级20例(19.6%),平均年龄(44±17)岁;II级37例(36.3%),平均年龄(36±18)岁;III级21例(20.6%),平均年龄(28±18)岁;IV级24例(23.5%),平均年龄(36±15)岁;57例(55.9%)为轻度肝损伤,男37例(64.9%),女20例(35.1%);45例(44.1%)为严重肝损伤,男34例(75.6%),女11例(24.4%)。
2.2 各组患者血清K+、Na+值的相关检验及对比分析
I、II、III、IV级肝损伤、非肝损伤组患者血清K+、Na+值的正态性检验P值分别为0.388、0.150均>0.05,说明血清K+、Na+服从正态分布;方差齐性检验P值分别为0.62、0.75均>0.05,说明方差齐。各组患者检验指标结果表明组间具有可比性(均P<0.001)。I、II级、非肝损伤患者间血清K+和Na+的值差异无统计学意义(均P>0.05);I、II级较III、IV级患者血清K+的值高,差异均有统计学意义(P=0.015,P=0.004;P=0.005,P=0.001);III、IV级较非肝损伤患者血清K+的值低,差异有统计学意义(均P<0.001);I、II级较III、IV级患者血清Na+的值低,差异均有统计学意义(P=0.007,P=0.031;P=0.001,P=0.004);III、IV级较无肝损伤患者血清Na+的值高,差异均有统计学意义(P=0.001,P=0.005)(表2-3);III、IV级患者血清K+和Na+的值差异无统计学意义(P=0.729,P=0.57)(表4)。
表2 各组患者血清K+、Na+值的比较(mmol/L,±s)

表2 各组患者血清K+、Na+值的比较(mmol/L,±s)
无肝损伤 I级 II级 III级 IV级 F P K+ 4.22±0.39 4.08±0.32 4.08±0.42 3.74±0.49 3.69±0.50 7.142 <0.001 Na+ 138.94±2.81 139.40±3.15 139.07±2.68 142.07±4.05 141.46±3.13 5.408 <0.001
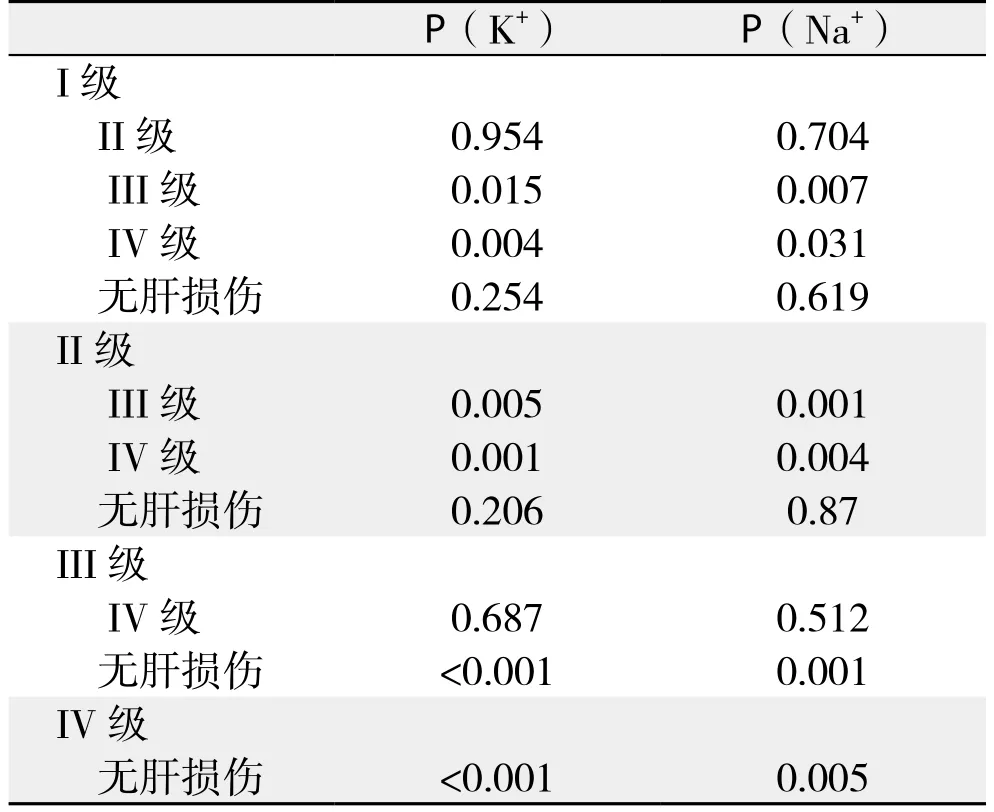
表3 各组患者血清K+、Na+值的两两比较
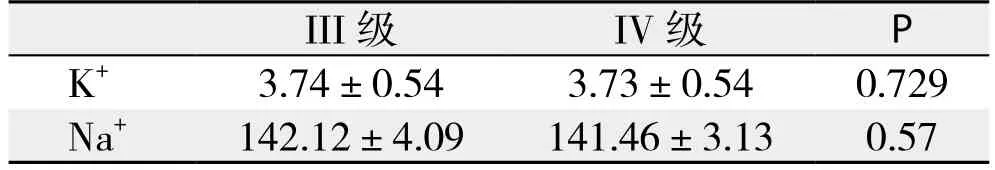
表4 Ⅲ级、Ⅳ级肝损伤患者血清钾、钠水平的比较
2.3 肝损伤患者血清K+、Na+相关性分析
血清K+、Na+的水平在肝损伤及严重肝损伤组中呈中等程度负相关(P<0.001,r=-0.534;P<0.001,r=-0.504);在轻度肝损伤组中呈弱负相关(P=0.003,r=-0.390)(表5-7)。

表5 肝损伤患者血清K+、Na+水平的相关性

表6 严重肝损伤患者血清K+、Na+水平的相关性
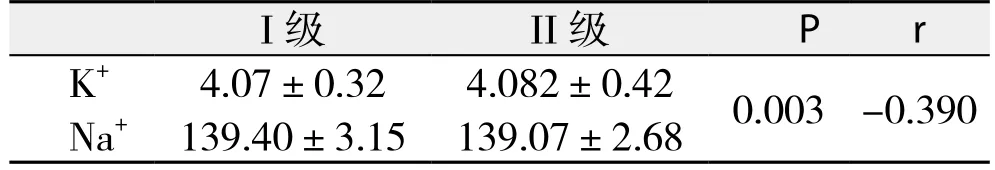
表7 轻度肝损伤患者血清K+、Na+水平的相关性
2.4 严重肝损伤患者血清K+、Na+的ROC曲线
血清K+在严重肝损伤患者中的ROC曲线下的面积为0.721,P<0.001,敏感度为91.66%,特异度为51.12%;血清Na+的ROC曲线下的面积为0.712,P<0.001,敏感度为60%,特异度为70.24%。血清K+、Na+联合检测在严重肝损伤患者中的ROC曲线下的面积为0.742,P<0.001,敏感度为44.4%,特异度为92.9%(图1)。通过ROC曲线评估,血清K+、Na+的最佳阈值分别为3.625 mmol/L、 140.2 mmol/L。
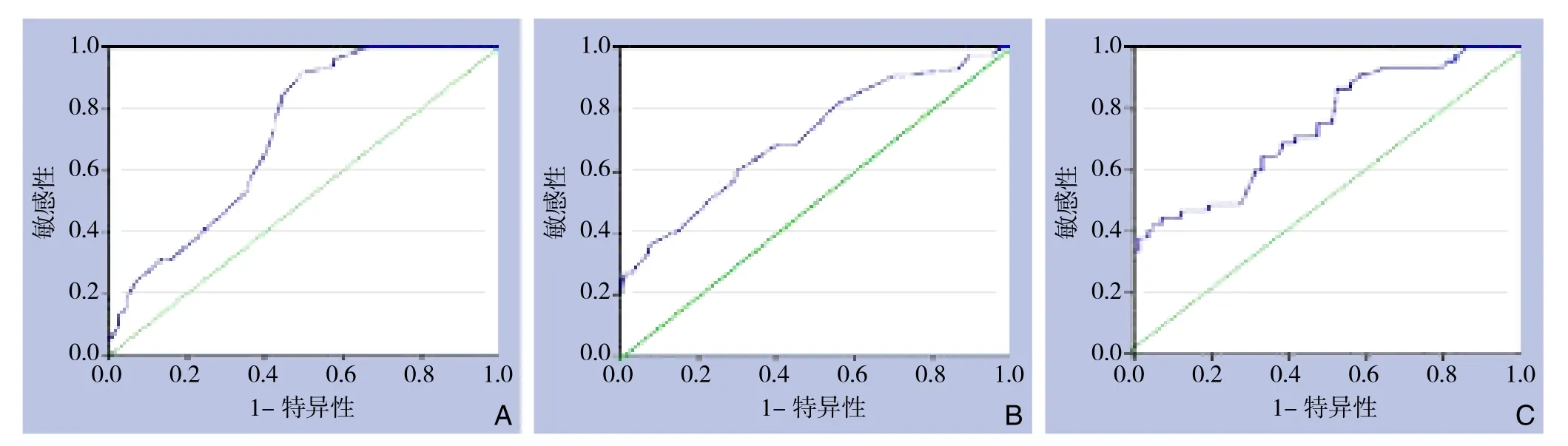
图1 严重肝损伤患者血清K+、Na+的ROC曲线 A:血清K+阈值;B:血清Na+阈值;C:血清K+、Na+联合检测
3 讨 论
肝脏是一个容易损伤的器官,这与它的大小、位置、肝实质和Glisson纤维鞘脆弱有关[6]。肝脏也是一个富含神经纤维的器官,不仅支配神经丰富,而且肝实质里面的神经也很丰富,夏锋等[7]用Sevier-M unger改良法染色切片得出人与大鼠肝脏内分布有丰富的神经纤维,粗细不一;汇管区的神经纤维分布相对密集,纤维略粗,神经纤维与肝动脉、门静脉分支紧密伴行;肝小叶内神经纤维与肝细胞末梢距离近。人体的肝脏标本中汇管区内的神经纤维分布与大鼠相似,且肝小叶内的神经分布较大鼠密集。Stoyanova等[8]也证实肝汇管区和肝小叶内存在大量的自主神经纤维。交感神经是肝内的主要神经,其主要分布于汇管区血管周围,肝小叶内也有部分神经末梢分布。Gardemann等[9]证明门静脉周围分布大量的肾上腺素能神经纤维,在左右门静脉主干旁分布大部分粗的神经束为肾上腺素能神经,肝动脉分支旁也常见,而在门静脉分支及胆管旁偶见。采用神经元特异性烯醇化酶(neurorrspecificrendolase,NSE)与儿茶酚胺合成相关酶的抗体发现肝实质由60%的无髓鞘轴索供应,交感神经为供应脉管系统的神经纤维。Miyazawa等[10]采用抗S-100蛋白及NSE的抗体证实了肝窦内神经纤维中分布有肾上腺素能神经。严重的肝脏损伤,伴随者肝实质细胞的破裂,应当引起高血钾,但是相关文献[11-12]报道为低血钾,认为存在一个促进钾转入细胞内的假说,尤其是在肝脏内富含神经纤维,一旦肝脏损伤,则会刺激肝内的肾上腺素纤维,引起肾上腺素的释放,最后激活肾上腺受体,然后通过直接(β肾上腺能的激活通过cAMP机制激活Na+-K+泵促进细胞摄钾)或间接的途径促进血清钾由细胞外转入细胞内[12-13](肝糖原分解-血糖升高-胰岛素分泌增加-通过激活Na+-K+-ATP酶),Na+-K+-ATP酶的激活导致Na+-K+交换,每移入3个K+,则移出2个Na+。本研究结果表明肝损伤组较非肝损伤组的血清K+降低、血清Na+升高;严重肝损伤较轻度肝损伤的血清K+降低,血清Na+升高,但不明显,这可能与血清K+和Na+在血液中的分布有关, K+主要分布在细胞内,细胞外的K+对内移的K+的很敏感,而Na+主要分布在细胞外,细胞外的Na+对外移的Na+不敏感,而我们检测的为细胞外的离子。且通过血清K+、Na+的水平在肝损伤及严重肝损伤组中相关性分析提示两者为负相关,也验证了机体存在这一Na+-K+泵的假说。有研究[4]表明肝损伤越严重,低钾越显著,本研究虽得出了严重肝损伤较轻度肝损伤的血清K+降低,但通过单独分析表明III、IV级患者血清K+和Na+的值虽有差异但无统计学意义,这可能与本研究样本量相对较少有关。因此这一观点有待于进一步研究论证。
在临床中,低钾会引起肌无力,一旦呼吸肌受累,可致呼吸困难或窒息;低钾的患者会有肠麻痹的表现,影响生活质量;低钾对心脏的影响表现为传导阻滞和节律异常,严重者会引起室颤。所以对血清钾的监测尤为重要,尤其是认识到严重肝损伤患者会出现血清K+降低的可能性。
对于肝损伤的治疗,包括手术治疗和非手术治疗,目前主张只要血流动力学稳定、无腹膜刺激体征、无合并腹部其它脏器的损伤,不论肝损伤的严重程度,首先考虑非手术治疗[14-16]。笔者结合文献[14-16]及通过本研究分析主张,一旦出现血流动力学不稳定、腹膜刺激征、合并腹腔其它脏器或血清K+低于3.625 mmol/L和血清Na+高于140.2 mmol/L则考虑行手术治疗。研究表明,非手术治疗失败后也不会对患者产生明显的伤害。而影响患者预后的一个重要因素为是否合并腹腔脏器其它的器官的损伤[16-17],且脾损伤在腹部外伤中,位居第一,所以本研究选择了以闭合性脾损伤作为无肝损伤的对照组,以此来探讨血清K+、Na+水平在闭合性肝损伤分级中的应用价值。但非手术治疗对医院亦有基本的要求,如重症监护病房及随时中转开腹的条件等。非手术治疗具有并发症少、输血量少、病死率低等优点[18-19]。轻度肝损伤非手术治疗成功率可达100%[20-21],因此鉴别肝损伤的严重程度非常有必要。
丙氨酸转氨酶(alanine aminotransferase,ALT)及谷草转氨酶(aspartate aminotransferase,AST)是判断肝损伤较敏感的指标,患者的ALT、AST及乳酸脱氢酶(Lactate dehydrogenase,LDH)正常,提示应该不是严重的肝外伤,只有当ALT及AST均大于正常值的2倍时,其诊断严重肝外伤的敏感度为93.1% ,特异度为38.5%[22]。本研究表明血清K+低于3.625 mmol/L时诊断严重肝外伤的敏感度为91.66%,特异度为51.12%;血清Na+高于140.2 mmol/L时诊断严重肝外伤的敏感度为60%,特异度为70.24%;血清K+、Na+联合检测诊断严重肝外伤的敏感度为44.4%,特异度为92.9%。说明两者确定肝损伤分级有一定的准确性。ROC曲线显示血清K+和Na+与肝损伤相关及血清K+、Na+联合检测的敏感度和特异度,曲线以下的区域表示该检验是区分肝损伤程度的良好指标。因此,笔者认为,在闭合性肝损伤中,当血清K+低于3.625 mmol/L和血清Na+高于140.2 mmol/L时,结合ALT及AST均大于正常值的2倍,这对严重肝损伤的诊断是一个非常重要的依据,对临床医生及时有效地选择合适的治疗方案具有一定指导性的意义。
[1] Sikhondze WL, Madiba TE, Naidoo NM, et al. Predictors of outcome in patients requiring surgery for liver trauma[J]. Injury,2007, 38(1):65–70.
[2] Sataa S, Chekib K, Riadh M, et al. Nutcracker syndrome as an incidental finding on computed tomography scan after blunt abdominal trauma[J]. Tunis Med, 2012, 90(2):192–195.
[3] Kreimeyer S, Grenacher L. Modern imaging techniques for liver trauma[J]. Chirurg, 2009, 80(10):896–907. doi: 10.1007/s00104–009-1726–8.
[4] Meriggi F, Gramigna P, Tramelli P. About Usefulness of Kalemia Monitoring after Blunt Liver Trauma[J]. HPB Surg, 2012:279708.doi: 10.1155/2012/279708.
[5] Becker CD, Mentha G, Terrier F. Blunt abdominal trauma in adults:role of CT in the diagnosis and management of visceral injuries Part 1: Liver and spleen[J]. Eur Radiol, 1998, 8(4):553–562.
[6] Kumawat JL, Mathur PN, Mathur K, et al. A retrospective study of blunt trauma abdomen[J]. J Evolution Med Dent Sci, 2015,4(59):10263–10269.
[7] 夏锋, 何振平, 王晓丽, 等. 大鼠肝脏内神经分布的形态学观察[J]. 第三军医大学学报, 2003, 25(22):2025. doi: 10.3321/j.issn:1000–5404.2003.22.038 Xia F, He ZP, Wang XL, et al. Morphologic olservation of nerve fibres in liver parenchyma[J]. Acta Academiae Medicinae Militaris Tertiae, 2003, 25(22):2025. doi: 10.3321/j.issn:1000–5404.2003.22.038
[8] Stoyanova II. Relevance of mast cells and hepatic lobule innervation to liver injury[J]. Rom J Gastroenterol, 2004, 13(3):203–209.
[9] Gardemann A, Püschel GP, Jungermann K. Nervous control of liver metabolism and hemodynamics[J]. Eur J Biochem, 1992,207(2):399–411.
[10] Miyazawa Y, Fukuda Y, Imoto M,et al. Immunohistochemical studies on the distribution of nerve fibers in chronic liver diseases[J]. Am J Gastroenterol, 1988, 83(10):1108–1114.
[11] Beal AL, Scheltema KE, Beilman GJ, et al. Hypokalemia following trauma[J]. Shock, 2002, 18(2):107–110.
[12] Zavagli G, Pampolini M, Cavallini G, et al. Different kalemia in abdominal trauma[J]. J Trauma, 1988, 28(4):526–529.
[13] Beal AL, Deuser WE, Beilman GJ. A role for epinephrine in posttraumatic hypokalemia[J]. Shock, 2007, 27(4):358–363.
[14] Stassen NA, Bhullar I, Cheng JD, et al. Nonoperative management of blunt hepatic injury: an Eastern Association for the Surgery of Trauma practice management guideline[J]. J Trauma Acute Care Surg, 2012, 73(5 Suppl 4):S288–293. doi: 10.1097/TA.0b013e318270160d.
[15] 杨长安, 钟德玝, 陈志康. 闭合性肝外伤的治疗分析: 附 109 例报告[J]. 中国普通外科杂志, 2007, 16(12):1178–1180.Yang CA, Zhong DW, Chen ZK. Treatment of blunt liver injury: a report of 109 cases[J]. Chinese Journal of General Surgery, 2007,16(12):1178–1180.
[16] Boese CK, Hackl M, Müller LP, et al. Nonoperative management of blunt hepatic trauma: A systematic review[J]. J Trauma Acute Care Surg., 2015, 79(4):654–660. doi: 10.1097/TA.0000000000000814.
[17] Mallikarjun P, Cheeti VS, Karupothula RS. A prospective study on the management of liver trauma[J]. JEBMH, 2015, 2(39):6203–6215.
[18] von Bahten LC, Nicoluzzi JE, Olandoski M, et al. Trauma abdominal fechado: análise dos pacientes vítimas de trauma hepático em um Hospital Universitário de Curitiba[J]. Rev Col Bras Cir, 2006, 33(6):316–320.
[19] Kozar RA, Moore JB, Niles SE, et al. Complications of nonoperative management of high grade blunt hepatic injuries[J]. J Trauma, 2005, 59(5):1066–1071.
[20] Ghnnam WM, Almasry HN, Ghanem MA. Non-operative management of blunt liver trauma in a level II trauma hospital in Saudi Arabia[J]. Int J Crit Illn Inj Sci, 2013, 3(2):118–123. doi:10.4103/2229–5151.114271.
[21] 钟文和, 罗梅华. 肝外伤的非手术治疗[J]. 中国普通外科杂志,2005, 14(7):547–548.Zhong WH, Lyo MH. Nonoperative treatment of liver injurie[J].Chinese Journal of General Surgery, 2005, 14(7):547–548.
[22] Tan KK, Bang SL, Vijayan A, et al. Hepatic enzymes have a role in the diagnosis of hepatic injury after blunt abdominal trauma[J].Injury, 2009, 40(9):978–983. doi: 10.1016/j.injury.2009.02.023.
