2R,3R-丁二醇和2,3-丁二醇诱导匍匐翦股颖抗病性的比较
2017-03-28马晖玲刘兴菊
马 源,马晖玲,刘兴菊
(甘肃农业大学草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070)
2R,3R-丁二醇和2,3-丁二醇诱导匍匐翦股颖抗病性的比较
马 源,马晖玲,刘兴菊
(甘肃农业大学草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070)
以2R,3R-丁二醇和2,3-丁二醇作为诱抗剂,在诱导匍匐翦股颖产生对褐斑病抗性的过程中,重点比较了不同施用方式的诱抗效果,筛选出了诱抗剂的最佳作用方式和浓度。结果表明:匍匐翦股颖接菌后第15 d,2R,3R-丁二醇根部注射处理下,100 μmol/L的病情指数最低,诱导效果最佳;而与叶面喷施相比,叶面喷施的诱导效果不明显;2,3-丁二醇根部注射处理下,250 μmol/L的病情指数最低,诱导效果最佳,而与叶面喷施相比,叶面喷施的诱导效果不明显。结果表明,100 μmol/L的2R,3R-丁二醇与250 μmol/L的2,3-丁二醇根部注射可有效诱导匍匐翦股颖产生对褐斑病的抗性。
匍匐翦股颖;2R,3R-丁二醇;2,3-丁二醇;褐斑病
匍匐翦股颖(Agrostisstolonifera)为禾本科翦股颖属多年生草本植物,叶片质地柔软纤细,耐低修剪,广泛建植于高尔夫球、保龄球场等场地。但匍匐翦股颖的抗病性较差,容易感染币斑病、条黑粉病、褐斑病等[1],严重影响草坪功能的发挥并给草坪生产和经营带来极大损失。通过抗病诱导方式找到适当的诱导因子将其潜能激发出来,就可以抵御各种病害。其中,化学抗剂可抗菌谱广,对环境安全,不易产生抗药性,作用时间长,且抗病性诱导剂用量少,防治效果好,是一种具有广泛应用前景的新型植物病害防治剂[2-3]。
目前,诱导植物抗病性的机制有两种形式,系统获得抗性(SAR),诱导系统抗性(ISR)。SAR可以被一些植物激发子激活进而诱导植物抗病,这些激活物可以在植株体局部诱导抗病性反应继而这种反应如信号一般传遍植株体各个部位,使得整个植株系统地获得抗病性,这种反应信号的传导是一种短距离的传递,通常以叶面喷施为主。而ISR往往由土壤根际的植物促生菌(PGPR)所激活,这类信号分子是乙烯(ET)和茉莉酸(JA)等[4],通常为根部注射。2003年Suzuki等[5]在匍匐翦股颖的抗病诱导研究中发现Pseudomonasfluorescens株系HP72可引发匍匐翦股颖对立枯丝核菌(Rhizoctoniasolani)产生抗性[5]。2004年Ryu等[6]研究认为,植物根际促生菌分泌的挥发性有机物2,3-butanediol及其同分异构体在诱导植物产生抗病性的过程中具有重要的作用[6]。2010年,加拿大学者Cortes-Barco和Hsiang等[7-9]报道了BDO和PC1(异链烷烃混合物)以ISR方式根部施入植株体后可抑制分别由真菌Sclerotiniahomoeocarpa,Rhizoctoniasolani和Microdochiumnivale导致的3种草坪叶病,施入PC1或BDO可减少匍匐翦股颖叶病区域20%~40%。
试验采用新型诱导剂丁二醇的2种同分异构体2R,3R-丁二醇(2R,3R-BD)与2,3-丁二醇(2,3-BD),通过叶面喷施和根部注射处理匍匐翦股颖,观察比较了2种不同施用方式下的诱抗效果,寻找丁二醇诱导匍匐翦股颖抗褐斑病的最佳诱导剂浓度和施用方式,以期为丁二醇诱导其他植物抗多种病害的作用方式提供研究基础。
1 材料和方法
1.1 试验材料
供试匍匐翦股颖品种为Penn-A4,由北京克劳沃公司提供。诱导剂2R,3R-BD购自Sigma,2,3-BD购自西亚试剂。匍匐翦股颖褐斑病病原物为立枯丝核菌(Rhizoctoniasolani),购自中国科学院菌种保存中心。
1.2 试验设计
营养土∶沙∶蛭石以2∶1∶1混合,种植前经高温、高压灭菌后,装于花盆中播种翦股颖种子,并置于一定温湿度条件的温箱中,植株生长8 d后用丁二醇处理,诱导7 d后接种立枯丝核菌。240 mL组培瓶中装60 mL试验土,加入20 mL蒸馏水,使沙土中的含水量控制在17%。
1.2.1 种植 种植前处理种子用无菌水浸泡6 h,用70%乙醇溶液浸泡1 min,无菌水冲洗2次,20%次氯酸钠浸泡15 min,无菌水冲洗5~6次,种植于240 mL的组培瓶,每瓶0.3 g。培养在25℃的恒温培养箱中。
1.2.2 种植前诱导剂与菌种间的关系 PDA培养基制作中加入不同浓度梯度的2R,3R-BD和2,3-BD,并接种立枯丝核菌,观察培养基中菌种的发病情况,发现2种诱导剂对立枯丝核菌在离体培养条件下没有抑制效果,在试验过程中无影响。
1.2.3 种植后诱导和接种 2R,3R-BD以50、75、100、125、150 μmol/L(以C1,C2,C3,C4,C5表示)分别设5个浓度梯度,2,3 -BD设150、250、350、450、550 μmol/L 5个浓度(以D1,D2,D3,D4,D5表示),不用诱导剂处理只接种为CK。植物在恒温箱中正常生长8 d后,以2种诱导剂处理植株并且保证诱导环境中无其他杂菌以防污染,每个处理3个重复。将不同浓度丁二醇分别用注射器注射和叶面喷施的方式施用到匍匐翦股颖上,每瓶根部注射10 mL,叶面喷施8 mL。用封口膜封住瓶口。丁二醇处理幼苗后第7 d后接种病原菌。立枯丝核菌在PDA固体培养基中,25℃培养4 d后,用灭菌的打孔器取6 mm直径菌丝块,加入到PDB液体培养基,在25℃、100 r/min的摇床培养5 d后研磨为菌丝,确定浓度为D340=0.8,使用该浓度菌丝悬浮液喷雾法接种。
1.3 匍匐翦股颖褐斑病发病程度基本标准
接菌种后第7,10和15 d,参照文献[10]的调查与评定方法,进行病情观察,统计病叶率并计算病情指数。匍匐翦股颖褐斑病严重度的分级标准:0级:无症状;1级:叶片上有零星菌丝;2级:10%~40%的叶片上有菌丝;3级:40%~60%的叶片上有菌丝体生长并有坏死迹象;4级:60%~80%的叶片上有丰富的菌丝体和坏死现象;5级:全部植株普遍感病。

1.4 数据分析方法
运用SPSS软件对数据进行统计分析,运用Excel进行图表制作。
2 结果与分析
2.1 不同浓度2R,3R-BD根部注射对匍匐翦股颖发病程度的影响
接种病原菌后随时间延长,对照与各浓度的病情指数均呈上升趋势,一定浓度的2R,3R-BD根部注射可明显降低匍匐翦股颖褐斑病病情指数(图1)。接种第7 d后,发病不明显,各处理间差异不显著。接种后第10 d,各浓度的病情指数显著低于CK,而且C3的病情指数最低,为1.6%。在第15 d C3的病情指数显著低于CK,C3的病情指数最低,为27.2%,CK的病情指数是其3.34倍。结果表明C3浓度的2R,3R-BD根部注射可明显降低匍匐翦股颖褐斑病的病情指数。
2.2 不同浓度2,3-BD根部注射对匍匐翦股颖发病程度的影响
接种病原菌后第15 d可明显观察到,一定浓度的2,3-BD根部注射可有效降低匍匐翦股颖褐斑病的病情指数(图1)。接种后第7 d各处理间差异不显著。接种后第10 d,除D5外其他浓度的病情指数都显著低于CK,并且D2的病情指数显著低于其他处理。在第15 d,除D5以外,其他浓度的病情指数显著低于CK,同时D2的病情指数显著低于其他处理。表明2,3-BD的D2浓度最适宜,诱导效果最为明显,根部注射可有效降低匍匐剪股颖褐斑病的病情指数。
2.3 不同浓度2R,3R-BD叶面喷施对匍匐翦股颖病情指数的影响
接种病原菌后各处理的病情指数呈明显上升趋势,2R,3R-BD叶部喷施后诱导匍匐翦股颖抗褐斑病效果不明显(图2)。接种后第7 d,各处理差异不显著。接种后第10 d,C5病情指数最高,其他处理差异不显著。在接种后第15 d,C3、C4的病情指数显著低于其他处理,分别达到67.47%、69.87%。因此,叶面喷施2R,3R-BD的C3、C4可在一定程度降低匍匐剪股颖褐斑病的病情指数,但效果不明显。
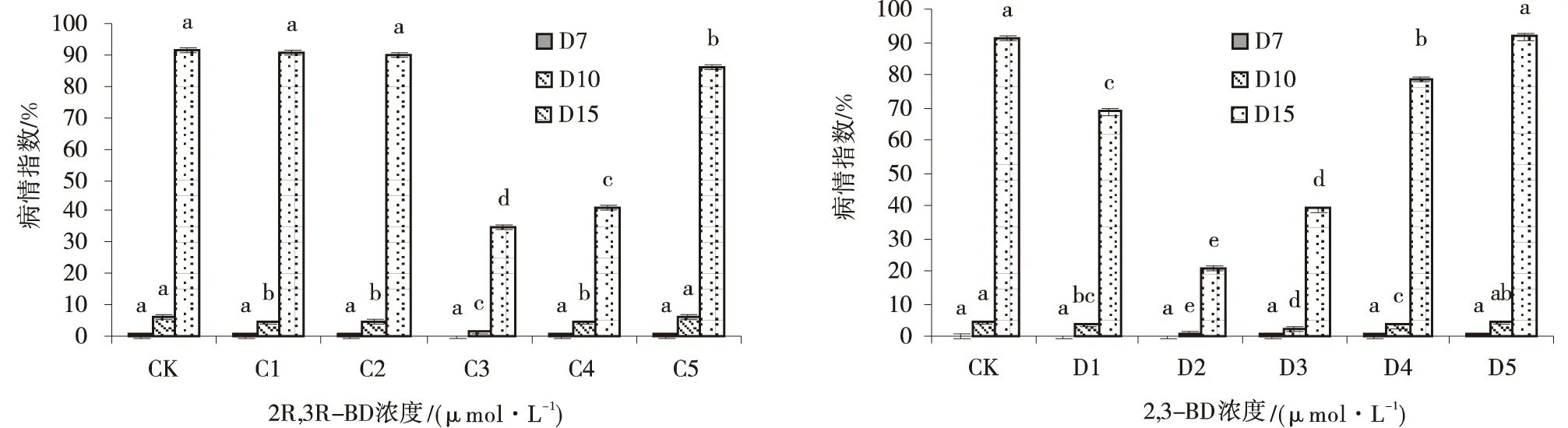
图1 不同浓度2R,3R-BD和2.3-BD根部注射处理下匍匐翦股颖的病情指数Fig.1 The disease index of roots injection treatment at different concentrations of 2R,3R-BD and 2,3-BD
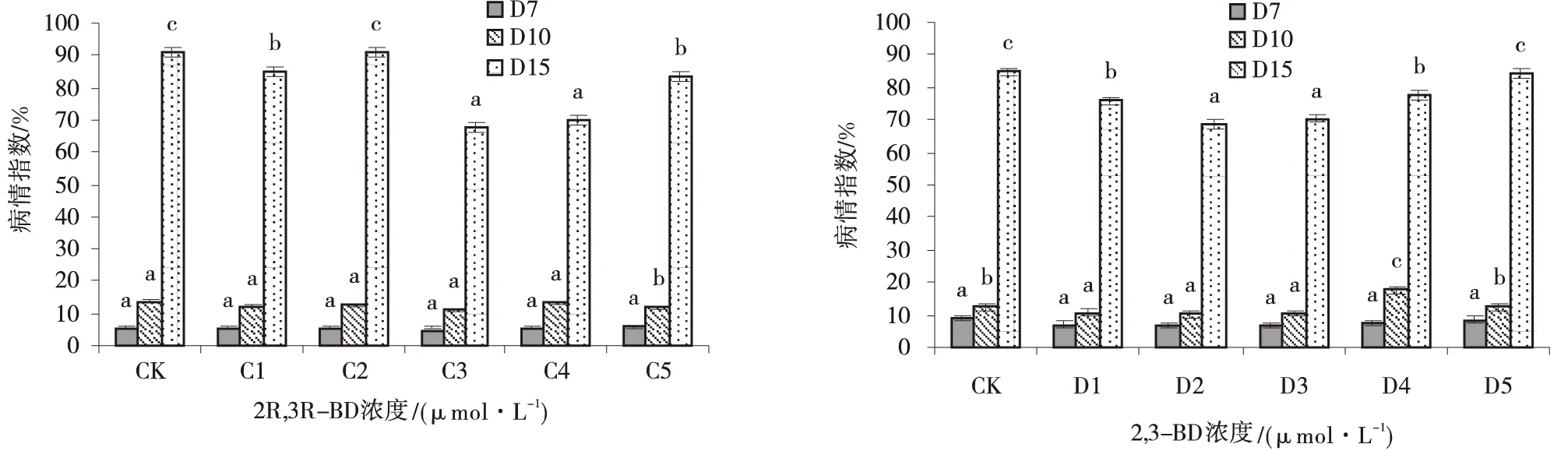
图2 不同浓度2R,3R-BD和2,3-BD叶面喷施处理下匍匐翦股颖的病情指数Fig.2 The disease index of foliage spray treatment at different concentrations of 2R,3R-BD and 2,3-BD
2.4 不同浓度2,3-BD叶面喷施对匍匐翦股颖病情指数的影响
接种病原菌后结果表明,2,3-BD叶部喷施诱导匍匐翦股颖抗褐斑病的效果不明显(图2)。接种后第7 d,各处理差异不显著。接种后第10 d,D4、D5的病情指数低于其他处理,并且其他各处理差异不显著。而接种后第15 d,D2、D3的病情指数低于其他处理,但其病情指数已分别达68.8%、70.4%。试验表明叶面喷施2,3-BD对降低匍匐翦股颖褐斑病的病情指数效果不明显。
2.5 两种丁二醇在不同时间不同作用方式下对匍匐翦股颖病情指数的影响
通过比较发现,两种诱导剂在进行根部注射时效果最好(图3)。第7 d时通过根部注射的两种诱导剂其病情指数分别为0.3%和0.5%,与叶面喷施的5%和6%相比,根部注射的效果最好而且差异极显著。第10 d根部注射最低的病情指数分别为1.6%和1.07%,效果比叶面喷施的最低病情指数分别降低了11倍和10倍,抗病效果极显著。第15 d使用2种最佳浓度诱导剂,叶面喷施下其病情指数为67%和68%,是根部注射后其病情指数35%的2倍和21%的 3倍。因此,通过比较发现根部注射的作用效果明显优于叶面喷施的作用效果。所以最佳的作用方式是根部注射。
2.6 不同浓度丁二醇对植株发病的诱导效果影响
2,3-BD与2R,3R-BD分别设置不同浓度,根部注射和叶面喷施处理匍匐翦股颖,接种后第15 d的诱导效果表明,2,3-BD 的D2与2R,3R-BD的C3浓度根部注射,都能诱导匍匐翦股颖抗褐斑病,诱导效果分别为86.07%、70.32%。叶面喷施2R,3R-BD,C3、C4两个浓度虽然有一定诱导作用,但诱导效果分别为25.9%、23.2%,与根部注射相比较其作用效果不明显,表明根部注射是2R,3R-BD的有效作用方式。叶面喷施2,3-BD后,D2和D3的诱导效果分别为18.8%、16.9%,诱导效果不明显,因此,2,3-BD的有效作用方式是根部注射(表1)。
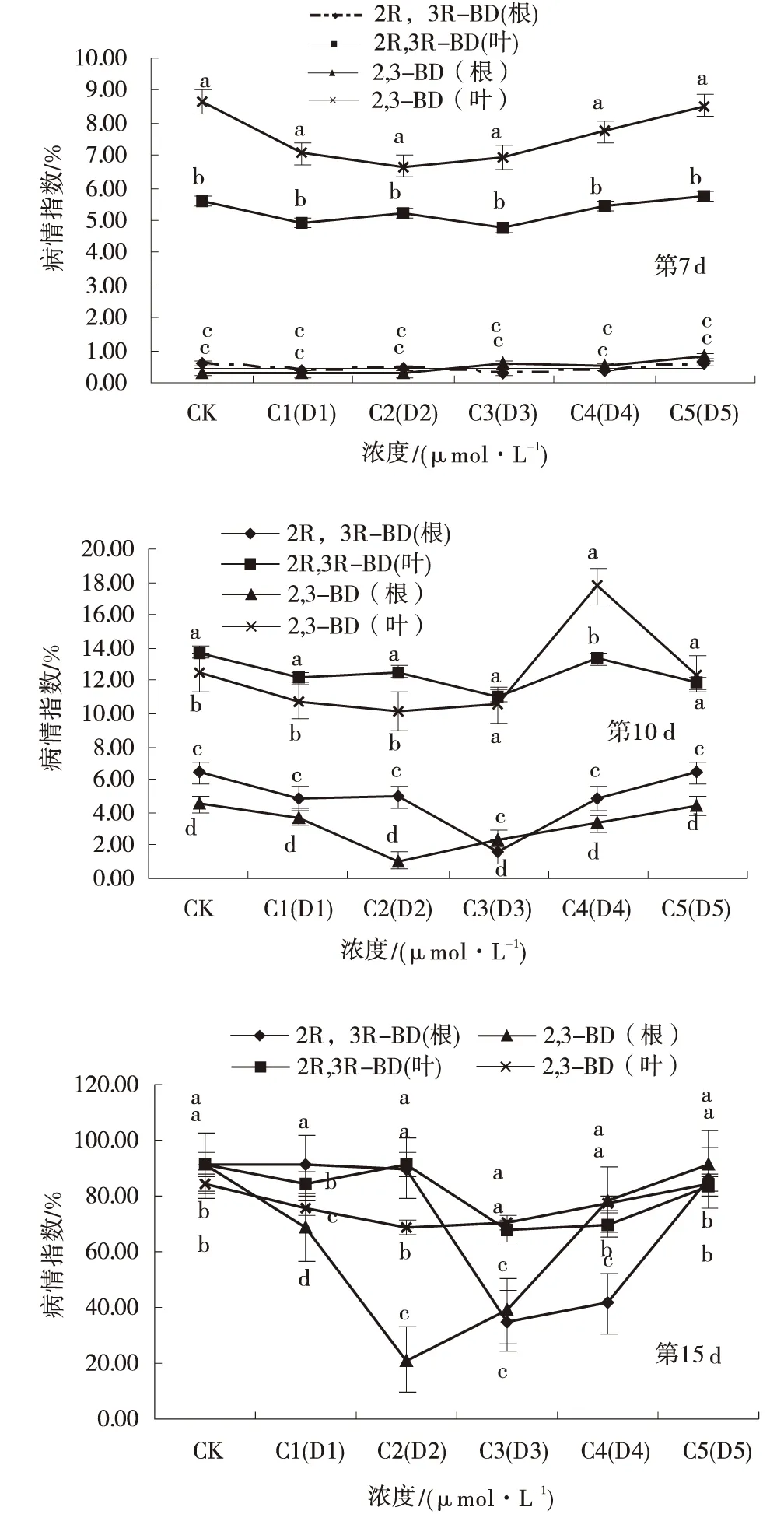
图3 两种丁二醇在不同时间不同作用方式处理下匍匐翦股颖的病情指数Fig.3 The disease index of roots injection treatment at different concentrations of 2R,3R-BD and 2,3-BD
3 讨论
防治植物病害的主要措施是化学防治,除造成经济损失外,有些杀菌剂还对人类和环境造成极大伤害。开发绿色环保的生物农药显得尤为重要,植物抗病诱导剂的有效成分属天然产物,诱导植物发挥自身抗病潜力,是草坪病害防治的新方法。同时诱导剂的不同使用浓度对不同植物病害的防治效果差异显著[11-17]。

表1 2,3-BD与2R,3R-BD 不同使用方式对匍匐翦股颖抗病性的诱导效果
注:纵列字母不同者表示差异显著(P<0.05)
2,3-丁二醇存在3种同分异构体,现有研究表明,2,3-butanediol的左旋体2R,3R-BD可以诱导烟草抗E.carotovorasubsp.carotovoraSCC1,但不能够对P.syringaepv.tabaci产生抗性,其右旋体2S,3S -BD则对植物体没有作用[18-19]。ChoongChoong -Min Min研究认为 2,3-butanediol的外消旋体(2R,3R -BD与2S,3S -BD的混合物)可诱导拟南芥产生ISR。研究结果表明 2,3-butanediol立体异构的混合物与其左旋2R,3R -BD能够有效诱导匍匐翦股颖产生抗病性。综上所述,2,3-butanediol及其同分异构体诱导不同植物对多种病原菌产生抗性存在个体差异性。
Song等[12]使用2R,3R-BD诱导烟草的ISR,设置100 pg/株~1 mg/株不同剂量,结果表明2R,3R-BD的剂量为100 μg/株时抵抗由E.carotovora引起的软腐病效果最佳,当剂量小于10 pg/株时不能诱导烟草产生ISR。Cortes-Barco等[17]的研究表明,100 μmol/L的2R,3R-BD可诱导本氏烟草抗由C.orbiculare引起的炭疽病,叶面害积降低引起的炭疽病,叶面害积降低77%。以上结果表明微量浓度的2,3-BD及其同分异构体能够诱导植物产生ISR[18-20]。
4 结论
(1)一定浓度诱导剂处理能够有效降低匍匐翦股颖褐斑病的病情指数,2,3-BD与2R,3R-BD能够诱导匍匐翦股颖对褐斑病产生抗性。采用两种丁二醇2R,3R-BD、2,3-BD分别通过根部注射和叶部喷施作用方式,都能诱导匍匐翦股颖对褐斑病产生抗性。同时诱导剂的不同使用浓度对不同植物病害的防治效果差异显著。而在2R,3R-BD根部注射的5个浓度中100 μmol/L在接种后第15 d病情指数最低,为27.2%,诱导效果为70.32%,诱导效果最佳,可诱导匍匐翦股颖对褐斑病产生抗性。而2R,3R-BD叶面喷施后,100 μmol/L、125 μmol/L 2个浓度虽有一定诱导作用,但诱导效果分别仅为25.9%、23.2%,与根部注射相比诱导效果不明显。试验表明,2R,3R-BD诱导匍匐翦股颖产生褐斑病的最佳作用方式是根部注射。
(2)2,3-BD和2R,3R-BD两种诱导剂叶面喷施与根部注射相比诱导效果不明显,试验表明,两种诱导剂诱导匍匐翦股颖产生褐斑病的最佳作用方式是根部注射。通过根部注射的抗病性诱导效果比叶面喷施好得多,再次证实了BDO诱导匍匐翦股颖的抗病性是依ISR作用方式进行的。
[1] 杨昆.珠江三角洲主要森林下植被和区域森林生物量的研究[D].广州:中山大学,2007.
[2] 邢家华,陈定花,朱卫刚,等.植物化学诱抗剂[J].浙江化工,2002(33):51-52.
[3] Durrant,Dong X.Systemicacquired resistance[J].Annuat Review of Phyto-pathology,2004,42:185-209.
[4] Mccorn M,Creelman R A,Bell E,etal.Jasmonate is essential for insect defence Arabidopsis[J].Proceedings of the National Academy of Seciences of USA,1997,94:5473-5477.
[5] Suzuki S,He Y.Indole-3-acetic acid production inPseudomonasfluorescensHP72 and its association with suppression of creeping bentgrass brown patch CurrentMicrobiology[J].2003,47:0138-0143.
[6] Ryu C,Farag M,Hu C,etal.Bacterial volatiles induce systemic resistance in Arabidopsis[J].Plant Physiology,2004,134,1017-1026.
[7] Cortes-Barco A M,Hsiang T,Goodwin P H.Induced systemic resistance against three foliar diseases of Agrostisstoloniferaby (2R,3R)-Butanediol or an isoparaffin mixture.Annals of Applied Biology[J].Plant Pathology,2010,157:179-189.
[8] JI Rui-qin,Dong Cai-hua,GAO Rong-cun.Methyl asson ate,benzothiadiazol and oxalic acid induce resistance to Sclerotiniasclerotiorum in Brassica napus[J].Chinese Journal of Oil Crop Sciences,2006,28(2):184-188.
[9] Hsiang T,Goodwin P H,Cortes-Barco A M.Plant defense activators and control of turfgrassdiseases[J].Outlooks on Pest Management,2011,22(4):160-164.
[10] 南志标.牧草病害的调查与评定[M].北京:中国农业版社,1998:214-236.
[11] 王韧.重庆地区匍匐翦股颖越夏养护及病虫害防治措施[J].绿色科技,2012(5):38-39.
[12] Song Hee Han,Seung Je Lee,Jae Hak Moon,etal.Ga cS-Dependent Production of 2R,3R-Butanediol by Pseudomonas chlororaphis O6 is a Major Determinant for Eliciting Systemic Resistance[J].The American Phytopathological Society,2006,19(8):924-930.
[13] 马祥,马晖玲,安惠惠,等,诱导剂丁二醇对匍匐翦股颖抗病相关的防卫酶活性的影响[J].草原与草坪,2012,32(3):37-42.
[14] 马晖玲,房媛媛.植物抗病性及诱导抗病性在匍匐翦股颖病害防治中的应用[J].草业学报,2014,23(5):312-320.
[15] 穆合塔尔,王瑞,刘荣堂.多菌灵防治草坪草腐霉枯萎病的研究[J].草原与草坪,2000,89(2):22-25.
[16] 罗来银.植物诱导抗病性研究进展及其应用前景[J].农技服务,2012,29(2):175-177.
[17] Cortes Barco A M,Goodwin P H,Hsiang T.Comparison of induced resistance activated by benzothiadiazole,(2R,3R)-butanediol and an isoparaffin mixture against anthracnose of Nicotiana benthamiana[J].Plant pathology,2010,59(4):643-653.
[18] Kampfenkel K,Van Montagu M,Inze D.Extraction and determination of ascorbate and dehydroascorbate from plant tissue[J].Anal Biochem,1995,225(1):165-167.
[19] 房媛媛,马晖玲.AsA-GSH循环参与2,3-丁二醇、2R,3R-丁二醇诱导后匍匐翦股颖的抗丁二醇诱导后匍匐翦股颖的抗病反应[J].草业学报,2015,24(11):82-90.
Comparisons on 2R,3R-butanediol and 2,3-butanediol induced disease resistance of creeping bentgrass
MA Yuan,MA Hui-ling,LIU Xing-ju
(CollegeofPrataculturalScience,GansuAgriculturalUniversity/KeyLaboratoryofGrasslandEcosystem,MinistryofEducation/PrataculturalEngineeringLaboratoryofGansuProvince/Sino-U.S.CentersforGrazinglandEcosystemSustainability,Lanzhou730070,China)
2,3-butanediol and 2R,3R-butanediol were used as revulsants to induce the resistance of bentgrass to brown spot,and the optimum treatment method and concentration were studied.The results showed that the disease index of creeping bentgrass injected with 2R,3R-BD at 100 mol/L and 2,3-BD at 250 mol/L after15 days inoculation was the lowest.The effect of foliage application on induced disease resistance was not obvious.
creeping bentgrass;2R,3R-butanediol;2,3-butanediol ;brown spot
2015-10-22;
2016-06-03
国家自然科学基金“丁二醇诱导匍匐翦股颖抗病性及其ISR机理研究”(31360583)资助
马源(1989-),男,甘肃嘉峪关人,在读硕士研究生。 E-mail:mayuan608@163.com 马晖玲为通讯作者。
S 543;S 482.8
A
1009-5500(2017)01-0079-06
