芒花粉活力及柱头可授性研究
2017-03-28孙扣忠蒋建雄
孙扣忠,胡 彬,蒋建雄,3
(1.盐城市新洋农业试验站,江苏 盐城 224049; 2.湖南农业大学 生物科学技术学院,湖南 长沙 410128;3.江苏大学 环境与安全工程学院/生物质能源研究所,江苏 镇江 212013)
芒花粉活力及柱头可授性研究
孙扣忠1,胡 彬2,蒋建雄2,3
(1.盐城市新洋农业试验站,江苏 盐城 224049; 2.湖南农业大学 生物科学技术学院,湖南 长沙 410128;3.江苏大学 环境与安全工程学院/生物质能源研究所,江苏 镇江 212013)
采用I2-KI染色法和离体萌发法测定芒(Miscanthussinensis)花粉活力以及不同保存条件下的花粉寿命,并利用H2O2法检测雌蕊柱头的可授性。结果表明:芒花粉量大,平均花粉量/胚珠比(P/O值)达到5445±2883,属于专性异交性植物,且花粉初始活力较高,平均为78.68%±17.46%,但离体花粉的活力丧失快,室温干燥和湿润条件下保存的花粉寿命分别为70 min和100 min。不同基因型在花粉量、花粉活力及寿命上存在变异。雌蕊柱头可授性较高,活性可持续8 d,最佳授粉期为开花前1 d至开花后1 d。
芒;花粉活力;柱头可授性;P/O值
芒属(Miscanthus)植物为禾本科C4类多年生高大草本纤维素类植物,主要分布在东亚、东南亚和太平洋群岛等地区,我国是世界芒属植物资源的分布中心[1-3]。芒属植物具有生物质产量高、抗逆性强、适应性广等特点,可用于造纸、制药、水土保持和生态修复等[4-5]。近年来,芒属作为一种具有重要开发利用前景的能源植物而受到国内外的广泛关注[6]。芒(Miscanthussinensis)是芒属的一个广布种,在日本、朝鲜半岛以及我国从吉林南部到海南三亚等地区均有分布,其类型多样,蕴藏着丰富的基因资源,是目前在欧美地区被广泛研究和栽培的优良三倍体自然杂交种M.xgiganteus的亲本种之一[7-9]。
传粉是植物授粉受精过程的一个重要环节,花粉粒由传粉媒介(昆虫、风或其他媒介)传送到雌蕊柱头而完成传粉过程。为保证授粉成功,必须使花粉在具有生活力时到达适宜的柱头。因此,植物花粉活力与柱头可授性评价是繁殖生物学的重要研究内容[10-11]。目前国内外对于芒的繁殖生物学研究鲜有报道,严重限制了对该类植物资源的开发利用。因此,通过对芒的花粉活力以及柱头可授性开展系统的研究,旨在阐明该物种的繁殖生物学特征,为进一步开展芒的遗传学分析和遗传改良方面的研究奠定基础。
1 材料和方法
1.1 试验材料
采集野外的芒种质资源,其原产地信息见表1。采集根状茎种植于试验圃中,进入盛花期后取样进行测定分析。
1.2 试验方法
1.2.1 花粉活力测定 I2-KI染色法[12]测定不同基因型芒花粉活力以及花药散粉后不同时段的花粉活力变化情况,每隔2 h取样测定1次。散粉当天采集花粉,置于载玻片上,加1~2滴I2-KI溶液,在Olympus普通光学显微镜(100×)下观察,花粉粒显现蓝黑色即为有活力。每次随机观测100个花粉粒,计算染色百分率,3次重复,取平均值。
离体萌发法 参考Brewbaker & Kwack液体培养基配方[13],并在此基础上稍作改动:A 无机盐母液:HBO30.1 g,Ca(NO3)2·4H2O 0.3 g,MgSO4·7H2O 0.2 g,KNO30.1 g,加蒸馏水至100 mL。
B 应用培养基:无机盐母液 1 mL,蔗糖2 g,蒸馏水9 mL。
花期选取正常开花植株,将花序中上部小穗剪下(颖片已展开但花药尚未开裂)。每个样本收集30个花药放在干净玻璃片上,分别置于铺有干燥滤纸和湿润滤纸的培养皿,室温(25℃)条件下保存备用。待花药自然开裂,花粉粒散出,每隔10 min用毛笔将花粉均匀散在置有培养基的凹面载玻片上,置于25℃暗培养30 min,在Olympus光学显微镜(100×)下观察,每次选取5个视野(每个视野花粉粒数大于50)测定花粉活力,以花粉管长度超过花粉粒直径2倍视为萌发,3次重复,统计其平均萌发率。花粉萌发率即代表其活力。持续测定直至萌发率值下降至零为止。

表1 试验材料的来源信息
1.2.2 柱头可授性测定 采用Dafni的过氧化氢法[14]对芒雌蕊柱头的可授性进行测定:早上6∶00~8∶00,对当天开花小穗进行标记,连续标记10 d,取不同开花天数的雌蕊柱头测定其可授性。将收集到的柱头置于凹面载玻片中,滴加现配的3%过氧化氢溶液,5~10 min后在Olympus光学显微镜(40×)下观察柱头表面产生气泡的情况。若柱头表面有大量气泡则判定为可授,柱头表面仅有微量气泡冒出或无气泡则为不可授。根据气泡数量将柱头可授性强度分为4个等级。每40个柱头为一组,统计具有可授性的柱头数占供检柱头总数的比例,3次重复,取平均值。
1.2.3 花粉量/胚珠比(P/O)测定 在开花当天,随机选取即将开放、花药尚未开裂的小穗,放入2 mL离心管中,每个离心管1个小穗(3个花药),室温条件下静置待花药前端自然裂开散粉,加入1 mL碘液,在振荡器下振荡30s混匀后用移液枪吸取5 μL花粉溶液于载玻片上,在Olympus光学显微镜(40×)下直接观察记数,测量的数值乘以200,即为一个小穗中的花粉粒总数,3次重复,最后计算平均值。芒的一个小穗中胚珠数为1,因此,其P/O值等于一个小穗中的花粉粒总数。
1.2.4 数据统计与分析 数据的平均值采用Microsoft Excel进行,利用DPS软件进行方差分析和多重比较分析,百分率数据经转换后进行方差分析(Duncan法)。
2 结果与分析
2.1 花粉活力的测定
2.1.1 I2-KI染色法 I2-KI染色法判断花粉是否具有生活力的主要依据是花粉内含物淀粉遇碘发生变色反应。芒花粉经I2-KI染色后颜色较深,说明其花粉中的淀粉含量较高(图1)。对10份不同基因型芒的花粉活力进行测定,结果表明,不同基因型植株的花粉初始活力均较高,平均为78.68%±17.46%。

图1 I2-KI染色法检测芒基因型Mis06的花粉活力Fig.1 The pollen viability in M.sinensis genotype Mis06 determined with I2-KI staining method
测定芒小穗开花散粉后不同时间的花粉活力,发现散粉后不同时间段的花粉染色率较高,均达78%以上,差异不显著(图2)。实际而言,花粉在室温下离体保存数小时后已经完全失去活力,但由于花粉细胞内的淀粉仍然存在,故仍被染色,采用I2-KI染色法对花粉活力跟踪测定可能无法做出正确判断。
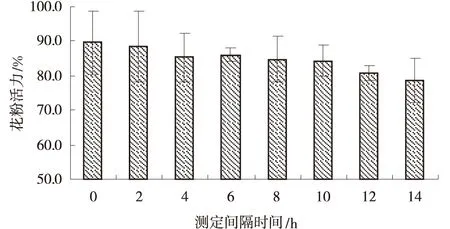
图2 I2-KI染色法测定的不同离体保存时间下芒基因型Mis06花粉活力Fig.2 The variation of pollen viability in M.sinensis at different in vitro storage duration determined by I2-KI staining method
2.1.2 离体萌发法 通过对Brewbaker & Kwack培养基中蔗糖的浓度进行筛选,发现20%的蔗糖浓度对芒花粉的萌发及花粉管生长较为适宜。
在室温(25℃)干燥和室温湿润两种条件下,利用离体萌发法对不同基因型(n=10)的芒花粉活力进行测定。结果表明,不同基因型的花粉活力存在明显差异(图3,表2)。不同保存条件下,花粉活力随着离体时间的延迟不断下降,最后完全失活,干燥条件下较湿润条件下花粉活力的下降更快。花药刚开裂时,花粉的平均萌发率为64.56%±15.86%,离体保存10 min后,湿润条件下平均萌发率下降至57.67%±17.57%,而干燥条件下则降至44.38%±14.73%;湿润条件下保存70 min后,平均萌发率为18.62%±7.90%,100 min后降低至0,而干燥保存条件下保存70 min后花粉活力完全丧失,萌发率为0(表2)。所以,室温干燥条件下芒的花粉寿命约为70 min,湿润条件下花粉寿命不超过100 min。

图3 不同基因型芒花粉生活力的离体萌发检测Fig.3 The determination of pollen viability in M.sinensis with in vitro germination method注:A.基因型Mis02 (58.22%);B.基因型Mis06(86.29%)

离体时间/min干燥最大值最小值平均值湿润最大值最小值平均值090.0031.7164.56±15.8690.0031.7164.56±15.861078.6917.7444.38±14.7398.0825.6457.67±17.572072.458.3331.5±15.7983.0815.6650.05±15.293050.826.4119.89±13.1268.5721.6243.67±13.014055.062.1716.89±14.2068.7521.3338.94±12.155015.316.1011.47±3.3760.267.4732.16±13.346011.594.947.41±2.6956.529.7128.18±12.25700.000.000.0036.734.7218.62±7.90800.000.000.0030.435.1714.26±7.4890---18.751.6911.95±5.34100---0.000.000.00
对不同基因型花粉活力的检测结果进行方差分析,结果显示,不同基因型、不同保存时间及不同保存条件之间存在极显著差异,表明它们对花粉活力均有极显著影响(P<0.01);基因型×保存时间×保存条件互作存在极显著差异,表明不同基因型芒的花粉对不同保存时间和不同保存条件具有特殊的适应性(表3)。
2.2 柱头可授性
在自然条件下,芒雌蕊柱头活力最高值出现在开花前一天(-1 DPA)和开花当天(0 DPA),柱头可授性为100%;1 DPA时,柱头可授性随时间变化开始下缓慢下降,4 DPA时降低至50%;到7 DPA时只有极少数柱头具可授性,8 DPA时完全丧失(表4)。由此可知,芒的柱头可授期约为8 d,最佳可授期为-1~1 DPA。从柱头可授性强弱分析,-1~1 DPA的柱头呈现出强可授性,柱头表面产生大量气泡;从2~5 DPA柱头呈现较强可授性,产生较多气泡;到6 DPA,柱头可授性逐渐减弱,产生少数气泡(图4)。

表3 芒花粉活力方差分析
注:****表示0.000 1极显著水平

表4 开花后不同时间芒柱头可授性
注:同列不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01);-表示柱头不具可授性;+表示柱头具可授性;++表示柱头具较强可授性;+++表示柱头具强可授性
从柱头颜色变化来看,最初颖片未展开时花蕾中的柱头呈白色,此时的柱头不具备可授性;而-1 DPA和0 DPA的柱头颜色为鲜艳的紫红色;2~7 DPA后柱头颜色逐渐由紫红色变为暗紫红色,极少数柱头呈现棕色甚至黑色。

图4 基因型Mis06雌蕊柱头在开花后不同天数的可授性强弱比较Fig.4 The comparison of stigma receptivity of genotype Mis06 at different days post-anthesis注:A.1 DPA时的柱头可授性;B.6 DPA时的柱头可授性
2.3 花粉量/胚珠比(P/O)
为了阐明芒属于哪种类型的繁育系统,统计了其花粉量与胚珠比(P/O),芒的每个小穗中包含3个花药和一个胚珠,通过对其花粉量测定,发现不同基因型的单个小穗中平均花粉量存在较大的变异,但在花序同一位置上两个孪生小穗的花粉量差异不大。每个小穗中的花粉量介于2 162±228~11 720±912,平均值为5 445±2 883。因为芒每个小穗中的胚珠数目为1,因此芒的平均P/O值为5445±2883(图5)。根据Cruden划分的繁育系统标准[15 ],芒是属于专性异交性植物。

图5 不同基因型芒的平均P/O值Fig.5 The average P/O values of different M.sinensis genotypes
3 讨论
研究采用I2-KI染色法和离体萌发法对芒的花粉活力进行测定,其中I2-KI染色法的测定值与离体萌发法相比偏高,在烟草(Nicotianatabacum)等植物的花粉活力测定中也存在类似现象[16]。离体萌发法的测定值能更真实地反映花粉的活力变化规律,但其操作步骤耗时费力,一般适用于花粉萌发需时较短的植物,如金鱼草、烟草和百合等[13];I2-KI染色法不能实时地反映花粉活力,但该方法操作步骤简单,效率高,可用于花粉活力的初步筛查,特别是大样本的花粉活力普查。
花粉量与胚珠比(P/O)是鉴定植物繁育系统的关键指标之一,芒的P/O平均值为5 445±2 883,属于专性异交性植物,这与目前认为芒为自交不亲和性植物的观点相一致。本研究表明,不同基因型芒植株花粉初始萌发活力及花粉寿命的差异明显,室温条件下的花粉平均萌发率为64.56%±15.86%,散粉后70~100 min内其活力完全丧失,且干燥条件下活力下降比湿润条件下更快,这是传粉或授粉过程中的不利因素,极大地限制了传粉距离和授粉时间。禾本科植物的花粉通常为三细胞花粉,寿命短,但有研究表明,较低温度和较高湿度通常有利于花粉活力的保持,有利于植株的结实率[17]。李要民等[18]也发现低温高湿(5℃、80%)条件下,水稻、玉米和狼尾草3种禾本科植物的花粉活力保持的时间可达30 d以上。芒的同一圆锥花序上小穗是从花序中部向上部和下部依次开放,整个花序开放时间持续数天,而雌蕊柱头的可授性能持续8 d,可以有效缓解花粉寿命短对传粉造成的压力,因此,柱头和花粉的活性不是限制芒植株自交结实的因子。
蕾期人工授粉通常是克服植物自交不亲和性的一种有效途径与方法[19-20]。研究表明,芒雌蕊柱头在开花前一天(-1 DPA)已具备了较高的可授性,这为采用蕾期人工授粉方法以获得其自交种子及培育纯系提供了可能。纯系的培育可以为进一步开展芒的遗传学分析、杂种优势利用以及全基因组测序等研究奠定材料基础。
4 结论
芒属于专性异交性植物,在开花期内其花粉和雌蕊柱头的活性均能维持较高水平,而且两者的成熟期可以相遇,说明它们并不是导致芒发生自交不亲和性的原因。此外,利用芒繁育系统的特点开展不同基因型之间的人工杂交育种是十分可行的。
[1] 刘亮,朱明,朱太平.芒荻类植物资源的开发和利用 [J].自然资源学报,2001,16(6):562-563.
[2] Zub H W,Brancourt-Hulmel M.Agronomic and physiological performances of different species of Miscanthus,a major energy crop.A review[J].Agronomy for Sustainable Development,2010,30(2):201-214.
[3] Chung J,Kim D.Miscanthus as a potential bioenergy crop in East Asia[J].Journal of Crop Science and Biotechnology,2012,15(2):65-77.
[4] 文浩,艾辛,蒋建雄,等.采用SSR分子标记鉴定荻与南荻F1杂交种的真实性[J].草原与草坪,2013,33(4):7-11,22.
[5] 梁绪振,陈太祥,白史且,等.芒属(Miscanthus)植物种质资源研究进展[J].草业与畜牧,2010(10):1-5.
[6] 陈少风,何俊,周朴华,等.芒和五节芒的核型研究[J].江西农业大学学报,2008(1):123-126.
[7] 于慧,胡晓颖,徐信兰,等.须芒草族植物花粉形态的观察[J].热带亚热带植物学报,2000(2):164-170.
[8] Collura S,Azanbre B,Finqueneisel G,etal.Miscanthus x giganteus straw and pellets as sustainable fuels:combination and emission tests[J].Environmental Chemistry Letters,2006,4(2):75-78.
[9] Heaton E A,Dohleman F G,Long S P.Meeting U.S.biofuel goals with less land:The potential of Miscanthus[J].Global Change Biology,2008,14(9):2000-2014.
[10] 傅鲜桃,杨春华,陈灵鸷,等.“广益”扁穗牛鞭草花粉特性及结实性研究[J].草业学报,2008,17(2):61-76.
[11] 赵金花,李青丰,那仁图雅,等.3种野生葱属植物花粉活力和柱头可授性研究[J].草业科学,2010,27(4):93-96.
[12] 于晓英,卢向阳,龚明福,等.瓜叶菊花粉生活力研究[J].湖南农业大学学报 (自然科学版),2005,31(1):42-46.
[13] 胡适宜.植物胚胎学试验方法(一):花粉生活力的测定[J].植物学通报,1993,10(2):60-62.
[14] Dafni A,Kevan P G,Husband B C.Practical pollination biology[M].Cambridge,Ontarie,Canada:Enviroquest Ltd,2005:47-51.
[15] Cruden R W.Pollen-ovule ratios:a conservative indicator of breeding systems in flowering plants[J].Evolution,1977,31(1):32-46.
[16] 孙光玲,汪银生,胡乾政.烟草花粉贮藏与活力测定[J].中国烟草,1994(1):20-22.
[17] 李训贞,梁满中,周广洽,等.水稻开花时的环境条件对花粉活力和结实的影响[J].作物学报,2002,28(3):417-420.
[18] 李要民,陈良碧.不同温湿条件下贮藏的3种禾本科植物花粉活力变化[J].植物生理学通讯,1998,34(1):35-37.
[19] Rêgo M M,Rêgo E R,Bruckner C H,etal.Overcoming self-incompatibility in passion fruit by double pollination in anthesis stages[J].Acta Horticulturae,2013,1000:533-536.
[20] Gradziel T M,Robinson R W.Breakdown of self-incompatibility during pistil development in Lycopersicon peruvianum by modified bud pollination[J].Sexual Plant Reproduction,1989,2(1):38-42.
Study on pollen viability and stigma receptivity ofMiscanthussinensis
SUN Kou-zhong1,HU Bin2,JIANG Jian-xiong2,3
(1.XinyangAgriculturalExperimentStationofYanchengCity,Yancheng224049,China; 2.CollegeofBioscience&Biotechnology,HunanAgriculturalUniversity,Changsha410128,China; 3.BiofuelsInstitute,CollegeofEnvironmentandSafetyEngineering,JiangsuUniversity,Zhenjiang212013,China)
The pollen viability for differentMiscanthussinensisgenotypes and the pollen life-span under dry or wet storage conditions were evaluated by in vitro pollen germination method and I2-KI staining method,and the stigma receptivity was also determined with H2O2method.Results showed that the anther ofM.sinensishad a large number of pollen grains with a mean pollen-ovule ratio (P/O) up to 5445±2883,belonging to a reproduction system of oligate xenogamy.The average initial pollen viability was 78.68%±17.46%,but at room temperature (25℃),the pollen viability for all tested genotypes only lasted around 70 minutes under dry storage condition and 110 minutes under wet condition,respectively.The different genotypes kept a higher stigma receptivity until 8 days post-anthesis (8 DPA),and the optimal period to receive pollen grains was from -1 DPA to 1 DPA.
Miscanthussinensis;pollen viability;stigma receptivity;P/O
2016-07-05;
2016-10-31
江苏省农业科技自主创新资金项目 (CX(15)1005) 和国家863课题(2012AA10180104)资助
孙扣忠(1965-),女,江苏阜宁人,助理研究员,研究方向为植物遗传育种研究。 E-mail:sunkouzhong@126.com 蒋建雄为通讯作者。
Q 944.58
A
1009-5500(2017)01-0014-06
