饲用玉米根际促生菌资源筛选及其特性研究
2017-03-28李建宏李雪萍张建贵师尚礼蒋永梅马文文
李建宏,李雪萍,张建贵,姚 拓,师尚礼,蒋永梅,马文文
(甘肃农业大学 草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070)
饲用玉米根际促生菌资源筛选及其特性研究
李建宏,李雪萍,张建贵,姚 拓,师尚礼,蒋永梅,马文文
(甘肃农业大学 草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070)
为获得玉米根际促生菌(PGPR)菌株并明确其功能特性;以玉米根系及根际土壤为材料,利用选择性培养基分离筛选溶磷菌与固氮菌,测定所选菌株溶磷能力和固氮酶活性,并测定其产IAA的能力,从中筛选综合性能优良的菌株,在此基础上,运用生理生化鉴定和16SrDNA分子生物学鉴定相结合的方法鉴定优良菌株的种属。结果表明:玉米根际有大量PGPR菌,分布特征表现出根表(RP)>根表土(RS)>远根土(NRS)>根内(HP)的数量分布规律,呈根际效应。最终获得262 株PGPR菌,其中固氮菌48 株,溶解无机磷细菌108 株,溶解有机磷细菌106 株,有分泌IAA能力的菌株15株。筛选出综合性能优良、有进一步开发应用潜力的菌株7株。经鉴定其中3株为Pseudomonasfluorescens;2株为Bacillus subtilis;Klebsiellaoxytoca和Bacillusmegaterium各1株。
玉米;植物根际促生菌;固氮菌;溶无机磷菌;溶有机磷菌;16SrDNA
农牧业生产中,氮、磷素供应量直接影响作物潜在生产性能和生态功能的发挥。为了满足植物生产所需的氮、磷素等营养物质,化肥一直被认为是解决这一问题的主要(或唯一)途径。在经济落后且土壤贫瘠的西部地区,大量使用高成本的化肥是农牧业生产成本提高的主要因素之一。同时,随着化肥施用量的增加,出现了肥效下降、利用率降低等现象,且土壤和植物中NO2-等累积,污染环境和危及人、畜及食品安全。此外,生产化肥对非再生能源消耗大,破坏土壤结构及微生物多样性等,引起土壤退化。因此,探寻其他肥料来源以部分替代化肥的作用,实现高效益的循环农业已迫在眉睫。
近些年研究表明,植物根际促生菌(简称PGPR或促生菌)不但可以固定空气中的氮气,同时一些菌还兼具溶解土壤中不能被植物直接利用的磷素,分泌植物生长调节物质,促进植物根系生长和矿物质吸收,增强抗病性的功能[1]。用从不同环境、不同植物群落根际分离获得的特定促生菌株生产的生物菌肥与化肥相比具有成本低、使用安全、持续效果好、增产稳定、非再生能源消耗少、经济效益高、对环境和食品无污染等优点,同时,还可改善土壤结构、提高土壤有机质含量和改良盐碱地[2-3]。纵观世界生物肥料研究与应用现状,发达国家(如美国)仍然是世界上研究、生产和使用生物肥料的大国。我国化肥年产量、总产量和单位面积使用量均居世界第一,而微生物肥料年生产量不足化肥的1‰,且品种单一(以豆科植物根瘤菌肥为主),禾本科植物(除水稻外)及其他非豆科植物专用菌肥的生产几乎空缺。虽然国外已有规模化的促生菌肥产品,但不同生境的植物根际生存着不同的菌株,而不同菌株对环境的适应性不同。因此,我们只能借鉴国外的成功经验,从我国特定气候、植物及生境中不断地分离筛选高效菌株,以生产出适合我国特定气候、植物及生境的生物菌肥[4-6]。
玉米具有较高的营养价值,用途广泛,既可以作为优质杂粮食用,也是世界上最受重视的饲料作物之一。在我国粮食和畜牧业生产中占有重要地位。另一方面,虽然玉米具有极其重要的经济价值和生态作用,但其生长过程对氮素和磷素的需求量较大。100年来,化肥一直是提供玉米氮、磷素的主要途径。然而,随着化肥使用量的不断增大,其负面影响日益明显。
因此,筛选玉米根际PGPR菌,并将其运用于玉米专用生物肥料的研制和生产,不仅对促进我国玉米种植业发展具有重要意义,而且对发展绿色农业,保护生态环境具有重要意义。
1 材料和方法
1.1 材料
研究区位于甘肃省武威市黄羊镇,2013年8月在采样区用五点法获取玉米根系及根际0~25 cm土壤样品,存储于无菌容器,低温运输至实验室立即分离。
1.2 方法
1.2.1 样品处理 为了研究PGPR菌在植物根际的分布特点,分离时参照文献[7]的方法,将根际划分为4个区域,即远根土(NRS)、根表土(RS)、根表面(RP)与根内(HP)。
1.2.2 联合固氮菌分离纯化及固氮特性测定 联合固氮菌的分离与纯化:在NFM培养基[8-9]表面运用涂布平板法分离纯化联合固氮菌;固氮菌固氮酶活性的测定:乙炔还原法(ARA)[10]测定固氮酶活性。
1.2.3 溶磷菌的分离纯化与溶磷能力测定 溶磷菌的分离纯化 溶解无机磷菌株运用平板涂布法在PKO无机磷培养基[7,11]表面分离纯化;溶解有机磷菌株运用平板涂布法在蒙金娜有机磷培养基表面分离纯化[12]。
溶磷能力测定 溶磷圈法(定性测定,用于菌株初筛);通过钼蓝比色法定量测定菌株溶磷量,用于菌株复筛[13]。
1.2.4 菌株分泌IAA特性测定 IAA定性测定 spot比色法(用于菌株初筛)[14];IAA定量测定 高效液相色谱法(用于菌株复筛)[15]。
1.2.5 菌株鉴定 生理生化特征鉴定 将各菌株进行淀粉水解试验、乙酰甲基甲醇(V-P)试验、过氧化氢酶试验、石蕊牛奶试验、明胶液化试验、吲哚产生试验、产硫化氢试验、糖发酵试验、柠檬酸盐利用试验、氧化酶试验、酪朊反应、需VB2试验、需泛酸盐试验等,准确观察并记录试验结果。
16S rRNA分子生物学鉴定 用细菌基因组DNA提取试剂盒(OMEGA,美国)提取各菌株的DNA;用琼脂糖凝胶电泳法和紫外分光光度法检测分析DNA的纯度及浓度;扩增引物为细菌16S rDNA扩增通用引物27F-1492R,序列分别为:27F:5-AGAGTTTGATCCTG GCTCAG-3;1492R:5-GGTTACCTTGTTACGACTT-3,由上海生工生物工程股份有限公司合成。
扩增反应体系为(25 μL):10×buffer缓冲液2.5 μL,10 mmol/L的Mg2+1.5 μL,25 mmol/L的dNTP 0.5 μL,20 μmol/L的PCR引物各0.5 μL,5 U/μL的TaqDNA聚合酶0.25 μL,约25 ng/μL的模板DNA 2.0 μL,无菌双蒸水稀释至25 μL。PCR反应程序为:94℃预变性5 min,94℃变性30 s,55℃退火60 s,72℃延伸30 s,重复扩增40个循环,最后72℃延伸10 min,4℃保存,然后采用琼脂糖凝胶电泳法完成扩增产物的检测。DNA Marker为DL2000(上海生工生物科技公司,中国上海),将扩增出的产物的测序直接交上海生工生物科技公司完成。以 GenBank中相似度超过 99%的序列的对比序列,运用Clustal X 1.83及Mega 5.3软件以 N-J邻接法构建系统发育树。
1.3 数据处理
数据整理及制图采用 Excel 2007,数据分析采用 SPSS 17.0。
2 结果与分析
2.1 玉米根际促生菌株的分离纯化及其数量分布
利用NFM、PKO和蒙金娜选择培养基从玉米根际分离出生长速度快、菌落较大的溶解有机磷、无机磷和具固氮能力的菌株,经纯化获得262株,其中固氮菌48株,溶解无机磷108株,有机磷106株。这些菌株在玉米根际的分布特征均表现出根表(RP)>根表土(RS)>远根土(NRS)>根内(HP)的数量分布规律(图1),即表现出很强的根际效应。
2.2 玉米根际联合固氮菌特性
利用乙炔还原法测定了分离自玉米根际的48 株固氮菌株,其中10 株具有良好的固氮酶活性(表1),固氮酶活性在2.65~178.94 nmol C2H4/(h·mL),且各菌株之间固氮酶活性差异较大,大于50 nmol C2H4/(h·mL)的菌株占50%,固氮酶活性最强的5 株菌分别为ZPRW82>ZPRW95>ZPRN45>ZPRS32>ZPRP1,除ZPRS32、ZPRP1之间差异不显著外,这5株菌的固氮酶活性都显著高于其他菌株,且均分离自根系表面,生长速度在中等或中等以上。其他菌株固氮酶活性都低于17 nmol C2H4/(h·mL),其中固氮酶活性相对最低的为分离自玉米远根土壤中的ZPRN1 菌株,固氮酶活性为2.65 nmol C2H4/(h·mL),菌株生长速度也较慢。
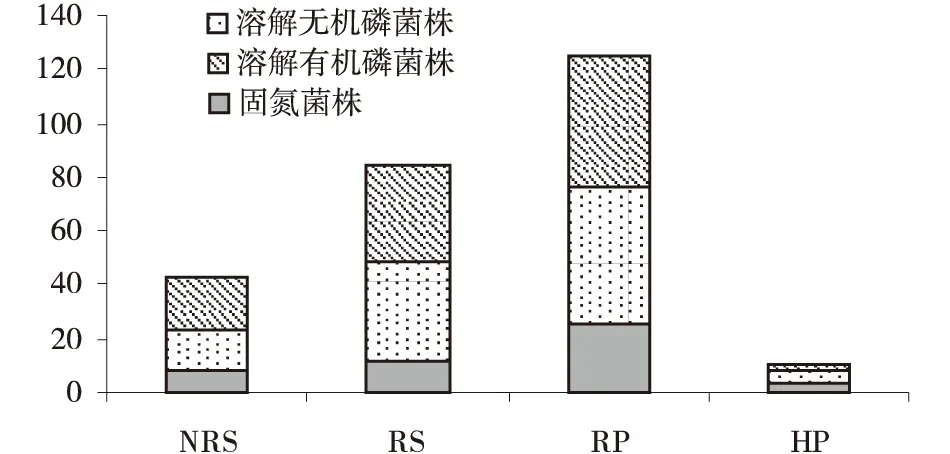
图1 固氮菌株与溶磷菌株数量及分布Fig.1 Sources and distribution of nitrogen fixing and phosphate solubilizing bacteria
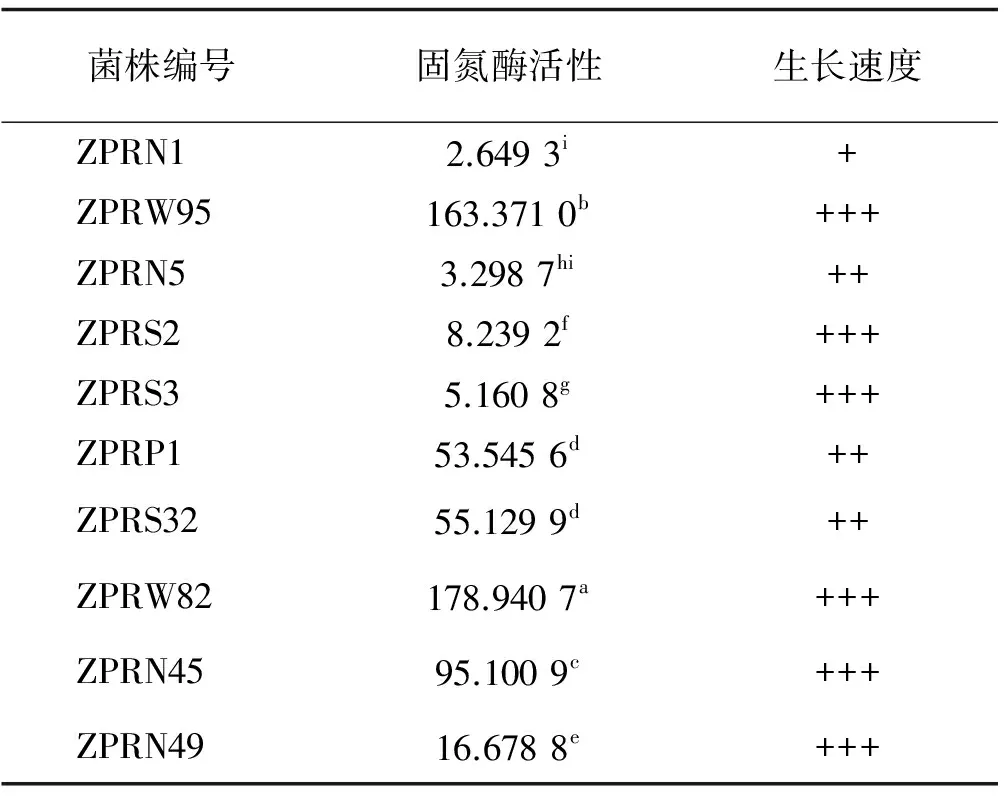
表1 菌株固氮酶活性
注:1.同列不同小写字母表示差异显著(P<0.05),下同;2.+、++、++++代表菌株生长速度,分别为较慢、中等、较快,测量时将菌株在LB培养基于28℃进行纯培养,以能生长为明显的单菌落为准判别生长速度,24 h内的为生长速度较快, 48 h内为中等,72 h内较慢
2.3 玉米根际溶磷菌特性
供试的108株菌株中14 株具有良好的溶解Ca3(PO4)2的能力(PKO 无机磷培养基),占供试菌株的12.96%,溶磷量为3.10~514.28 μg/mL,以菌株ZPRW63的溶磷量最高,且显著高于其他13 株;菌株ZPRP32的溶磷量最低。溶解无机磷的菌株的D/d值在1.32~3.80,以ZPRP12的最大,但溶磷量并不是最高,最小的为菌株ZPRP32,且溶磷量ZPRP32也是最低的;溶磷量最高的ZPRW63 的D/d 值却不是最大的,仅为1.5,菌株ZPRW63 的溶磷量也达到了482.31 μg/mL,但D/d 值也只有2.43。各菌株的PKO 培养液pH在4.04~5.84,均偏酸性,pH 小于5 的菌株溶磷量相对比较高。供试的106 株菌株仅以蛋黄卵磷脂为唯一有机磷源的蒙金娜培养基培养发现,其中14 株具有良好的溶解有机磷的能力,占供试菌株的13.21%。溶磷量为4.66~39.88 μg/mL,以ZPRM29与ZPRM45 溶磷量最高,且显著高于其他13株;菌株ZPRM24的溶磷量最低。溶解有机磷的菌株的D/d值在1.12~3.0,以ZPRM49的最大,但溶磷量也不是最高,最小的为菌株ZPRM33,溶磷量为24.21 μg/mL,却不是最低;溶磷量最高的ZPRM29与ZPRM45的D/d值都为1.63,介于1.12~3.0;各菌株的蒙金娜培养液pH在7.31~7.94,均偏碱性(表2)。
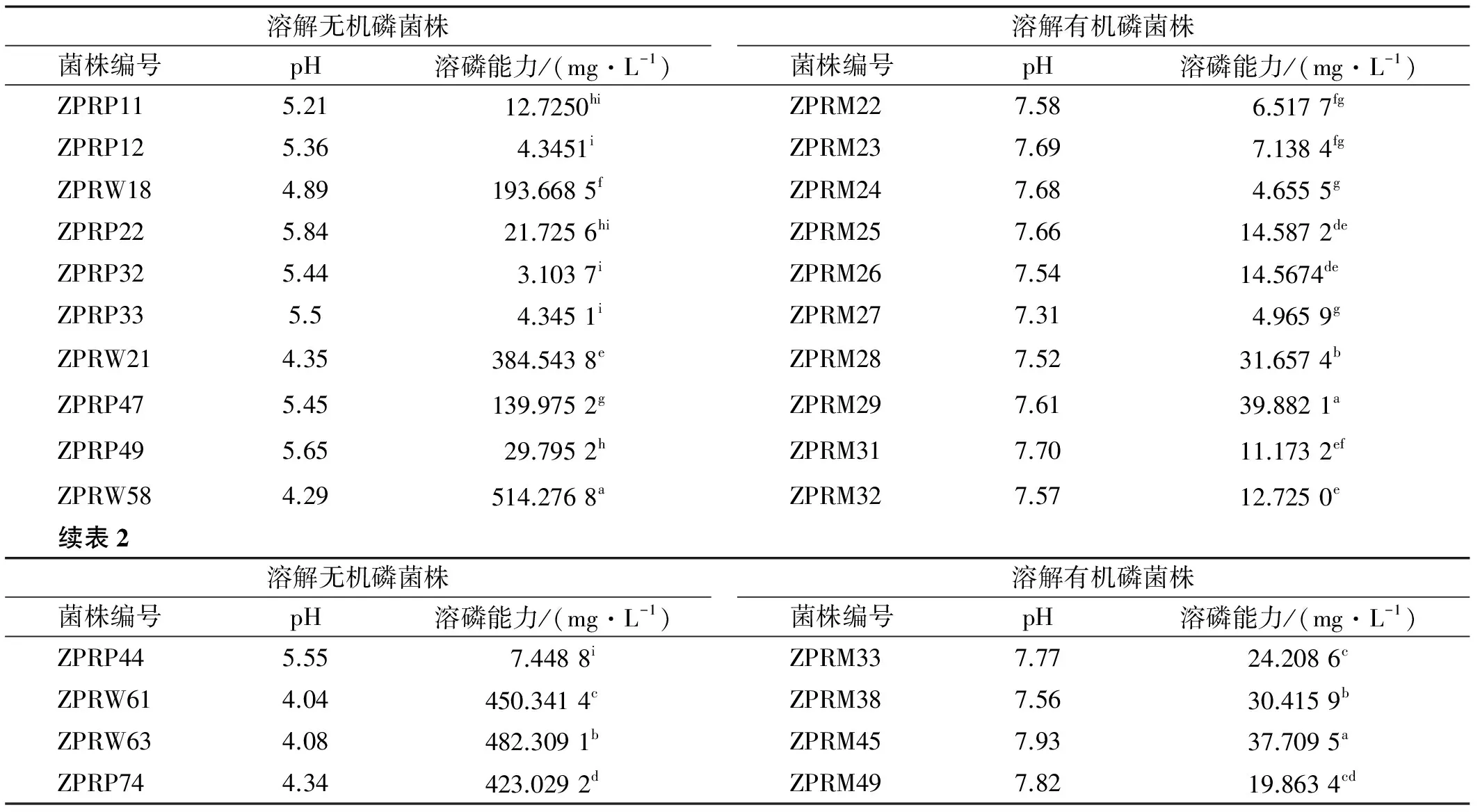
表2 各菌株溶解磷能力
注:同列不同小写字母表示差异显著(P<0.05),下同
2.4 根际优良菌株分泌IAA特性

表3 菌株在King 培养基中分泌IAA 量
注:+,++和+++分别表示浅红、粉红、深红;同列不同小写字母表示差异显著(P<0.05),下同
利用显色法和比色法分别对供试的262株菌株分泌IAA的能力进行了测定,结果表明,15株菌株具有分泌IAA的能力,占供试菌株的5.73%,各菌株的显色反应与分泌IAA的量成正比关系,即分泌量越大,颜色反应越强烈。各菌株分泌IAA的能力差异显著,分泌量在1.36~17.80 μg/mL;其中ZPRM45的分泌量最大,ZPRM28的分泌量最小;介于两者之间相对较好的菌株有6株,分别为ZPRW21、ZPRW18、ZPRP89、ZPRP92、 ZPRM31和ZPRP88(表3)。
2.5 优良PGPR菌株的筛选
将2.2,2.3和2.4 所得优良菌株按照试验方法进行交叉测定,结果表明,有7 株菌株具有作为玉米根际促生菌的潜力,其中ZPRW18,ZPRW21和ZPRW82菌株既具有固氮、溶磷能力,又具有分泌IAA 的能力。其他4 种菌株则具有其中2 个能力。综上,ZPRW18、ZPRW21、ZPRW58、ZPRW61、ZPRW63、ZPRW82、ZPRW95等7 株菌综合特性优良,具有进一步研究开发的潜力,故作为后期深入研究的供试菌株。
2.6 优良菌株鉴定结果
2.6.1 生理生化鉴定 根据表 4生理生化实验结果,结合菌株革兰氏染色特性、菌落特征,查阅《伯杰细菌鉴定手册》[16]以及《常见细菌系统鉴定手册》[17]得到ZPRW18,ZPRW58和ZPRW63为假单胞属,ZPRW21,ZPRW61和ZPRW95为芽孢杆菌属,ZPRW82暂无法确定(图2)。

表4 菌株生理生化反应结果
注:表中的符号与《伯杰细菌鉴定手册(第八版)》和《常见细菌鉴定手册》保持一致,+表示该反应为阳性,-表示该反应为阴性

图2 所分离菌株分子系统进化树Fig.2 Phylogenetic tree of the isolate strains.
2.6.2 分子生物学鉴定结果 综合生化实验结果和分子鉴定结果,发现研究中所分离的菌株形态及生化鉴定结果和分子鉴定结果能很好的吻合,说明此次研究的鉴定结果准确可靠,鉴定结果(表5)。

表5 优良PGPR菌株鉴定结果
3 讨论
国内外的很多研究者在筛选高效溶磷菌株的过程中,以溶磷圈的有无及大小为标准判断菌株溶磷能力的有无及高低[18-19]。但研究发现,溶磷圈的大小和溶磷量不完全呈正相关,也有学者发现了相似的现象[10,20-22],分析原因是菌株的溶磷机理的复杂性[23],溶磷圈的出现主要是体现溶磷微生物产酸而造成的,现有研究表明,产酸是微生物溶磷的主要途径[24],产生的酸性物质包括葡萄糖酸、2-酮戊二酸、乳酸、草酸、氨基酸、延胡索酸、苹果酸、柠檬酸和琥珀酸等有机酸[25]和H2S、H2SO4等无机酸[26],在酸类物质作用下,培养基中Ca3(PO4)2或CaCO3等成分溶解,出现溶磷圈;但除了产酸外,微生物还通过酶解作用和蛋白质作用[27]溶解土壤中的难溶性磷。因此,溶磷圈的大小并不能完全反应溶磷能力的高低,在研究中,以溶磷圈法作为定性测定,钼锑抗比色法作为定量测定,两个相结合,来确定菌株的溶磷能力,努力使误差降低。
在分离、纯化具有固氮能力、溶解无机磷和溶解有机磷能力菌株时,发现各菌株数量均表现出“根表>根表土>远根土>根内”的根际分布趋势,此研究结果与马文文等[28],张英[29],以及赵小蓉等[20-21]的研究结果相一致,由此说明PGPR菌株在土壤中的数量除了受土壤理化性质、肥力、类型及其耕作措施等因素外,PGPR菌的分布同时也受植物强烈的根际效应的影响。据此可以推测,不同植物根际促生菌的组成必然不同,因此,要开发效果良好的促生菌产品,就必须从相应环境中相应植物的根际分离,当然,选育出适应性广的优良菌株也是一个好的研究方向。
除此次研究的溶磷、固氮、分泌生长素等功效外,PGPR另外一个重要的功能就是用于防治农作物病害[30]。用于生防研究的细菌中,荧光假单胞杆菌(Pseudomonasfluorescens)是研究报道最多的一种生物防治细菌,它们大量存在于植物根际,繁殖迅速、能分泌嗜铁素和抗生素,而成为植物位点和空间微环境的有力竞争者,从而对多种植物病原菌有抑制作用。孙广正等[30]研究发现促生菌LHS11对黄瓜枯萎菌(Fusariumoxysporiumsp.cucumerinum),西瓜尖镰孢菌(Fusariumoxysporumsp.niveum)抑制效果达80%以上,具有较好的应用潜力。而此次研究也分离出了Pseudomonasfluorescens和Bacillussubtilis,参考前人文献推测其有拮抗病原菌的潜力,这一方面研究将是下一步工作的重点。
4 结论
玉米根际有大量PGPR菌,分布特征表现出根表(RP)>根表土(RS)>远根土(NRS)>根内(HP)的数量分布规律,最终获得262 株PGPR菌,其中固氮菌48 株,溶解无机磷108 株,有机磷106 株,有分泌IAA能力的菌株15株。筛选出综合性能优良,有进一步开发应用潜力的菌株7株,经鉴定其中3株为Pseudomonasfluorescens,2株为Bacillussubtilis,Klebsiellaoxytoca和Bacillusmegaterium各1株;玉米PGPR菌分布呈根际效应,最终筛选出7 株综合性能良好、有进一步开发利用价值的PGPR。
[1] 姚拓.促进植物生长菌的研究进展[J].草原与草坪,2002(2):3-5.
[2] 荣良燕,姚拓,冯今,等.PGPR微生物肥代替部分化肥对豌豆生长的影响[J].草原与草坪,2014,34(1):7-12.
[3] 陈龙,姚拓,柴强,等.微生物肥料替代部分化学肥料对玉米生长及品质的影响[J].草原与草坪,2016,36(1):20-25,30.
[4] Kumar N,Sowmyamala B V,Kumar S.Effect of plant growth promoting rhizobacteria (PGPR) on growth and yield of bitter gourd[J].International Journal of Applied Biology and Pharmaceutical Technology,2012,3(1):1-7.
[5] 姚拓.高寒地区燕麦根际联合固氮菌研究Ⅱ固氮菌的溶磷性和分泌植物生长素特性测定[J].草业学报,2004(3):85-90.
[6] 胡江春,薛德林,马成新,等.植物根际促生菌(PGPR) 的研究与应用前景[J].应用生态学报,2004,15 (10):1963-1966.
[7] Hafeez F Y,Malik K A.Manual on biofertilizer technology.NIBGE,Pakistan,2000.
[8] 许光辉,郑洪元.土壤微生物分析方法手册[M].北京:农业出版社,1986.
[9] 姚槐应,黄昌勇.土壤微生物生态学及其实验技术[M].北京:科学出版社,2006.
[10] 王国基.根际促生专用菌肥研制及其对玉米促生作用的研究[D].兰州:甘肃农业大学,2014.
[11] Hafeez F Y,Yasmin S,Ariani D,etal.Plant growth-promotingbacteria as biofertilizer[J].Agron Sust Devel,2006:26:143-150.
[12] 马文彬,姚拓,王国基,等.根际促生菌筛选及其接种剂对箭筈豌豆生长影响的研究[J].草业学报,2014,23(5):241-248.
[13] 荣良燕,姚拓,马文彬,等.岷山红三叶根际优良促生菌对其宿主生长和品质的影响[J].草业学报,2014,23(5):231-240.
[14] 李玉娥,姚拓,荣良燕.溶磷菌溶磷和分泌IAA特性及对苜蓿生长的影响[J].草地学报,2010,18(1):84-88.
[15] 马文彬.9种豆科牧草根际促生菌资源筛选及特性研究[D].兰州:甘肃农业大学,2015.
[16] Buchanan R E,Gibbons N E.中国农科院微生物研究所《伯杰细菌鉴定手册》翻译组译.伯杰细菌鉴定手册[M].北京:科学出版社,1984.
[17] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[18] 程宝森,房玉林,刘延林,等.渭北旱塬葡萄根际解磷细菌的筛选及其对葡萄促生效应研究[J].西北农业学报,2009(4):185-190.
[19] 吴凡,崔萍,夏尚远,等.桑树根际解磷细菌的分离鉴定及解磷能力的测定[J].蚕业科学,2007,33(4):521-527.
[20] 赵小蓉,林启美,李保国.微生物溶解磷矿粉能力与pH及分泌有机酸的关系[J].微生物学杂志,2003,23(3):5-7.
[21] 赵小蓉,林启美,李保国.溶磷菌对4种难溶性磷酸盐溶解能力的初步研究[J].微生物学报,2002,42(2):236-241.
[22] Narsian V.Aspergillus aculeatus as a rock phosphate solubilization[J].Soil Biology and Biochemistry,2000,32(4):559-565.
[23] 唐哲,杨洪一,李丽丽.解磷真菌的研究进展与应用前景[J].安徽农业科学,2014,42(32):11287-11288,11296.
[24] Patel D K,Archana G,Naresh K G.Variation in the nature of organic acid secretion and mineral Phosphate solubilization byCitrobactersp[J].DHRSS in the presence of different sugars.current microbiology,2008,65:168-174.
[25] Gyaneshwar P,Naresh Kumar G,Parekh L J,etal.Role of soil microorganisms in improving Pnutrition of plants[J].Plant Soil,2002,24(5):83-93.
[26] Prasanna N D,Vijayalakshmi K,Shaheen S K,etal.Screening and isolation of phosphate solubilizing Pseudomonas stutzeri[EGB(3)] from gut of earthworm (Eisenia foetida):solubilization as influence by organic acids[J].Journal Pure Appl.Microbiol,2010,4(2):717-723.
[27] Delvasto P,Ballester A,Munoz J A,etal.Mobilization of Phosphorus from Iron Ore by the Bacterium Burkholderia Caribensis FeGL03[J].Minerals Engineering,2009,22:1-9.
[28] 马文文,姚拓,蒲小鹏,等.东祁连山7 种禾草根际溶磷菌筛选及其溶磷特性[J].草业科学,2015,32( 4):515-523.
[29] 张英.西藏阿里高寒草原四种牧草根际促生菌资源筛选及促生机理研究[D].兰州:甘肃农业大学,2013.
[30] 孙广正,姚拓,赵桂琴,等.荧光假单胞菌防治植物病害研究现状与展望[J].草业学报, 2015,24(4):174-190.
Study on screening and characteristics of PGPR isolated from maize
LI Jian-hong,LI Xue-ping,ZHANG Jian-gui,YAO Tuo,SHI Shang-li,JIANG Yong-mei,MA Wen-wen
(CollegeofPrataculturalScience,GansuAgriculturalUniversity/KeyLaboratoryofGrasslandEcosystem,MinistryofEducation/PrataculturalEngineeringLaboratoryofGansuProvince/Sino-U.S.CentersforGrazinglandEcosystemSustainability,Lanzhou730070,China)
In order to obtain the plant growth promoting rhizobacteria (PGPR) from maize and identify the function,the phosphate-solubilization bacteria and nitrogen fixation bacteria were isolated by using rhizosphere soil and selective medium.The potential PGPR strains were screened by measuring the phosphate-solubilization capacity (organic phosphorus and inorganic phosphorus),nitrogen fixation capacity and IAA secretion capacity.And then,the potential strains were identified through physiological and biochemical tests,as well as 16SrDNA sequence analyses.The number of PGPR shown the following order: RP (rhizoplan or root surface) > RS (root soil) > NRS (soil away from roots) > HP (histoplan or root interior).Totally 262 PGPR strains were isolated from the maize rhizosphere,including 48 nitrogen fixing strains,108 inorganic phosphorus-solubilization strains,106 organic phosphorus-solubilization strains and 15 inorganic phosphorus-solubilization strains.In which,7 strains were excellent and had application potential (3 strains werePseudomonasfluorescens,2 strains wereBacillussubtilis,1 strain wasKlebsiellaoxytocaand 1 strain wasBacillusmegaterium).
maize,plant growth promoting rhizobacteria,nitrogen fixing bacteria,inorganic phosphate-solubilizing bacteria,organic phosphate-solubilizing bacteria,16SrDNA
2016-03-14;
2016-04-20
国家自然基金项目(31360584)和农业部国家牧草产业技术体系(CARS-35)资助
李建宏(1986-),男,甘肃临潭县人,在读博士研究生。 E-mail:lijianhong123@126.com 姚拓为通讯作者。
Q 939.96
A
1009-5500(2017)01-0044-07
