高速逆流色谱分离纯化花色苷研究进展
2017-03-28栗瑜婉刘清清徐贞贞
栗瑜婉,刘清清,徐贞贞
(1中国农业科学院农业质量标准与检测技术研究所/农业部农产品质量安全重点实验室,北京 100081;2中国农业大学食品科学与营养工程学院,北京 100083;3西北大学化工学院,西安 710069)
高速逆流色谱分离纯化花色苷研究进展
栗瑜婉1,2,刘清清1,3,徐贞贞1
(1中国农业科学院农业质量标准与检测技术研究所/农业部农产品质量安全重点实验室,北京 100081;2中国农业大学食品科学与营养工程学院,北京 100083;3西北大学化工学院,西安 710069)
高速逆流色谱(HSCCC)技术是一种连续高效的新型液—液分配色谱技术,本文综述了花色苷单体的商业化现状及利用逆流色谱法分离纯化花色苷单体的研究进展。
高速逆流色谱;花色苷;分离纯化;研究进展
花色苷是一类重要的植物化学成分,属于多酚类化合物[1]。花色苷主要分布于鲜花、水果、蔬菜和谷类豆类等植物中[2],是一种天然水溶性色素,可以赋予植物红、紫、蓝、黑等不同的颜色[3]。据报道,现有27个科、72个属植物的根、茎、叶、花和果实等器官的细胞中含有花色苷,来源十分丰富[4]。
已报道的花色素有23种,其中自然界中常见的主要有矢车菊色素(Cy)、飞燕草色素(Dp)、矮牵牛色素(Pt)、芍药色素(Pn)、天竺葵色素(Pg)和锦葵色素(Mv)六大类[4],自然条件下游离的花青素极少见,多以花色苷形式存在[5]。已报到的花色苷有500余种[3]。花色苷具有一定的生理活性,如改善视觉功能[6]、改善大脑功能[7]、抗肥胖症[8]、抗糖尿病[9]、抗心血管疾病[10]和抗癌症[11]等。花色苷还可用作天然色素(欧盟食品添加剂编号E163)及功能食品添加剂等。近年来,对花色苷研究的热点已从资源评价、定性定量、稳定性及简单的体外抗氧化活性分析等领域转向对其生理活性的研究。目前,对花色苷的生理活性研究均采用花色苷单体、提取物或富含花色苷的食品在人、动物和细胞三大体系进行实验。基于上述,从天然产物中分离纯化花色苷单体具有重要意义。
1 花色苷及其单体商业化情况概述
市售花色苷粗提取物种类及品种繁多,但商业化的花色苷单体极其有限,市售花色苷单体仅为30余种,以Cy、Dp、Pn、Mv、Pt和Pg六大类为主,其总量不足已报到花色苷单体总量的1%。目前,全球生产花色苷单体的公司不足10家,如挪威的“Polyphenols Laboratories”、美国“INDOFINE Chemical”和“ChromaDex”、法国“Extrasynthese”及国内的“上海同田”等公司。其中“Polyphenols Laboratories”是全球最早也是目前规模最大的花色苷单体生产公司,可提供36种花色苷单体。表1罗列了市售28种花色苷单体的中文名称、CAS号及分子式信息,其中Cy类9种、Dp类6种、Pn类5种、Mv类4种、Pn和Pg各2种,且均为非酰基化花色苷。商品化花色苷单体种类不足极大地制约了花色苷生理功能和作用机理的相关研究,因此开展分离纯化花色苷单体的工作极具重要性和挑战性。
2 高速逆流色谱法制备花色苷单体研究现状
高速逆流色谱法(HSCCC)是20世纪80年代初,由美国国立健康研究院的Ito和Bowman在液液分配色谱的基础上研究和发展起来的一种现代色谱分离制备技术[12]。与传统的液—固色谱相比,它的固定相和流动相都是液体,不需要固体支撑,避免了因不可逆吸附而引起的样品损失、失活、变性等弊端,且被分离物质与液态固定相之间能可充分接触,使得样品的制备量大大提高[13]。我国自1978年3月开展逆流色谱技术的相关研究,是继美国、日本之后较早开展应用逆流色谱的国家[14]。HSCCC具有连续、高效、制备量大等优点,已经被成功地应用于花色苷的分离纯化[15-16]。
2.1 溶剂体系对花色苷分离效果的影响
花色苷多具极性,因此分离纯化花色苷多采用极性较强的溶剂体系,常用正丁醇(BuOH)和水作为两项基本溶剂,同时由于花色苷在较低pH值下(pH<2)以稳定的花色烊阳离子形式,因此溶剂体系中也常含有三氟乙酸(TFA),三氟乙酸的溶剂浓度0.01%~0.1%不等[17-18]。研究表明,甲基叔丁基醚(MTBE):BuOH:乙腈(ACN):水:TFA的溶剂体系是HSCCC法分离花色苷单体的最常用溶剂体系(表2)。由于花色苷具有多样性,溶剂体系的差异化有益于不同花色苷单体的分离纯化,因此分离不同植物源花色苷时,应针对具体的花色苷单体进行溶剂体系优化[15,18-19]。通常,较高疏水性的溶剂体系有利于中极性的低聚花色苷及含双糖苷的花色苷被流动相洗脱,此时单花色苷可在固定相中保留,而较低疏水性的溶剂体系可将高极性单花色苷通过流动相洗脱[15]。

表1 部分市售花色苷标准品
HSCCC溶剂体系的优化一般通过调整系统中BuOH的比例、考察待分离花色苷单体在溶剂体系中的分配系数来实现:K值较小时目标花色苷分离效果不好,而K值较大,洗脱时间又会过长,因此通常分配系数K值在0.5~2之间可得到最适合分离溶剂体系[20]。分配系数优化越好,花色苷分离效果越好,如Chen等[21]与Li等[20]分别从蓝果忍冬及黑米糠提取物中分别分离出1种花色苷单体,纯度分别为98.1% (MTBE:BuOH:ACN:水:TFA=2:2:1:5:0.01)与96.89% (MTBE:BuOH:ACN:水:TFA=2:2:1:5:0.1);易建华等[22]采用MTBE:BuOH:ACN:水:TFA=2:2:1:5:0.01的溶剂体系从紫甘蓝中分理处3种花色苷单体,虽然花色苷种类有所提升,但每种单体的纯度也有所下降,仅为76.28%、45.46%和91.46%。分离花色苷种类越多,对分配系数的优化的要求越高:Qiu等[23]利用溶剂体系MTBE:BuOH:ACN:水:TFA=1:4:1:5:0.01从紫甘薯中纯化出4种花色苷单体,且4种花色苷纯度显著提高,分别为95.5%、95.0%、97.8%和96.3%;陆英等[24]利用溶剂体系MTBE:BuOH:ACN:0.2%TFA=2:5:1:6从紫甘薯(广紫薯135)中纯化得到2种花色苷单体,两种组分纯度分别为98.7%与96.8%。通过比较上述紫甘蓝和紫甘薯的实验结果,两个研究的目标花色苷均为酰基化花色苷,且目标原料中花色苷的种类也较多,此时适当调高BuOH的比例的溶剂体系,更有利于极性较弱的酰基化花色苷单体的分离。
2.2 其他因素对花色苷分离效果的影响
除剂体系外,仪器选择,洗脱方式、转向和转速、样品浓度、进样方式以及柱温等也不同程度的影响分离效果[25]。Schwarz等[16]采用经典溶剂体系MTBE:BuOH:ACN:水=3:1:1:5(采用0.1%的TFA酸化)利用不同流速(5.0、2.5 mL/min)从黑接骨木汁中分别纯化得到了cyanidin 3-glucoside与cyanidin 3,5-diglucoside。而Sheng等[26]发现,较快流速得到花色苷单体的分离效果较差、峰重叠较严重,在较低流速1.5 mL/min的流速下,从桑葚花色苷粗提物中分离出4种花色苷。此外,增加分离级数也可有效增强花色苷分离效果,如Li等[27]采用两级HSCCC技术,从木瓜花瓣中分离纯化出3种花色苷与3种花色素,且所有花色苷单体及花色素纯度均高于95%。
3 结论与展望
花色苷类物质的生理活性是近年来的研究热点,但由于市售花色苷单体种类极其有限,极大地制约了单体的机理研究工作。由于其种类繁多,大规模制备技术存在局限性,因此进一步研究其制备技术、突破花色苷分离工作的局限性,对研究不同花色苷单体在细胞、动物等研究模型的中可能的吸收机制和作用机理,可为全面评价花色苷类物质生理活性提供重要理论依据,因此,花色苷单体的工业化生产意义重大,此类产品的商业化价值较高,市场潜力巨大。同时,HSCCC技术在花色苷高效分离及工业化生产领域的应用,值得进一步挖掘。◇
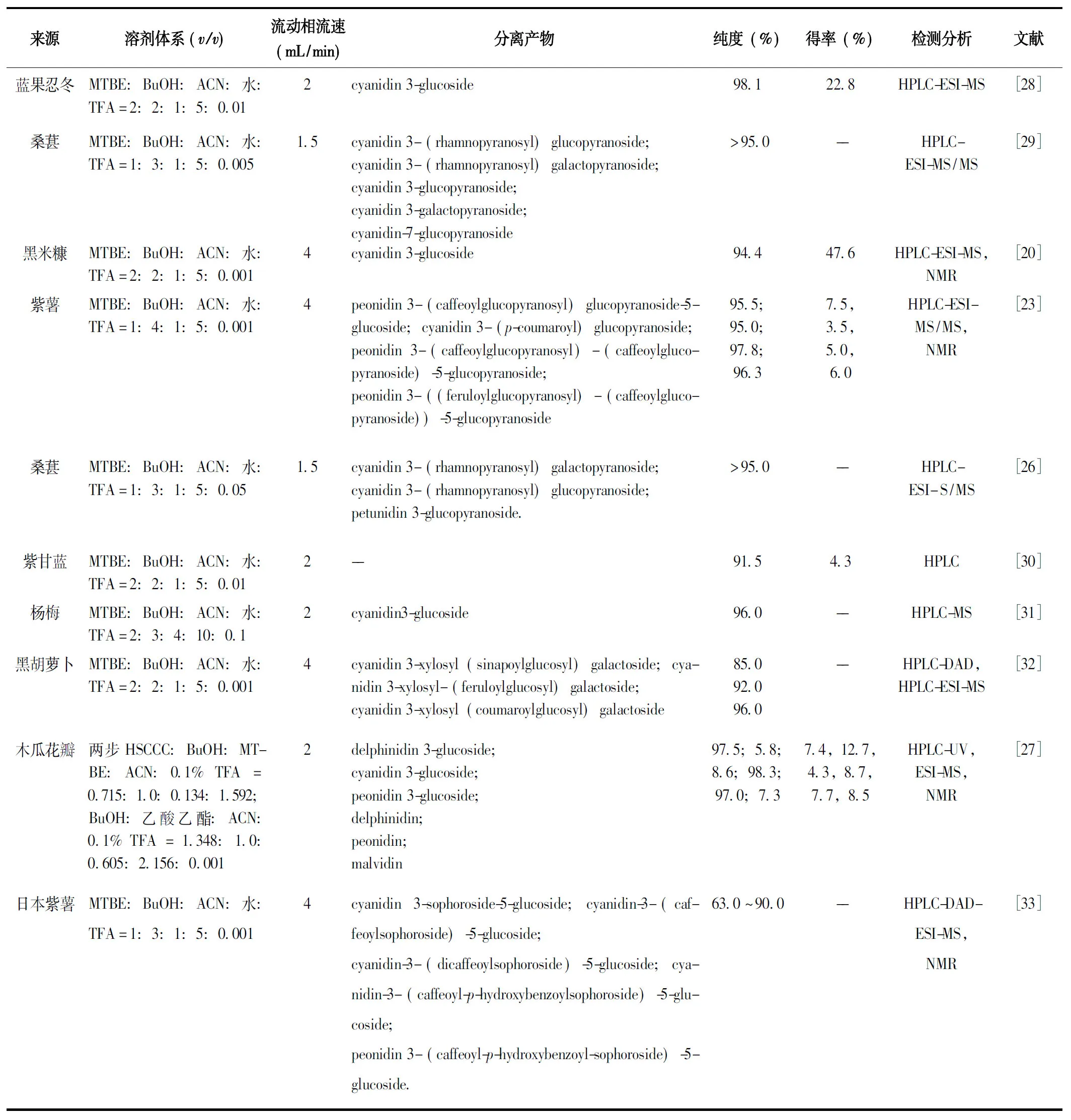
表2 近10年部分HSCCC分离纯化花色苷
[1]Navas,M.J.,et al.Analysis and Antioxidant Capacity of Anthocyanin Pigments.Part IV:Extraction of Anthocyanins[J]. Critical Reviews in Analytical Chemistry,2012,42(4):313-342.
[2]孙建霞,张燕,孙志健,等.花色苷的资源分布以及定性定量分析方法研究进展[J]. 食品科学,2009,30(5):263-268.
[3]Escribano-Bailon,M.T.,C.Santos-Buelga,and J.C.Rivas-Gonzalo.Anthocyanins in cereals[J]. Journal of Chromatography A,2004,1054(1-2):129-141.
[4]Bueno,J.M.,et al.Analysis and Antioxidant Capacity of Anthocyanin Pigments.Part I:General Considerations Concerning Polyphenols and Flavonoids[J]. Critical Reviews in Analytical Chemistry,2012,42(2):102-125.
[5]孙建霞,等.花色苷的资源分布以及定性定量分析方法研究进展[J]. 食品科学,2009,30(5):259-264.
[6]Nakaishi,H.Effects of Black Currant Anthocyanoside Intake on Dark Adaptation and VDT Work-induced Transient Refractive Alteration in Healthy Humans[J]. Alternative Medicine Review,2000,5(6):553-563.
[7]Shukitt-Hale,B.,et al.Plum juice,but not dried plum powder,is effective in mitigating cognitive deficits in aged rats[J]. Nutrition,2009,25(5):567-573.
[8]Titta,L.,et al.Blood orange juice inhibits fat accumulation in mice[J]. International Journal of Obesity,2010,34:578-588.
[9]Prior,R.L.,et al.Whole berries versus berry anthocyanins:interactions with dietary fat levels in the C57BL/6J mouse model of obesity[J]. Journal of Agricultural & Food Chemistry,2008,56(3):647-653.
[10]Mink,P.J.,et al.Flavonoid intake and cardiovascular disease mortality:a prospective study in postmenopausal women1-4[J]. American Journal of Clinical Nutrition,2007,85(3):895-909.
[11]Ha,U.S.Anthocyanin Induces Apoptosis of DU-145 Cells In Vitro and Inhibits Xenograft Growth of Prostate Cancer[J]. Yonsei Medical Journal,2015,56(1):16-23.
[12]Ito,Y.and R.L.Bowman,Countercurrent chromatography:liquid-liquid partition chromatography without solid support[J]. Science,1970,167(3916):281-283.
[13]Degenhardt,A.,et al.,Preparative isolation of anthocyanins by high-speed countercurrent chromatography and application of the color activity concept to red wine[J]. Journal of Agricultural & Food Chemistry,2001,48(12):5812-8.
[14]张天佑.逆流色谱技术的开发利用和动向[J]. 国际科技交流,1988(6).
[15]Valls,J.,et al.Advanced separation methods of food anthocyanins,isoflavones and flavanols[J]. Journal of Chromatography A,2009,1216(43):7143-7172.
[16]Schwarz,M.,et al.Application of high-speed countercurrent chromatography to the large-scale isolation of anthocyanins[J]. Biochemical Engineering Journal,2003,14(3):179-189.
[17]尚远宏,曾桢,田金凤.应用高速逆流色谱分离天然产物中成分的研究进展[J]. 西南民族大学学报(自然科学版),2016,42(2):156-161.
[18]Renault,J.H.,et al.Preparative separation of anthocyanins by gradient elution centrifugal partition chromatography[J]. Journal of Chromatography A,1997,763(1-2):345-352.
[19]胡晓丹,孙爱东,张德权.高速逆流色谱分离紫苏叶花色素苷的研究[J]. 中药材,2010(10):1586-1588.
[20]Li,B.,et al.Combination of high-speed countercurrent chromatography and reversed phase C18 chromatography for large-scale isolation of cyanidin-3-O-β-d-glucoside from black rice bran extract[J]. Industrial Crops and Products,2012,37(1):88-92.
[21]Chen,L.,et al.Isolation of cyanidin 3-glucoside from blue honeysuckle fruits by high-speed counter-current chromatography[J]. Food Chem,2014,152:386-90.
[22]易建华.高速逆流色谱分离纯化紫甘蓝花色苷[J]. 食品与机械,2012.
[23]Qiu,F.,et al.Preparative isolation and purification of anthocyanins from purple sweet potato by high-speed counter-current chromatography[J]. Journal of Separation Science,2009,32(12):2146-2151.
[24]陆英,等.高速逆流色谱制备分离紫甘薯花色苷[J]. 分析化学,2011,39(6):851-856.
[25]曹雪丽.高速逆流色谱分离技术[M].北京:化学工业出版社,2005:39-53.
[26]Sheng,F.,et al.Separation and identification of anthocyanin extracted from mulberry fruit and the pigment binding properties toward human serum albumin[J]. Journal of Agricultural and Food Chemistry,2014,62(28):6813-6819.
[27]Li,S.,et al.Combination of supercritical fluid extraction with counter-current chromatography to isolate anthocyanidins from the petals of Chaenomeles sinensis based on mathematical calculations[J]. Journal of Separation Science,2013,36(21-22):3517-3526.
[28]Chen,L.,et al.Isolation of cyanidin 3-glucoside from blue honeysuckle fruits by high-speed counter-current chromatography[J]. Food Chemistry,2014(152):386-390.
[29]Du,Q.,J.Zheng,and Y.Xu.Composition of anthocyanins in mulberry and their antioxidant activity[J]. Journal of Food Composition and Analysis,2008,21(5):390-395.
[30]易建华,潘毛头,朱振宝.高速逆流色谱分离纯化紫甘蓝花色苷[J]. 食品与机械,2012,28(6):129-132.
[31]Sun,C.,et al.Purification and anti-tumour activity of cyanidin-3-O-glucoside from Chinese bayberry fruit[J]. Food Chemistry,2012,131(4):1287-1294.
[32]Montilla,E.C.,et al.Anthocyanin composition of black carrot Cultivars antonina,beta sweet,deep purple,and purple haze[J]. Journal of Agricultural and Food Chemistry,2011,59(7):3385-3390.
[33]Montilla,E.C.,et al.Preparative isolation of anthocyanins from Japanese purple sweet potato varieties by high-speed countercurrent chromatography[J]. Journal of Agricultural and Food Chemistry,2010,58(18):9899-9904.
(责任编辑 李婷婷)
Research Advancements of Separation and Purification of Anthocyaninsby High Speed Counter-Current Chromatography
LI Yu-wan1,2,LIU Qing-qing1,3,XU Zhen-zhen1
(1Institute of Quality Standard & Testing Technology for Agro-products,Chinese Academy of Agricultural Sciences/Key Laboratory of Agro-food Safety and Quality,Ministry of Agriculture,Beijing 100081,China;2College of Food Science and Nutritional Engineering,China Agricultural University,Beijing 100083,China;3College of Chemical Engineering,Northwest University,Xi’an 710069,China)
High-Speed Counter-Current Chromatography(HSCCC)is a kind of efficient productive chromatographic technique based on continous liquid-liquid partition.The research advancements of of commercial application of individual anthocyanins and separation and purification of individual anthoaynins by HSCCC were reviewed.
High-Speed Counter-Current Chromatography (HSCCC);anthocyanin;separation and purification;research advancement
国家自然科学基金项目(项目编号:31401666);中国农业大学2016大学生国家创新项目(项目编号:201610019046)。
粟瑜琬(1997— ),女,本科生,研究方向:食品科学。
徐贞贞(1985— ),女,博士,助理研究员,研究方向:农产品质量与安全。
