西罗莫司抗红藻氨酸诱发的未成年C57BL/6小鼠癫痫的有效剂量
2017-03-28吴美玲杨鑫杰刘福荣王昱植陈丹娇曾玲晖
吴美玲,杨鑫杰,刘福荣,王昱植,陈丹娇,吴 赟,朱 锋,曾玲晖
(浙江大学城市学院医学院,浙江杭州 310015)
西罗莫司抗红藻氨酸诱发的未成年C57BL/6小鼠癫痫的有效剂量
吴美玲,杨鑫杰,刘福荣,王昱植,陈丹娇,吴 赟,朱 锋,曾玲晖
(浙江大学城市学院医学院,浙江杭州 310015)
目的探索西罗莫司(Sir)治疗未成年小鼠癫痫的安全有效剂量及作用。方法10日龄的C57BL/6小鼠单次ip给予卡莫酸(红藻氨酸,KA)12.0 mg·kg-1诱导癫痫,于造模后24 h隔天分别ip给予Sir 0.3,1.0和3.0 mg·kg-1直至3 d、7 d、3周、5周和6周,采用Western蛋白印迹法检测S6蛋白表达及其磷酸化水平,确定最低有效剂量。观察Sir最低有效剂量对学习记忆和生长发育的影响,其中Doublecortin(DCX)免疫荧光染色检测海马神经元发育,Morris水迷宫测定小鼠学习记忆水平,悬尾、O迷宫和新事物认知实验测定小鼠焦虑抑郁状态。结果Western蛋白印迹结果显示,Sir 0.3 mg·kg-1对正常小鼠和KA致痫小鼠S6蛋白磷酸化无显著影响,而1.0和3.0 mg·kg-1均可显著抑制KA致痫小鼠S6蛋白磷酸化(P<0.05)。选取Sir 1.0 mg·kg-1作为最低有效剂量。Sir 1.0 mg·kg-1对DCX表达和体质量无显著影响。Morris水迷宫结果显示,与正常对照组相比,模型组小鼠平台潜伏期和游泳距离明显延长(P<0.05),穿越平台象限次数明显下降(P<0.05),而Sir 1.0 mg·kg-1可显著逆转KA致痫模型小鼠学习记忆功能下降(P<0.05),且与正常对照组无显著差异。KA致痫模型小鼠在悬尾实验中显示悬尾不动时间明显上升(P<0.05),O迷宫实验中移动距离、开臂中停留时间以及新事物认知实验中与新事物的触碰时间、触碰频率、移动距离和速度明显缩短(P<0.05),而Sir 1.0 mg·kg-1可显著逆转KA致痫模型小鼠的焦虑抑郁状态(P<0.05),且与正常对照组无显著差异。结论Sir 1.0 mg·kg-1对未成年期癫痫小鼠的mTOR信号通路异常激活和癫痫后共病形成有抑制作用,且不良反应轻微,为理想的给药剂量。
癫痫;西罗莫司;学习认知功能;蛋白表达
癫痫是大脑神经元异常放电,导致短暂的大脑功能障碍的一种慢性疾病,也是神经系统的常见病和多发病。据统计,癫痫总体发病率为0.08‰,发达国家为0.5‰,发展中国家是发达国家的2~3倍[1]。癫痫的反复发作影响相应的神经生物学、认知、心理学以及社会学等方面的功能[2]。婴幼儿期是癫痫发作的高峰期,患病率为1.8‰~3.5‰,在产科重症监护单元的发生率为1%~2%[3]。导致婴幼儿期癫痫的病因众多,主要包括低氧缺血性脑病、急性代谢性疾病、脑血管疾病、神经系统感染和先天性发育异常等[4]。生命早期癫痫发作可能导致慢性癫痫认知障碍和行为变化,如自闭症[5]。近年来,越来越多的动物研究提示,婴幼儿期频繁或较长时间的癫痫发作可因干扰脑的发育进程引起神经网络结构和功能的异常改变。婴幼儿时期大脑及身体各器官均未发育成熟,所以相对于成年期癫痫其治疗更棘手,疗效并不尽如意,且对婴幼儿神经系统产生抑制作用,造成低血压、心动过缓、窒息和呼吸抑制,以及停药后引发撤药综合征[6]。因此,探寻新的治疗靶点及研发新型药物将有利于婴幼儿期癫痫的治疗。
哺乳动物西罗莫司靶蛋白〔mammalian target of sirolimus(Rapamycin),mTOR)〕信号通路是调控细胞生长增殖和蛋白质合成的重要信号通路,通过磷酸化作用调控细胞内mRNA的翻译,参与膜蛋白转运、蛋白质降解、蛋白激酶C信号转导和核糖体合成等[7]。核糖体蛋白S6为mTOR信号通路的效应蛋白,经P70S6激酶作用磷酸化,从而调控蛋白质翻译及细胞生长[8]。前期研究表明,卡莫酸(红藻氨酸,kainic acid,KA)诱导的癫痫动物模型中,mTOR信号通路的激活以磷酸化S6蛋白水平显著增加为特征[9-10]。Sir是mTOR的特异性抑制剂,作为抗肿瘤药和免疫抑制剂已广泛应用于临床[11-13]。在神经系统,mTOR信号通路调节神经元发育和突触可塑性[14]。我们的前期研究发现,在多种癫痫模型中mTOR通路被异常激活[15-19],给予mTOR抑制剂Sir治疗能减少甚至消除自发性癫痫及相应的神经损害[20-21]。mTOR异常激活在婴幼儿缺血缺氧引起的获得性癫痫中起重要作用,Sir给药可降低mTOR信号通路的异常激活[5]。然而,高剂量Sir的长期用药会导致生长发育迟缓和免疫功能降低等不良反应。为此,本研究在10日龄出生C57BL/6小鼠采用KA诱导癫痫发作,探讨降低Sir剂量在未成年小鼠中的作用,从而进一步为Sir临床应用于婴幼儿癫痫提供理论依据。
1 材料与方法
1.1 试剂和主要仪器
KA购自美国Nanocs公司;Sir购自美国LC实验中心;S6、p-S6抗体购自美国CST公司;DCX抗体购自美国Santa Cruz生物公司;BCA蛋白浓度测定试剂盒、辣根过氧化物酶标记的二抗、吐温80、PEG400和Triton X-100购自南京碧云天公司;荧光二抗购自美国LI-COR公司;硝酸纤维素膜和ECL化学发光试剂盒购自德国Millipore公司;多聚甲醛、无水乙醇、蔗糖购自上海国药集团化学试剂有限公司;BSA购自上海泽衡生物技术有限公司。
1.2 动物造模和用药方法
出生后10 d龄的C57BL/6小鼠用于本实验,一共180只,由上海斯莱克实验动物中心提供,实验动物许可证:SCXK 2007-0005。动物实验遵守浙江大学医学院动物实验管理规范。动物的饲养条件为温度(24±1)℃,湿度40%~60%,昼/夜各12 h。KA用生理盐水溶解成5.0 g·L-1后,以12.0 mg·kg-1的剂量单次ip给予诱导C57BL/6小鼠急性癫痫发作。癫痫的分级参照1972年Raccine制定的标准[22],急性痫性发作大于三级的动物用于下一步实验。癫痫分级标准:一级,静止不动伴随口/面部运动;二级,点头及落水狗样抖动;三级,前肢痉挛;四级:竖立和(或)全身僵直;五级,竖立并跌倒。Sir用乙醇溶解成30 g·L-1贮存于-20°C,临用前用含5%吐温80、5%PEG400和4%乙醇的溶剂新鲜配制。
小鼠随机分为正常对照组、模型组和给药组,正常对照组注射生理盐水,模型组注射KA 12.0 mg·kg-1,给药组给予KA 12.0 mg·kg-1和Sir,Sir于KA诱发癫痫后24 h隔天给药1次直至3 d、7d、3周、5周和6周。在探究不同剂量Sir对海马及皮质S6蛋白活性影响实验中,Sir分为0.3,1.0和3.0 mg·kg-1组。在用Western蛋白印迹实验确定Sir 1.0 mg·kg-1为有效剂量后,后续实验Sir剂量为1.0 mg·kg-1。
1.3 Western蛋白印迹法检测海马和皮质S6蛋白的表达及磷酸化水平
小鼠在KA致痫后3 d、1周、3周和5周断头取脑,分离海马及相应大小的皮质组织,经超声裂解组织后离心取上清测定蛋白浓度。蛋白经SDSPAGE电泳分离和转膜,在脱脂牛奶中室温封闭1 h,分别加入p-S6和S6抗体孵育,采用ECL化学发光法获取蛋白表达信号,并采用ImageJ软件分析其积分吸光度,计算p-S6/S6的比值。
1.4 Doublecortin(DCX)免疫荧光染色检测海马神经元发育
小鼠经5%水合氯醛深度麻醉后暴露心脏,迅速将注射器针插入小鼠左心室,并剪开右心耳,灌以生理盐水,继以4%多聚甲醛磷酸盐缓冲液快速灌注,迅速开颅取全脑,4%多聚甲醛磷酸盐缓冲液继续固定24 h,依次经15%、30%蔗糖溶液脱水包埋,经冠状切面冰冻切片,片厚20 μm,贴附于涂有铬钒明胶的载玻片上,每隔100 μm取一片。切片用PBS冲洗后,在含有0.1%Triton X-100和5%小牛血清蛋白的TBS缓冲液中室温孵育30 min。后与DCX特异性一抗于4℃孵育过夜,次日与相应荧光标记的二抗反应,结果在激光共聚焦显微镜下观察。选定固定区域进行计数,计算单位面积内各组DCX阳性细胞数量。
1.5 Morris水迷宫实验检测平台潜伏期、游泳距离、游泳速度和平台穿过次数
造模后给药4周开始进行水迷宫实验。水迷宫实验前需对小鼠进行连续4 d的训练,每天训练4次,每次间隔1 h。实验前,先将小鼠置于平台上10 s,让其观察周围环境,随后将小鼠分别从4个象限随机放入水迷宫中。摄像头记录小鼠运动轨迹,当小鼠到达平台后10 s停止记录。如小鼠在60 s内未找到平台,则引导其到平台上并停留10 s。训练4 d后,将小鼠从平台对面象限放入水迷宫中,小鼠的平台潜伏期(小鼠到达平台的时间)、游泳距离、游泳速度以及撤掉平台后穿过平台区域的次数将由SmartV2.5软件记录。
1.6 悬尾实验检测小鼠记录小鼠6 min内的累计不动时间
小鼠在完成水迷宫实验后进行悬尾、O迷宫以及新事物认知实验。实验前3 d,实验者对动物进行适应性接触。实验当天,将动物移入测试间适应30 min。将小鼠置于悬尾箱(20 cm×20 cm×30 cm),距尾尖0.75 cm用胶带固定尾部,使小鼠头向下悬挂,用摄像头记录小鼠6 min内的累计不动时间。
1.7 O迷宫实验记录小鼠5 min内移动距离和开臂中停留时间
O迷宫是根据动物对新异环境的探究特性和对高悬敞开臂的恐惧形成矛盾冲突行为来考察动物的焦虑状态。将小鼠面对闭臂区,放置于开臂和闭臂区的接点处,记录5 min内移动距离和开臂中停留时间。
1.8 新事物认知实验记录小鼠对新事物的触碰时间、触碰频率、移动速度与距离
在测试期间,小鼠现放入开口方木盒(50 cm× 50 cm×25 cm)内并允许自由探索5 min以期适应环境。然后,将小鼠移入饲养笼内。5 min后,小鼠返回盒内进入受训期。此时,有两个完全相同的物体(彩色纸盒,大小为6.0 cm×6.0 cm×3.5 cm)于距盒壁8 cm处沿一方墙直线排开。小鼠自另外两个拐角之一放入盒内,在自由探索5 min后再被送回饲养笼内。间歇5 min后,小鼠被再引入实验盒内进行实验期的自由探索。此时,两个受训期使用过的彩色纸盒之一被一紫色小盒(7.0 cm×7.0 cm×5.5 cm)置换并位于原位,而另一已熟悉的彩色纸盒被移至新物体相对的拐角以防止小鼠空间的偏倚。记录小鼠对新事物的触碰时间、触碰频率、移动速度和距离。
1.9 统计学分析
所有数据均用SPSS19.0统计软件进行统计分析。数据采用多组间比较用AVONA分析,组间两两比较采用LSD检验,结果描述用均值表示,P<0.05认为差异具有统计学意义。
2 结果
2.1 Sir对KA致痫未成年小鼠海马和皮质S6蛋白磷酸化的影响
KA造模后,给予Sir 0.3,1.0和3.0 mg·kg-1,连续7 d。与正常对照组相比,模型组海马和皮质均出现p-S6表达增加;Sir 0.3 mg·kg-1给药组并未见S6蛋白磷酸化明显抑制,而Sir 1.0 mg·kg-1可显著逆转p-S6的过度激活(P<0.05),Sir 3.0 mg·kg-1逆转p-S6的过度激活作用更显著(P<0.01)(图1)。在给药后3 d、3周和5周的实验中均得到类似结果(结果未显示)。上述结果提示,Sir 1.0 mg·kg-1对KA致痫后诱发的mTOR信号通路异常激活均有抑制作用。因此,在后续实验中,选取1.0 mg·kg-1作为Sir的给药剂量。

Fig.1 Effect of sirolimus(Rapamycin,Sir)on phosphorylation of S6 protein in hippocampus(A,B)and cortex(C,D)of kainic acid(KA)-induced seizure of young mice by Western blotting.Mice were given KA 12.0 mg·kg-1(ip),and 24 h later Sir was given and sacrificed at 7 d.B And D were the semiquantitative results of A and C,respectively.x±s,n=6.*P<0.05,compared with normal control group;#P<0.05,##P<0.01,compared with KA model group.
2.2 低剂量Sir对KA致痫未成年小鼠海马DCX表达和体质量无明显影响
如图2A~D所示,模型组小鼠海马区DCX的阳性细胞数与正常对照组无显著差异,Sir 1.0 mg·kg-1给药组虽然可见阳性细胞数有一定减少但未具显著性差异。
模型组小鼠体质量较正常对照组稍有减轻,Sir 1.0 mg·kg-1组减轻更显著,但3组间并无显著差异(图3)。以上结果提示,小剂量Sir对KA致痫未成年小鼠的体质量和神经元并无显著影响。

Fig.2 Effect of Sir 1.0 mg·kg-1on neuron development in young mice after KA induced seizure by doublecortin(DCX)immunofluorescent staining(×40).See Fig.1 for the treatment.A-C:representative images of DCX;D:quantitative result of DCX positive cells per field in different groups.x±s,n=16.

Fig.3 Effect of Sir 1.0 mg·kg-1on body mass of young mice after KA induced seizure.See Fig.1 for the treatment.x±s,n=12.
2.3 低剂量Sir对KA致痫未成年小鼠学习记忆的影响
Morris水迷宫检测结果显示(图4),与正常对照组相比,KA致痫小鼠平台潜伏期明显增长(P<0.05),穿越平台次数明显降低(P<0.05),游泳距离显著延长(P<0.05),提示空间记忆功能受损。与模型组比,Sir 1.0 mg·kg-1给药明显缩短平台潜伏期和游泳距离(P<0.05),增加穿越平台象限次数(P<0.05),可逆转学习记忆功能的损害。三组间游泳速度并无显著性差异。
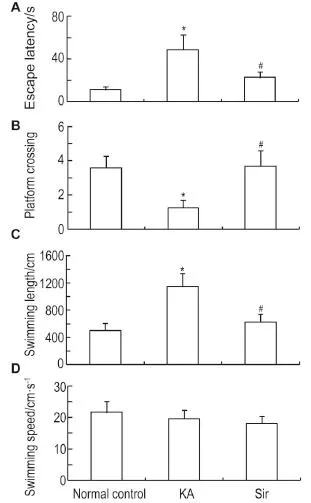
Fig.4 Effect of Sir 1.0 mg·kg-1on escape latency(A),number of platform crossings(B),swimming length(C)and swimming speed(D)in young mice after KA induced seizure.Mice of 10 d of age were induced seizure and administered Sir for 4 weeks and subjected to Morris water maze experiment.x±s,n=12.*P<0.05,compared with normal control group;#P<0.05,compared with KA model group.
2.4 低剂量Sir对KA致痫未成年小鼠累计不动时间的影响
悬尾结果显示(图5),与正常对照组相比,模型组小鼠6 min内的累计不动时间显著延长(P<0.05),Sir 1.0 mg·kg-1给药后可缩短小鼠6 min内的累计不动时间,缓解此种焦虑抑郁状态(P<0.05)。

Fig.5 Effect of Sir 1.0 mg·kg-1on freezing time in open arm in young mice after KA induced seizure by tail suspension test.See Fig.3 for the treatment.x±s,n=12.*P<0.05,compared with normal control group;#P<0.05,compared with KA model group.
2.5 低剂量Sir对KA致痫未成年小鼠内移动距离和开臂中停留时间的影响
O迷宫结果显示(图6),与正常对照小鼠组相比,模型组小鼠移动距离缩短及在开臂中停留时间缩短(P<0.05),Sir 1.0 mg·kg-1给药后对上述各种异常均有不同程度的缓解(P<0.05)。
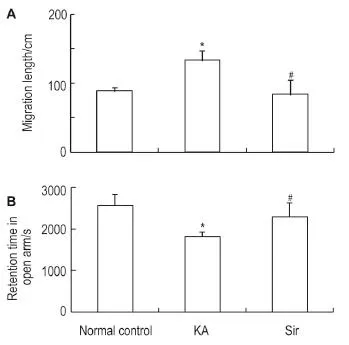
Fig.6 Effect of Sir 1.0 mg·kg-1on migration length(A)and retention time in open arm(B)in young mice after KA induced seizure by O maze.See Fig.3 for the treatment.x±s,n=12.*P<0.05,compared with normal control group;#P<0.05,compared with KA model group.
2.6 低剂量Sir对KA致痫未成年小鼠新事物认知实验对新事物的触碰时间、触碰频率、移动速度与距离的影响
新事物认识结果显示(图7),与正常对照小鼠组相比,模型组小鼠新事物认知实验中对新事物的触碰时间与触碰频率,并伴随移动速度与距离的显著下降(P<0.05),Sir 1.0 mg·kg-1给药后可缓解此种焦虑抑郁状态(P<0.05)。
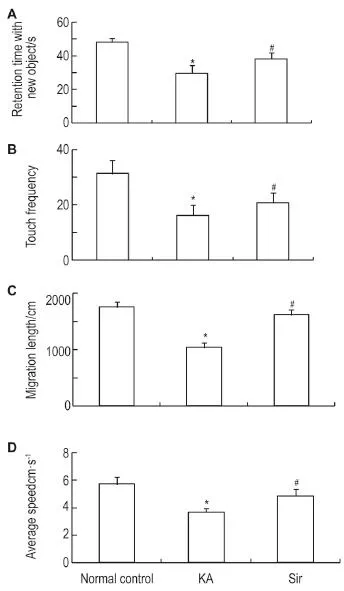
Fig.7 Effect of Sir 1.0 mg·kg-1on retention time with new object(A),touch frequency(B),migration length(C),and average speed(D)in young mice after KA induced seizure by new object recognition test.See Fig.3 for the treatment.x±s,n=12.*P<0.05,compared with normal control group;#P<0.05,compared with KA model group.
3 讨论
在我们前期对Sir副作用的研究中发现,较大剂量的Sir可导致未成年期小鼠生长发育迟缓[23]。在本研究中,我们尝试降低Sir剂量,从而达到降低过度激活的mTOR信号通路但又不影响生长发育的效果。本研究结果显示,Sir 1.0 mg·kg-1则可以显著抑制KA致痫后S6蛋白磷酸化。以DCX阳性细胞数目为指标,观察Sir对神经元发育的影响,Sir 1.0 mg·kg-1对DCX的阳性细胞数并无显著影响,体质量的下降无显著意义,本课题虽并未对Sir的其他副作用(如免疫抑制作用)进行系统观测,但上述结果提示,Sir 1.0 mg·kg-1产生的副作用并不明显,为未成年小鼠癫痫合适的给药剂量。在我们前期对正常10日龄大鼠使用Sir的观察中,发现Sir 1.0 mg·kg-1对10日龄大鼠生长发育有一定延缓作用[23],与本次实验数据略有不同,其原因可能与KA致痫后mTOR信号通路本身过度激活有关。行为学结束后,我们又检测了S6蛋白及其磷酸化水平,结果与7 d处死时一致,Sir 1.0 mg·kg-1能显著逆转KA所致信号通路激活。由此可见,行为学与p-S6水平存在一致性。
目前研究显示,癫痫患者常伴有认知障碍和抑郁症等癫痫共病。癫痫发生后痫样放电干扰正常神经元间的信息传递,改变正常的突触连接和回路生长,导致神经元功能紊乱;癫痫发作伴发的低氧血症、高碳酸血症、兴奋性神经递质过度释放等都会导致神经元凋亡和坏死;癫痫发作后细胞因子表达异常,影响神经发生和突触可塑性、神经组织发育异常、代谢异常以及睡障碍和神经递质系统异常等,从而导致学习记忆功能受损[24]。在中央颞叶癫痫患者的致灶区,5-羟色胺与受体结合降低,同时还发现海马区与扣带回区5-羟色胺结合降低的水平影响情绪沮丧的程度[25]。癫痫与抑郁共病的发病机制,主要包括下丘脑-垂体-肾上腺轴功能失调,兴奋性神经递质谷氨酸功能失调,去甲肾上腺素和5-羟色胺传递缺陷等神经递质和(或)神经病理异常[26]。可见,癫痫与认知障碍和抑郁症等共病存在着共同的发病机制。本实验中,在KA致痫的未成年C57BL/6小鼠中,虽未见明显自发性癫痫发作从而无法评估Sir对癫痫的抑制作用,但在我们前期对KA致痫大鼠的研究中,发现Sir可显著抑制KA致痫后自发性癫痫的发作[10]。本研究亦发现Sir可抑制KA致痫后学习记忆功能障碍和兴奋焦虑状态,提示mTOR信号通路可能是癫痫和癫痫后共病的共同发病机制。
综上所述,低剂量Sir能降低KA致痫未成年小鼠mTOR信号通路的激活,并改善学习记忆功能障碍和焦虑抑郁状态,且无明显不良反应。
[1] Kobau R,Zahran H,Thurman DJ,Zack MM,Henry TR,Schachter SC,et al.Epilepsy surveilance among adults-19 States,Behavioral Risk Factor Surveillance System,2005[J].MMWR Surveill Summ,2008,57(6):1-20.
[2] Wiebe S,Hesdorffer DC.Epilepsy:being ill in more ways than one[J].Epilepsy Curr,2007,7(6):145-148.
[3]Badawy RA,Harvey AS,Macdonell RA.Cortical hyperexcitability and epileptogenesis:understanding the mechanisms of epilepsy-Part 2[J].J Clin Neu⁃rosci,2009,16(4):485-500.
[4] Wirrell EC,Grossardt BR,Wong-Kisiel LC,Nickels KC.Incidence and classification of newonsetepilepsyand epilepsysyndromesin children in Olmsted County,Minnesota from 1980 to 2004:a population-based study[J].Epilepsy Res,2011,95(1/2):110-118.
[5] Talos DM,Sun H,Zhou X,Fitzgerald EC,Jackson MC,Klein PM,et al.The interaction between early life epilepsy and autistic-like behavioral consequences:a role for the mammalian target of rapamycin(mTOR)pathway[J].PLoS One,2012,7(5):e35885.
[6]Li S,He NH.Diagnosis and treatment of neonatal seizures[J].Chin Gen Prac(中国全科医学),2005,8(24):2073-2075.
[7] Russo E,Citraro R,Constanti A,De Sarro G. The mTOR signaling pathway in the brain:focus on epilepsy and epileptogenesis[J].Mol Neurobiol,2012,46(3):662-681.
[8] Avruch J,Lin Y,Long X,Murthy S,Ortiz-Vega S. Recent advances in the regulation of the TOR pathway by insulin and nutrients[J].Curr Opin Clin Nutr Metab Care,2005,8(1):67-72.
[9] Chen L,Hu L,Dong JY,Ye Q,Hua N,Wong M,et al.Rapamycin has paradoxical effects on S6 phosphorylation in rats with and without seizures[J].Epilepsia,2012,53(11):2026-2033.
[10]Zeng LH,Rensing NR,Wong M.The mammalian target of Rapamycin signaling pathway mediates epileptogenesis in a model of temporal lobe epilepsy[J].J Neurosci,2009,29(21):6964-6972.
[11] Harris TE,Lawrence JC Jr.TOR Signaling[J]. Sci STKE,2003,2003(212):re15.
[12] Chong ZZ,Shang YC,Wang SH,Maiese K. Shedding new light on neurodegenerative diseases through the mammalian target of Rapamycin[J]. Prog Neurobiol,2012,99(2):128-148.
[13] Maiese K.Cutting through the complexities of mTOR for the treatment of stroke[J].Curr Neuro⁃vasc Res,2014,11(2):177-186.
[14] Kamada Y,Sekito T,Ohsumi Y.Autophagy in yeast:a TOR-mediated response to nutrient starvation[J].Curr Top Microbiol Immunol,2004,279:73-84.
[15]Cascino GD.Epilepsy:contemporary perspectives on evaluation and treatment[J].Mayo Clin Proc,1994,69(12):1199-1211.
[16]Wong M,Ess KC,Uhlmann EJ,Jansen LA,Li W,Crino PB,et al.Impaired glial glutamate transport in a mouse tuberous sclerosis epilepsy model[J]. Ann Neurol,2003,54(2):251-256.
[17]Meikle L,Pollizzi K,Egnor A,Kramvis I,Lane H,Sahin M,et al.Response of a neuronal model of tuberous sclerosis to mammalian target of Rapamycin(mTOR)inhibitors:effects on mTORC1 and Akt signaling lead to improved survival and function[J].J Neurosci,2008,28(21):5422-5432.
[18]Orlova KA,Parker WE,Heuer GG,Tsai V,Yoon J,Baybis M,et al.STRADalpha Deficiency results in aberrant mTORC1 signaling during corticogenesis in humans and mice[J].J Clin Invest,2010,120(5):1591-1602.
[19]Zhou J,Blundell J,Ogawa S,Kwon CH,Zhang W,Sinton C,etal.Pharmacologicalinhibition of mTORC1 suppresses anatomical,cellular,and behavioral abnormalities in neural-specific Pten knock-outmice[J].J Neurosci,2009,29(6):1773-1783.
[20]Zeng LH,Xu L,Gutmann DH,Wong M.Siramycin prevents epilepsy in a mouse model of tuberous sclerosis complex[J].Ann Neurol,2008,63(4):444-453.
[21]Chen L,Hu L,Dong JY,Ye Q,Hua N,Wong M,Zeng LH.Siramycin has paradoxical effects on S6 phosphorylation in rats with and without seizures[J]. Epilepsia,2012,53(11):2026-2033.
[22]Racine RJ,Burnham WM,Gartner JG,Levitan D. Rates of motor seizure development in rats subjected to electrical brain stimulation:strain and inter-stimulation interval effects[J].Electro⁃encephalogr Clin Neurophysiol,1973,35(5):553-556.
[23]Lu Z,Liu F,Chen L,Zhang H,Ding Y,Liu J,et al. Effect of chronic administration of low dose Rapa⁃mycin on development and immunity in young rats[J].PLoS One,2015,10(8):e0135256.
[24]Chen ZM,Ding MP.Research progress in the comorbidity of epilepsy and depression[J].Mod Pract Med(现代实用医学),2014,26(12):1465-1467.
[25]Theodore WH, Hasler G, Giovacchini GA,Reeves-Tyer P,Herscovitch PA.Reduced hippo⁃campal 5HT1A PET receptor binding and depres⁃sion in temporal lobe epilepsy[J].Epilepsia,2007,48(8):1526-1530.
[26]Chen ML,Bai Y.Relationship between epilepsy and cognition dysfunction[J].Chin J Rehabil Theory Pract(中国康复理论与实践),2012,18(4):341-343.
Effective dosage of sirolimus for seizure treatment of immature C57BL/6 mice induced by kainic acid
WU Mei-ling,YANG Xin-jie,LIU Fu-rong,WANG Yu-zhi,CHEN Dan-jiao, WU Yun,ZHU Feng,ZENG Ling-hui
(School of Medicine,Zhejiang University City College,Hangzhou 310015,China)
OBJECTIVETo explore the safe and effective dose of sirolimus(Rapamycin,Sir)and its effect on seizure comorbidities.METHODSImmature C57BL/6 mice at postnatal 10 d of age were administered with kainic acid(KA)12.0 mg·kg-1intraperitoneally by a single injection to induce acute seizure.Sir 0.3,1.0 and 3.0 mg·kg-1was injected 24 h after seizure every other day until 3 d,1 week, 3 weeks,5 weeks and 6 weeks.Western blotting analysis was used to detect the expression and phos⁃phorylation level of S6 protein and to determine the minimum effective dose of Sir.Effect of the mini⁃mum effective dose of Sir on cognitive function and body growth was observed by several evaluations. Immunofluorescent intensity of Doublecortin(DCX)immunofluorescent staining was conducted to evaluate the development of neurons in the hippocampus.Morris water maze was used to assess the cognitive function.Tail suspension test,O maze and new object recognition test were used to study the anxiety-like behaviors of mice.RESULTSThe result of Western blotting showed that Sir 0.3 mg·kg-1had no significant effect on the phosphorylation of S6 protein in normal mice or KA mice,whereas 1.0 and 3.0 mg·kg-1could significantly inhibit the phosphorylation of S6 protein in KA mice(P<0.05).Sir 1.0 mg·kg-1had no obvious effect on DCX-positive cells or body wass.Morris water maze showed that KA-induced seizure resulted in prolonged escape latency and swimming length(P<0.05),and a decreased crossing number of target quadrant(P<0.05).Sir 1.0 mg·kg-1significantly reversed the deficit of cognitive function of KA-induced seizure mice(P<0.05),whereas no significant difference was found between Sir group and normal control group.Compared with normal control group,model group showed increased freezing time in tail suspension test(P<0.05),decreased migration length and reten⁃tion time in open arms in O maze(P<0.05),decreased retention time and touch frequency with new objects,migration length and average speed in new object recognition test(P<0.05).Sir 1.0 mg·kg-1significantly reversed the above anxiety and depression status,whereas no significant difference was found between sirolimus group and normal control group.CONCLUSIONSir 1.0 mg·kg-1inhibits the abnormal activation of mTOR pathway and the formation of epilepsy comorbidity in immature mice. Along with its mild side effect in development,Sir 1.0 mg·kg-1will be an ideal dose to be used in the treatment of seizure in immature mice.
epileptic seizure;sirolimus;learning and memory;protein expression
s:ZHU Feng,Tel:(0571)88018979,E-mail:zhuf@zucc.edu.cn;ZENG Ling-hui,Tel:(0571) 88284356,E-mail:zenglh@zucc.edu.cn
R971.6
:A
:1000-3002-(2017)01-0051-08
10.3867/j.issn.1000-3002.2017.01.006
2016-07-13 接受日期:2016-11-26)
(本文编辑:乔 虹)
国家自然科学基金(81371429);杭州市科技局重大科技创新项目(20152013A02);杭州市科技局社会公益项目(20160533B73)
吴美玲,女,硕士研究生,从事神经系统疾病药理学研究。
朱 锋,E-mail:zhuf@zucc.edu.cn,Tel:(0571)88018979;曾玲晖,E-mail:zenglh@zucc.edu.cn,Tel:(0571)88284356
Foundation item:The project supported by National Natural Science Foundation of China(81371429);Hangzhou Science and Technology Major Project for Innovation(20152013A02);and Hangzhou Science and Technology Project (20160533B73)
