“百会”透“曲鬓”针刺法对脑出血大鼠脑组织中PERK蛋白表达影响的实验研究
2017-03-28邹伟牛明明于学平孙晓伟滕伟戴晓红袁梦飞陈秋欣刘鹏姚冬
邹伟,牛明明,于学平,孙晓伟,滕伟,戴晓红,袁梦飞,陈秋欣,刘鹏,姚冬
(1.黑龙江中医药大学附属第一医院,黑龙江 哈尔滨 150040; 2.黑龙江中医药大学,黑龙江 哈尔滨 150040)
“百会”透“曲鬓”针刺法对脑出血大鼠脑组织中PERK蛋白表达影响的实验研究
邹伟1,牛明明2,于学平1,孙晓伟1,滕伟1,戴晓红1,袁梦飞2,陈秋欣1,刘鹏2,姚冬2
(1.黑龙江中医药大学附属第一医院,黑龙江 哈尔滨 150040; 2.黑龙江中医药大学,黑龙江 哈尔滨 150040)
目的:探讨“百会”透“曲鬓”针刺法对脑出血大鼠脑组织细胞内质网应激PERK通路关键蛋白PERK表达的影响。方法:将Wistar雄性大鼠随机分为SHAM组、模型组、针刺组、3-MA组、3-MA+针刺组,再将各组随机分为4个时间亚组,每亚组6只。采用自体血注射的方法建立脑出血大鼠模型,3-MA组于造模前15 min注射3-MA自噬抑制剂,针刺组和3-MA+针刺组于造模成功后以“百会”透“曲鬓”针刺法进行干预,于相应时间节点取材。根据改良版神经缺损评分系统(mNSS)对大鼠神经功能进行评价,并用Western Blot法分析PERK蛋白相对表达量的变化。结果:神经功能评价方面,造模前大鼠无神经功能缺损体征。造模后SHAM组大鼠各时间点评分无显著差异,其余各组神经功能缺损体征于72 h时各项缺损体征达到最高峰,后有所缓解,7 d时针刺组神经功能缺损体征明显改善(P<0.05),3-MA组于各时间点神经功能缺损最重,3-MA+针刺组神经缺损情况较3-MA组轻。Western Blot法检测结果显示,除SHAM组外,其余各组PERK蛋白相对表达量均有随时间变化的趋势,分别于6h最低,后逐渐升高,至7 d最高;相同时间点,针刺组相对表达量最高(P<0.01),3-MA组蛋白相对表达量明显低于其他各组(P<0.05),3-MA+针刺组表达量略高于3-MA组。结论:“百会”透“曲鬓”针刺法对脑出血大鼠神经功能恢复具有促进作用,可能促进内质网应激PERK通路的激活。
自噬;针刺;脑出血;PERK通路
脑出血(intracerebral hemorrhage,ICH)是指非外伤性脑实质出血,出血后的神经细胞死亡的过程是影响患者预后和神经功能缺失情况的关键步骤。细胞损伤及营养匮乏将导致细胞自噬和内质网应激(Endoplasmic Reticulum Stress,ER stress)的发生,并使细胞自发性启动一系列应激反应来缓解损伤,以保持细胞内稳态和细胞正常生理功能的发挥,PERK通路是内质网应激状态下未折叠蛋白反应(Unfolded Protein Response,UPR)的主要通路之一,该通路的激活与自噬体的形成有着密切的联系[1],是研究自噬和内质网应激机制的重要切入点。头针针刺对急性脑出血后脑损伤和脑水肿具有拮抗作用[2],还可以抑制TNF-α介导的免疫炎性反应[3],并促进神经营养因子(NGF)表达[4],从而发挥其脑出血后的脑保护和治疗作用。本研究以脑出血大鼠为模型,研究“百会”透“曲鬓”针刺法对脑出血后大鼠神经功能及PERK通路相关蛋白PERK表达的影响。
1 材料与方法
1.1 实验仪器与试剂
台式牙钻机(中国上海齿科医械厂,307-6型);立体定位仪(中国成都仪器厂,STW-1型);组织匀浆器(瑞士Fluka公司);低温冷冻离心机(德国Thermo公司,002421);电泳仪(美国 BIO-RAD公司,1645070);Mini P-4电泳槽(北京凯元信瑞仪器有限公司,MP-3030);湿转电泳槽(北京凯元信瑞仪器有限公司,MP-3035);MultiSkan3酶标仪(德国Thermo公司,51119000);3-Methyladenine(3-甲基腺嘌呤,3-MA,美国CALBIOCHEM公司,189490);蛋白抽提试剂(上海碧云天生物技术有限公司,P0033);BCA蛋白定量试剂盒(上海碧云天生物技术有限公司,P0010);BSA(上海碧云天生物技术有限公司,P0007);蛋白上样缓冲液(上海碧云天生物技术有限公司,P0015);电泳缓冲液(上海碧云天生物技术有限公司,P0014A);TBST(上海碧云天生物技术有限公司,P0023C3);中分子量蛋白Marker(上海碧云天生物技术有限公司,P0061);湿转缓冲液(上海碧云天生物技术有限公司,P0021A);NC膜(0.45um,美国Millipore公司,HATF00010);PERK(C33E10,Cell Signaling Techology,3192);#-actin(天德悦(北京)生物科技公司,TDY041);山羊抗兔IgG HRP(天德悦生物科技公司,S004)。
1.2 实验动物
符合国家二级动物标准的健康Wistar雄性大鼠120只,由黑龙江中医药大学动物实验中心提供。动物饲养于清洁级动物室,室温控制在18℃ ~22℃,湿度45% ~55%,日光周期 12 h(08:00 am~08:00 pm),自由觅食饮水。实验前饲养(8±2)d,体质量符合(330±30)g的标准后入组,造模前12 h开始禁食,6 h前开始禁水。
1.3 实验分组
将符合实验标准的大鼠随机分为5组,即空白对照组(SHAM组)、模型对照组(模型组)、3-MA抑制剂组(3-MA组)、针刺组、3-MA抑制剂+针刺组(3-MA+针刺组),每组24只,再将各组随机分为4个时间亚组(造模后12 h、24 h、72 h、7 d),每亚组6只。SHAM组按正常造模操作,但不注血,分别于对应时间点取材;模型组造模后于对应时间点取材;针刺组于造模后6 h开始以28号1寸毫针由患侧百会穴透刺曲鬓穴,每24 h针刺1次(参照《实验动物穴位图谱》取穴,进针0.8寸,留针30 min,每5 min捻转1次,每次5 min,针刺过程中共捻针3次);3-MA组在造模前15 min于前囟点右1.5 mm,后0.8 mm定位钻孔注射3-MA抑制剂(400 nM);3-MA+针刺组于注射抑制剂和自体血后,给予与针刺组相同的针刺方法进行干预。
1.4 动物模型制备
依据大鼠立体定位图谱[5]和自体血注射的方法[6]制备脑出血大鼠模型。大鼠以腹腔注射10%水合氯醛(350 mg/kg)的方法进行麻醉,并以俯卧位固定于立体定位上,取两耳尖连线中点备皮、切口,充分暴露前囟点及冠状缝,以立体定位仪定位注血点(前囟点为中心,右侧3.5 mm,后侧0.2 mm),用1.0 mm直径牙钻头钻孔至硬脑膜表面。鼠尾消毒后于尾端3 cm处剪断,以微量注射器取血50 μl,并沿钻孔垂直进针6 mm,以25 μl/min的注血速度,将自体血注入尾状核,留针5 min后缓慢出针。术后局部喷洒庆大霉素并用牙科水泥密封颅骨钻孔,缝合头皮并消毒创口皮肤,断尾处消毒包扎,以防感染。
1.5 动物模型成功标准
参考Bederson神经功能缺损体征评分法(Postural Reflex Test)[7],对造模前后大鼠的神经功能进行评分,评分>1者判定为出现神经功能缺损体征,且处死后取脑证实颅内血肿者视为造模成功,否则弃之不用,在同批大鼠中随机抽样重新入组。
1.6 实验动物干预方法
SHAM组以造模方法操作,但不注血、不做干预,分别于对应时间点取材;模型对照组造模后于对应时间点取材;抑制剂组在造模前15 min于前囟点右1.5 mm,后 0.8 mm定位钻孔注射 3-MA抑制剂(0.2 mg/kg);针刺组于造模后6 h开始以28号1寸毫针由患侧百会穴透刺曲鬓穴,每24 h针刺1次(参照《实验动物穴位图谱》取穴,进针0.8寸,留针30 min,每5 min捻转1次,每次5 min,共计3次),3-MA+针刺组于注射抑制剂和自体血后,以于针刺同样的针刺方法进行干预。
1.7 神经功能缺损评价
参考大鼠神经功能缺损评价系统(Neurological Severity Score,NSS)[8]、Bederson神经功能缺损体征评分法(Postural Reflex Test)[7]、网屏测验(Screen Test)[9-10]和平衡木测验评分法 (Balance Beam Test)[11],建立改良版大鼠神经功能缺损评价系统(modified Neurological Severity Score,mNSS),分别于造模前和造模后6 h处及死前对大鼠神经功能进行评分(评分精确至0.1),最后计算总分,最高分为11分,具体评分标准如前所述[12]。
1.8 Western Blot法分析蛋白相对表达量
大鼠于相应时间点过量麻醉后,直接断头取脑,将脑组织样本迅速放入液氮中速冻,通过RIPA蛋白抽提试剂盒提取脑组织蛋白,以BCA蛋白浓度测定法对脑组织蛋白进行定量,上样后经SDS-PAGE凝胶电泳、湿转法转膜后,以一抗PERK(1∶1 000)4℃孵育过夜,二抗(1∶10 000)孵育1 h,以ECL试剂进行显影成像,光片于凝胶成像系统下白光扫描,进行吸光度分析,用同一标本内参β-actin(1∶10 000)进行校正,以蛋白相对表达量=目的条带表达强度/β-actin表达强度为公式计算出蛋白相对表达量。
1.9 统计分析
所有数据均用SPSS19.0统计软件进行分析,计量数据以(均数±标准差)表示,组间比较用ANOVA方差分析,两两比较采用 SNK-q检验,检验标准为0.05,即P<0.05差异具有统计学意义。
2 结果
2.1 各实验组大鼠神经功能评价结果
模前大鼠mNSS评分为0分,即无神经功能缺损体征。造模后SHAM组大鼠各时间点评分无显著差异,仍为0分,其余各组出现神经功能缺损体征,于72 h时各项体征达到最高峰,而后有所缓解,至7 d时,针刺组神经功能缺损体征明显改善,与其他各实验组两两比较,差异显著(P<0.05),模型组7 d时神经功能恢复情况略好于3-MA组和3-MA+针刺组; 3-MA组于各时间点神经功能缺损最为严重(P<0.05),3-MA+针刺组神经缺损情况较3-MA组轻。结果比较和分析如表1、图1所示。
表1 各组造模后神经功能缺损综合评分mNSS比较(±s,n=6)
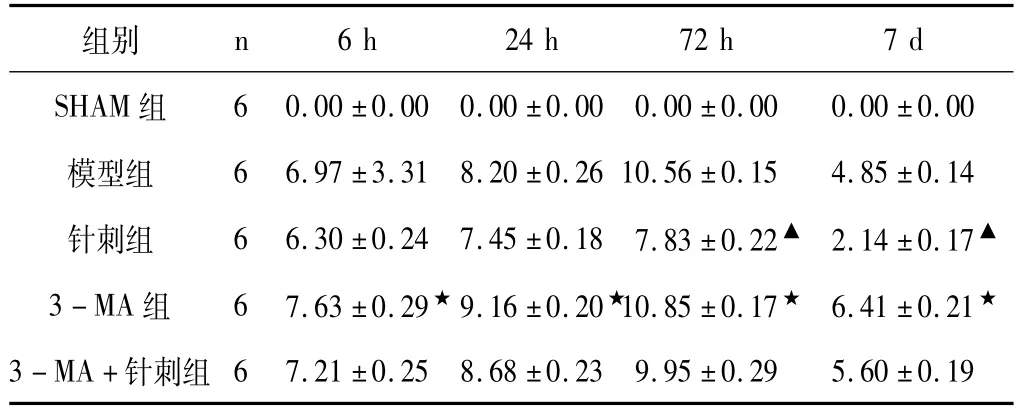
表1 各组造模后神经功能缺损综合评分mNSS比较(±s,n=6)
注:针刺组与其他各组两两比较,★P<0.05;3-MA组与其他各组两两比较,▲P<0.05。
组别n 6 h 24 h 72 h 7 d SHAM组6 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00模型组 6 6.97±3.31 8.20±0.26 10.56±0.15 4.85±0.14针刺组 6 6.30±0.24 7.45±0.18 7.83±0.22▲2.14±0.17▲3-MA组 6 7.63±0.29★9.16±0.20★10.85±0.17★6.41±0.21★3-MA+针刺组6 7.21±0.25 8.68±0.23 9.95±0.29 5.60±0.19

图1 各组神经功能缺损综合评分(mNSS)比较
2.2 各实验组大鼠脑组织中PERK的Western Blot法检测结果
如表2、图2所示,各实验组组PERK蛋白相对表达量呈时间相关性,6 h时最低,7 d时表达量最高,SHAM组PERK蛋白相对表达量于个时间点未见明显差异(P>0.05);相同时间点的组间比较,针刺组相对表达量均高于其他各组(P<0.05);3-MA组PERK蛋白相对表达量最低(P<0.05),3-MA+针刺组相对表达量略高于3-MA组但低于模型组。
表2 各组造模后PERK蛋白免疫组织化学染色结果比较(±s,n=6)
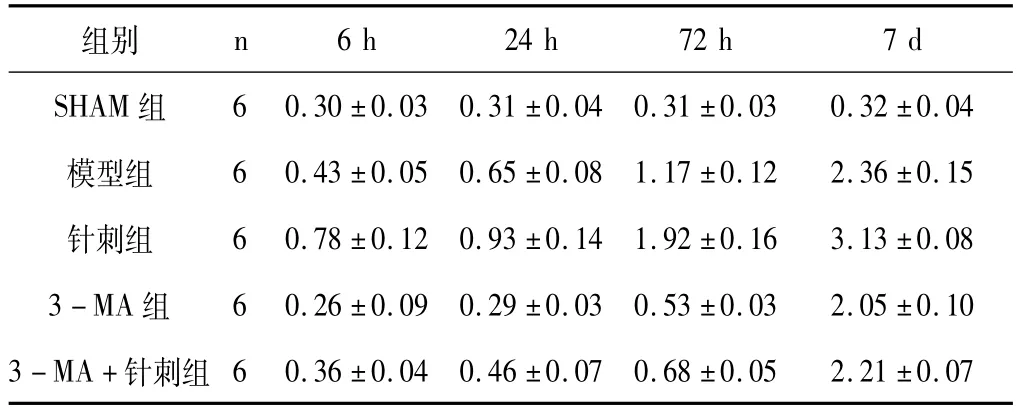
表2 各组造模后PERK蛋白免疫组织化学染色结果比较(±s,n=6)
注:针刺组与其他各组两两比较,★P<0.05;3-MA组与其他各组两两比较,▲P<0.05。
组别n 6 h 24 h 72 h 7 d SHAM组6 0.30±0.03 0.31±0.04 0.31±0.03 0.32±0.04模型组 6 0.43±0.05 0.65±0.08 1.17±0.12 2.36±0.15针刺组 6 0.78±0.12 0.93±0.14 1.92±0.16 3.13±0.08 3-MA组 6 0.26±0.09 0.29±0.03 0.53±0.03 2.05±0.10 3-MA+针刺组6 0.36±0.04 0.46±0.07 0.68±0.05 2.21±0.07
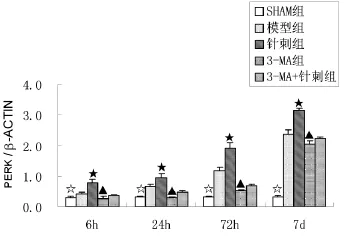
图2 各实验组PERK蛋白免疫印迹分析结果比较
3 讨论
3.1 PERK通路在内质网应激和自噬中的作用
细胞稳态的重构对疾病的发生发展具有重要意义,而内质网应激(ER Stress,ERS)和未折叠蛋白反应(UPR)对细胞在应激条件下的存活密切相关[13-15],ERS和UPR对疾病的影响也被越来越多实验研究所证实[16-19]。当细胞各项生理机能处于正常水平时,内质网内蛋白质的合成与转运也呈动态平衡状态,内质网膜上的常驻分子伴侣GRP78与UPR三个效应元件即PERK、IRE1和ATF6稳定结合,使三者处于失活状态。一旦细胞遭受损伤,内稳态被破坏,蛋白质合成的合成受到干扰,致使大量错误折叠蛋白或未折叠蛋白的堆积,GRP78就会与三者解离,转而结合错误折叠蛋白或未折叠蛋白,随着GRP78的解离,PERK、IRE1和ATF6也随之被激活,通过调控其下游基因的表达来降低蛋白质的合成或促进蛋白和细胞碎片的降解,使细胞内稳态得以恢复、使细胞的正常生理功能得以保护。
PERK(protein kinase R -like endoplasmic reticulum kinase)是一种内质网常驻跨膜酶蛋白,在人体内由EIF2AK3(Eukaryotic translation initiation factor 2-alpha kinase 3)基因编码,GPR78的解离导致PERK的自磷酸化形成二聚体,并磷酸化真核翻译起始因子EIF2α,从而降低了细胞内蛋白质合成的翻译效率,致使细胞内蛋白质合成的减少,缓解了内质网内因蛋白质过载引发的应激状态,对细胞内稳态的重构具有促进作用。尽管未折叠蛋白反应的三条通路均参与了内质网应激诱导细胞自噬或凋亡的细胞稳态重构过程,越来越的研究表明PERK及其通路的特定下游因子在细胞存活或死亡的发展趋势上发挥着不可替代的作用。有研究[20]发现,维系细胞稳态的自噬流的形成需要PERK通路的参与,而EIF2α的磷酸化也是自噬诱导的必要条件,在自噬的初始诱导阶段,一系列EIF2α磷酸化依赖型选择性翻译介导了ATG12的表达,从而促进了ATG5-ATG12-ATG15泛素连接系统的形成,推进自噬体双层膜结构的延展和成熟。由此可见,PERK通路对细胞自噬及细胞内稳态的维持和恢复具有重要意义。
3.2“百会”透“曲鬓”针刺法对PERK通路的影响
本实验研究分别对各组大鼠脑组织中PERK通路关键蛋白PERK进行Western Blot法检测,结果显示,SHAM组于各时间点PERK通路相关蛋白的相对表达量较低,且并无显著变化;而其余各组的蛋白表达量呈时间相关性,6 h时最低,至7 d时最高,而相同时间点内组间比较,针刺组的表达量明显高于其他各组(P<0.05),模型组次之,3-MA组的相对表达量为最低,3-MA+针刺组的表达量略高于3-MA组但低于模型组。实验结果表明,大鼠脑出血模型建立后,随着大鼠脑组织损伤的加重,PERK通路被激活,导致PERK蛋白表达水平升高,而“百会”透“曲鬓”针刺法的干预则使PERK通路的活跃程度明显提高,且此影响有随脑出血时间的进展和针刺干预次数的累加而愈加明显的趋势,同时,3-MA抑制剂对自噬的抑制作用同时也抑制了PERK通路的活跃程度,而针刺刺激的干预(3-MA+针刺组),则在一定程度上缓解了这种抑制作用,使PERK通路仍可持续激活,由此可见,“百会”透“曲鬓”针刺法可以促进PERK通路的激活,且可缓解由3-MA抑制剂对自噬的抑制作用和PERK通路活跃度减低情况。
头针针刺对脑出血治疗作用已经被大量的临床实验所证实,而随着现代医学技术的发展,对针灸治疗疾病的机理研究也愈加深入。有研究证实,针刺百会穴在改善大鼠脑出血后的局部脑血流量的同时,对神经功能症状的恢复也发挥着积极作用[21-22]。刘氏[23]研究证明,针刺能提高急性脑出血家兔脑组织SOD活性,具有抗脂质过氧化的作用。同时,针刺还可能通过改变血清中抑制因子的表达来促进神经干细胞分化,从而促进脑出血后脑损伤的修复[24]。邹伟教授科研团队的前期实验研究从组织形态学、神经营养因子、炎性反应研究、神经重塑和细胞凋亡机制等[25-27]角度验证了“百会”透“曲鬓”针刺法对脑出血大鼠脑组织神经细胞的保护作用及对神经功能恢复的积极意义,本研究在此基础之上,以内质网应激PERK通路为切入点,进一步探讨了“百会”透“曲鬓”针刺法对脑出血大鼠脑组织PERK通路的的激活作用,证实了“百会”透“曲鬓”针刺法可以改善脑出血大鼠的神经功能缺损状况,揭示了“百会”透“曲鬓”针刺法对脑出血大鼠神经细胞保护的潜在机制,为针刺机理研究和脑出血治疗方案的探索提供了新的思路。
[1]Adolph TE,Tomczak MF,Niederreiter L,et al.Paneth cells as a site of origin for intestinal inflammation[J].Nature,2013,503(7475): 272-276.
[2]张国威,邹伟,刘芳,等.针刺对脑出血急性期大鼠脑损伤及脑水肿拮抗作用的机理研究[J].针灸临床杂志,2010,26(7):46-51.
[3]于晓刚,东贵荣,周景华.针刺对急性脑出血大鼠TNF-α的影响[J].中国针灸,2004,24(5):35-39.
[4]刘芳,邹伟,张国威,等.针刺对脑出血大鼠神经生长因子基因表达的影响[J].针灸临床杂志,2007,23(6):46-51.
[5]包新民,舒斯云.大鼠脑立体定位图谱[M].北京:人民卫生出版社,1991.
[6]Rosenberg GA,Mun-Bryce S,Wesley M,et al.Collagenase-induced intracerebral hemorrhage in rats[J].Stroke;a journal of cerebral circulation,1990,21(5):801-807.
[7]Bederson JB,Pitts LH,Tsuji M,et al.Rat middle cerebral artery occlusion:evaluation of the model and development of a neurologic examination[J].Stroke;a journal of cerebral circulation,1986,17 (3):472-476.
[8]Chen J,Sanberg PR,Li Y,et al.Intravenous administration of human umbilical cord blood reduces behavioral deficits after stroke in rats[J].Stroke;a journal of cerebral circulation,2001,32(11):2682-2688.
[9]Chesney JA,Kondoh T,Conrad JA,et al.Collagenase-induced intrastriatal hemorrhage in rats results in long-term locomotor deficits[J].Stroke;a journal of cerebral circulation,1995,26(2):312-317.
[10]徐莉,李玲,陈景藻,等.康复训练对大鼠脑梗塞神经功能恢复的影响[J].中华物理医学与康复杂志,2000,22(2):86-88.
[11]Altumbabic M,Peeling J,Del Bigio MR.Intracerebral hemorrhage in the rat:effects of hematoma aspiration[J].Stroke;a journal of cerebral circulation,1998,29(9):1917-1922.
[12]邹伟,于婷婷,王冬,等.头针透穴法对脑出血大鼠脑组织中βcatenin表达影响的实验研究[J].中医药信息,2014,31(1): 76-79.
[13]Kozutsumi Y,Segal M,Normington K,et al.The presence of malfolded proteins in the endoplasmic reticulum signals the induction of glucose-regulated proteins[J].Nature,1988,332(6163):462-464.
[14]Cox JS,Walter P.A novel mechanism for regulating activity of a transcription factor that controls the unfolded protein response[J].Cell,1996,87(3):391-404.
[15]Rosbash M.Mixed mechanismsin yeast pre-mRNA splicing?[J].Cell,1996,87(3):357-359.
[16]Wang P,Xu T-Y,Wei K,et al.ARRB1/β-arrestin-1 mediates neuroprotection through coordination of BECN1-dependent autophagy in cerebral ischemia[J].Autophagy,2014,10(9):1535-1548.
[17]Zhang X,Yuan Y,Jiang L,et al.Endoplasmic reticulum stress induced by tunicamycin and thapsigargin protects against transient ischemic brain injury:Involvement of PARK2-dependent mitophagy[J].Autophagy,2014,10(10):1801-1813.
[18]Sheng R,Liu XQ,Zhang LS,et al.Autophagy regulates endoplasmic reticulum stress in ischemic preconditioning[J].Autophagy,2012,8(3):310-325.
[19]Ginet V,Puyal J,Clarke PG,et al.Enhancement of autophagic flux after neonatal cerebral hypoxia-ischemia and its region-specific relationship to apoptotic mechanisms[J].The American journal of pathology,2009,175(5):1962-1974.
[20]Kouroku Y,Fujita E,Tanida I,et al.ER stress(PERK/eIF2alpha phosphorylation)mediates the polyglutamine-induced LC3 conversion,an essential step for autophagy formation[J].Cell death and differentiation,2007,14(2):230-239.
[21]邹伟,刘芳,张国威.针灸治疗脑出血的研究进展[J].中医药信息,2007,24(2):31-33.
[22]丁为国,李丽欣,许红.针刺百会穴对急性脑血肿大鼠局部脑血流量的影响[J].上海针灸杂志,2003,22(5):7-8.
[23]刘汉平.针刺对家兔脑出血急性期血浆NO脑组织SOD、LPO的影响[J].陕西中医,2003,24(6):567-571.
[24]王素娥,彭争荣,钟广伟.针刺对脑源性神经干细胞分化的影响[J].中国康复医学杂志,2007,22(5):459-461.
[25]邹伟,张国威,刘芳.针刺百会透曲鬓对脑出血大鼠脑组织形态学影响的实验研究[J].针灸临床杂志,2008,24(11):41-45.
[26]陈秋欣,邹伟,牛明明,等.针刺对脑出血大鼠血清TNF-α、IL-6含量的影响[J].上海针灸杂志,2015,10(10):1006-1008.
[27]于学平,孙晓伟,邹伟.百会透曲鬓对脑缺血再灌注大鼠脑微血管纤维连接蛋白表达的影响[J].中医药学报,2016,44(5): 71-73.
Effect of Baihui-Qubin Acupuncture Therapy on PERK Protein Expression in Intracerebral Hemorrhage Rat Models
ZOU Wei1,NIU Ming-ming2,YU Xue-ping1,SUN Xiao-wei1,TENG Wei1,DAI Xiao-hong1,YUAN Meng-Fei2,CHEN Qiu-xin1,LIU Peng2,YAO Dong2
(1.The First Affiliated Hospital of Heilongjiang University of Chinese Medicine,Harbin 150040,China; 2.Heilongjiang University of Chinese Medicine,Harbin 150040,China)
Objective:To investigate the effect of Baihui-Qubin acupuncture on PERK expression of PERK pathway key proteins in intracerebral hemorrhage(ICH)rat models.Methods:Wistar rats were randomly divided into five groups:sham group,ICH model group,inhibitor group,acupuncture group and inhibitor+acupuncture group(24 rats in each group);4 sub-groups were divided based on different time points(12hrs,24hrs,72hrs,7days),with 6 rats in each subgroup.Establish intracerebral hemorrhage rat models by autologous blood injection.Brain tissues were harvested at altered time points in sham group and ICH model group.3-MA inhibitor was injected before 15 minutes of autologous blood injection.Baihui-Qubin acupuncture was implemented in acupuncture group and inhibitor+acupuncture group from 6hrs after ICH(once per 24hrs).Brain tissues were also harvested at altered time points.Evaluate the neurological deficit at 6hrs after ICH and before tissues being harvested.Western Blot studies were performed to analyze the expression of PERK in brain tissues.Results:Neurological deficit evaluation:the neurological behave in acupuncture group was improved,which was associated with the acupuncture involvement.Western Blot results showed that the expression of PERK was increased in acupuncture group and reduced in inhibitor group as well as the inhibitor+acupuncture group which was slightly higher than that in the inhibitor group.Conclusion:Baihui-Qubin acupuncture therapy can alleviate the neurological deficits and also has an effect on PERK pathway activation.
Autophagy;Acupuncture;ICH;PERK pathway
R246
A
1002-2406(2017)02-0075-05
国家自然科学基金项目(No.81473764);国家留学基金项目(No.201408230060)
邹伟(1965-),男,主任医师,教授,博士研究生导师,主要从事中西医结合治疗脑血管病的研究工作。
2016-05-12
修回日期:2016-06-07
