间接竞争化学发光酶联免疫分析法检测番茄酱和果汁中异细交链孢菌酮酸
2017-03-27李焕婷杨金易徐振林雷红涛肖治理孙远明沈玉栋
朱 帆,李焕婷,王 弘,杨金易,徐振林,雷红涛,肖治理,孙远明,沈玉栋
(华南农业大学食品学院,广东省食品质量安全重点实验室,广东 广州 510642)
间接竞争化学发光酶联免疫分析法检测番茄酱和果汁中异细交链孢菌酮酸
朱 帆,李焕婷,王 弘*,杨金易,徐振林,雷红涛,肖治理,孙远明,沈玉栋*
(华南农业大学食品学院,广东省食品质量安全重点实验室,广东 广州 510642)
针对番茄酱和果汁中链格孢霉菌毒素污染问题,建立异细交链孢菌酮酸(iso-tenuazonic acid,ITeA)间接竞争化学发光酶联免疫分析法。通过棋盘法和单因素试验确定最佳包被原质量浓度为15.6 ng/mL、抗体质量浓度为稀释96 000 倍、缓冲体系pH 7.4、竞争反应时间和二抗反应时间分别为40 min和50 min。方法IC50为2.13 ng/mL,线性范围为0.50~9.12 ng/mL,检测限为0.10 ng/mL,与结构功能类似物交叉反应率均小于0.1%,样品添加回收率在78.60%~110.83%之间,变异系数均小于15%。本方法适用于样品中ITeA污染的特异性快速筛查。
毒素;异细交链孢菌酮酸;多克隆抗体;化学发光免疫分析;快速检测
细交链孢菌酮酸(tenuazonic acid,TeA)是链格孢霉、稻瘟病菌的次级代谢产物之一,具有急性、亚急性毒性,细胞毒性及潜在的致癌性[1-3],其产毒能力极强,已被美国食品药品监督管理局列入有毒化学物质名册[4]。异细交链孢菌酮酸(iso-tenuazonic acid,ITeA)是TeA的结构类似物,均属于链格孢霉四价酸类有毒代谢物,与TeA在毒理学上具有一定的相似性[5-7],Qin Jianchun等[8]发现,当水体中ITeA和TeA的质量浓度达到10 μg/mL时,咸水虾的死亡率分别高达73.6%和68.9%。链格孢霉对生长环境适应能力较强,毒素对谷物、果蔬等农产品污染情况呈现全球性频发趋势[9-13]。如,Asam等[14]研究发现ITeA在谷物食品、糖果中的含量达(75±8) μg/kg和(64±5) μg/kg。因此,开发灵敏准确的ITeA检测方法,对于农产品、食品的毒素污染监测非常重要。
目前,ITeA的检测方法主要是高效液相色谱-质谱法[14-15],该方法准确可靠,常作为确证方法,但存在设备昂贵、需要专业人员、前处理复杂耗时、样品通量低等不足。免疫检测技术具有高通量、灵敏、快速等特点,可与高效液相色谱-质谱法确证技术搭配应对量大面宽的农产品、食品安全快速筛查需求,近年来已成为研究热点[16-17]。而采用化学发光信号增强技术的化学发光酶联免疫分析(chemiluminescence immunoassay,CLEIA)方法具有高灵敏度、操作简单、应用广泛等优点,已经被应用于农药、兽药、生物毒素等食品危害成分的快速检测[18-21]。但是,有关ITeA的CLEIA快速检测技术研究目前鲜见报道。因此,本研究基于抗原抗体特异反应结合化学发光信号增强技术,拟建立了ITeA的间接竞争CLEIA(indirect competitive CLEIA,icCLEIA)检测方法,用于高效液相色谱法-质谱确证前样品的大批量筛查,简便快速,对于实现食品中ITeA快速筛检具有重要参考和实用价值。
1 材料与方法
1.1 材料与试剂
番茄酱、苹果汁(广州市购),经验证为阴性样品。
水合肼 阿拉丁试剂股份有限公司;ITeA、TeA、异细交链孢菌酮酸水合肼衍生物(ITeAH)、ITeAH卵清蛋白包被原(ITeAH-ovalbumin,ITeAH-OVA)、抗ITeAH单克隆抗体由实验室制备[22-13];交链孢酚(alternariol,AOH)、交链孢酚单甲醚(alternariol monomethylether,AME) 北京泰乐祺股份有限公司;封闭液化学发光液、增强液 广州万联生物公司。
1.2 仪器与设备
96 孔化学发光板 深圳金灿华公司;DEM-3型自动洗板机 北京拓普分析仪器有限公司;SupectraMax I型化学发光微孔板读板机 美国MD公司。
1.3 方法
1.3.1 icCLEIA方法的建立
用0.1 mol/L pH 7.4碳酸盐缓冲溶液将ITeAH-OVA稀释到一定质量浓度,100 μL/孔37 ℃包被过夜。用含0.05%吐温的磷酸缓冲溶液洗涤2 次,加入封闭液(5%的脱脂奶粉水溶液)120 μL/孔,振荡混匀,37 ℃孵育3 h;甩干孔中液体,37 ℃烘干备用。将适量ITeA标品溶于氯仿中,加入过量水合肼振荡反应30 min,氮吹挥干氯仿,加入适量甲醇复溶至1 mg/mL,梯度稀释成不同质量浓度,50 μL/孔加入板孔,再加入稀释后的抗体50 μL/孔,37 ℃孵育40 min,洗板5 次,加入100 μL/孔HRP标记的羊抗兔抗体;37 ℃孵育50 min;洗板5 次,加入化学发光底物液100 μL/孔,振荡反应1 min,测定相对发光值(relative light unit,RLU)。
1.3.1.1 包被抗原质量浓度
RLUmax/IC50(RLUmax为最大相对发光值,IC50为半抑制浓度)越大,化学发光检测方法的灵敏度和重复性越好[24],因此,将RLUmax、IC50、RLUmax/IC50作为优化实验的综合参考指标。
将包被原稀释32 000、64 000、128 000、192 000 倍,按照icCLEIA法步骤,测定并计算出相应RLUmax和IC50,选取最佳包被质量浓度。
1.3.1.2 抗体质量浓度
在包被原质量浓度确定的情况下,将抗体分别稀释32 000、64 000、96 000、128 000 倍。按照1.3.1节步骤,测定并计算出相应RLUmax和IC50,选取最佳抗体质量浓度。
1.3.1.3 缓冲体系pH值
IteAH是一种烯醇式的化合物,其在弱酸性、中性、弱碱性中都可能有较好的溶解性,通过改变缓冲液的pH值,找出药物溶解的最佳pH值;其次,抗体作为一种蛋白质,其活性和稳定性易受缓冲液的pH值影响,进而导致分析方法的灵敏度和准确性受到影响。因此,本实验考察了反应体系pH 6.4、7.4、8.4对抗原抗体反应的影响。
1.3.1.4 竞争反应时间
分别考察了20、30、40、50 min 4个不同竞争反应时间对灵敏度及稳定性的影响。
1.3.1.5 二抗反应时间
分别考察了不同二抗反应时间(30、40、50、60 min)对抑制曲线的影响,比较不同竞争时间条件下IC50、RLUmax、RLUmax/IC50的变化,确定最佳反应时间。
1.3.2 icCLEIA标准曲线的建立
在最优条件下,以ITeA质量浓度为横坐标,RLU/RLU0为纵坐标(RLU为添加药物时的相对发光值,RLU0为不添加药物时的相对发光值,即为RLUmax),用Origin 9.0软件进行四参数拟合绘制标准曲线,计算ITeA的半抑制浓度(IC50)、线性范围(IC20~IC80)及检测限(IC10)[25]。
1.3.3 特异性实验
采用交叉反应率(cross-reactivity,CR)评价方法特异性,CR越大,特异性越差[26]。按照1.3.3节的方法分别绘制ITeA类似物的抑制曲线,并计算出相应的CR见下式:

1.3.4 样品前处理
番茄酱(苹果汁):取2 g(2 mL)样品于15 mL离心管中,加5 mL氯仿振荡提取2 次,4 629×g离心10 min,取上清液加入适量水合肼,振荡反应35 min后,氮吹吹干溶剂;加入1 mL H2O复溶,经0.22 μm滤膜过滤后稀释30 倍后用于测定。
1.3.5 样品添加回收
取2 g(2 mL)样品,分别加入ITeA标准品250、50、25 ng/g(ng/mL),按照1.3.5节方法处理后,用CLEIA方法平行测定3 次。
1.3.6 高效液相色谱条件
色谱柱:SunFireTM-C18(4.6 mm×250 mm,5 μm);流速:1 mL/min;柱温:35 ℃;进样量:50 μL;流动相:A为含5 mmol/L甲酸铵溶液(氨水调节pH 7.8),B为乙腈。梯度洗脱程序:0~5 min,5% B;5~8 min,5%~45% B;8~25 min,45%~100% B;25~30 min,100% B;检测波长:305 nm;出峰时间:21 min。
2结果与分析
2.1 CLIEA工作条件的确定
2.1.1 包被原质量浓度的确定

图1 包被原质量浓度对CLEIA的影响Fig.1 Effect of coating antigen concentration on CLEIA
如图1所示,随着包被原质量浓度逐渐降低,RLUmax均逐渐降低,IC50呈先降低后上升的趋势。当稀释64 000 倍时,RLUmax/IC50最大,IC50最小,RLUmax适中。因此,确定最佳稀释倍数为64 000 倍,此时的包被原质量浓度为15.6 ng/mL。
2.1.2 抗体质量浓度的确定
由图2可以看出,抗体稀释32 000 倍时,RLUmax/IC50最大,但RLUmax较大,IC50最大;因此,选择稀释96 000 倍作为最佳抗体稀释倍数,此时RLUmax/IC50>106,IC50较小,RLUmax适中,且此时抗体的用量更少。
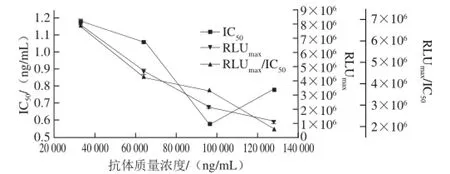
图2 抗体质量浓度对CLEIA的影响Fig.2 Effect of antibody concentration on CLEIA
2.1.3 缓冲体系pH值的确定

图3 缓冲溶液pH值对CLEIA的影响Fig.3 Effect of buffer pH on CLEIA
如图3所示,随着pH值升高,IC50先降低后上升,RLUmax/IC50逐渐上升;当pH 7.4时,IC50最低,RLUmax/IC50较大,RLUmax适中;当pH 8.4时,RLUmax/IC50最高,但其与当pH 7.4时较为接近;综上,选择pH 7.4为最佳缓冲体系的pH值。
2.1.4 竞争反应时间的确定

图4 竞争反应时间对CLEIA的影响Fig.4 Effect of competitive reaction time on CLEIA
如图4所示,随着竞争反应时间的延长,IC50呈先下降后上升趋势,RLUmax、RLUmax/IC50先上升后下降;反应40 min时,IC50最小,RLUmax/IC50最大。因此,选择40 min为最佳竞争反应时间。
2.1.5 二抗反应时间的确定
如图5所示,当二抗反应时间为50 min时,IC50最小,RLUmax/IC50最高,继续延长反应时间,虽然RLUmax、RLUmax/IC50变化不大,但是IC50升高,因此,确定最佳二抗反应时间为50 min。

图5 二抗反应时间对CLEIA的影响Fig.5 Effect of secondary antibody reaction times on CLEIA
2.2 标准曲线的建立
在最佳实验条件下,以ITeA质量浓度为横坐标,RLU/RLU0为纵坐标建立ITeA的icCLEIA标准曲线,采用Origin 9.0拟合,计算得到该标准曲线的方程为y=0.031+ 0.952 2/[1+(x/2.13)0.9530],R2=0.999 6,该方法的IC50为2.13 ng/mL,线性范围为0.50~9.12 ng/mL,方法检测限为0.10 ng/mL。
2.3 特异性实验结果
考察ITeA结构功能类似物的CR,结果显示CR小于0.1%(表1),说明建立的icCLEIA特异性良好。

表1 ITeA及其类似物与抗体的交叉反应Table1 Cross-reactivity of ITeA and its analogues with antibody
2.4 样品添加回收实验结果
向阴性样品(番茄酱、苹果汁)分别添加250、 50、20 ng的ITeA标准品,采用所建立的icCLEIA方法及高效液相色谱方法检测并计算平均回收率及变异系数(coefficient of variation,CV)。表2显示:icCLEIA方法的番茄酱、苹果汁样品的平均回收率分别为78.60%~93.30%和81.87%~110.83%,CV小于15%,高效液相色谱法的样品回收率分别在80.50%~91.15%和79.40%~111.26%,CV小于15%。

表2 样品添加回收实验(n=3)Table2 Recoveries of spiked real samples (n= 3)
3 讨 论
在免疫分析方法中,方法灵敏度和稳定性主要取决于抗体原抗体间的特异性反应及可逆性反应是否达到平衡。本研究考察了包被原质量浓度、抗体质量浓度、缓冲溶液pH值、竞争反应时间和二抗反应时间对icCLEIA方法的影响。结果表明在抗原固相化的过程中,合适的抗原和抗体质量浓度是影响反应平衡的关键,质量浓度过低则导致相互之间不能充分结合,反应不完全,质量浓度过高又容易造成多层吸附导致抗原决定簇的相互遮掩,从而对分析方法稳定性和灵敏度造成影响;其次,抗体是一种活性蛋白,需要适宜质量浓度的盐离子及pH值维持其内外渗透压的平衡和抗体的活性;而且ITeA是一种烯醇式化合物,缓冲体系的pH值对其溶解性也会造成一定的影响,实验结果表明最佳的缓冲溶液pH 7.4;最后,抗原抗体的反应时间也是影响方法灵敏度的重要因素,随着反应时间的延长,方法的IC50均呈现先减小后增大的趋势,这可能是因为反应时间过短会导致抗原抗体间的结合不完全,过长则容易造成非特异性吸附,因而只有合适的反应时间才能使方法的灵敏度达到最佳。
4 结论
针对农产品、食品中ITeA污染物,通过条件优化,建立了其icCLEIA快速检测方法,该方法IC50为2.13 ng/mL,线性范围在0.50~9.12 ng/mL之间;果汁、番茄样品添加回收率为78.60%~110.83%,CV小于15%,说明该方法准确可靠,适用于高通量样品种ITeA污染的快速筛检。
参考文献:
[1] OSTRY V. Alternaria mycotoxins: an overview of chemical characterization, producers, toxicity, analysis and occurrence in foodstuffs[J]. World Mycotoxin Journal, 2008, 1(2): 175-188. DOI:10.3920/WMJ2008.x013.
[2] SIEGEL D, MERKEL S, KOCH M, et al. Quantification of the alternaria mycotoxin tenuazonic acid in beer[J]. Food Chemistry, 2010, 120(3): 902-906. DOI:10.1016/J.Foodchem.2009.10.070.
[3] SMITH E R, FREDRICKSON T N, HADIDIAN Z. Toxic effects of the sodium and the N,N’-dibenzylethylenediamine salts of tenuazonic acid (NSC-525816 and NSC-82260)[J]. Cancer Chemotherapy Reports: Part 1, 1968, 52(5): 579-585.
[4] OSTRY V. Alternaria mycotoxins: an overview of chemical characterization, producers, toxicity, analysis and occurrence in foodstuffs[J]. World Mycotoxin Journal, 2008, 1(2): 175-188. DOI:10.3920/WMJ2008.x013.
[5] 强胜, 董云发, 安传福, 等. 紫茎泽兰链格孢菌代谢物用于生物除草的方法: 1644046A[P]. 2005-10-03.
[6] GITTERMAN C O. Antitumor, cytotoxic, and antibacterial activities of tenuazonic acid and congeneric tetramic acids[J]. Journal of Medicinal Chemistry, 1965, 8(4): 483-486. DOI:10.1021/jm00328a015.
[7] LEBRUN M H, NICOLAS L, BOUTAR M, et al. Relationships between the structure and the phytotoxicity of the fungal toxin tenuazonic acid[J]. Phytochemistry, 1988, 27(1): 77-84. DOI:10.1016/0031-9422(88)80594-6.
[8] QIN J C, ZHANG Y M, LING H, et al. Cytotoxic metabolites produced by Alternaria No. 28, an endophytic fungus isolated from Ginkgo biloba[J]. Natural Product Communications, 2009, 4(11): 1473-1476.
[9] MARINA E H M, KORN U. Alternaria mycotoxins in wheat: a 10 years survey in the Northeast of Germany[J]. Food Control, 2013, 34(1): 191-197. DOI:10.1016/j.foodcont.2013.04.018.
[10] ABRAMSON D, DELAQUIS P, SMITH D. Assessment of ochratoxin A and tenuazonic acid in Canadian ice-wines[J]. Mycotoxin Research, 2007, 23(3): 147-151. DOI:10.1007/BF02951511.
[11] STINSON E E, OSMAN S F, HEISLER E G, et al. Mycotoxin production in whole tomatoes, apples, oranges, and lemons[J]. Journal of Agricultural and Food Chemistry, 1981, 29(4): 790-792. DOI:10.1021/jf00106a025.
[12] LI F Q, YOSHIZAWA T. Alternaria mycotoxins in weathered wheat from China[J]. Journal of Agricultural and Food Chemistry, 2000, 48(7): 2920-2924. DOI:10.1021/jf0000171.
[13] NOSER J, SCHNEIDER P, ROTHER M, et al. Determination of six alternariatoxins with UPLC-MS/MS and their occurrence in tomatoes and tomato products from the Swiss market[J]. Mycotoxin Research, 2011, 27(4): 265-271. DOI:10.1007/s12550-011-0103-x.
[14] ASAM S, LIU Y, KONITZER K, et al. Development of a stable isotope dilution assay for tenuazonic acid[J]. Journal of Agricultural and Food Chemistry, 2011, 59(7): 2980-2987. DOI:10.1021/jf104270e.
[15] ASAM S, RYCHLIK M. Potential health hazards due to the occurrence of the mycotoxin tenuazonic acid in infant food[J]. European Food Research and Technology, 2013, 236(3): 491-497. DOI:10.1007/ s00217-012-1901-x.
[16] 余振, 周雪林, 陈娟, 等. 食品安全检测中的酶联免疫技术应用农产品加工[J]. 农产品加工, 2014, 9(9): 59-61. DOI:10.3969/jissn.1671-9646(X).2014.09.019.
[17] 汤轶伟, 高子媛, 魏立巧, 等. 标记免疫层析技术在食品安全检测中应用进展[J]. 食品安全质量检测学报, 2014, 5(7): 1913-1916.
[18] 金茂俊, 王静, 杨丽华, 等. 化学发光免疫分析方法在食品安全检测中的研究进展[J]. 食品安全质量检测学报, 2014, 5(3): 840-844.
[19] FANG L, CHEN H, YING X, et al. Micro-plate chemiluminescence enzyme immunoassay for aflatoxin B1in agricultural products[J]. Talanta, 2011, 84(1): 216-222. DOI:10.1016/j.talanta.2011.01.021.
[20] WANG J, ZHENG L, DONG Y, et al. Establishment of enhanced chemiluminescent immunoassay formats for stanozolol detection in animal-derived foodstuffs and other matrices[J]. Food Analytical Methods, 2015, 9(5): 1284-1292. DOI:10.1007/s12161-015-0307-3.
[21] LIU X Y, LI A F, CHEN M, et al. Chemiluminescence assay of organophosphorous pesticides phoxin in vegetable[J]. Chinese Journal of Analytical Chemistry, 2007, 35(12): 1809-1912.
[22] 王雅丽, 王锋, 王弘, 等. 基于光谱法研究异细交链孢菌酮酸半抗原-抗体的相互作用[J]. 现代食品科技, 2015, 31(5): 25-30. DOI:10.13982/j.mfst.1673-9078.2015.5.005.
[23] 杨星星, 刘细霞, 王弘, 等. 细交链孢菌酮酸酶联免疫吸附分析方法研究[J]. 分析化学, 2012(9): 1347-1352. DOI:10.3724/ SP.J.1096.2012.11253.
[24] QUAN Y, ZHANG Y, WANG S, et al. A rapid and sensitive chemiluminescence enzyme-linked immunosorbent assay for the determination of fumonisin B1in food samples[J]. Analytica Chimica Acta, 2006, 580(1): 1-8. DOI:10.1016/j.aca.2006.07.063.
[25] SUN W J, SHEN Y D, SUN Y M, et al. Determination of residues of chlorpromazine in pork by chemiluminescent enzyme immunoassay[J]. Chinese Journal of Analytical Chemistry, 2012, 40(9): 1397-1402. DOI:10.3724/SP.J.1096.2012.20054.
[26] ZHANG W, HE L, ZHANG R, et al. Development of a monoclonal antibody-based enzyme-linked immunosorbent assay for the analysis of 6-benzylaminopurine and its ribose adduct in bean sprouts[J]. Food Chemistry, 2016, 207: 233-238. DOI:10.1016/ j.foodchem.2016.03.103.
Development of Indirect Competitive Chemiluminescene Enzyme Immunoassay (icCLEIA) Method for Determination of Iso-Tenuazonic Acid in Fruit Juice and Tomato Sauce
ZHU Fan, LI Huanting, WANG Hong*, YANG Jinyi, XU Zhenlin, LEI Hongtao, XIAO Zhili, SUN Yuanming, SHEN Yudong*
(Key Laboratory of Food Quality and Safety of Guangdong Province, College of Food Science, South China Agricultural University, Guangzhou 510642, China)
An indirect competitive chemiluminescene enzyme immunoassay (icCLEIA) for the rapid determination of isotenuazonic acid (ITeA) in fruit juice and tomato sauce was developed. The optimized experimental parameters were obtained as follows: the coating antigen concentration was 15.6 ng/mL, the antibody was diluted 96 000 folds, the buffer pH was 7.4, and the time of competition and anti-mouse IgG reaction were 40 and 50 min, respectively. The half maximal inhibitory concentration (IC50) of the proposed method was 2.13 ng/mL with limit of detection (LOD) of 0.10 ng/mL in the linear range from 0.50 to 9.12 ng/mL. The cross-reactivity with ITeA analogues was lower than 0.1%. The recoveries of ITeA from spiked samples ranged from 78.60% to 110.83%. The coeff i cient of variation was lower than 15%. This proposed icCLEIA provided an eff i cient method for rapid detection of ITeA in real samples.
mycotoxin; iso-tenuazonic acid (ITeA); polyclonal antibody; chemiluminescene enzyme immunoassay; rapid detection
10.7506/spkx1002-6630-201704040
TS207.3
A
1002-6630(2017)04-0250-05
朱帆, 李焕婷, 王弘, 等. 间接竞争化学发光酶联免疫分析法检测番茄酱和果汁中异细交链孢菌酮酸[J]. 食品科学, 2017, 38(4): 250-254. DOI:10.7506/spkx1002-6630-201704040. http://www.spkx.net.cn
ZHU Fan, LI Huanting, WANG Hong, et al. Development of indirect competitive chemiluminescene enzyme immunoassay (icCLEIA) method for determination of iso-tenuazonic acid in fruit juice and tomato sauce[J]. Food Science, 2017, 38(4): 250-254. (in Chinese with English abstract)
10.7506/spkx1002-6630-201704040. http://www.spkx.net.cn
2016-03-28
国家自然科学基金面上项目(31371769;31271866);广东省科技计划项目(2013B040402006;2014A020219008;2014A050503059;2014A030311043)
朱帆(1991—),男,硕士研究生,研究方向为食品质量与安全。E-mail:shipin3211@sina.com
*通信作者:王弘(1973—),女,教授,博士,研究方向为食品安全与营养。E-mail:gzwhongd@163.com
沈玉栋(1977—),男,教授,博士,研究方向为食品安全分析与传感技术。E-mail:syd_tyx@163.com
