氢核磁共振结合正交偏最小二乘法对油菜蜜中果葡糖浆掺假的判别分析
2017-03-27刘红兵罗立廷
陈 雷,刘红兵,罗立廷
(中国科学院武汉物理与数学研究所,波谱与原子分子物理国家重点实验室,武汉磁共振中心,湖北 武汉 430071)
氢核磁共振结合正交偏最小二乘法对油菜蜜中果葡糖浆掺假的判别分析
陈 雷,刘红兵,罗立廷
(中国科学院武汉物理与数学研究所,波谱与原子分子物理国家重点实验室,武汉磁共振中心,湖北 武汉 430071)
利用氢核磁共振(1H nuclear magnetic resonance,1H NMR)谱图结合正交偏最小二乘(orthogonal partial least squares,OPLS)法对油菜蜂蜜和果葡糖浆掺假蜂蜜进行判别分析。采集了303 个油菜蜜样品和180 个按照不同比例配制的果葡糖浆掺假蜂蜜样品的1H NMR谱图,并对油菜蜜主要糖类成分和部分低含量化合物进行了信号归属。采用OPLS对训练集数据进行分析,建立蜂蜜果葡糖浆掺假判别模型。通过排列实验法对模型进行可靠性检验。结果显示,油菜蜜和果葡糖浆掺假蜂蜜样品在OPLS得分图中能明显区分。训练集和测试集样品的总体判别正确率分别为98.40%和98.24%。因此,1H NMR与OPLS相结合可以实现油菜蜜中果葡糖浆掺假的快速鉴别。该方法是基于对蜂蜜成分的整体分析,避免了仅仅分析个别成分指标的检验方法中存在的缺陷,为蜂蜜质量监控提供了一种新思路。
蜂蜜;核磁共振;正交偏最小二乘法;掺假
蜂蜜是一种蜜蜂采集植物的花蜜、分泌物或者蜜露,与自身分泌物混合后,经充分酿造而成的天然甜物质[1]。作为一种天然保健品和营养品,深受广大消费者的青睐。尽管国家标准中明确规定蜂蜜是天然物质,不允许人为添加和去除任何物质,但目前国内市场上蜂蜜掺假现象屡禁不止,严重损害了广大消费者的利益,影响了蜂蜜产业的健康发展。蜂蜜市场掺假严重的原因主要有4点:1)蜂蜜中主要糖类物质是葡萄糖、果糖,结构比较简单,同时受蜜源植物种类、花期长短、气候以及蜂蜜的加工、储存、结晶等多种因素影响,造成蜂蜜各成分的含量波动范围较大,这些客观原因,使得蜂蜜掺假简单、方便;2)目前掺假的主要手段是在蜂蜜中加入外源植物糖浆,例如玉米糖浆、甜菜糖浆、大米糖浆等[2-3],市场上糖浆的价格远低于蜂蜜的价格,不法生产厂商从掺假蜂蜜中能获得更多的经济利益;3)掺假蜂蜜本身对人体危害程度不及其他一些掺假食品,没有引起消费者的高度警惕;4)缺乏有效检测手段,导致打击蜂蜜掺假面临困难。
蜂蜜品质的传统检测方法包括感官鉴别、花粉分析以及理化指标测试[4-6]。感官鉴别带有一定的主观性、经验性;花粉分析受到的外界影响因素较多,存在较大的不确定性;仅依靠理化指标测试已不能区分蜂蜜的真假。近年来,利用先进的现代仪器设备,针对蜂蜜掺假发展了多种检测分析技术和方法,主要包括稳定碳同位素比率法[7-9]、色谱分析(气相色谱、高效液相色谱、薄层色谱、离子色谱)及其联用技术[10-15]、光谱分析(近红外、荧光、拉曼、紫外-可见吸收光谱)[16-22]、淀粉酶检测法[23-24]、差示扫描量热法[25]、电子鼻[26]等。这些方法都存在缺点,并只在一定范围内适用[2,27]。因此,糖浆掺假蜂蜜的识别问题还没有得到完全解决。检测技术的滞后影响到蜂蜜产品的质量保证和食用安全,必须进一步开展蜂蜜掺假的鉴别研究,建立一套灵敏、准确、高效、普适的蜂蜜掺假鉴定方法,以保护消费者利益和保证蜂蜜产业健康发展。
氢核磁共振(1H nuclear magnetic resonance,1H NMR)是一种非常重要的研究和分析测试工具,在化学、生物、医学等领域中得到广泛应用,对有机小分子和生物大分子的结构解析具有重要作用。NMR技术有如下特点:1)样品预处理简单,无需预筛选,可以避免由于分离所造成的微小成分的丢失;2)无损伤性,不会破坏样品的结构和性质,可以进行实时和动态的检测;3)谱图中信号的相对强弱直接反映了样品中各组分的相对含量;4)可设计多种编辑手段,实验方法灵活多样。
采用1H NMR技术测试食品等复杂混合体系可以得到样品中多种化学成分的信息[28-29],但是各种成分信号的重叠也使得图谱变得十分复杂。通常,仅靠肉眼观察只能从NMR图谱中获得很有限的信息。而多元统计分析可以有效而全面地分析谱图数据,从复杂的数据中最大限度地提取信息,建立数学模型。通常采用的多元统计分析方法包括主成分分析、聚类分析、偏最小二乘(partial least squares,PLS)法、正交偏最小二乘(orthogonal partial least squares,OPLS)法、支持向量机等。其中OPLS法是在PLS法的基础上提出的一种新型的多元统计数据分析方法[30],其最大的特点是可以去除自变量X中与分类变量Y无关的变化,使分类信息主要集中在一个主成分中,模型变得简单和易于解释,其判别效果及主成分得分图的可视化效果更加明显[31]。
1H NMR技术结合多元统计分析在食品研究中已得到比较广泛的使用,在食品成分分析、真伪鉴别、品质评价和产地、年份区分等领域有很多应用成果[32-35]。Godelmann等[32]报道了1H NMR结合多元统计分析应用于葡萄酒种类、产地和酿造年份的区分;Schievano等[33]采集了118 份蜂蜜氯仿提取物的1H NMR谱图,结合主成分分析和PLS进行蜂蜜溯源分析;李爱平等[34]对食醋的1H NMR数据利用判别-PLS法进行分析,建立了食醋品种分类模型,比较了不同食醋的差异化学成分;蔡波太等[35]结合聚类和判别分析建立了鉴别地沟油的模型,盲测的正确率达93.8%。
本实验利用1H NMR技术结合OPLS法对蜂蜜掺假进行鉴别研究。首先采集油菜蜜样品和糖浆掺假蜂蜜样品的1H NMR谱图,对谱图进行分析,归属特征信号。然后利用OPLS对谱图的分段积分数据矩阵进行分析,建立真假蜂蜜鉴别模型。最后对训练集和测试集样品进行鉴别,验证模型的可靠性。
1 材料与方法
1.1 材料
实验所用的蜂蜜来至湖北省仙桃、松滋、汉川以及湖南省澧县等地区的养蜂场,品种为油菜花蜜。为保证样品的真实性,直接从蜂箱中的巢脾取样,选取自然酿造成熟的封盖蜂蜜采集。共收集了303 个样品,贮藏在4~8 ℃冰箱中备用。
掺假用的果葡糖浆从市场上采购。共购买了8 家生产商的18 种不同规格的果葡糖浆。将果葡糖浆按质量比(m糖浆/m蜂蜜)5%、10%、30%、50%以及70%加入到油菜蜜中。每种果葡糖浆分别掺入任选的2 个油菜蜜样品,共配制糖浆掺假蜂蜜样品180 份。
1.2 试剂
K2HPO4·3H2O、NaH2PO4·2H2O(均为分析纯)上海国药集团试剂有限公司;NaN3(分析纯) 天津福晨化学试剂厂;重水(D2O,99.9%氘代,含0.05 g/100 mL 2,2,3,3-氘代三甲基硅烷丙酸钠(2,2,3,3,-d(4)-3-(trimethylsilyl)propionic acid sodium salt,TSP)) 美国Cambridge Isotope Laboratories公司;用于样品制备的磷酸盐缓冲溶液(0.15 mol/L K2HPO4/NaH2PO4,pH 7.40)使用含10% D2O的双蒸水配制而成。其中缓冲溶液包含的TSP和NaN3(0.01 g/100 mL)分别用作化学位移内标物和防腐剂。
1.3 仪器与设备
AVANCE 500MHz液体NMR仪(配有宽带反相检测探头、自动进样器) 瑞士布鲁克公司;AL104电子天平 梅特勒-托利多仪器(上海)有限公司;移液枪德国艾本德公司;Micro 17R微量台式离心机 美国赛默飞世尔科技公司;5 mm核磁管 美国诺雷尔公司。
1.4 方法
1.4.1 NMR样品的制备
先将油菜蜜从冰箱取出,放置至室温。对于已结晶的样品,在60 ℃水浴中加热,待样品完全溶解,再进行取样。称取蜂蜜样品50.00 mg,置于离心管中,加入600 µL磷酸盐缓冲溶液。在涡旋混合器上振荡10 min,实现均匀混合。混合物离心10 min,取550 µL上清液转移到5 mm NMR管中。共配制303 个油菜蜜的NMR样品待检。
对于糖浆掺假蜂蜜,按上面所述方法,共配制成180 个NMR待测样品。
对于果葡糖浆,按上面所述方法,共配制成18 个NMR待测样品。
1.4.2 NMR测试及数据处理
油菜蜜样品、糖浆掺假样品以及果葡糖浆样品的NMR测试在500 MHz液体NMR仪上进行,使用宽带反检测探头,温度298 K。采用noesypr1d脉冲序列(90°-t1-90°-tm-90°-采样)采集1D1H NMR谱。序列中90°脉冲的脉宽为10.2 µs,t1和tm(混合时间)分别设为4 µs和100 ms,延迟等待时间为2.0 s。采用预饱和方法进行水峰抑制,即施加强度约为50 Hz的低功率连续波脉冲照射水峰,持续时间2.0 s。1H NMR的谱宽设为δ 20,采样点数为32 768,信号累加次数为64 次。
使用Topspin软件(3.2, Bruker Biospin)对采集到1D1H NMR数据进行处理。变换点数设为65 536,指数线宽因子为0.3 Hz,手动调相位和基线校正。内标TSP的共振峰设为δ 0.00,进行化学位移定标。将处理好的1H NMR谱图导入AMIX软件(3.9.11,Bruker Biospin)中进行分段积分。为消除残余水信号的影响,剔除δ 4.73~δ 4.93区间的信号。采用峰面积归一化,即各分段积分值除以积分区域总的峰面积,得到归一化的强度积分数据。
1.4.3 多元统计分析
1.4.3.1 训练集和测试集的构建
从303 个油菜蜜样品中随机选出213 个样品,从180 个糖浆掺假蜂蜜样品中选出100 个样品(5 种糖浆掺入量,每种各20 个),构成训练集,共313 组强度积分值数据;余下的90 个油菜蜜样品和80 个糖浆掺假蜂蜜样品(5 种糖浆掺入量,每种各16 个)组成测试集,共170 组强度积分值数据。
1.4.3.2 OPLS法
油菜蜜样品和糖浆掺假蜂蜜样品的类别变量值分别设为1和2,作为因变量(Y变量)。归一化的强度积分值作为自变量(X变量)。将训练集数据导入SIMCA-P+ 14.0(Umetrics, Umeå, Sweden)软件中,采用自适换算进行标准化。随后进行OPLS计算,得到判别模型。采用排列实验法对模型的可靠性进行检验。将测试集样品的数据代入经过检验的模型,计算得到各样品的类别变量值。当类别变量Y在1±0.5之间时,样品判断为油菜蜜;当类别变量Y在2±0.5之间时,样品判断为糖浆掺假蜂蜜。
2 结果与分析
2.1 油菜蜜1H NMR谱图分析

图1 油菜蜜样品的1H NMR谱图Fig.1 Complete1H NMR spectrum with local enlargement of a rape honey
图1a显示了油菜蜜样品的1H NMR谱图,大致可以分成3 个区域,包括脂肪区(δ 0.00~δ 3.00)、糖类化合物区(δ 3.00~δ 6.00)和芳香区(δ 6.00~δ 9.50)。通过化学位移、J偶合常数、文献数据对照[36-40]以及13C NMR谱、1H-1H化学位移相关谱、1H-13C异核单量子相干谱可以对其中大部分信号进行归属,鉴定出多个化合物。比较强的共振峰都集中在δ 3.00~δ 6.00之间,主要是蜂蜜中葡萄糖和果糖的信号。蜂蜜中存在α-吡喃葡萄糖(α-glucopyranose,α-Glu)和β-吡喃葡萄糖(β-glucopyranose,β-Glu)两种葡萄糖构型。δ 5.243的双峰信号归属为来自α-吡喃葡萄糖的C(1)H,受到C(2)H的偶合而裂分,J偶合常数为3.75 Hz;β-吡喃葡萄糖C(1)H的化学位移为δ 4.654,受C(2)H的偶合而裂分成双峰,J偶合常数为7.95 Hz。β-吡喃葡萄糖C(2)H的化学位移为δ 3.252,分别受到C(1)H和C(3)H的偶合,为双二重峰形。果糖在蜂蜜中主要以β-吡喃果糖(β-fructopyranose,β-FP)、α-呋喃果糖(α-fructofuranose,α-FF)和β-呋喃果糖(β-fructofuranose,β-FF)3 种构型存在。β-FP的含量最高,β-FF次之,α-FF最少。果糖的信号主要集中在δ 3.5~δ 4.2之间(图1b),可以观察到β-FP的C(6)Hʹ为dd峰形,其中一个双重峰的化学位移为δ 4.041,另一个双重峰与α -FF 4(C)H、β-FPC(5)H的信号重叠(δ 4.028~δ 3.983);δ 4.088~δ 4.15的信号来至α-FF C(4)H和β-FF C(3)H、C(4)H。葡萄糖、果糖的详细1H NMR数据见表1。

表1 油菜蜜中主要糖类化合物的1H NMR数据Table1 1H NMR data for carbohydrates present in rape honey

续表1

表2 油菜蜜中低含量化合物的1H NMR数据Table2 1H NMR data for minor compounds present in rape honey
脂肪区的共振峰主要来自氨基酸、有机酸以及乙醇等化合物。可以观察到缬氨酸、乙醇、乳酸、丙氨酸和乙酸的CH3基团信号以及脯氨酸、谷氨酰胺、琥珀酸的CH2基团信号(图1c),例如δ 1.188的三重峰信号来自乙醇的CH3基团;δ 1.483的双峰信号归属为丙氨酸的CH3基团,J偶合常数为7.34 Hz;δ 2.408的单峰信号归属为琥珀酸的CH2基团。芳香区处于谱图的低场区,可以鉴定出5-羟甲基糠醛、酪氨酸、苯丙氨酸以及甲酸(图1d)。例如,可以观测到酪氨酸苯环上的C(3)H、C(5)H和C(2)H、C(6)H两组质子的双重峰信号,化学位移分别为δ 6.906、δ 7.197。以上化合物的共振峰都较弱,反映出其在蜂蜜中的含量较少。各化合物在油菜蜜1H NMR中出现的特征峰归属见表2。
2.2 果葡糖浆和果葡糖浆掺假蜂蜜的1H NMR谱
果葡糖浆也称高果糖浆或异构糖浆。工业上主要采用淀粉为原料,经过液化、糖化转化成葡萄糖,再经葡萄糖异构酶将其中的一部分葡萄糖异构成果糖,形成果糖和葡萄糖的混合糖浆。按照国家标准[41],果糖和葡萄糖的含量应占糖浆干物质的92%以上。本实验共收集了18 种果葡糖浆,每种糖浆都采集了1H NMR谱。图2显示了其中一个果葡糖浆的1H NMR谱。与油菜蜜的1H NMR谱一致,强的共振峰都出现在δ 3.00~δ 6.00之间,主要是葡萄糖和果糖的信号。而在脂肪区与芳香区,分别可以观察到乳酸、乙酸以及甲酸的共振峰,其他信号较少。油菜蜜1H NMR谱中出现的丙氨酸、脯氨酸等5 种氨基酸的特征峰并未在该果葡糖浆样品的1H NMR谱中观察到。同时,也没有发现果葡糖浆自身独有的共振峰。其余17 个果葡糖浆的1H NMR谱与之类似,限于篇幅未列出。
果葡糖浆成分单一,油菜蜜成分复杂。对于油菜蜜含有而果葡糖浆不含有的化合物,糖浆的掺入起着一种“稀释”作用。随着糖浆掺入量的增加,这些化合物的含量在降低。在1H NMR谱上可以观察到其相应的共振峰亦随之下降。图2显示了果葡糖浆掺假蜂蜜的1H NMR谱,糖浆配制比例分别为5%和50%。对于果葡糖浆掺入量样品(5%),稀释效应不明显,其1H NMR谱与油菜蜜样品的1H NMR谱极为相似,很难区分。而果葡糖浆掺入量样品(50%),稀释效应较明显,观察到丙氨酸、脯氨酸等5 种氨基酸,其特征峰的强度都有下降。

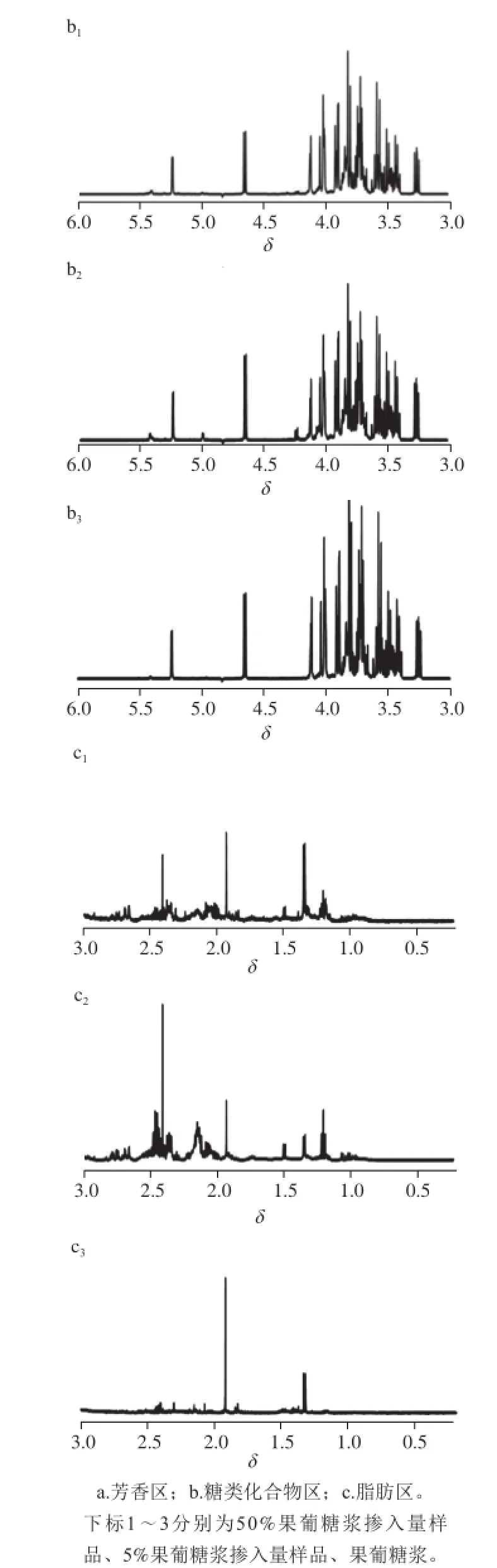
图2 果葡糖和果葡糖浆掺假蜂蜜的1H NMR谱Fig.2 1H NMR spectra of high fructose syrup and adulterated honey samples
2.3 正交成分个数的确定
OPLS的最大特点是可以去除自变量X中与因变量Y无关的数据变异(即与Y正交的成分)。通过反复迭代,逐次增加去除的正交成分,可以有效地消除数据中的结构噪声和信息冗余。正交成分数的多少对模型的预测性能有一定影响。对于1.4.3节构建的训练集和测试集数据(积分区间为δ 0.1~δ 9.5,积分间隔为δ 0.004),依次增加去除的正交成分数,分别建立OPLS模型。利用这些模型对训练集和测试集样品进行判别,将发生误判的样品个数作为衡量模型优劣的一个指标,误判数越少,模型性能越好。正交成分数对模型的影响如图3所示。

图3 正交成分数对样品误判数的影响Fig.3 Effect of orthogonal components on misclassif i cation
从图3可以看出,对训练集样品的误判数随着正交成分数的增加而减少,例如正交成分数为1,误判个数为29;正交成分数增加到11,则只有1例误判。对于测试集样品,误判数随着正交成分数的增加先减少后增加。正交成分数等于7时,误判数最少(9 例);正交成分数为11,误判个数增加到17。这说明模型中去除的正交成分数过多会导致过拟合现象,即训练集判别正确率很高而测试集判别正确率较低。因此确定最佳的正交成分数不能仅仅依靠训练集的结果,还应参考测试集的计算结果。在后面的计算中,正交成分数都确定为7。
2.41H NMR谱积分区间的选择
在利用1H NMR谱建模过程中,需要选择合适的化学位移区域,进行分段积分。如果选取的积分区间过小,将会因不能完整反映样品的信息而导致模型预测准确度降低;如果选取的积分区间过大,引入的噪声信号会增加,降低建模和预测效率。如有研究者在对啤酒1H NMR数据的主成分分析中,经过比较只选择了碳水化合物区间(δ 3.0~δ 5.5)的积分数据[38]。根据2.1节的分析,油菜蜜样品的1H NMR谱图可以分成3 个区域,因此建立了5 种积分区间。积分区间1(δ 0.1~δ 9.5)包括了脂肪区、糖类化合物区和芳香区,相当于全谱;积分区间2(δ 0.1~δ 6.0)由脂肪区、糖类化合物区组成;积分区间3(δ 3.0~δ 9.5)由糖类化合物区和芳香区组成。积分区间4去除了信号最强的糖类化合物区,只含脂肪区(δ 0.1~δ 3.0)和芳香区(δ 6.0~δ 9.5)。积分区间5 只包含糖类化合物区(δ 3.0~δ 6.0)。表3列出了采用不同积分区间建立的OPLS模型对训练集和测试集样品进行判别的结果,包括训练集的交叉验证均方根误差(root mean square error of cross validation,RMSECV)和测试集的预测均方根误差(root mean square error of predication,RMSEP)。从表3可以看出,选择不同的积分区间确实会对模型的预测性造成一定影响。考察训练集的交叉验证误判数,积分区间1和2的结果相接近,明显低于其他3种积分区间。对测试集样品进行判别,采用积分区间2建立的OPLS模型的误判数为3,RMSEP为0.264 1,小于积分区间1的结果(误判数为9,RMSEP为0.302 1)。因此积分区间2是最佳的选择。这也可以从谱图分析中得到解释。芳香区的信号较少,并且强度比较弱。积分区间包含芳香区后反而增加了噪声信号,导致模型性能下降。在以下的计算中均选择积分区间2(δ 0.1~δ 6.0)进行分段积分。

表3 基于不同积分区间建立的模型对训练集和测试集的判别结果Table3 Results of discrimination of training and testing sets based on models with various integral regions
2.5 基于OPLS的蜂蜜掺假判别
构建的训练集中包含313 个样品(油菜蜜样品213 个,糖浆掺假蜂蜜样品100 个),选择的积分区间为δ 0.1~δ 6.0,积分间隔为δ 0.004。剔除残余的水信号,共获得1 426 个强度积分变量,构成313×1 426的数据矩阵。利用OPLS对其进行分析,建立模型。当去除7个正交成分后,模型的和Q2分别达到了0.852、0.783,其中和Q2分别表示模型对因变量Y的拟合能力以及模型的预测能力。以预测成分的得分值(tp[1])和第1个正交成分的得分值(to[2])分别作为横纵坐标绘制得分散点图。如图4所示,油菜蜜样品和糖浆掺假蜂蜜样品可以在得分散点图上明显区分,即组内聚集、组间分开,可视化效果明显。
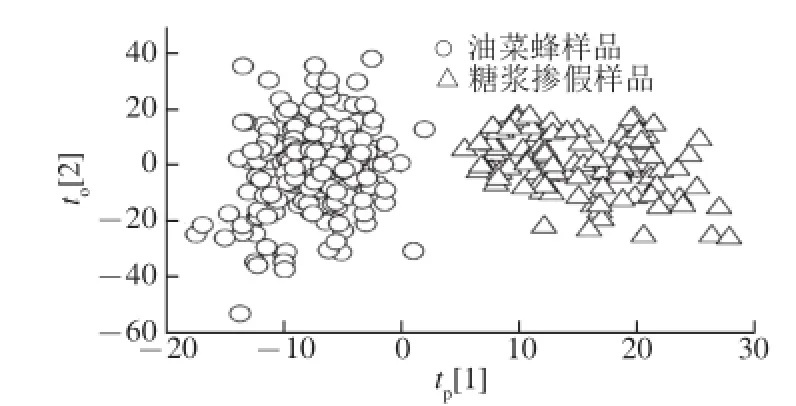
图4 训练集样品OPLS得分图Fig.4 OPLS score plot of training set
为验证模型的可靠性,采用排列实验法。该方法保持X变量不变,通过随机变化Y变量的顺序,观察多个Y变量的顺序随机排列的模型与原始Y变量模型之间的差异。然后对Y变量顺序随机排列模型的R2值、Q2值与原始鉴别模型的R2值、Q2值之间做回归线。回归线的斜率越大,与纵轴的截距越小,提示有越多的数据用来解释模型,因而模型的预测能力也比较好。若原始模型的预测能力(Q2值)大于任何一个Y变量随机排列模型的预测能力,则模型质量较好,反之此模型较差。判别模型可靠性的验证如图5所示,共进行160 次随机排列,R2回归线、Q2回归线与纵轴的截距分别为0.301、-0.429。最右端原始鉴别模型的Q2值大于左边任何一个Y变量随机排列模型的Q2值。因此验证结果显示模型有效可靠。

图5 排列实验对OPLS模型的可靠性验证Fig.5 Validation of OPLS model by permutation test
利用OPLS鉴别模型对训练集和测试集样品的类别变量值进行计算。计算值在1±0.5之间的样品为油菜蜜样品,计算值在2±0.5之间的为糖浆掺假蜂蜜样品。若计算值不在上述范围内,则判定样品归类不明确。图6中以样品类别变量的真实值为纵坐标,计算值为横坐标,绘制散点图,反映了训练集和测试集中样品类别变量真实值与计算值之间的关系。从图6a可以发现,训练集中共有5 个样品发生了误判,其中假阳性2 个(油菜蜜样品判别为糖浆掺假样品),假阴性3 个(糖浆掺假样品判别为油菜蜜样品)。总体正确率为98.40%。将测试集数据带入训练集创建的OPLS模型中进行验证,根据计算得到的类别变量值判断样品的真假。类别变量计算值与真实值之间的差异由RMSEP表示。测试集的总体正确率为98.24%,只有3 个样品的判别结果为假阴性,RMSEP为0.264 1。上述计算结果可以说明OPLS模型对判断蜂蜜掺假具有较高的可靠性。


图6 训练集(a)和测试集(b)中样品类别变量真实值与计算值之间的关系图Fig.6 Relationship between real value and calculated values of training (a) and testing sets (b)
在上述判别分析中,共出现6 例假阴性(训练集样品3 个,测试集样品3 个)。经检查,发生误判的这些样品的果葡糖浆掺入量都较低,其中5%糖浆掺入量的样品有4 个,10%糖浆掺入量样品有2个。而糖浆掺入量在30%以上的样品都得到正确判断。表4列出了不同糖浆掺入量样品的均方根误差及判别结果。均方根误差越小,代表判别的可靠性越高。从表4可以看出,较高糖浆掺入量样品(30%以上)的均方根误差明显比低糖浆掺入量样品(5%、10%)的小。说明不同的糖浆掺入量确实会对样品的判别造成一定影响。

表4 OPLS模型对不同糖浆掺入量样品的判别结果Table4 Results of discrimination of adulterated samples with various syrup concentrations based on OPLS model
3 结 论
本实验采用1H NMR技术和OPLS分析结合的方法进行蜂蜜果葡糖浆掺假的判别分析,建立了数学模型,其结果能很好地区分油菜蜜样品和果葡糖浆掺假蜂蜜样品,并在谱图分析、数据处理和模型验证等方面进行了研究探讨。对蜂蜜的主要成分葡萄糖、果糖的1H NMR信号进行了全部归属,发现了蔗糖、丙氨酸、酪氨酸等10 个低含量化合物的特征峰。讨论了在建立OPLS判别模型中正交成分数以及1H NMR谱积分区间的选择。经过比较,最佳的正交成分数确定为7,谱图积分区间为δ 0.1~δ 6.0。包含313 个样品的训练集建立的OPLS判别模型对训练集和测试集样品的判别正确率分别达到了98.40%和98.24%,表明模型对蜂蜜果葡糖浆掺假具有较高的判别能力。总体来讲,1H NMR技术具有制备样品简单,采样迅速,能够获得样品全面的化学组成信息,与OPLS分析方法结合能够方便、快捷、准确地判别蜂蜜糖浆掺假,为蜂蜜质量评估鉴定提供了一条新途径。
今后研究将会进一步收集各类蜂蜜样品(包括掺假蜂蜜),不断扩充数据库的样本数量,对本实验建立的方法和模型进行考察;同时充分利用NMR中的各种技术,并结合化学计量学手段,寻找真假蜂蜜之间的化学差异成分,为蜂蜜质量监控提供参考。
[1] 卫生部. 蜜蜂: GB 14963—2011[S]. 北京: 中国标准出版社, 2011.
[2] 裴高璞, 史波林, 赵镭, 等. 蜂蜜质量市场动态及掺假检测方法现状分析[J]. 食品科学, 2013, 34(15): 329-336. DOI:10.7506/spkx1002-6630-201315068.
[3] 袁玉伟, 张志恒, 叶雪珠, 等. 蜂蜜掺假鉴别技术的研究进展与对策建议[J]. 食品科学, 2010, 31(9): 318-322.
[4] 李崇善, 彪清湖, 张国权. 蜂蜜的质量鉴别及掺假检验[J]. 甘肃科技纵横, 2002, 31(5): 35-37. DOI:10.3969/j.issn.1672-6375.2002.05.018.
[5] 国家质量监督检验检疫总局, 中国国家标准化管理委员会. 蜂蜜中植物花粉的测定方法: GB/T 23194—2008[S]. 北京: 中国标准出版社, 2008.
[6] 李水芳, 朱向荣, 单扬. 蜂蜜掺假鉴别技术研究进展[J]. 食品工业科技, 2009, 30(11): 353-356.
[7] 国家质量监督检验检疫总局. 蜜蜂中碳-4植物糖含量测定方法 稳定同位素比率法: GB/T 18932.1—2002[S]. 北京: 中国标准出版社, 2002.
[8] SIMSEK A, BILSEL M, GOREN A C.13C/12C pattern of honey from Turkey and determination of adulteration in commercially available honey sample using EA-IRMA[J]. Food Chemistry, 2012, 130(4): 1115-1121. DOI:10.1016/j.foodchem.2011.08.017.
[9] DONG Hao, LUO Donghui, XIAN Yanping, et al. Adulteration identif i cation of commercial honey with the C-4 sugar content of negative values by an elemental analyzer and liquid chromatography coupled to isotope ratio mass spectroscopy[J]. Journal of Agricultural and Food Chemistry, 2016, 64(16): 3258-3265. DOI:10.1021/jf401912u.
[10] RUIZ-MATUTE A I, RODRÍGUEZ-SÁNCHEZ S, SANZ M L. Detection of adulterations of honey with high fructose syrups from inulin by GC analysis[J]. Journal of Food Composition and Analysis, 2010, 23(3): 273-276. DOI:10.1016/j.jfca.2009.10.004.
[11] 张其安, 杨少波, 王坤, 等. 高效液相色谱法检测蜂蜜中大米糖浆掺假[J]. 中国蜂业, 2016, 67(1): 47-50. DOI:10.3969/ j.issn.0412-4367.2016.01.026.
[12] XUE Xiaofeng, WANG Qiang, LI Yi, et al. 2-Acetylfuran-3-glucopyranoside as a novel marker for the detection of honey adulterated with rice syrup[J]. Journal of Agricultural and Food Chemistry, 2013, 61(31): 7488-7493. DOI:10.1021/jf401912u.
[13] 国家质量监督检验检疫总局. 蜜蜂中高果糖淀粉糖浆测定方法 薄层色谱法: GB/T 18932.2—2002[S]. 北京: 中国标准出版社, 2002.
[14] CORDELLA C, MILITAO J S L T, CLEMENT M C, et al. Detection and quantification of honey adulteration via direct incorporation of sugar syrups or bee-feeding: preliminary study using high-performance anion exchange chromatography with pulsed amperometric detection (HPAEC-PAD) and chemometrics[J]. Analytica Chimica Acta, 2005, 531(2): 239-248.
[15] DU Bing, WU Liming, XUE Xiaofeng, et al. Rapid screening of multiclass syrup adulterants in honey by ultrahigh-performance liquid chromatography/quadrupole time of flight mass spectrometry[J]. Journal of Agricultural and Food Chemistry, 2015, 63(29): 6614-6623. DOI:10.1021/acs.jafc.5b01410.
[16] 陈兰珍. 蜂蜜品质近红外光谱评价技术研究[D]. 北京: 中国农业科学院, 2010.
[17] 李水芳, 单杨, 张欣, 等. 蜂蜜用葡萄糖溶液掺假的近红外光谱检测[J]. 食品研究与开发, 2011, 32(5): 114-119. DOI:10.3969/ j.issn.1005-6521.2011.05.034.
[18] 屠振华, 朱大洲, 籍保平, 等. 基于近红外光谱技术的蜂蜜掺假识别[J]. 农业工程学报, 2011, 27(11): 382-387. DOI:10.3969/ j.issn.1002-6819.2011.11.071.
[19] 尹春玲, 胡乐乾, 郑晓丹, 等. 基于荧光光谱和模式识别技术的掺假蜂蜜识别[J]. 应用化学, 2011, 28(10): 151-153.
[20] PARADLKS M M, IRUDAYARAJ J. Discrimination and classification of beet and cane inverts in honey by FT-Raman spectroscopy[J]. Food Chemistry, 2002, 76(2): 231-239. DOI:10.1016/ S0308-8146(01)00292-8.
[21] 李水芳, 单杨, 尹永, 等. 拉曼光谱法快速鉴别蜂蜜中掺入甜菜糖浆的可行性研究[J]. 中国食品学报, 2012, 12(6): 148-152. DOI:10.3969/j.issn.1009-7848.2012.06.022.
[22] 欧文娟, 孟耀勇, 张小燕, 等. 紫外可见吸收光谱结合主成分分析-反向传播人工神经网络鉴别真假蜂蜜[J]. 分析化学, 2011, 39(7): 1104-1108.
[23] 李军生, 何仁, 江权燊, 等. 蜂蜜淀粉酶在鉴别蜂蜜掺假中的应用研究[J]. 食品科学, 2004, 25(10): 59-62. DOI:10.3321/ j.issn:1002-6630.2004.10.009.
[24] 叶云, 梁超香, 李军生, 等. 利用同工酶技术检测蜂蜜品质的新方法[J]. 食品科学, 2006, 27(6): 177-178. DOI:10.3321/ j.issn:1002-6630.2006.06.039.
[25] CORDELLA C, ANTINELLI J, AURIERES C, et al. Use of differential scanning calorimetry (DSC) as a new technique for detection of adulteration in honeys. 1. study of adulteration effect on honey thermal behavior[J]. Journal of Agricultural and Food Chemistry, 2002, 50(1): 203-208. DOI:10.1021/jf010752s.
[26] 裴高璞, 史波林, 赵镭, 等. 典型掺假蜂蜜的电子鼻信息变化特征及判别能力[J]. 农业工程学报, 2015, 31(增刊1): 325-330. DOI:10.3969/j.issn.1002-6819.2015.z1.039.
[27] 吴燕涛, 穆同娜, 王绍清, 等. 现代分析技术在蜂蜜掺假鉴别中应用研究进展[J]. 食品研究与开发, 2015, 36(5): 137-142. DOI:10.3969/ j.issn.1005-6521.2015.05.033.
[28] MANNINA L, SOBOLEV A P, VIEL S. Liquid state1H high field NMR in food analysis[J]. Progress in Nuclear Magnetic Resonance Spectroscopy, 2012, 66(1): 1-39.
[29] 陈波, 康海宁, 韩超, 等. NMR指纹图谱与模式识别方法在食物分析中的应用[J]. 波谱学杂志, 2006, 23(3): 397-407. DOI:10.3969/ j.issn.1000-4556.2006.03.015.
[30] TRYGG J, WOLD S. Orthogonal projections to latent structures (O-PLS)[J]. Journal of Chemometrics, 2002, 16(3): 119-128. DOI:10.1002/cem.695.
[31] BYLESIO M, RANTALAINEN M, CLOAREC O, et al. OPLS discriminant analysis: combining the strengths of PLS-DA and SIMCA classif i cation[J]. Journal of Chemometrics, 2006, 20(8): 341-351. DOI:10.1002/cem.1006.
[32] GODELMANN R, FANG F, HUMPFER E, et al. Targeted and nontargeted wine analysis by1H NMR spectroscopy combined with multivariate statistical analysis. differentiation of important parameters: grape variety, geographical origin, year of vintage[J]. Journal of Agricultural and Food Chemistry, 2013, 61(23): 5610-5619. DOI:10.1021/jf400800d.
[33] SCHIEVANO E, PEGGION E, MAMMI S.1H nuclear magnetic resonance spectra of chloroform extracts of honey for chemometric determination of its botanical origin[J]. Journal of Agricultural and Food Chemistry, 2010, 58(1): 57-65. DOI:10.1021/jf9022977.
[34] 李爱平, 李震宇, 邢婕, 等. 核磁共振代谢组学技术检测食醋化学成分[J]. 食品科学, 2013, 34(12): 247-253. DOI:10.7506/spkx1002-6630-201312051.
[35] 蔡波太, 袁龙飞, 周影, 等. 基于1H NMR 指纹图谱结合多变量分析的地沟油检测方法[J]. 中国科学: 化学, 2013, 43(1): 1-10.
[36] BOFFO E F, TAVARES L A, TOBIAS A C T, et al. Identif i cation of components of Brazilian honey by1H NMR and classif i cation of its botanical origin by chemometric methods[J]. LWT-Food Science and Technology, 2012, 49(1): 55-63. DOI:10.1016/j.lwt.2012.04.024.
[37] LOLLI M, BERTELLI D, PLESSI M, et al. Classif i cation of italian honeys by 2D HR-NMR[J]. Journal of Agricultural and Food Chemistry, 2008, 56(4): 1298-1304. DOI:10.1021/jf072763c.
[38] ZHENG Xin, ZHAO Yanrong, WU Huifeng, et al. Origin identif i cation and quantitative analysis of honeys by nuclear magnetic resonance and chemometric techniques[J]. Food Analytical Methods, 2016, 9(6): 1470-1479. DOI:10.1007/s12161-015-0325-1.
[39] CALIGIANI A, ACQUOTTI D, PALLA G, et al. Identif i cation and quantification of the main organic components of vinegars by high resolution1H NMR spectroscopy[J]. Analytica Chimica Acta, 2007, 585(1): 110-119. DOI:10.1016/j.aca.2006.12.016.
[40] KODA M, FURIHATA K, WEI F, et al. NMR-based metabolic profiling of rice wines by F2-selective total correlation spectra[J]. Journal of Agricultural and Food Chemistry, 2012, 60: 4818-4825. DOI:10.1021/jf3008647.
[41] 国家质量监督检验检疫总局. 果葡糖浆: GB/T 20882—2007[S].北京: 中国标准出版社, 2007.
[42] 赵蕊, 张巍, 欧阳捷, 等. 啤酒1H NMR指纹谱与模式识别分析[J].食品科学, 2008, 29(12): 564-567.
Detection of Honey Adulteration with High Fructose Syrups Using1H Nuclear Magnetic Resonance and Orthogonal Partial Least Squares
CHEN Lei, LIU Hongbing, LUO Liting
(National Center for Magnetic Resonance in Wuhan, State Key Laboratory of Magnetic Resonance and Atomic and Molecular Physics, Wuhan Institute of Physics and Mathematics, Chinese Academy of Sciences, Wuhan 430071, China)
Combination of1H nuclear magnetic resonance (1H NMR) spectroscopy and orthogonal partial least squares (OPLS) was successfully employed to detect rape honey adulteration with high fructose syrups. Three hundred and three authentic and 180 adulterated honey samples were analyzed. Glucose, sucrose and 13 minor components in honey samples were detected and identif i ed from their1H NMR spectra. The OPLS model based on NMR data was applied to detect adulteration in honey falsif i ed by intentional addition of different concentrations of high fructose syrups. A distinct discrimination between authentic and adulterated honey samples was achieved in OPLS score plot. Overall classif i cation rates of training set and testing set were 98.40% and 98.24%, respectively. Hence,1H NMR spectroscopy coupled with OPLS offered a rapid and accurate tool for honey adulteration detection. The method avoided the disadvantage of monocomponent analysis and provided a potential standard for quality control of honey.
honey; nuclear magnetic resonance (NMR); orthogonal partial least squares (OPLS); adulteration
10.7506/spkx1002-6630-201704045
TS207.3
A
1002-6630(2017)04-0275-08
陈雷, 刘红兵, 罗立廷. 氢核磁共振结合正交偏最小二乘法对油菜蜜中果葡糖浆掺假的判别分析[J]. 食品科学, 2017, 38(4): 275-282. DOI:10.7506/spkx1002-6630-201704045. http://www.spkx.net.cn
CHEN Lei, LIU Hongbing, LUO Liting. Detection of honey adulteration with high fructose syrups using1H nuclear magnetic resonance and orthogonal partial least squares[J]. Food Science, 2017, 38(4): 275-282. (in Chinese with English abstract)
10.7506/spkx1002-6630-201704045. http://www.spkx.net.cn
2016-06-15
中国科学院仪器设备功能开发技术创新项目(YG2011095)
陈雷(1977—),男,高级工程师,博士,研究方向为磁共振技术及应用。E-mail:chenlei@wipm.ac.cn
