儿茶素氧化产物及形成机制研究
2017-03-25丁阳平陆昌琪候宏晓岑远建童华荣
丁阳平+陆昌琪+候宏晓+岑远建+童华荣
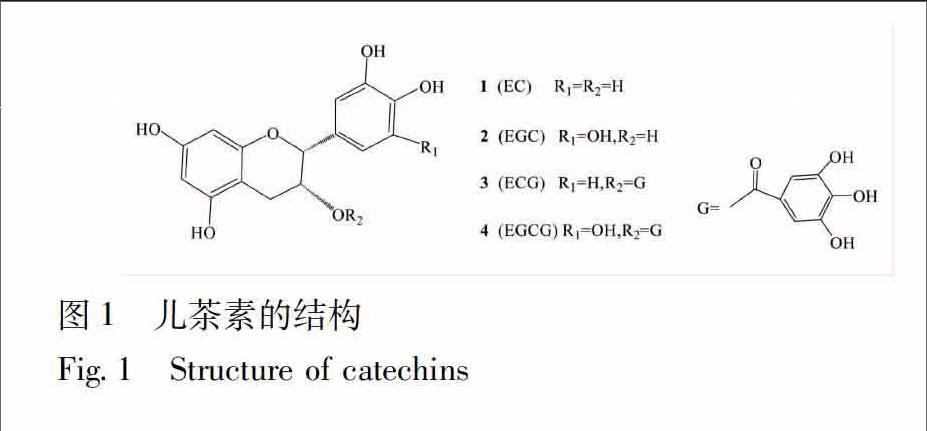

[摘要]儿茶素是茶叶核心成分,对茶叶品质影响极大。儿茶素能进一步氧化聚合形成新的红茶多酚,但其形成机制仍然不太清楚。文章综述了低分子量儿茶素氧化聚合产物及其可能的形成机制,为进一步研究茶黄素类、茶红素类乃至茶褐素类化合物及儿茶素药理作用机制奠定基础。
[关键词]儿茶素; 氧化产物; 形成机制
Progress in catechins oxidation products and their formation mechanism
DING Yangping1,2, LU Changqi1,2, HOU Hongxiao1,2, CEN Yuanjian1,2, TONG Huarong1,2*
(1 College of Food Science, Southwest University, Chongqing 400716, China;
2 Chongqing Key Laboratory of Agricultural Products Processing, Chongqing 400716, China)
[Abstract]Catechins are the key components of tea and have a great impact on its quality Catechins can be oxidized to form a new black tea polyphenols, some of which have better pharmacological effect However, the formation mechanism of these new polyphenols is still unclear In this paper, oxidation products coming from catechins and the formation mechanism of the new compounds are reviewedIt is the base of further study on theaflavins, thearubigins and theabrownines
[Key words]catechins; oxidation products; formation mechanism
植物多酚,如儿茶素、原花青素、黄酮醇等在食品、饮料及天然药物中具有多种保健作用,这些化合物在活的植物细胞中是稳定的,但一旦组织遭到破坏,它们就会通过酶促或非酶促氧化转变成新的多酚。多酚类物质易于氧化的特性在植物氧化应激防御体系中扮演重要角色,但对水果蔬菜的采后贮藏且带来不少麻烦。茶叶多酚是植物多酚的典型代表,其氧化变化及控制对茶叶品质影响很大。茶叶多酚的氧化一直是相关学者关注的焦点。早在20世纪50年代末,Roberts利用色谱技术揭示了红茶多酚及其结构特征,并用茶叶粗酶氧化儿茶素单体探讨影响发酵的因素[12]。随后Takino课题组首次成功更正了茶黄素类结构,证实它是具有苯骈卓酚酮骨架的亮红色色素[34]。此后,报道了大量茶黄素类衍生物及相关色素。
红茶多酚是一种典型的氧化多酚,是在茶叶发酵过程中由儿茶素经酶促或非酶促氧化聚合而成[57]。从儿茶素的结构可知(图1),其主要有三个反应位点,即A环上的C6和C8及B环的C6′,因此儿茶素的酶促氧化产物非常复杂,包含多种低聚物[8]。它们中的大多数已用化学、色谱及光谱方法进行了鉴定,但其真正形成机制仍不清楚,这极大地引起了天然产物化学工作者的兴趣。
1儿茶素聚合物的形成
11EC及其衍生物聚合物的形成
儿茶素酶促氧化除了能形成茶黄素以外,其二聚体产物
是另一主要代谢途径。儿茶素二聚体最早是由Roberts[1]发现,但直到10年以后,这些化合物的结构才得以陆续证实[9]。其中化合物6是最早被鉴定的儿茶素二聚体,命名为dehydrodicatechin A(脱氢儿茶素二聚体A)[10]。研究发现这一化合物是由邻苯二酚进一步氧化及羟基脱氢后形成的酮类物质(图2)。
Sang等[11]从EC辣根POD/H2O2氧化体系中分离得到3
种主要产物7~9(图3)。它们都是由一分子EC的A环和另一分子EC的B环通过单键连接而成的EC二聚体,这一结果也显示EC的A,B环都具有抗氧化作用。这类化合物的形成的机制是(图3) EC首先通过单电子转移与POD反应,随后将B环的羟基去质子化形成一对共振电子对,这些自由基会进攻另一分子EC的C8(或C6)形成化合物7,8(或9)。Takashi等用香蕉匀浆液处理EC分离得到另一种新的三聚体(10)(图4)[12]。
Kazuhiro Uchida等[13]研究发现用CuCl2·2H2O氧化 EC得到新化合物11和12,分别命名为dehydrotricatechin B1和dehydrotricatechin B2,而EC在K3Fe(CN)6/NaHCO3体系中能生成另一种新化合物13命名dehydrotricatechin A(图5),其形成机制(图6)。首先是EC在氧化剂的作用下氧化成邻醌,随后儿茶素的A环亲核加成到邻醌。
12EGCG聚合物的形成
121TheasinensinsTheasinensins(图7)是由C2C2′(B
丁阳平等:儿茶素氧化产物及形成机制研究rings)连接的典型黄烷3醇二聚体,又称双黄烷醇类物质,是红茶发酵过程中最主要的氧化产物。另外,在茶鲜叶[14]和半发酵的乌龙茶[15]中也发现了theasinensins。 Theasinensins化合物的CC单键由于受空间位阻的影响无法自由旋转,因此会产生一系列阿托异构体,这些化合物的绝對构型直到1988年才得以证实[15]。
Tanaka等[16]随后进一步研究发现theasinensins类化合物只在红茶发酵初期由相应的theasinensins醌(14a,16a)还原而成,由于该中间体醌不稳定,在色谱分离或浓缩过程中易分解,因此无法得到。为了跟踪该醌类二聚体,将揉捻叶用邻苯二胺处理后发现有theasinensins醌吩嗪衍生物(化合物20,21)生成,利用色谱分离及一系列光谱分析确定了这些衍生物的结构,间接地证实了这一醌类中间体的存在。但用相同的试剂处理市售红茶并没有得到该吩嗪衍生物,进一步证实这些二聚体醌只在红茶加工中前期出现,而在后期转化了(图8)。另外,研究发现theasinensins醌用邻苯二胺处理后生成的是具有R二苯键吩嗪衍生物20,21,随后又能被还原成具有R二苯键的theasinensin A,因此认为此二聚体间优先通过R二苯键进行连接。
为了进一步研究theasinensins的形成机制,Tanaka等[17]用梨匀浆液处理EGCG,并从中分离到另一不稳定中间体22 (dehydrotheasinensin A),戚向阳[18]将K3Fe[CN]6和NaHCO3配制成氧化剂,对EGCG进行氧化,同样得到化合物22。它是由EGCG醌的富电子C2′加成到另一分子EGCG醌的不饱和羧基上形成的二聚体,形成的可能机制route A(图9)。
化合物22为无色无定形粉末,在HPLC图谱中呈现一宽峰,这很可能是由于它存在水合醌异构体,而两者之间的
动态平衡形成了这一色谱特征,氢谱、碳谱表现出复杂的共振也表明存在这一水合醌平衡,HMBC和COSY相关性进一步证实了这一结构。另外,化合物22在加热条件下会发生氧化还原歧化反应[17],除了生成化合物theasinensins A (14)和D (18)外还有大量氧化产物生成,如化合物23(galloyl oolongtheanin)和24(图10)。由于theasinensins是主要的红茶多酚,因此研究这一转化机制对了解红茶多酚的形成至关重要[19]。Tanaka等[16]发现化合物21的歧化作用发生在茶叶发酵后期,即发酵叶加热干燥阶段,前已证实化合物14a只在前期形成,因此可以推测化合物21应该是化合物14a和theasinensins之间的过渡中间体(图8)。另外,研究表明这一歧化反应受不同处理方式的影响:在常温下用温和的还原试剂Vit C或硫醇处理化合物21很容易发生氢化作用,生成的主要是具有立体选择性的化合物theasinensin A (14);而其水溶液在加热的条件下生成的是具有S二苯键的theasinensin D和氧化产物23(galloyl oolongtheanin);在室温及中性水溶液中化合物21能同时生成还原产物14,18及氧化产物23,27[17]。
122EGCG醌二聚体Valcic课题组[20]在加热加氧的条件下用AMVN[2,2偶氮二异丁氰(2,4二甲基正丁基氰)]作为自由基引发剂氧化EGCG,分离得到一种化合物25(EGCG醌二聚体A),它是由2分子EGCG邻醌(4a)通过亲核加成反应生成含有2个具有空间位阻羧基的三环亚结构,随后通过水合作用释放空间张力并形成乙醚桥[21] (图9,路线 B)。
化合物26(EGCG醌二聚体B)和27(dehydrotheasinensin AQ)是从巯基乙醇处理过的EGCG氧化产物中分离得到的另外2个还原产物。化合物26为白色不定型粉末,其结构与EGCG醌二聚体A相似,命名为EGCG醌二聚体B,其形成机制路线C(图9)。化合物27为黄色不定型粉末,最大吸收波长为277,447 nm,可与邻苯二胺反应生成吩嗪类衍生物,证实有1,2二酮结构的存在[22]。
Tanaka等[23]用茶PPO氧化EC(形成EC醌氧化EGCG)和EGCG混合物并从中分离得到一种EGCG二聚体(28)。此化合物为棕色无定形粉末,HMBC和NOESY谱及红外数据显示存在环戊烯酮结构。其形成机制(图11)包括经过稳定性很差的EGCG邻醌异构体4b的水合作用,然后通过环缩合、脱羧、氧化及分子间环加成反应最终形成化合物28。
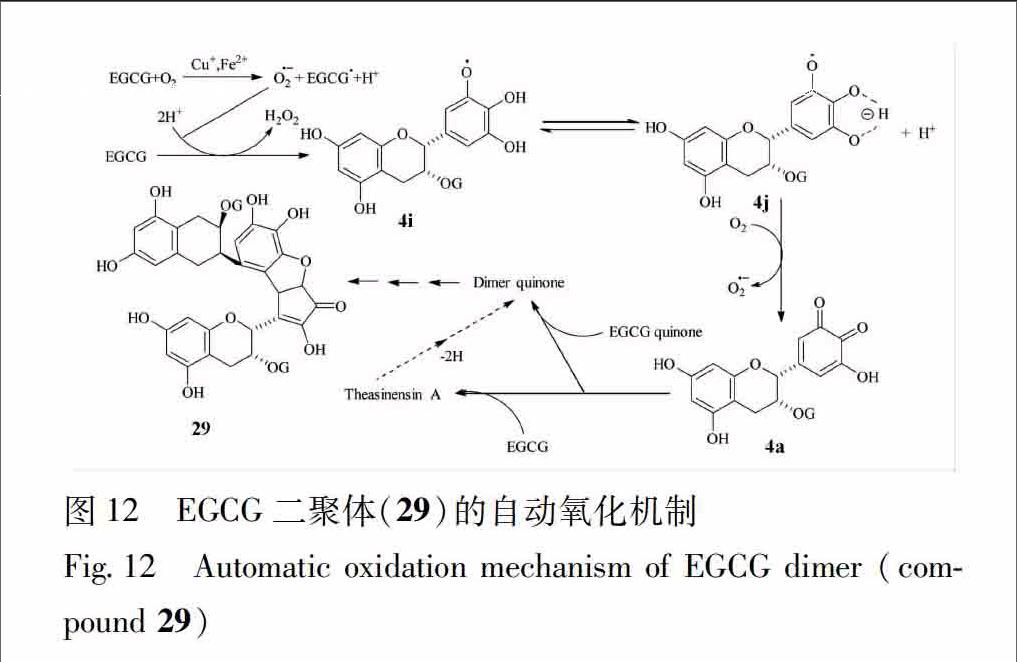
Sheng等[24]用实时质谱分析了EGCG在中性及弱碱性条件下的自动氧化产物,并发现了1个EGCG二聚体(29),其自动氧化机制(图12)。他认为首先是EGCG在Cu2+或Fe3+催化下被空气中的氧氧化形成EGCG自由基(EGCG·),EGCG·作为阴离子自由基(EGCG·-)与氧反应生成EGCG醌,而EGCG醌与另一分子EGCG反应形成EGCG二聚体theansinensin A。theansinensin A还能被另一分子EGCG醌进一步氧化形成化合物29。
123TheacitrinsTheacitrins是一类不稳定的黄色色素,具有5,7,8a三羟基环烷醇[α]茚1,6,8(3aH,3bH,8aH)三酮结构。研究表明它的生成及降解对红茶多酚的多样性起到至关重要的作用。
Powell等[2528]在研究红茶多酚自动氧化水解产物时分离得到theacitrin A(30),theacitrin B(31),theacitrin C(32)(图13)。它们是红茶中不溶于乙酸乙酯且能与咖啡因形成沉淀的一类化合物,并且比TFs,theaflavic acids亲水性更强,结构研究发现它们没有典型红茶色素的苯骈卓酚酮骨架[28]。随后Davis等[29]从脱咖啡因阿萨姆红茶的甲醇丙酮提取物中分离得到化合物30从而正式确定其结构。化合物30的形成机制(图14)[30],首先是EGCG和EGC的B环氧化分别形成自由基4k和2a,随后这2个自由基通过CC单键连接生成中间体30a,该中间体再经历分子内环化、重排和水合作用形成该化合物。
随后Davis等[29]又分离得到2个与化合物30结构相似的化合物31和32。根据HPLC,ESIMS,UVVis譜(吸收
波长277,379 nm)及化学方法推测其可能的结构式。随后,Matsuo等[31]首次从EGCG与梨匀浆液中分离并鉴定了化合物32(theacitrin C),并提出其可能的形成机制(图15),首先是EGCG B环氧化成EGCG醌,EGCG醌与另一分子EGCG 之间通过1,4加成形成CC单键,再经一系列氧化及分子内1,2加成生成二环[321]辛烷中间体,然后重排生成化合物32。该化合物不稳定,在加热条件下能生成化合物33,34(图16),其中2,5环己二烯1酮通过芳香化形成更稳定的连苯三酚是促进化合物32发生消除反应的主要原因。
随后,他们对theacitrins的降解进行了深入研究,并发现化合物30(theacitrin A)能经烯酮苯酚重排形成化合物
(图17)。Powell等[28,30]推测该类化合物(theacitrins)可能是形成TRs的先质或者是TFs進一步氧化形成TRs的中间体。
124EGCG三聚体Takashi等[22]用日本梨氧化EGCG分离得到化合物36,其为无定形白色粉末,最大吸收波长为275 nm,氢谱表明有4个芳香单质子峰及没食子酰基的2个双质子单峰,显示B环的C2通过共价键连接在D环的C2上形成了theasinensintype化合物,质谱显示为EGCG三聚体,其中theasinensin的BB′环之间二苯键的绝对构型为R。此外,用化合物theasinensins形成的类推法可知化合物36为36a的还原产物。化学还原后没有检测到theasinensin D进一步证实了这一绝对构型。生物合成的偶联过程(图18),这与化合物dehydrotheasinensin A 生物合成theasinensin A和theasinensin D的过程类似[17]。另外,在纯化过程中发现有相似色谱行为的化合物表明有化合物36的异构体存在,虽然没有分类得到,但是这一阿托异构体很可能是由GB′′环之间的二苯键构型不同形成。
化合物36的形成表明除了B环醌外,没食子酰基醌也
能通过分子间偶联形成微量聚合多酚。
13EGC及衍生物聚合物的形成
EGC有2条氧化途径:一是与EC及其酯型化合物发生缩合反应生成茶黄素类;另一是形成EGC二聚体。Tanaka课题组[12]研究发现EGC与EGCG的氧化具有很多相似之处,如EGC主要的氧化产物为类似的dehydrotheasinensin C(37,图19),同样它能进一步降解生成theasinensin C(16),theasinensin E(19),desgalloyl oolongtheanin(38)和dehydrotheasinensin E(39),除了主要产物37外,还能生成与EGCG产物类似的化合物42和43(图19)。而与EGCG氧化不同的是EGC的氧化产物中还含有少量的proepitheaflagallin(40,存在2种同分异构体40a和40b),40a脱羧后形成41(proepitheaflagallin,同名)(图19)[16,32],40b脱羧后经dienonephenol重排形成hydroxytheaflavin(见23 theaflagallin)。最近Yosuke Matsuo用未成熟的橘子匀浆液氧化连苯三酚型儿茶素得到1个新化合物44,并用COSY, HSQC和HMBC对化合物desgalloyl oolongtheanin(38)的结构进行了修正(图20化合物38a)[33]。
Tanaka等首次分离得到化合物39[34],可以推测出化合物39(dehydrotheasinsin E)是EGC通过分子间加成形成的具有S二苯键的化合物。
研究发现EGC醌的反应具有高度立体选择性,生成的二聚体构型与C2的构型及C2和C3之间的相对构型有关,如EGC的主要氧化产物是dehydrotheasinensin C(37)(图19),而GC的氧化产物以化合物46为主(图21)。另外在相同的氧化条件下,GC减少的速度明显比EGC慢,说明酶优先氧化的是EGC而不是GC,显示酶的专一性与底物的立体化学结构有关。随后对GC的一对对映体45a[2R,3S(+)GC]和45b[2S,3R (-)GC](图22)进行研究发现酶对两者没有差异,可能的原因是酶只将儿茶素B环氧化成邻醌,而随后的聚合反应是非酶促作用。醌二聚体46(为31的同分异构体)是proepitheaflagallin(40b)脱羧后的同分异构体,已证明它也是epitheaflagallin(66)的先质[35]。
2茶黄素类及其衍生物的形成
21Theaflavins(TFs)
茶黄素及其单酯或双酯衍生物是儿茶素氧化的另一主要产物[4,3637]。茶黄素类是一类具有3′,4′二羟基苯骈卓酚酮骨架的多酚类化合物,它是由邻苯二酚型儿茶素B环和连苯三酚型儿茶素B环缩合而成,其中连苯三酚型儿茶素B环最终形成茶黄素类七元环骨架,邻苯二酚型儿茶素B环保持不变。早在20世纪60年代Takino等[36]就提出了这一骨架的可能形成机制(图23),认为首先是儿茶素被氧化形成邻醌,然后通过分子间醇醛缩合反应生成中间体TFsa,再经分子内醇醛缩合反应形成三环二酮中间体TFsb,此中间体经历苄基酸型重排(benzylic acidtype rearrangement)、脱羧后生成苯骈卓酚酮结构。
1998年Haslam等[38]提出了苯骈卓酚酮形成的另一可能机制(图24)。这一机制涉及到儿茶素B环之间通过分子间自组装成具有区域选择性的氢醌型ππ复合体,最后脱羧生成苯骈卓酚酮结构。而第3种形成机制则认为(图25)多酚氧化酶首先将EC氧化成EC醌,然后缺电子的EC醌进攻富电子的连苯三酚型B环,后经氧化、脱羧最终形成茶黄素类化合物[36,38]。3种机制同时认为二环[3,2,1] 辛稀中间体TFse可能是形成茶黄素类化合物的关键。近来,Yanase等[3940]成功地分离到这一二环辛烯中间体,并认为这一中间体经水化、氧化及脱羧后生成茶黄素类(图26)。
Collier等从茶叶中分离得到该类茶黄素的2种同分异构体52和54(图27)[37,41],它们是由于先质儿茶素的差向
异构体形成的茶黄素类非对映异构体,命名为isotheaflavins或neotheaflavins。Davis等和Lewis等[4243]随后分别从红茶中分离得到另外2种茶黄素类同分异构体53(isotheaflavin3′Ogallate)和55(neotheaflavin3Ogallate)(图27),并且通过化学氧化ECG与GC及C与EGCG分别合成了化合物53和55,从而证实了它们的绝对构型。此外,Nishimura等[44]从红茶醇水溶液中分离鉴定了2种甲基化茶黄素类56[TF3O(3OMe)G]和57 [TF3O(3OMe)G3′G](图27)。最近Huadong Chen等[45]用LC/ESIMS/MS还发现红茶中存在茶黄素三没食子酸酯及茶黃素3,3′,5,5′四没食子酸酯(图28)。
另外,研究发现除了茶叶PPO外,其他植物如枇杷叶、日本梨、苹果和香蕉等PPO同样能将EC和EGC氧化成该类茶黄素类化合物,推测其形成机制与茶叶发酵相似[12]。
22Theaflavates
研究表明与儿茶素B环相比,没食子酸衍生物中连苯三酚的活性较低,但儿茶素B环也能与没食子酸衍生物之间发生氧化偶联,如,ECG单独进行酶促氧化时一分子ECG中的没食子酰基能与另一分子ECG B环进行分子间偶合反应生成具有苯骈卓酚酮结构的氧化聚合产物。这种通过酯型儿茶素D环与邻苯二酚型儿茶素B环氧化偶联形成的茶黄素类衍生物命名为theaflavates(图29)。
Wan等[46]用NaHCO3/Fe(CN)6体系氧化ECG分离得到1种ECG二聚体theaflavate A(61)。随后Lewis等[43]首次从红茶中分离得到另一类似化合物62,命名为theaflavate B。Sang等[47]在山葵POD/H2O2体系中通过儿茶素两两反应分离得到18个苯骈卓酚酮类衍生物,其中首次发现了化合物64(neotheaflavate B)。Kusano等[48]用日本梨作为酶源氧化ECG分离得到2种同类型ECG三聚体及四聚体化合物theaflavate C(63)和bistheaflavate A(65)。
23Theaflagallins
Takino等[49]发现在氧存在的条件下,漆酶能将没食子酸和EGC(或EGCG)转变成茶黄素类衍生物(66和67,图30)。Takashi等[22]用梨作为酶源氧化EGCG也分离得到化合物67。这类化合物具有1′,2′,3′三羟基3,4苯骈卓酚酮结构,是由2分子连苯三酚环缩合而成,命名为(epi)theaflagallins[1,3536,50]。随后Nonaka等[35]从红茶中分离得到化合
物66的差向异构体68(图31),这类化合物的形成机制(图32)。首先在PPO作用下没食子酸和EGC(或EGCG)的B环被氧化成醌类中间体[51],随后醌中间体进行Michael加成及跨环羧基加成,最后脱羧形成。
如前所述Matsuo等[52]用EGC作为底物分离得到化合物40b,该化合物不稳定除能脱羧生成化合物41外,
在加热的条件下1,4环己二烯还能发生二烯酮苯酚重排生成化合物69(hydroxytheaflavins),同时也能发生消除反应生成化合物66(epitheaflagallin)(图33)。并且发现[53]化合物66只来源于EGC。随后,他们[54]又成功分离得到化合物40的前体化合物proepitheaflagallin B(40c)(图33)。在形成过程中首先是EGC和EGC醌之间通过1,2加生成中间体40d,来源于EGC的B环继续氧化成40e,40e随后通过分子内1,2加成(EGCG B环的C2′和C4′羧基)形成二环
[321]辛烯中间体40f,随后来源于EGC醌C环C3的羟基与EGC B环C3的羰基之间形成半缩醛生成化合物40c。
24Theaflavic acids
Coxon等[55]通过化学方法合成并表征了theaflavic acid(72)和epitheaflavic acid(73)(图34),这是邻苯二酚型儿茶素B环与没食子酸形成的氧化聚合产物。紧接着Berkowitz等[5657]又从EGC茶叶粗酶氧化产物中分离得到另一化合物74(epitheaflavic acid3′gallate)。
25多苯骈卓酚酮型茶黄素类衍生物
由于2分子儿茶素B环及没食子酸衍生物与1分子儿茶素B环之间都能形成苯骈卓酚酮骨架,因此从理论上就可能存在多苯骈卓酚酮型茶黄素类衍生物。Sang等[58]研究发现酯型茶黄素的没食子酰基与EGCG(或EGC)的B环具有同样的活性,能进一步与EC反应形成二苯骈卓酚酮型茶黄素类76 (theadibenzotropolone A) (图35),其形成机制(图36)。另外TF3G还能与C反应生成相应的同分异构体77(theadibenzotropolone B),并且研究发现红茶中化合物76的含量(220 μg·kg-1)是77(70 μg·kg-1)的3倍,其可能的原因是EC(48 mV at pH 135)的氧化还原电位值要远低于C(79 mV,pH 135),因此EC更容易发生氧化反应[59]。另外neotheaflavin3Ogallate(55)也能与EC反应生成78 (theadibenzotroplone C),但是不能与C反应得到化合物79。而TF3,3′dG与EC反应得到的是三苯骈卓酚酮型化合物80(theatribenzotropolone A),而不是预测的2个二苯骈卓酚酮型衍生物,说明1分子TF3,3′dG与2分子EC进行反应(图35)。研究发现多苯骈卓酚酮结构的形成机制与茶黄素类和theaflavates的形成相似[43,46]。
3展望
研究發现儿茶素化合物具有多种药理功能,如可以通过调节相关酶的活性来抑制癌细胞增殖,诱导癌细胞凋亡,但不同儿茶素单体间存在明显差异[6061]。Frei等[62]发现,EGCG可通过清除ROS,NO或与ROS反应生成稳定化合物的方式来有效平衡人体内的自由基,从而达到抗氧化目的。Nakanishi T[63],Nance C[64]等研究证明,儿茶素还具有抗炎症、抗菌、抗病毒的效用。另外,儿茶素在预防心脑血管疾病[65]及保护肾脏、肝脏、神经系统等方面也都具有良好效果[66]。但由于儿茶素化合物稳定性差,因此它们在这些治疗或预防作用中到底发挥多大作用并不清楚,另外,Wei[67]及本课题组的研究发现经氧化处理后的EGCG对某些癌细胞株的抑制作用更强,因此推测儿茶素化合物氧化产物及氧化产物形成过程中产生的不稳定中间体也可能发挥着重要作用,如醌、半醌等[68]。因此研究儿茶素氧化产物及形成机制对探讨儿茶素类化合物的药理作用机制提供重要信息。儿茶素类氧化产物的形成过程复杂,且大多数中间体不稳定,因此如何对众多不稳定化合物实现瞬间鉴定或用化学及物理方法“固定”这些不稳定中间体都是未来机制研究的重要方向。随着先进的色谱、波谱及其它鉴定技术的发展,将会获得更多新化合物的结构及形成过程信息,这为将来研究儿茶素类的药理机制及定点开发具有某些特定生理活性化合物奠定基础。
[参考文献]
[1]Roberts E A H,Myers M M The phenolic substances of manufactured tea. Ⅳ. —Enzymic oxidations of individual substrates[J]. J Sci Food Agr, 1959,10(3):167
[2]Roberts M S A study of neutral hydrogen in IC 10[J] Astron J, 1962, 67:431
[3]Takino Y, Imaga H, Horikawa H,et al Studies on the mechanism of the oxidation of tea leaf catechins Part Ⅲ Formation of a reddish orange pigment and its spectral relationship to some benzotropolone derivatives[J] Agr Biol Chem, 1964, 28(1): 64
[4]Takino Y A, Ferretti V, Flanagan M, et al The structure of theaflavin, a polyphenol of black tea[J] Tetrahedron Lett, 1965, 6(45):4019
[5]Haslam E Thoughts on thearubigins[J]Phytochemistry, 2003, 64(1):61
[6]Tanaka T, Matsuo Y, Kouno I Chemistry of secondary polyphenols produced during processing of tea and selected foods[J]Int J Mol Sci, 2010, 11(1):14
[7]Drynan J W, Clifford M N, Obuchowicz J, et al The chemistry of low molecular weight black tea polyphenols[J] Nat Prod Rep, 2010,27: 417
[8]LopezSerrano M, Ros Barcelo A Reversedphase and sizeexclusion chromatography as useful tools in the resolution of peroxidasemediated (+)catechin oxidation products[J] J Chromatogr A, 2001, 919: 267
[9]Ferretti A, Flanagan V P, Bondarovich H A, et al The chemistry of tea, structures of compounds A and B of roberts and reactions of some model compounds[J] J Agric Food Chem, 1968,16: 759
[10]Weinges K, Ebert W, Huthwelker D, et al Oxidative coupling of phenols4A Structure and mechanism of the formation of dehydrodicatechin A[J] Justus Liebigs Ann Chem, 1969, 726: 114
[11]Sang S M, Tian S Y, Jhoo J W, et al Chemical studies of the antioxidant mechanism of tea catechins: radical reaction products of epicatechin with peroxyl radicals[J] Bioorg Med Chem, 2003, 11: 3371
[12]Tanaka T, Mine C, Inoue K, et al Synthesis of theaflavin from epicatechin and epigallocatechin by plant homogenates and role of epicatechin quinone in the synthesis and degradation of theaflavin[J] J Agric Food Chem, 2002, 50: 2142
[13]Kazuhiro Uchida, Kazuki Ogawa, Emiko Yanase Structure determination of novel oxidation products from epicatechin: thearubigin[thi′Λbldn]like molecules[J] Molecules, 2016, 21(3):1
[14]Nonaka G I, Kawahara O, Nishioka I Tannins and related compounds ⅩⅤ A new class of dimeric flavan3ol gallates, theasinensins A and B, and proanthocyanidin gallates from green tea leaf[J]Chem Pharm Bull,1983, 31(11): 3906
[15]Hashimoto F, Nonaka G, Nishioka I Tannins and related compounds LⅩⅨ Isolation and structure elucidation of B,Blinked bisfalvanoids, theasinensins DG and oolongtheanin from oolong tea (2) [J] Chem Pharm Bull, 1988,36: 1676
[16]Tanaka T, Mine C, Watarumi S, et al Accumulation of epigallocatechin quinone dimers during tea fermentation and formation of theasinensins[J]J Nat Prod, 2002,65: 1582
[17]Tanaka T, Watarumi S, Matsuo Y, et alProduction of theasinensins A and D, epigallocatechin gallate dimers of black tea, by oxidationreduction dismutation of dehydrotheasinensin A[J] Tetrahedron, 2003, 59: 7939
[18]戚向陽EGCG氧化产物制备新技术及结果鉴定[J]中国食品学报, 2010,10:122
[19]Hashimoto F, Nonaka G, Nishioka I Tannins and related compounds CⅩⅣ Structures of novel fermentation products,theogallinin, theaflavonin and desgalloyl theaflavonin from black tea, and changes of tea leaf polyphenols during fermentation[J].Chem Pharm Bull, 1992, 40: 1383
[20]Valcic A, Muders A, Jacobsen N E, et al Antioxidant chemistry of green tea catechinsIdentification of products of the reaction of (-)epigallocatechin gallate with peroxyl radicals[J] Chem Res Toxicol, 1999, 12: 382
[21]Tanaka T, Mine C, Kouno I Structures of two new oxidation products of green tea polyphenols generated by model tea fermentation[J]Tetrahedron, 2002, 58: 8851
[22]Tanaka T, Matsuo Y, Kouno I A novel black tea pigment and two new oxidation products of epigallocatechin3Ogallate[J] J Agric Food Chem, 2005, 53: 7571
[23]Tanaka T, Mine C, Kouno I Structures of two new oxidation products of green tea polyphenols generated by model tea fermentation[J] Tetrahedron, 2002, 58: 8851
[24]Sang S M, Yang B B, Ho C T, et al Autoxidative quinone formation in vitro and metabolite formation in vivo from tea polyphenol (-)epigallocatechin3gallate: studied by realtime mass spectrometry combined with tandem mass ion mapping[J] Free Radical Biol Med, 2007,43 : 362
[25]Powell C The polyphenolic pigments of black tea[M] Guildford: University of Surrey, 1994
[26]Matsuo Y,Keita O,Hitomi M,et alStereochemistry of the black tea pigments theacitrins A and C[J]J Nat Prod, 2016,79:189
[27]Kuhernet N,Clifford M N,Mueller AOxidative cascade reactions yielding polyhydroxytheaflavins and theacitrins in the formation of black tea thearubigins:evidence by tandem LCMS[J]Food Funct, 2010(1):180
[28]Bailey R G, Nursten H E, McDowell I Isolation and analysis of a polymeric thearubigin fraction from tea[J]J Sci Food Agric,1992, 59: 365
[29]Davis A L, Lewis J R, Cai Y, et al A polyphenolic pigment from black tea[J] Phytochemistry,1997, 46: 1397
[30]Powell C, Clifford M N, Opie S C, et al Tea cream formation: the contribution of black tea phenolic pigments determined by HPLC[J]J Sci Food Agric, 1993, 63: 77
[31]Matsuo Y, Li Y, Watarumi S, et al Production and degradation mechanism of theacitrin C, a black tea pigment derived from epigallocatechin3Ogallate via a bicyclo[321]octanetype intermediate[J] Tetrahedron, 2011,67: 2051
[32]Tanaka T, Watarumi S, Matsuo Y, et al A new mechanism for oxidation of epigallocatechin and production of benzotropolone pigments[J]Tetrahedron, 2006,62: 4774
[33]Yosuke Matsuo, Fumiya Tadakuma, Takuya Shii, et al Selective oxidation of pyrogalloltype catechins with unripe fruit homogenate of Citrus unshiu and structural revision of oolongtheanins[J] Tetrahedron, 2015, 71, 2540
[34]Tanaka T, Inoue K, Betsumiya Y, et al Two types of oxidative dimerization of the black tea polyphenol theaflavin[J] J Agric Food Chem, 2001,49: 5785
[35]Nonaka G, Hashimoto F, Nishioka I Tannins and related compounds ⅩⅩⅩⅥ Isolation and structures of theaflagallins, new red pigments from black tea[J] Chem Pharm Bull, 1986,34: 61
[36]Takino Y, Imagawa H, Horikawa H, et al Studies on the mechanism of the oxidation of tea leaf catechins Part Ⅶ Formation of a reddish orange pigment and its spectral relationship to some benzotropolone derivatives[J] Agric Biol Chem, 1964, 28: 64
[37]Collier P D, Bryce T, Mallows R, et al The theaflavins of black tea[J] Tetrahedron 1973, 29(1): 125
[38]Haslam E Polyphenol complexation[J] AMER Chem Soc,1991, 202:1
[39]Yanase E, Sawaki K, Nakatsuka S The isolation of a bicyclo[321]intermediate during formation of benzotropolones, a common nucleus found in black tea pigments: theaflavins[J] Syn Lett 2005:2661
[40]Matsuo Y,Tanaka T,Kouno IProduction mechanism of proepitheaflagallin,a precursor of benzotropolonetype black tea pigment,derived from epigallocatechin via a bicyclo[321]oatanetype intermediate[J]Tetrahedron Lett, 2009:1348
[41]Willson K C, Clifford M NTea: cultivation to consumption [M]. London: Chapman & Hall,1992
[42]Davis A L, Cai Y, Davies A P, et al 1H and 13CNMR assignments of some green tea polyphenols[J] Reson Chem, 1996, 34: 887
[43]Lewis J R, Davis A L, Cai Y, et al Theaflavate B, isotheaflavin3′Ogallate and neotheaflavin3Ogallate: there polyphenolic pigments from black tea [J] Phytochemistry, 1998,49(8): 2511
[44]Nishimura M, Ishiyama K, Watanabe A, et al Determination of theaflavins including methylated theaflavins in black ea leaves by solidphase extraction and HPLC analysis[J]J Agric Food Chem, 2007, 55: 7252
[45]Chen H D, Shurlknight K, Leung T C, et al Structural identification of theaflavin trigallate and tetragallate from black tea using liquid chromatography/electrospray ionization tandem mass spectrometry[J] J Agric Food Chem, 2012, 60:10850
[46]Wan X, Nursten H E, Cai Y, et al A new type of tea pigmentfrom the chemical oxidation of epicatechin gallate and isolated from tea[J] J Sci Food Agric, 1997, 74: 401
[47]Sang S M, Lambert J D, Tian S Y, et al Enzymatic synthesis of tea theaflavin derivatives and their antiinflammatory and cytotoxic activities[J] Bioorgan Med Chem, 2004, 12: 459
[48]Kusano R, Tanaka T, Matsuo Y, et al Structures of epicatechin gallate trimer and tetramer produced by enzymatic oxidation[J] Chem Pharm Bull, 2007, 55: 768
[49]Takino Y, Imagawa H Studies on the mecha nism of the oxidation of tea leaf catechins[J] Biolsic Biotechnol Biochem, 1964, 28: 125
[50]Takino Y,Ferretti A, Flanagan V, et al Spectral evidence for structure of 3 flavanotropolones related to theaflavin an orangered pigment of black tea[J]Can J Chem, 1967, 45:1949
[51]Takino Y, Imagawa H, Aoki Y, et al Studies on the mechanism of the oxidation of tea leaf catechins—formation of the reddish orange pigment and its spectral relationship to some benztropine[J]. Agric Biol Chem, 1964, 27: 562
[52]Trost B M, Fleming I Comprehensive organic synthesis[M] London: Oxford, 1991
[53]Matsuo Y, Tanaka T, Kouno I A new mechanism for oxidation of epigallocatechin and production of benzotropolone pigments[J] Tetrahedron, 2006, 62(22):4774
[54]Matsuo Y, Tanaka T, Kouno I Production mechanism of proepitheaflagallin, a precursor of benzotropolonetype black tea pigment, derived from epigallocatechin via a bicyclo[321]octanetype intermediate[J] Tetrahedron Lett, 2009,50:348
[55]Owada E,Mieno MSynthetic studies of flavonoid compounds 2Improved synthesis of tricin[J]Nippon kagaku zasshi,1970,91: 1002
[56]Co H,Sanderson G W A new extraction method for determining 2thiobarbituric acid values of pork and beef during storage[J] J Food Sci, 1970, 35:160
[57]Berkowitz J E, Coggon P, Sanderson G W Formation of epitheaflavic acid and its transformation to thearubigins during tea fermentation[J]Phytochemistry,1971, 10: 2271
[58]Sang S M, Tian S Y, Meng X F, et al Theadibenzotropolone A, a new ype pigment from enzymatic oxidation of (-)epicatechin and (-)epigallocatechin gallate and haracterized from black tea using LC/MS/MS [J] Etrahedron Lett, 2002, 43:129
[59]Steenken S, Neta P J Oneelectron redox potentials of phenols Hydroxy and aminophenols and related compounds of biological interest[J] J Phys Chem, 1982, 86:3661
[60]Rathor K, Choudhary M, Odoi A Green tea catechin intervention of reactive oxygen speciesmediated ERK pathway activation and chronically induced breast cell carcinogenesis[J] Carcinogenesis, 2012,33: 174
[61]Kuzuhara T, Suganuma M, Fujiki H Green tea catechin as a chemical chaperone in cancer prevention[J] Cancer Lett, 2008,261: 12
[62]Frei B, Higdon J V Antioxidant activity of tea polyphenols in vivo: evidence from animal studies[J] J Nutr, 2003,133:3275
[63]Nakanishi T, Mukai K, Yumoto H Antiinflammatory effect of catechin on cultured human dental pulp cells affected by bacteriaderived factors[J] Eur J Oral Sci, 2010,118: 145
[64]Nance C L, Siwak E B, Shearer W T Precinical development of the green tea catechin,epigallocatechin gallate,as an HIV 1 therapy[J] J Allergy Clin Immunol, 2009,123: 459
[65]刘珊丽, 刘宗文, 卢沛琦, 等儿茶素对大鼠脑缺血/再灌注损伤的保护作用及机制[J] 中国药理学通报, 2010,26(2): 255
[66]徐先祥 儿茶素的药理作用研究综述[J] 郑州轻工业学院学报, 2012(27):60
[67]Wei Yaqing, Chen Pingping, Ling Tiejun, et al Certain (-)epigallocatechin3gallate (EGCG) autooxidation products (EAOPs) retain the cytotoxic activities of EGCG[J] Food Chem, 2016, 204: 218
[68]Long L H, Hoi A, Halliwell B Instability of, and generation of hydrogen peroxide by, phenolic cell culture media[J] Arch Biochem Biophys, 2010, 501: 162
[责任编辑丁广治]
[收稿日期]20160928
[基金項目]重庆市自然科学基金项目(cstc2014jcyjA80024) ; 西南大学基本科研业务费专项资金项目(XDJK2014C159) ; 西南大学博士基金项目(SWU111040); 重庆市特色食品工程技术研究中心能力提升项目(cstc2014ptgc8001)
[通信作者]*童华荣, 教授, 研究方向为天然产物化学, Email: barry4784088@126com
[作者简介]丁阳平, 讲师,研究方向为天然产物化学, Email: dingyangping@swueducn
