低剂量CoCl2预处理降低耳蜗毛细胞和螺旋神经元的顺铂毒性
2017-03-24李浩楠王东霞王泺璎范东艳王苹于姝媛
李浩楠 王东霞 王泺璎 范东艳 王苹 于姝媛
顺铂(cisplatin)作为一种高效的化疗药物广泛用于多种肿瘤疾病的治疗,如生殖细胞瘤、卵巢癌、睾丸癌、子宫内膜癌、肺癌、鼻咽癌[1]。然而它的副作用如耳毒性、肾毒性、神经毒性极大地限制了临床应用,顺铂的耳毒性表现在导致耳蜗毛细胞的缺失、血管纹的退化以及螺旋神经元细胞数量的减少。据统计有93%接受顺铂化疗的患者会引发感音神经性聋[2],目前对于顺铂的耳毒性尚无有效的治疗方法。
对于顺铂的耳毒性机制,在体外实验和体内实验均证明毛细胞的死亡是由于顺铂通过引发细胞凋亡的内在途径所导致的,细胞凋亡的内在途径涉及线粒体的损伤,损伤的线粒体释放出的细胞色素C可激活Caspase 9和Caspase 3。其中Caspase 3被认为是细胞凋亡效具体执行者之一,是细胞凋亡过程中最主要的终末剪切酶,它能够水解特定的蛋白底物进而导致细胞死亡。顺铂治疗后耳蜗内氧化应激产生的活性氧(reactive oxygen species,ROS)被认为是导致耳蜗细胞凋亡的主要诱因。顺铂治疗后,机体内的氧化与抗氧化平衡状态被打破,氧化应激增强,导致细胞内活性氧水平升高,而过氧化氢酶、超氧化物歧化酶等抗氧化酶活性降低,而且耳蜗又是一个相对封闭的系统,不能及时清理其内形成的ROS,使得ROS大量积聚,损伤脂质、蛋白质和核酸,进而促进炎症因子的表达[3]。
NF-kB是一个氧化还原敏感的转录因子,涉及ROS信号应答,参与多种细胞中的应激诱导的凋亡[4]。已有研究证明HIF1与肿瘤细胞的增殖和凋亡的调控有关,但是对它在凋亡中发挥的作用还有一定的争议[5]。氯化钴(CoCl2)作为一种可以模拟缺氧的化学物质可使HIF-1α蛋白稳定性增加,以促进HIF-1α的转录活性,从而为常氧条件下研究HIF-1α在顺铂听功能损伤中的内源性保护作用机制提供条件。本研究拟观察氯化钴对顺铂耳毒性的保护作用,并初步探讨其机制,试图找到一种治疗顺铂耳毒性的方法。
1 材料与方法
1.1 材料
动物:36只购于吉林大学实验动物中心出生4天Wistar大鼠(动物合格证号:SCXK-(吉)2007-0003)。实验设计已获得吉林大学第一医院伦理委员会批准,实验过程严格遵守实验动物管理条例。
试剂:培养皿,DMEM/F12培养基和胎牛血清购自美国Invitrogen公司,氯化钴、NF-200和TRITC-标记phalloidin购自美国Sigma-Aldrich公司,Caspase3、NF-κB和HIF-1α抗体购自碧云天生物技术研究所,Alexa Fluor 555羊抗鼠IgG抗体为Molecular Probe产品。
1.2 实验方法
1.2.1 耳蜗基底膜培养 在直径为35 mm的培养皿中加入完全培养基(1:1DMEM/F12+5%FBS+1%青霉素)500 μl,室温放置30 min;在无菌条件下将大鼠断头取出听泡,于显微镜下去除螺旋韧带分离耳蜗基底膜。将基底膜平铺在预先加入培养基的培养皿底部;3小时后向培养皿中补充1500 μl完全培养基;37℃,5%CO2,饱和湿度培养。
1.2.2 实验设计 将36只Wistar大鼠随机均分为4组:对照组、CoCl2处理组、顺铂处理组、CoCl2预处理加顺铂组。对照组加入1500 μl完全培养基培养24 h;CoCl2处理组加入1500 μlCoCl2浓度为100μM的完全培养基培养6 h后更换为1500 μl完全培养基继续培养18 h;顺铂处理组加入1500 μl顺铂浓度为200 μM的完全培养基培养24 h;CoCl2预处理加顺铂组加入1500 μlCoCl2浓度为100 μM的完全培养基培养6 h后更换为1500 μl顺铂浓度为200 μM的完全培养基继续培养18 h。各组耳蜗基底膜均培养24 h后弃去原有培养基并用4%多聚甲醛溶液常温固定1 h。
1.2.3 毛细胞染色观察计数 弃去固定液,用(phosphate buffer solution,PBS)清洗3遍后加入2%的Triton X-100处理20 min;加入(tetram ethylrhodam ineisothio-cyanate,TRITC)标记的phalloidin溶液(1:200稀释),常温染色20 min;甘油封片,激光共聚焦显微镜观察,照相。分别统计在耳蜗基底膜的中回100 μm长度范围的内外毛细胞存活数目,每个特定区域计数3个长度范围,取平均值。
1.2.4 螺旋神经元免疫荧光染色 弃去固定液,用PBS清洗3遍后加入2% Triton X-100处理20 min;PBS清洗后加入5%羊血清封闭1 h;滴加一抗(mouse anti-NF200,1:400稀释),4℃孵育过夜,用PBS清洗3遍;加入二抗(Alexa Fluor 555羊抗鼠IgG,1:400稀释),室温避光孵育1h,PBS洗3遍;甘油封片,激光共聚焦荧光显微镜下观察。分别在耳蜗基底膜的中回计数100*80 μm区域计数螺旋神经元细胞存活数目,每条基底膜计数3个区域,取平均值。
1.2.5 蛋白质印迹 为了探讨顺铂导致毛细胞死亡的分子机制,以及预先CoCl2处理保护的信号转导途径,本研究采用蛋白质印记(weatern blot)的方法分析HIF1α/NF-κB信号转导途径和细胞凋亡因子Caspase 3的表达变化。终止培养时收集耳蜗基底膜,加入细胞裂解液,超声破碎细胞,于低温离心机内(4℃,12000 rpm)离心15 min,取上清,采用二辛可宁酸法(bicinchoninicacid,BCA)进行蛋白定量,每孔上样30 μg/20 μl总蛋白,样品与5×上样缓冲液混匀后95℃ 5 min变性。上样于10 %的SDS-PAGE,120 V电泳2.5 h,电转移1.5 h,将凝胶上的蛋白带至聚偏氟乙烯膜(polyvinylidene fluoride,PVDF)膜上,取出转移后的PVDF膜用5%脱脂牛奶封闭2 h,加入一抗(HIF1a,1:500稀释,NF-kB,1:1000稀释,Caspase 3,1:1000稀释,actin,1:5000稀释),4℃孵育过夜,孵育后用TBST缓冲液洗膜3次,每次15 min,加入二抗,稀释浓度为1:2000,孵育1 h后,TBST(trisbuffered saline with tween)洗膜3次,然后加入ECL(electrochemical luminescence)化学发光底物,化学发光检测仪检测蛋白表达。以actin作为内参照,使用Image J软件对图像中条带的灰度值进行相对定量分析。
1.2.6 统计学分析 采用SPSS 18.0统计软件对所有数据进行分析,计量资料采用均数±标准差(x±s)表示,计数资料用例数(%)表示,组间比较采用X2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 大鼠耳蜗毛细胞染色观察
TRITC标记的phalloidin染色毛细胞,共聚焦显微镜下对照组耳蜗毛细胞呈红色荧光,3排外毛细胞和1排内毛细胞排列整齐,纤毛结构清晰。CoCl2处理组未见毛细胞出现结构改变和数目缺失。顺铂处理组毛细胞纤毛出现结构紊乱缺失,从底回至顶回递次严重,顶回未见明显缺失。CoCl2预处理加顺铂组毛细胞缺失现象明显减轻。计数中回存活的毛细胞,见图1。正常组为42.66±0.57(outerhaircell,OHC),11.66±0.58(inner hair cell.IHC),顺铂组为12.33±1.58(OHC),1.67±0.57(IHC)。内毛细胞损伤尤为严重,明显高于正常组和CoCl2作用组,P=4.702*10-6,P=3.413*10-6<0.01。CoCl2预处理加顺铂组中回毛细胞存活数目为34.00±2.00(OHC),4.00±1.00(IHC),明显高于顺铂处理组(OHC,P=0.000,IHC,P=0.025),氯化钴预处理加顺铂保护组毛细胞存活数目是顺铂处理组的2.81倍。
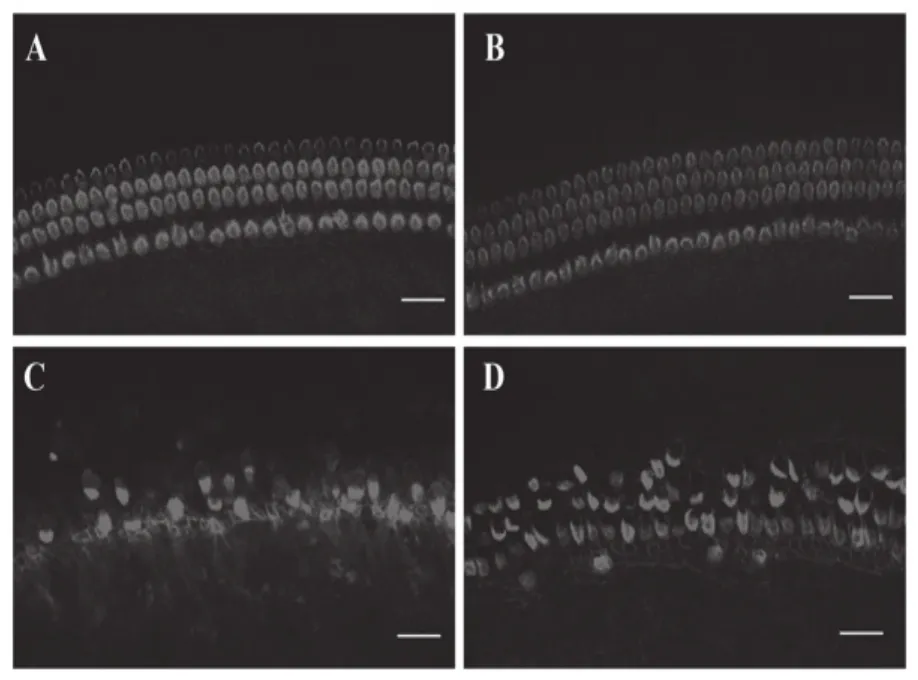
图1 毛细胞染色结果(中回,*800)
2.2 大鼠耳蜗螺旋神经元免疫荧光染色结果
采用NF-200抗体标记离体培养的耳蜗放射状神经纤维和神经元。如图2所示,对照组耳蜗神经元核浆清晰,神经纤维光滑成束,可见内毛细胞与神经纤维末梢接触紧密。顺铂组神经纤维明显变细,出现凋亡小结,神经元变小,且细胞核不清晰,神经纤维末梢水肿膨大,与内毛细胞缝隙增大。CoCl2处理组未见明显形态学改变。CoCl2预处理加顺铂组耳蜗神经元形态学明显好于顺铂处理组。计数单位面积中SGNs的存活数量,结果显示为对照组、CoCl2预处理加顺铂组、顺铂处理组的耳蜗神经元单位面积里的神经元数目分别为77.3±6.08、48.67±3.67、34.67±3.57。表明低剂量氯化钴预处理组存活神经元数目为单纯顺铂组的1.40倍,P=0.009,有统计学意义。
2.3 蛋白印迹实验结果
结果如图3所示,CoCl2处理组HIF1α蛋白表达明显高于对照组3.6倍(P=0.000),顺铂处理组与对照组未见明显差异。NF-κB在CoCl2作用后增加1.5倍(P=0.072),在CoCl2预处理加顺铂组增加2.05倍,顺铂处理组增加1.6倍。Caspase 3表达在CoCl2预处理加顺铂组比对照组高2.5倍,顺铂处理组最高且是对照组的3.91倍(P=0.001)。CoCl2预处理加顺铂组的Caspase 3表达明显低于顺铂处理组(P=0.009)。
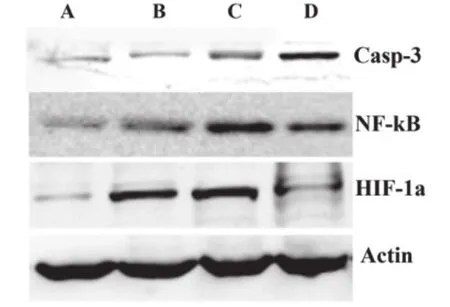
图3 各组HIF-1α、NF-kB、Caspase 3蛋白表达
3 讨论
顺铂由于其抗肿瘤的高效性广泛应用于临床抗肿瘤治疗,然而由于顺铂的毒副作用,使其临床应用受限。顺铂对于听功能损伤的具体机制目前尚未完全阐明,有研究[6]表明顺铂治疗后耳蜗内氧化应激产生的活性氧(ROS)被认为是导致耳蜗细胞凋亡的主要诱因。
本研究使用顺铂作用于离体培养的耳蜗基底膜,可见毛细胞和螺旋神经元的重度损伤和数目的减少。使用氯化钴预处理后加顺铂组,观察到毛细胞和螺旋神经元虽较于正常组有所损伤,但是毛细胞与螺旋神经元细胞状态明显优于单纯顺铂处理组,且存活细胞数目多于顺铂组。可见,氯化钴预处理对顺铂的耳毒性有一定的保护作用。
NF-kB是一个涉及ROS的转录因子,与细胞凋亡关系密切。根据细胞的类型和刺激的性质不同,NF-kB在细胞中表现为凋亡因子或抑凋亡因子。NF-kB在神经元中被证明为一个促进细胞凋亡的转录因子,在顺铂处理的毛细胞细胞系的研究中[7],应用NF-kB的抑制剂能够减弱Caspase 3的活性,证明了NF-kB在顺铂处理后的毛细胞中表现为促进凋亡的转录因子。在本研究中,顺铂处理组毛细胞与螺旋神经元细胞损伤严重,存活数目较少,蛋白质印迹结果表明NF-kB与Caspase 3的表达量较对照组可见明显升高。证明在体外实验中,顺铂处理后毛细胞与螺旋神经元细胞损伤与NF-kB转录水平升高导致的细胞凋亡有关。
缺氧诱导因子1(hypoxia-inducible factor 1,HIF-1)是由两个亚基组成的异源二聚体转录因子,HIF-1α既是HIF-1的活性亚基又是其调节亚基。HIF-1α极不稳定,在常氧条件下极易被降解,而在氧气浓度较低时,HIF-1α的稳定性增加进而使HIF-1转录活性增加[7]。在肿瘤细胞中发现,在缺氧环境下,HIF-1α能够激活一些抗凋亡转录因子的转录,并促进抗凋亡蛋白IAP-2的表达并降低促凋亡蛋白Bax的表达[5]。CoCl2是一种常用的HIF-1α的活性诱导剂,其能够在常氧条件下,通过与Fe2+竞争氧,达到常氧条件下诱导缺氧的目的[9]。对于不同类型的细胞,诱导HIF-1α表达升高所需氯化钴的浓度和处理时间有所不同。经过实验摸索[10],发现氯化钴浓度在100 μM且处理时间为6 h时既能保证有较高的HIF1α表达,又不会对毛细胞和螺旋神经元有所损伤。在本研究中,CoCl2处理组毛细胞与螺旋神经元细胞状态完好,与对照组相比未见明显差异,且HIF-1α表达水平明显提高,但NF-kB与Caspase 3表达量与对照组无明显差异,这表明氯化钴浓度在100μM且处理时间为6 h时对毛细胞与螺旋神经元无有害作用。CoCl2预处理加顺铂组毛细胞与螺旋神经元细胞状态均明显优于顺铂处理组,且存活细胞数目明显多于单纯顺铂组,具有统计学意义,这表明氯化钴预处理对于顺铂对毛细胞和螺旋神经元的损伤具有保护作用。蛋白质印迹结果显示,CoCl2预处理加顺铂组细胞内HIF-1α的表达水平明显高于顺铂组,CoCl2预处理加顺铂组与顺铂处理组NF-kB表达水平均明显高于正常组,这与加入顺铂处理引发的细胞的炎症反应有关,但是CoCl2预处理加顺铂组Caspase 3表达量明显低于顺铂处理组,推测与其细胞内有高水平的HIF-1α的表达,部分地抑制了NF-kB导致的细胞凋亡有关。因此,CoCl2预处理加顺铂组Caspase 3表达量明显低于顺铂处理组,对毛细胞和螺旋神经元有较好的保护作用。
本研究结果表明了氯化钴预处理导致细胞内HIF-1α的转录活性增加,其表达水平的提升能够与促进毛细胞和神经元凋亡的炎症因子NF-kB相互拮抗,部分抑制细胞的凋亡。本研究同时证明了氯化钴预处理对减轻顺铂对毛细胞和螺旋神经元的氧化应激损伤有明显作用。
[1]Waissbluth S,Daniel SJ.Cisplatin-induced ototoxicity:transporters playing a role in cisplatin toxicity[J].Hear Res,2013,299:37-45.
[2]Schellens JH,Planting AS,Ma J,et al.Adaptive intrapatient dose escalation of cisplatin in patients with advanced head and neck cancer[J].Anticancer Drugs,2001,12(8):667-675.
[3]Vogiatzi G,Tousoulis D,Stefanadis C.The role of oxidative stress in atherosclerosis[J].Hellenic J Cardiol,2009,50(5):402-409.
[4]Taylor CT.Interdependent roles for hypoxia inducible factor and nuclear factor-kappaB in hypoxic inflammation[J]. J Phy siol,2008,586(17):4055-4059.
[5]Greijer AE,van der Wall E. The role of hypoxia inducible factor 1 (HIF-1) in hypoxia induced apoptosis[J]. J Clin Pathol,2004,57(10):1009-1014.
[6]Liu J,Du L.PERK pathway is involved in oxygen-glucoseserum deprivation-induced NF-kB activation via ROS generation in spinal cord astrocytes[J].Biochem Biophys Res Commun,2015,467(2):197-203.
[7]Chung WH,Boo SH,Chung MK,et al.Proapoptotic effects of NF-kappaB on cisplatin-induced cell death in auditory cell line[J].Acta Otolaryngol,2008,128(10):1063-1070.
[8]Wang GL,Jiang BH,Rue EA,et al.Hypoxia-inducible factor 1 is a basic-helix-loop-helix-PAS heterodimer regulated by cellular O2 tension[J].Proc Natl Acad Sci USA,1995,92(12):5510-5514.
[9]Zhang YB,Wang X,Meister EA,et al.The effects of CoCl2 on HIF-1alpha protein under experimental conditions of autoprogressive hypoxia using mouse models[J].Int J Mol Sci,2014,15(6):10999-11012.
[10]Wang P,Du B,Yin W,et al.Resveratrol attenuates CoCl2-induced cochlear hair cell damage through upregulation of Sirtuin1 and NF-kappaB deacetylation[J].PLoS One,2013,8(11):e80854.
