《实验室制取气体的一般思路和方法》教学设计
2017-03-24赵西宁
赵西宁

一、教学目标
知识与技能:
1.掌握实验室制取气体的一般思路与方法。
2.掌握实验室制取氧气的方法。
3.掌握实验室制取二氧化碳的方法。
过程与方法:
1.通过探究活动过程,体验化学实验方法的科学性,掌握实验室中制取气体的一般思路与方法。
2.了解实验室制取气体的发生装置和收集装置确定的基本
依据。
情感、态度与价值观:
通过复习氧气的实验室制法来创设实验室制取二氧化碳的问题情境,既丰富了学生的科学体系,又讓学生在实验探究活动中体验、反思、熟悉基本实验操作技能,掌握实验室制取气体的一般思路与方法,体验了科学探究的乐趣,激发了学习化学的兴趣。
二、教学重点
实验室制取气体的一般思路和方法:包括反应原理和反应条件、实验发生装置和收集装置、气体验证。
三、教学难点
实验装置(发生装置和收集装置)的选择。
四、教学过程
【课前准备】
(一)知识回顾
1.实验室制取氧气的反应原理:
(1)2KMnO4 [△]K2MnO4+MnO2+O2↑
(2)2KClO3 [MnO2][△]2KCl+3O2↑
(3)2H2O2 [MnO2]2H2O+O2↑
2.实验装置:
(1)气体的发生装置:
(2)气体的收集装置:
(二)巩固练习
化学是一门以实验为基础的学科,化学所取得的丰硕成果与实验的重要作用是分不开的。请结合下列实验装置回答问题:
【讲授新课】
(一)CO2的实验室制取
1.药品:大理石或石灰石(CaCO3)、稀盐酸(HCl)。
2.反应原理:CaCO3+2HCl CaCl2+H2O+CO2↑。
3.实验装置:固体+液体→气体。
(1)发生装置:锥形瓶、长颈漏斗或分液漏斗、试管(不需要加热)。
(2)收集装置:集气瓶(向上排空气法)。
实验装置如图所示:
4.实验步骤:
(1)按要求连接好所需要的仪器;
(2)检查装置的气密性;
(3)向锥形瓶中放入大理石或石灰石;
(4)向长颈漏斗中注入稀盐酸;
(5)用向上排空气法收集二氧化碳气体;
(6)对收集的二氧化碳气体进行检验;
(7)对收集的二氧化碳气体进行验满。
方法一:
方法二:
5.检验和验满:
(1)检验:将生成的气体通入澄清石灰水中,若澄清石灰水变浑浊,即为二氧化碳气体。
(2)验满:将一根燃着的木条放在集气瓶口,若木条熄灭,则瓶内二氧化碳已满。
(二)实验室制取气体的一般思路和方法
1.设计思路
(1)选择适当的反应,包括反应原理和反应条件;
(2)选择合适的实验装置;
(3)验证所制得的气体。
2.反应物(药品)的选择原则
药品价格便宜、容易得到,反应速率适中、便于控制,尽量减少对环境的污染。
3.装置的确定
实验室制取气体的装置包括发生装置和收集装置两部分。
(1)确定气体发生装置和收集装置时应该考虑的因素
①反应物的状态和反应条件决定了气体的发生装置
反应物的状态:固体与固体的反应、固体与液体的反应、液体与液体的反应;
反应条件:是否加热、是否加催化剂等。
②与空气密度的大小和是否易溶于水决定了气体的收集装置
密度比空气大的气体,用向上排空气法收集;
密度比空气小的气体,用向下排空气法收集;
不易溶于水且不与水发生反应,使用排水法收集。
(2)装置类型
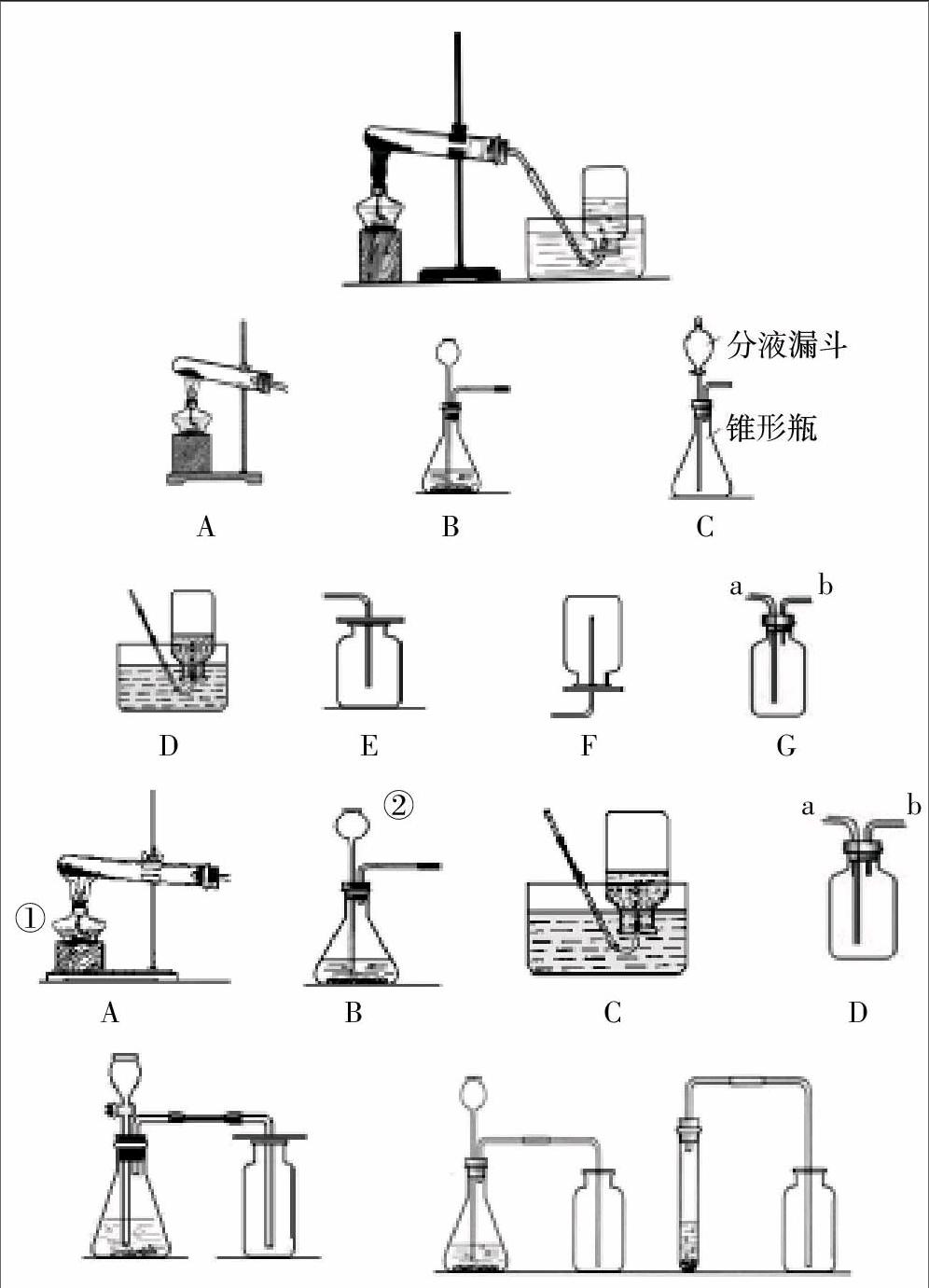
①固体+固体→气体(如下图A制取O2)
特点:试管口略向下倾斜,以免水倒流引起试管炸裂;
导管不能伸入试管中太长,否则不利于气体排出;
试管夹或铁夹夹在距离试管口处。
②固体+液体→气体(如下图B、C,制取O2、H2、CO2)
特点:长颈漏斗的末端必须要插入液面以下,形成一段液封,可防止生成的气体从上端口逸散在空气中;使用分液漏斗可以随时控制反应的发生或停止以及反应速率。
(3)收集方法:
①排水法(如下图D,可制取O2、H2)
特点:气体不易溶于水或难溶于水且不与水发生反应。
②排空气法
向上排空气法:如下图E。可制取气体密度大于空气密度,且不与空气成分反应,如O2、CO2。
向下排空气法:如下图F。可制取气体密度小于空气密度,且不与空气成分反应,如H2等。
【能力提升】
通过化学学习,你已经掌握了实验室制取气体的有关规律,以下是教师提供的一些实验装置。请你运用所学知识结合下图回答问题:
注:本文系甘肃省教育科学规划课题研究成果,课题名称:新课标下初中化学实验课堂教学模式的研究。课题类别:甘肃省教育科学“十二五”规划课题。课题申报号:LN2015—83;课题项目编号:[26779];课题批准号GS[2015]GHB0405。