基于Q-TOF-MS高分辨质谱系统分析山海棠素在小鼠体内的代谢
2017-03-21冯义骁
冯义骁,王 存
(1.西南大学附属中学,重庆400700)(2.重庆第二师范学院生物与化学工程学院,重庆400065)
0 引言
山海棠素(Triptophenolide)又名雷酚内酯,属山海棠素型二萜类生物碱成分,在卫矛科植物昆明山海棠(Tripterygium hypoglaucum(Levl.)Hutch)中含量较高,具有抗炎、抗肿瘤,免疫抑制的生物活性作用,是治疗类风湿关节炎的重要成分之一[1-3]。昆明山海棠分布在长江流域、西南和东北等地区[4],在临床治疗中常用于治疗自身免疫性疾病[5-6]。有研究发现昆明山海棠在肝、肾、肠胃、生殖系统等多个部位有明显的损害[7-9],山海棠素也是其中的毒性成分[10-11],因此,该文以昆明山海棠中山海棠素为研究目标,分析其在动物体内的生物代谢过程,该研究对其临床应用和生物毒性研究具有积极意义。
随着高分辨质谱的快速发展,质量亏损过滤(MDF)技术在数据挖掘,非目标化合物筛查,药物代谢及天然产物鉴定等方面具有越来越大的应用空间。借助超高效液相色谱与飞行时间质谱联用(UPLC/Q-TOF-MS)技术,分析中药复杂成分和中药的代谢,能够在省略分离纯化过程的同时鉴定痕量药物及代谢物,同时,在药物代谢物筛选与表征过程中,具有去除背景离子干扰,排除假阳性,提高效率等诸多明显优势。该研究以小鼠血浆中山海棠素的代谢为目标,采用高分辨质谱,基于多重质量亏损和动态背景扣除技术,系统分析了山海棠素在小鼠体内的代谢产物,为中药昆明山海棠的临床使用及相互作用研究提供一定参考。
1 材料
TripleTOF 4600高分辨质谱系统 (美国ABSCIEX公司);LC-30AD超高效液相系统 (日本SHIMADZU公司),R21G型高速冷冻离心机(日本日立公司);Elix10超纯水净化系统 (美国MILLIPOER公司);XS-105十万分之一精密电子天平(瑞士METTLERTOLEDO公司)。
山海棠素(Triptophenolide,南昌贝塔生物科技有限公司 批号:20282-201602),甲酸(Formicacid,Sigma-Aldrich公司,批号56302-10ML),水、乙腈、甲醇均为质谱纯(美国Fisher公司)。
2 方法
2.1 提取方法[12-15]
称取昆明山海棠药材粉末0.1 g,置于25 mL容量瓶中,取95%的乙醇溶液20 mL于容量瓶中,超声30 min放冷后定容,取1 mL于EP管中,10000 xg离心10 min,取上清液3 μL进样,进行UPLC/Q-TOF-MS分析。称取昆明山海棠药材粉末3.0 g,取95%的乙醇溶液20 mL浸泡6 h,95%乙醇回流提取3次,每次4 h,合并乙醇提取液后回收乙醇即得乙醇浸膏。
2.2 昆明山海棠提取物给药[16]
取18~20 g昆明小鼠12只(重庆市中药研究院实验动物中心提供,动物编号SCXK(渝)2012-0006),雌雄各半,分为A、B两组,饲养3 d后禁食12 h,自由饮水。A组灌胃同体积的生理盐水作为空白对照,B组按照20 g(生药)/kg(体重)剂量灌胃,A、B两组分别于给药后60 min取全血于肝素钠化的EP管中,10000 xg离心10 min取血浆备用。
2.3 样品采集与处理[17-19]
精密吸收小鼠血浆样品 200 μL置 1.5 mL EP管中,加入甲醇600 μL后于涡旋液体混合器上混匀2 min,以10000 xg离心10 min,分别吸取上清液和空白对照液3 μL进样,进行UPLC/Q-TOF-MS分析。
2.4 色谱与质谱条件[20]
超高效液相检测条件:系统选用Kinetex XB-C18 柱 (100×2.1 mm,2.6 μm), 流动相为含0.1%甲酸的超纯水(A)一乙腈(B),采用梯度洗脱程序:起始B为10%并持续1.00 min;1.00~8.00 min B变为80%,并持续至12.00 min;12.01 min B变为10%并持续至15.00 min。流速为300 μL/min;柱温为30℃。
TripleTOF 4600高分辨质谱系统采用ESI离子源,采用Positive离子化方式;质量扫描范围m/z 100~1000;鞘气为 55 Psi,辅助气为 55 Psi;气帘气为25 Psi,雾化温度600℃,采用TOF-MSProductIon-IDA扫描模式,TOF/MS一级预扫描和触发的二级扫描ProductIon-IDA离子累积时间分别250,100 ms,采用多重质量亏损(MMDF)和动态背景扣除(DBS)作为二级触发条件,解簇电压80 V,CE碰撞能量为35 eV,CES碰撞能量叠加为(35±15)eV。
3 结果与讨论
3.1 昆明山海棠提取物中山海棠素的MS分析
采用UPLC/Q-TOF-MS对山海棠素标准品和昆明山海棠提取物进行分析。山海棠素精确分子量(m/z 313.1798),山海棠素标准品在7.841 min出峰 (如图1A),昆明山海棠提取物在7.846 min处有响应(如图1B),进一步对其MS/MS碎片进行分析(如图2A、2B),判断昆明山海棠提取物中含有山海棠素。
如图2A和2B所示,山海棠素在ESI+Positive模式中的母离子为m/z 313.1803[M+H]+,经电离作用脱去异丙基和水分子后存在碎片m/z 253.1234,以及脱去羰基的m/z 225.1273。m/z 195.0805和m/z 183.0807是在m/z 225.1273的碎
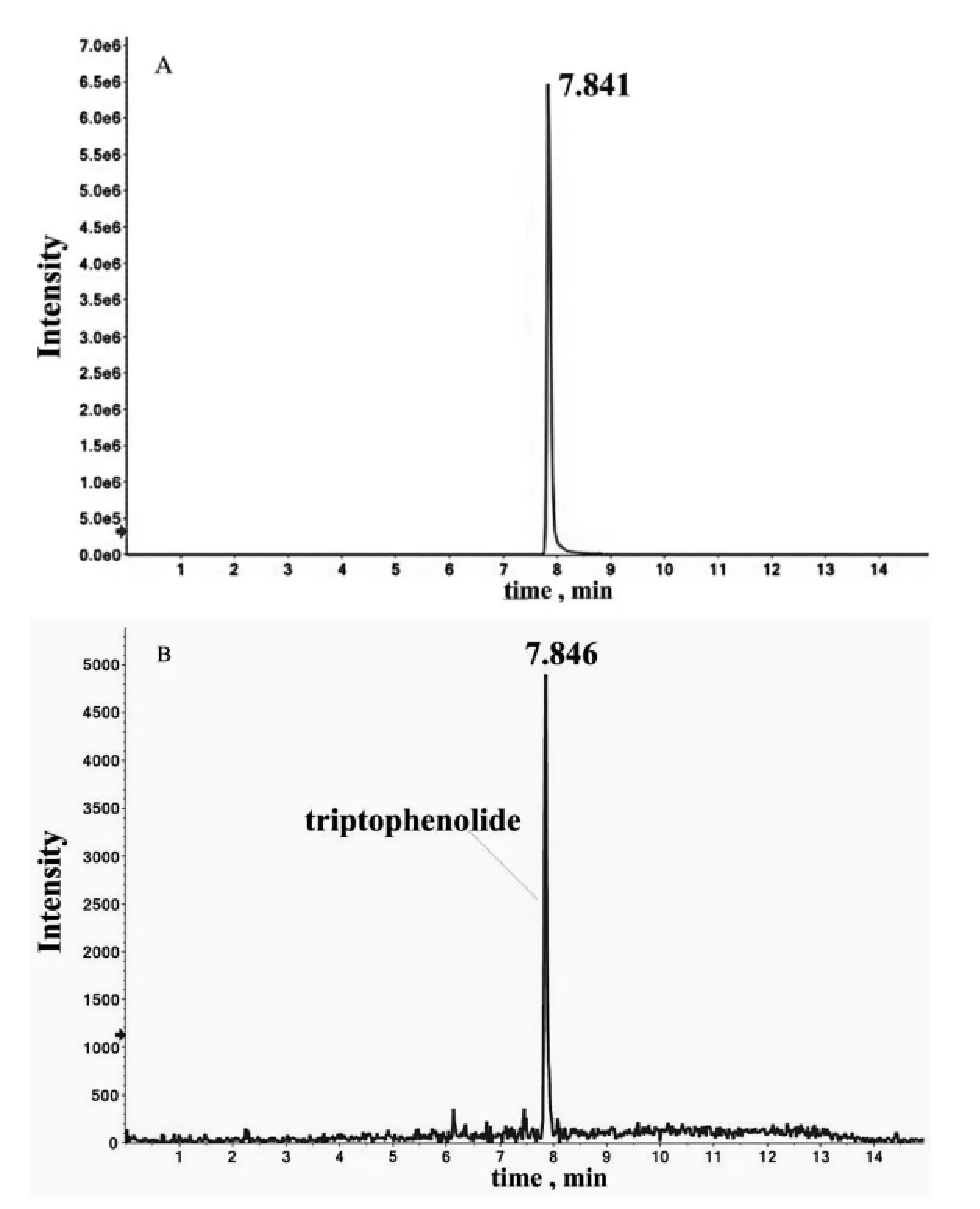
图1 山海棠素标准品和提取物中山海棠素的提取离子流图Fig.1 The extracted ion current(XIC)spectra of Triptophenolide and extract ive in positive ion mode A The XIC spectra of Triptophenolide;B The XIC spectra of extractive

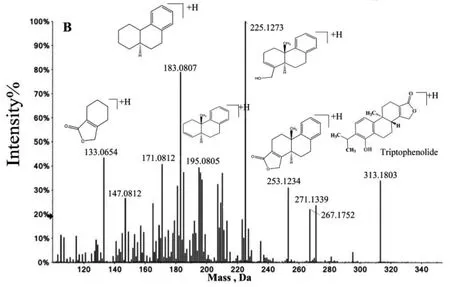
图2 山海棠素标准品的一级和二级质谱图Fig.2 The MS and MS/MS spectra of Triptophenolide in positive ion mode A The MS spectra of Triptophenolide;B The MS/MS spectra of Triptophenolide
3.2 昆明山海棠提取物在小鼠体内生物转化分析
小鼠昆明山海棠提取物灌胃60 min后,血浆样品中产生明显代谢产物,如图3所示。
3.3 山海棠素在小鼠体内代谢物分析
山海棠素在小鼠体内经氧化和甲基化后产生m/z 343.1904的代谢物,分析推断分子式为C21H26O4,质量偏差0.1 mg/L,由于山海棠素结构的特异性,氧化和甲基化不同的2,6,7位C原子的产物得到3种同分异构体;山海棠素的1位C原子能被甲基化为m/z 327.1956质量偏差为0.5 mg/L的代谢物,山海棠素的2、6、7位C原子皆能甲基化,所以有4个同分异构体;6、7位C原子能被氧化形成两个m/z分别为329.1742和329.1752的同分异构体。内水解—二氧化后产生m/z 363.1822的代谢产物,经分析为C20H26O6,质量偏差为5.4 mg/L,是山海棠素在小鼠体内较为重要的代谢产物。山海棠素在小鼠体内的代谢反应多发生在1、2、6、7位C上,且代谢产物众多,如表1所示。
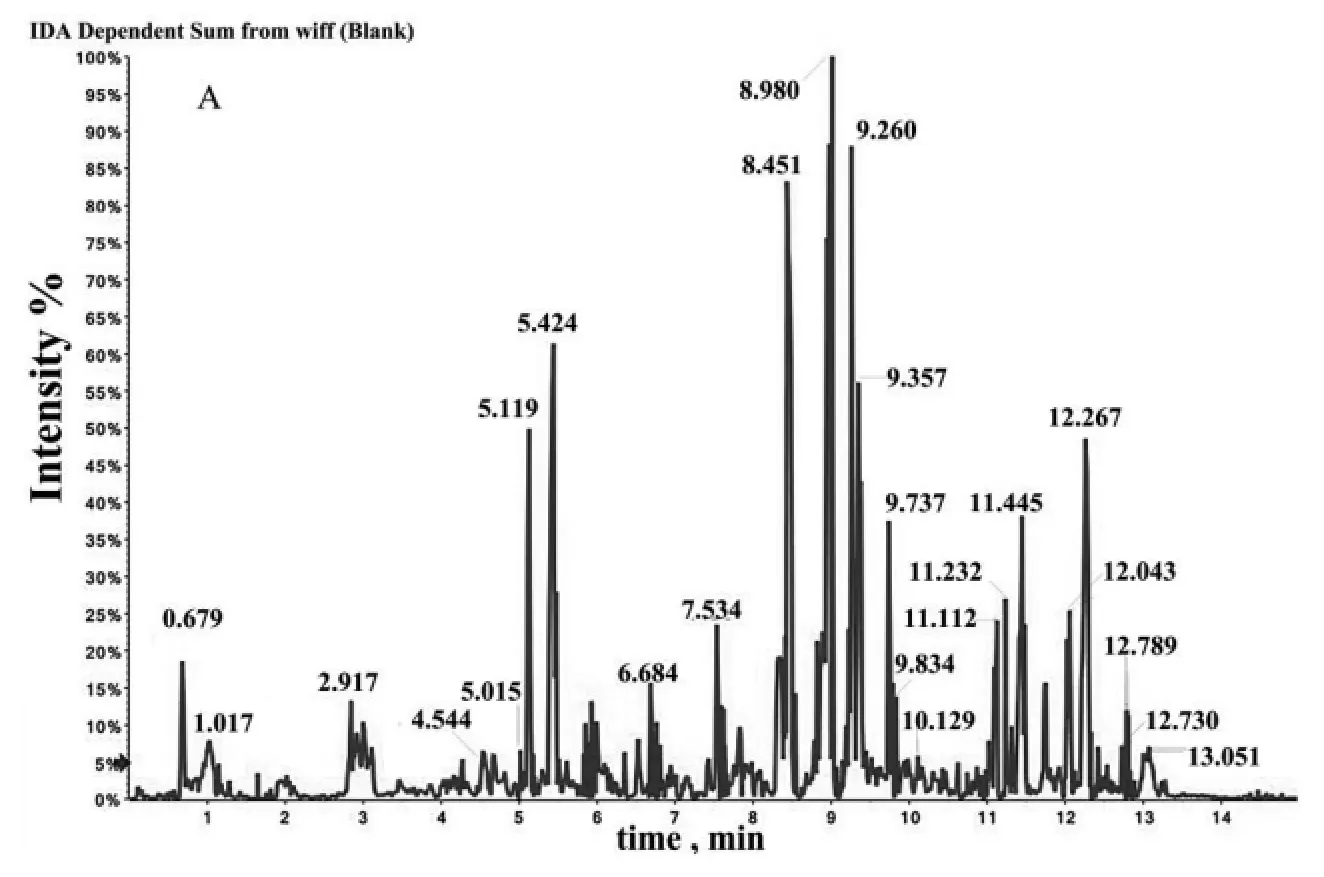
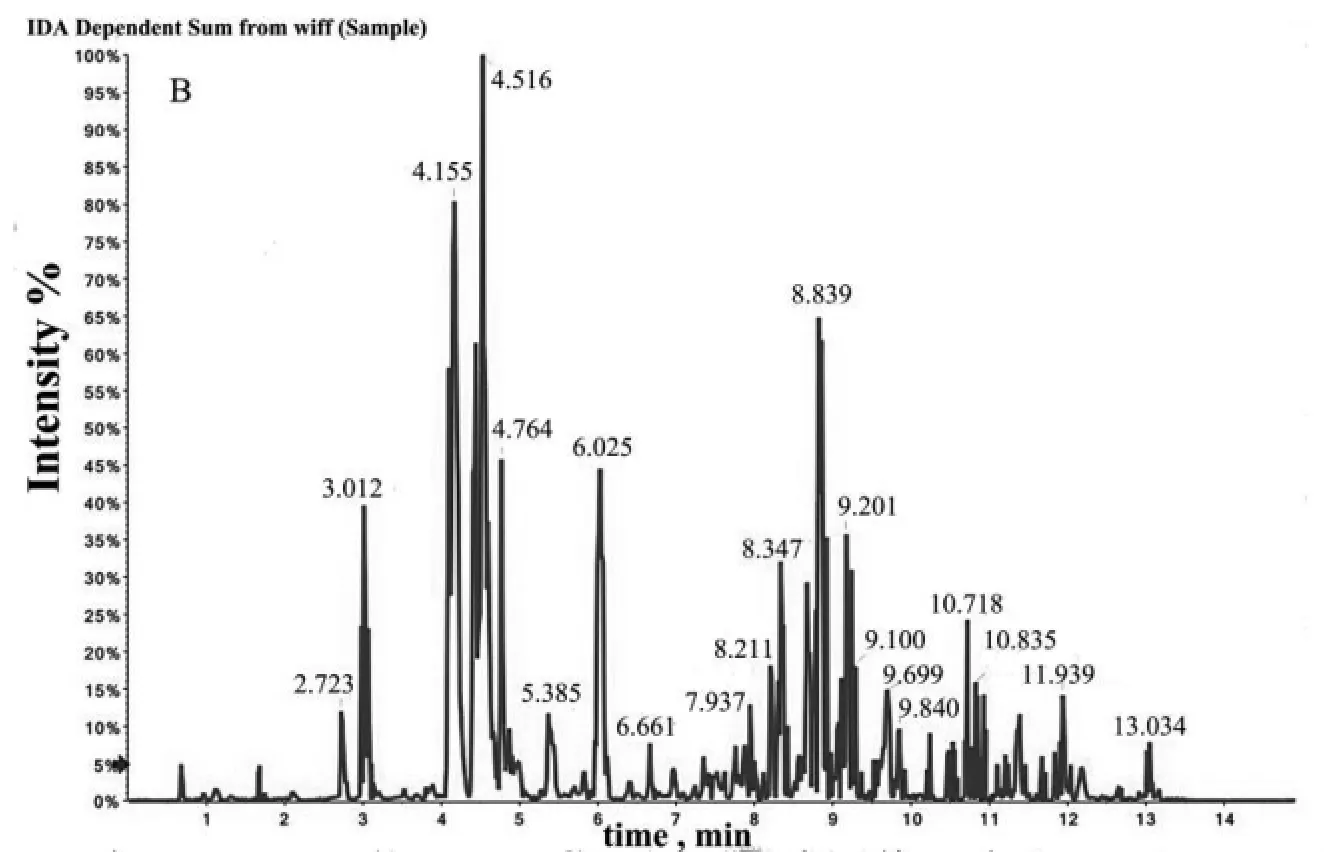
图3 给药60 min后空白组和实验组血浆样品的总离子流图Fig.3 The TIC spectra of the plasma of blank and experimental group at 60 min in positive ion mode A The TIC spectra of blank group;B The TIC spectra of experimental group
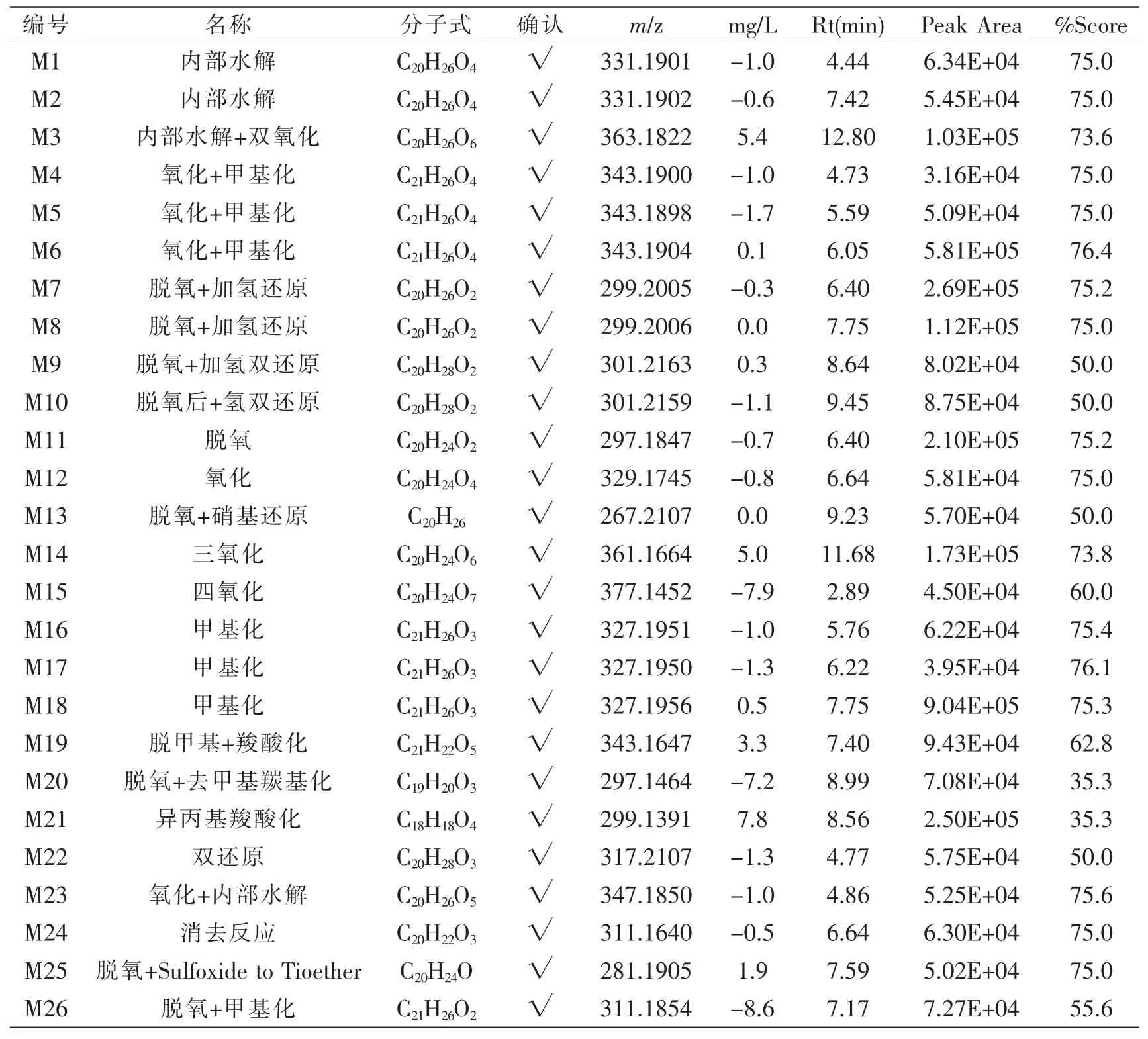
表1 山海棠素在小鼠体内代谢产物汇总Tab.1 The metabolites of biological transformation of triptophenolide in mouse
对昆明山海棠提取物中山海棠素在小鼠体内的代谢物进行系统分析后发现山海棠素在小鼠体内经过内部水解、氧化、甲基化、氧化后甲基化、三氧化等多种转化方式,形成系列相关代谢产物共26种,其生物转化过程(如图4)。
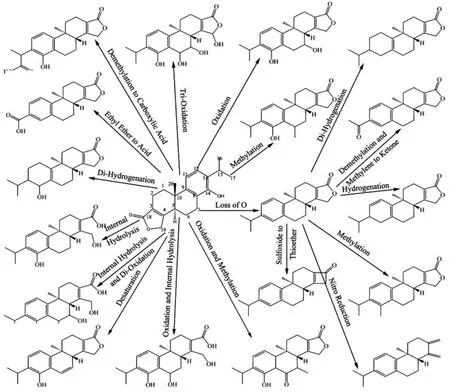
图4 山海棠素在小鼠体内代谢流程图Fig.4 The flow diagram of biological transformation of triptophenolide in mouse
3.4 讨论
该实验采用高分辨质谱技术和MetabolitePilot代谢物分析鉴定软件连用的方式,对昆明山海棠提取物中山海棠素在小鼠血浆中的生物代谢变化过程进行分析。研究结果表明,山海棠素在小鼠体内13位的异丙基和14位上的酚羟基容易断裂,三个六元环为雷公藤二萜类物质活性基团,呋喃环不是山海棠素的活性必要骨架结构部分,所以呋喃环在小鼠血浆中的降解对山海棠素的生物活性没有影响。
山海棠素作为昆明山海棠中有着良好临床治疗效果的二萜内酯类,其毒性药理作用一直有待研究,并且少有文献记载和报道,该次实验结果采用考察小鼠体内血浆中的山海棠素的毒性成分在血液中的变化情况来探究昆明山海棠的减毒增效作用机制,为改造山海棠素的结构、提高临床用药安全性提供参考。
[1]李新秀.代谢抑制在雷公藤活性成分致其肝肾毒性中的作用研究[D].济南:山东大学,2015,1-89.
[2]于东防,胡邦豪,陈国平,等.雷酚内酯的结构修正[J].药学学报,1990,25(12):929-931.
[3]杨峻,许静亚,张永忠,等.雷酚内酯的抗炎免疫药理作用[J].中草药,1995,1:24-27.
[4]李晓雷.昆明山海棠化学成分、生物活性及相关指纹图谱初探[D].昆明:昆明理工大学,2015,1-154.
[5]王超.雷公藤叶的化学成分及生物活性研究[D].北京:北京协和医学院研究生院,2013,1-319.
[6]曹宏伟.雷公藤治疗免疫系统疾病研究概况[J].山西中医,2014,30(7):56-57.
[7]郭艳红,谭垦.雷公藤的毒性及其研究概况[J].中药材,2007,30(1):112-117.
[8]徐小勇.雷公藤有效成份的提取及分离研究[D].杭州:浙江大学,2005,3:1-77.
[9]吕扬,郑启泰,田之悦,等.雷公藤二萜类化合物精细立体结构研究[J].天然产物研究与开发,1998,10(3):1-5.
[10]刘建群,伍秋珊,余昭芬,等.雷公藤两种活性成分热稳定性研究[J].江西中医药,2016,47(407):62-64.
[11]刘星雨,吴娜,张娇,等.生、炙甘草对小鼠 CYP3As及对雷公藤内酯醇解毒的比较[J].中成药,2014,36(12):2451-2457.
[12]田洋.植物源农药雷公藤中三萜类成分提取工艺研究[J].农业科技与装备,2012,12(222):11-13.
[13]冯群,孙蓉,黄伟,等.不同剂量雷公藤对小鼠抗炎作用的效-毒关联评价[J].中药药理与临床,2014,30(1):75-79.
[14]周莉玲,王旭深.雷公藤药材中雷酚内酯的薄层扫描法测定[J].中国中药杂志,1999,24(1):14-16.
[15]程自珍,肖银生,方义杰,等.雷公藤提取工艺的探讨[J].中国医药工业杂志,1990,21(10):435-436.
[16]何维.雷公藤初提物中萜类化合物分离及鉴别[J].儿科药学杂志,2009,15(5):48-50.
[17]郭延垒,吴明军,赵德璋,等.三重四级杆复合线性离子阱质谱对丹皮酚经大鼠肝微粒体外代谢产物的分析[J].中国医院药学杂志,2013,33(34):1657-1658.
[18]吴浩,狄留情,单进军,等.大鼠血浆中红景天苷UPLCMS/MS检测方法的建立及其在药动力学研究中的应用[J].中成药,2014,36(6):1176-1181.
[19]郭延垒,吴明军,李文娟,等.Q Exactive四极杆-静电场轨道阱高分辨质谱系统对丹皮酚经大鼠微粒体体外代谢产物的分析[J].分析化学,2013,7(41):1074-1079.
[20]刘建群,余昭芬,周立芬,等.HPLC-TOF/MS研究雷公藤甲素及雷公藤内酯酮体内代谢产物[J].海峡药学,2016,28(5):27-31.
