根域限制栽培模式下美人指葡萄生育期不同灌溉量研究
2017-03-21牛帅科魏建国杨丽丽孙聪伟赵艳卓宣立锋褚凤杰
牛帅科,魏建国,杨丽丽,陈 展,孙聪伟,赵艳卓,宣立锋,褚凤杰
(河北省农林科学院石家庄果树研究所,石家庄 050061)
葡萄根域限制栽培是指利用一些物理或生态的方法将葡萄的根域范围控制在一定的容积内,通过控制根系生长来调节地上部营养生长和生殖生长过程的一种栽培技术[1]。该栽培技术具有良好的保水性,且根系自身通过产生形态与生理的适应性变化,提高水分利用率[2]。
水分是葡萄生长和发育的关键环境因子之一,在葡萄的光合作用、呼吸作用、有机物合成与分解中起重要作用[3]。目前,国内对葡萄的露地及设施栽培中灌溉量、滴灌技术、调亏灌溉的影响研究较多,但对于根域限制栽培模式下灌溉量对葡萄生长发育、植株生理、果品质量综合的研究较少。为此,通过对根域限制栽培模式下不同灌水量试验,以期探寻不同水分状态对该模式下美人指葡萄生长过程中光合指标、枝条生长量、葡萄果实质量的影响,为根域限制栽培模式下美人指葡萄合理灌溉及节水灌溉提供科学依据。
1 材料和方法
1.1 试验区概况
石家庄市是河北省省会,地处河北省中南部。属于暖温带大陆性季风气候。太阳辐射的季节性变化显著,地面的高低气压活动频繁,四季分明,寒暑悬殊,雨量集中于夏秋季节。干湿期明显,夏冬季长,春秋季短。总降水量为401~752 mm,年总日照时数为1 916.4~2 571.2 h,其中春夏日照充足,秋冬日照偏少,土壤属沙壤土[4]。
1.2 试验品种
根域限制池内栽种3年生美人指葡萄,“T”形棚架栽培,株行距2 m×8 m,架高2.2 m。
1.3 试验材料
铝盒、取土环刀、取土器、烘箱、LI-6400XT便携式光合仪、SPAD-502叶绿素含量测定仪、烘箱、游标卡尺、电子天平、糖度计、酸度计。
1.4 试验设计
对美人指葡萄进行土壤不同含水量的3组处理,处理1、处理2、处理3分别为占田间持水率的60%~70%、50%~60%、40%~50%。采用室内环刀法测定田间持水率,取土器取土利用称重法测量并计算土壤相对含水量,每组试验设有3个重复处理,每周检测1次,确保土壤水分含量处于设计范围。
1.5 检测指标
(1)光合指标的测定。选定发育良好的枝条,从该枝条的基部数第5片叶子进行标记,分别在葡萄新梢生长期、花期、果实膨大期、果实成熟期对美人指叶片于晴朗天气的上午9-10点进行光合速率、气孔导度、胞间CO2浓度、蒸腾速率、叶绿素含量的测定,每个处理进行3组重复。
(2)葡萄枝条生长量的检测。在3组处理中,每组选定并标记3个枝条,从新梢生长期开始至果实膨大期为止,每周测量两次枝条长度,取平均数,葡萄进行正常的修剪管理工作,但需要修剪前后进行测量。
(3)葡萄果实生长量的检测。在3组处理中,每组选定3穗果实从坐果后至采收前,每穗果实选定并标记5粒果实对其直径进行测量,取平均数,每周测两次。
(4)果实品质的检测。在果实成熟期测定不同处理的果实平均单株产量以及果实品质(单粒重、穗重、可溶性固形物含量、含酸量)的指标。
2 结果与分析
2.1 土壤水分含量的测定结果
为保证土壤中的含水量,当葡萄进入新梢生长期到果实采收前每周对土壤含水量进行测定,当土壤中含水量低于试验处理则进行适当的灌水处理,土壤含水量变动曲线见图1。
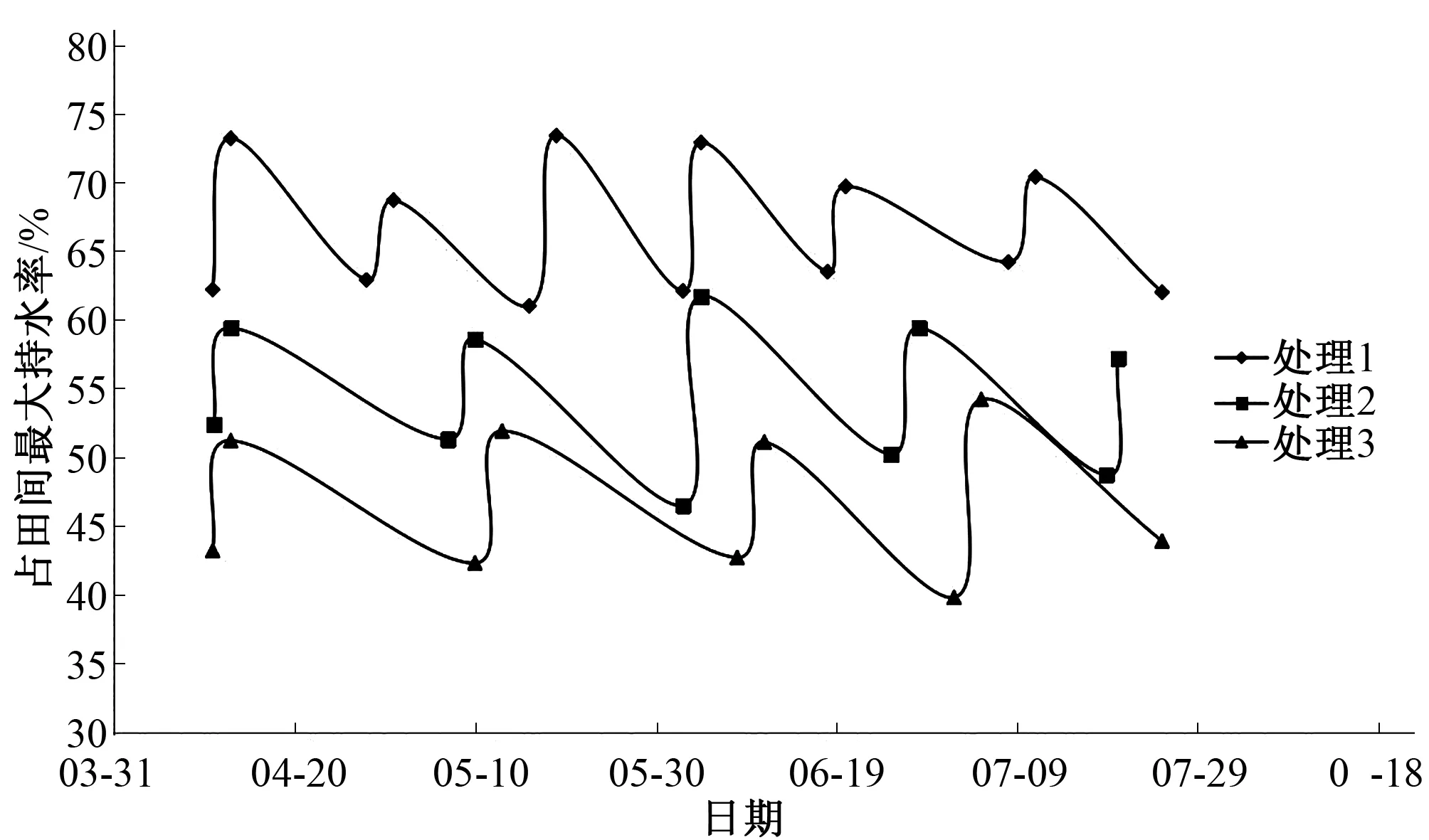
图1 土壤含水量变化过程Fig.1 Change process of soil moisture content
从图1中可以看出土壤含水量基本保持在试验处理范围之内。各处理在新梢生长期至采收后分别灌水6、5、4次,考虑到土壤水分含量越高时,土壤蒸发量、流失量也较大,故处理1灌水次数较多且灌水量也较大。处理3灌水次数及灌水量最少。从新梢生长期至果实采收,3个处理的灌水总量分别为750、460、340 L/棵。在正常的管理下,根域限制区美人指葡萄生育期灌水总量为750 L/棵左右。
2.2 光合参数的测定结果
气孔导度变化对植物水分状况及CO2同化有重要影响[5]。杨建民等人的研究表明,气孔开闭是整个植株对水分胁迫最为敏感的指标[6]。由图2可以看出,根域限制栽培模式下美人指葡萄叶片的气孔开放程度对水分环境较为敏感,随着水分胁迫程度的增加,气孔导度会随之降低。且处理1明显高于其他两个处理,处理2与处理3差异并不显著, 处理1四个时期的平均气孔导度分别比处理2、3高出41%,52%。说明在此栽培模式下,气孔导度会随着灌水量的减少而降低,遵循先快后慢的降低模式。处理1的气孔导度高峰出现在浆果发育期,而其他两个处理的高峰出现在花期与浆果发育期之间。

图2 不同灌水处理对美人指葡萄气孔导度的影响Fig.2 The influence of different water treatment on stomatal conductance of beauty finger grapes
研究表明气孔导度降低会有效降低葡萄的蒸腾作用,阻碍水分亏缺进一步发展,提高水分利用率,从而减轻胁迫对光合器官的伤害[3]。CO2通过气孔进入植物体,所以气孔导度直接影响胞间CO2浓度。由图3可以看出,在根域限制栽培模式下美人指葡萄的胞间CO2浓度变化规律基本符合气孔导度的变化规律,灌水量越少,胞间CO2受气孔导度的影响,其浓度越低,处理1较其他两个变化较剧烈,处理1四个时期的平均胞间CO2浓度分别比处理2、3高出28%、51%。处理1胞间CO2浓度高峰出现在花期,而其他两个处理的高峰出现在浆果发育期。
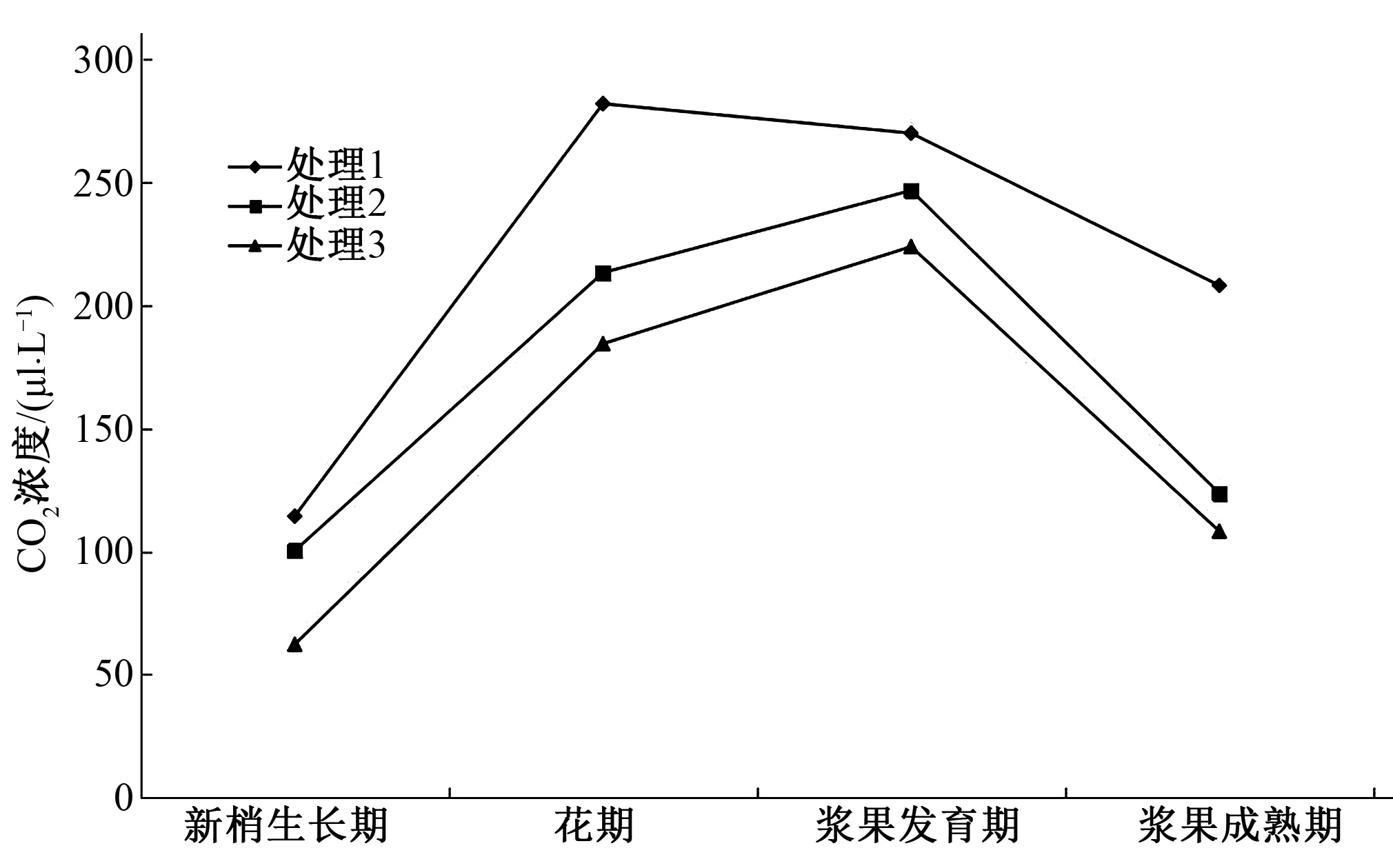
图3 不同灌水处理对美人指葡萄胞间CO2浓度的影响Fig.3 The influence of different water treatment on intercellular CO2 concentration of beauty finger grapes
由图4可以看出,根域限制栽培模式下美人指葡萄处理1蒸腾速率处于较高水平,特别是在浆果发育期与浆果成熟期,其他两个处理的蒸腾速率均较低,处理1四个时期的平均蒸腾速率分别比处理2、3高出40%、52%。处理1蒸腾速率的高峰出现在浆果发育期,其他两个处理的高峰出现在花期与浆果发育期之间。蒸腾速率与净光合速率关系密切,水分降低,蒸腾降低,净光合速率下降,葡萄积累的光合产物减少[7],从而会显著提高叶片的内在水分效率[8]。

图4 不同灌水处理对美人指葡萄蒸腾速率的影响Fig.4 The influence of different water treatment on transpiration rate of beauty finger grapes
在光合作用中,叶绿素对植物的光合作用关系最为密切。由图5可以看出,不同处理的叶片叶绿素含量随着处理程度的加深,无论在哪个时期均呈下降趋势,处理1四个时期的平均叶绿素含量分别比处理2、3高出17%、38%,说明水分影响叶片中叶绿素的合成,水分越低叶片中叶绿素含量越低。在本试验中每组处理叶片中叶绿素含量均变化不大,呈缓慢下降趋势,这说明在一定条件限定下,土壤水分含量高低有可能直接决定叶片叶绿素含量的高低。巨智强等人的研究表明水分胁迫会造成葡萄叶面积生长缓慢叶绿体含量下降,土壤灌水越少,叶片中叶绿素含量下降幅度越大[9]。在胡宏远的研究中表明中度以下水分胁迫叶绿素含量先增后降[10],与本试验结果有差异,这可能是由于受葡萄叶片成熟度的影响,叶绿素变化趋势不同。

图5 不同灌水处理对美人指葡萄叶绿素含量的影响Fig.5 The influence of different water treatment on chlorophyll concentration of beauty finger grapes
植株净光合能力的大小直接决定同化产物的多少。由图6可以看出,处理1的净光合速率值明显高于其他处理,这说明根域限制栽培模式下美人指葡萄的净光合速率与灌水量有直接关系,灌水量的减少降低了美人指葡萄的净光合能力,处理1四个时期的平均净光合速率分别比处理2、3高出18%、28%。同时从不同时期净光合能力的大小变化中可以看出,从新梢生长期到果实成熟期净光合速率先升高再降低,从花期到浆果发育期的净光合速率最大,处理1较其他两个处理先达极值。苏学德等人在研究中表明克瑞森无核在不同水分处理下花后60 d净光合速率达到极值,之后下降[7],变化趋势与本试验一致。叶片的净光合能力先增高后降低的变化趋势同样与叶片从幼叶到成熟再到衰老的过程相一致。

图6 不同灌水处理对美人指葡萄光合作用的影响Fig.6 The influence of different water treatment on photosynthetic rate of beauty finger grapes
2.3 葡萄生长量的检测
从葡萄进入新梢生长期后定期对葡萄新梢生长量进行测量,记录一定时间内不同处理方式下新梢生长量的变化,新梢变化曲线见图7。

图7 不同灌水处理对美人指葡萄新梢生长的影响Fig.7 The influence of different water treatment on shoot growth of beauty finger grapes
从图7中可以明显看出3个处理在不同水分状况下葡萄日生长量区别较大,处理1的葡萄新梢日生长量最大,处理3的日生长量最小。这说明水分在一定程度上能够促进新梢生长,同时通过控制水分也能够在一定程度上控制新梢生长,对降低营养生长控制树势具有重要意义。新梢分别在4月23日、5月14日、6月10日进行打顶,从图中可以看出打顶后新梢的生长速度明显下降,打顶后依然是处理1日生长量最快,处理3最慢,说明水分对新梢的恢复生长起重要作用。直至进入浆果发育期后各处理的新梢生长速度变慢,此时主要进行生殖生长。同时从图中可以看出无论灌水多少新梢生长规律都为花前最快,花期降低,花后稍有恢复,但随着坐果后新梢生长速度急速下降,这个规律不随灌水量的改变而改变。
2.4 葡萄果实生长量的检测
从葡萄坐果后定期对葡萄果实的直径进行测量,记录一定时间内不同处理方式下果实直径的生长变化,果实直径变化曲线见图8。
从图8中可以看出3组处理的葡萄果实的发育都呈双“S”型,经历两次膨大过程,与处理1相比处理2与处理3均缩短了第一次膨大期,提前进入了第二次膨大期,这与H.odeja等人[11]的试验结果相一致,灌水量的降低,可以缩短第一次果实膨大期,提前进入成熟期。与处理1相比处理2、3果实的直径较小,处理3略低于处理2,这说明果实的大小与水分状况有直接关系,在一定范围内灌水量越低则果实直径越小。现有广泛接受的假说认为水分的亏缺会影响葡萄第一次果实膨大期的细胞分裂,减少细胞数量,即使在第二次果实膨大期进行充分灌溉,葡萄果实也不会恢复正常大小[12,13]。
2.5 果实品质的检测
待果实成熟后采收,测定不同处理方式下的果实品质及产量,检测结果见表1。
从表1中可以看出随着灌水量的降低,穗重、粒重、产量都有不同程度的降低,说明灌水量的减少会直接影响产量。同时随着灌水量的降低其可溶性固形物升高、酸度降低、糖酸比升高,处理3品质指标最高,处理1最低,说明在一定范围内灌水量越低,葡萄品质越高。有研究表明,在非常严重的干旱胁迫下,远不能满足植物正常的代谢对水分的需要,光合作用受到抑制从而影响同化物质的积累,导致果实含糖量显著降低,但适度的水分胁迫对果实糖分的积累有明显的促进作用[14,15],Pascual Romero等人研究表明水分胁迫会提高葡萄品质,尤其是果实转色期后进行水分胁迫处理可溶性固形物提升明显[16]。从表中还可以看出总的可溶性固形物随着灌水量的减少在降低,由于灌水量减少后光合效率下降,故葡萄的同化作用必然降低。
3 结 语
通过对根域限制栽培模式下美人指葡萄进行不同程度的灌水处理研究,可以看出灌水量减少会降低葡萄总的营养生长量与生殖生长量。当灌水量降低,气孔导度、胞间CO2浓度、蒸腾速率、叶绿素含量、光合作用、总固形物合成量,均呈下降趋势。且灌水量的减少会影响不同光合参数的峰值变化,其中随着灌水量的减少气孔导度、蒸腾速率峰值会提前,而胞间CO2浓度、净光合速率峰值会滞后。
研究表明葡萄根系是首先感受到水分胁迫的器官,当葡萄根系经过感知水分胁迫后,根系中ABA合成增加,CTK合成降低[17,18]。ABA随着茎液流动被运送至地上部,引起叶片保卫细胞失水,气孔关闭,气孔导度降低,导致胞间CO2浓度下降,降低光合作用[19-21],提高水分利用率[22]。光合作用的强弱不仅反映出作物本身的生长发育水平,而且直接关系到果实品质[23]。所以葡萄持续的处于水分胁迫的情况下,有机物总的积累量必然会降低,胁迫程度越大影响越大。
本研究的结果还显示:一定的水分亏缺处理会在一定程度上提高果实品质。这可能有三个原因:第一,在降低灌水量后影响了树体的营养平衡,降低了营养生长从而把积累的有机物更多的转移到果实当中,从而提高了果实品质。第二,在降低灌水量后葡萄会提前进入成熟期,使得该处理的成熟期时间拉长从而提高果实品质。第三,在灌水量减少的情况下,总可溶性固形物含量在降低,而产量降低得更快,从而提高了可溶性固形物的百分比。具体原因需要进一步的试验验证。
[1] 段书延,吴玉森,高 振,等.根域限制对“巨峰”葡萄转色期和成熟期树体碳氮化合物含量的影响[J].园艺学报,2016,43 (3):431-440.
[2] Schurr U.Xylem sap sampling-new approaches to an old topic[J].Trends in Plant Science,1998,(3):293-298.
[3] 童正仙.水分胁迫对果树的影响研究进展[J].中国园艺文摘.2009,(11):127-129.
[4] 牛帅科,陈 展,宣立锋,等.石家庄地区葡萄生长期与气象条件的关系[J].河北果树,2015,(5):33-34.
[5] 高照全,邹养军,王小伟,等.植物水分运转影响因子的研究进展[J].干旱地区农业研究,2004,22(2):200-203.
[6] 杨建民,王中英.水分胁迫对新红星苹果幼树光合作用的影响[J].河北林学院学报,1993,8(2):103-107.
[7] 苏学德,李 铭,郭绍杰,等.不同灌水处理对克瑞森无核葡萄光合特性及果实品质的影响[J].安徽农业科学.2011,39(30):18 649-18 652.
[8] 杜宇旭,施 明,纪立东.等.滴灌条件下鲜食葡萄红地球合理灌水量研究[J].节水灌溉,2016,(2):35-39.
[9] 巨智强,成自勇,王 栋,等.水分胁迫对红地球葡萄生理生长的影响[J].甘肃农业科技,2015(2):42-45.
[10] 胡宏远,王振平.水分胁迫对赤霞珠葡萄光合特性的影响[J].节水灌溉,2016,(2):18-22.
[11] Ojeda H, Deloire A, Carbonneau A. Influence of water deficits on grape berry growth[J]. Vitis-Geilweilerhof, 2001, 40(3):141-145.
[12] Coombe B,Mccarthy M.Dynamics of grape berry growth and physiology of ripening[J]. Aust. J. Grape Wine Res., 2000,(6):131-135.
[13] Ojeda H,Deloire A,Carbonneau A.etal.Berry development of grapevines: Relations between the growth of berries and their DNA content indicate cell multiplication andenlargement[J].Vitis, 1999,38:145-150.
[14] 熊 江,卢晓鹏,李 静,等.水分胁迫对果实品质的影响研究进展[J].湖南农业科学,2014,(5):57-60.
[15] 黄 英,安进强,张 芮,等.水肥调控对设施延后栽培葡萄产量和品质的影响[J].干旱地区农业研究,2015,33(2):191-195.
[16] Pascual R,Rocío G,Francisco M, et al.Regulated Deficit Irrigation based upon optimum water status improves phenolic composition in Monastrell grapes and wines[J].Agricultural Water Management,2013,121:85-101.
[17] 周 磊,甘 毅,欧晓彬,等.作物缺水补偿节水的分子生理机制研究进展[J].中国生态农业学报.2011,19(1):217-225.
[18] 梁宗锁,康绍忠,高俊凤.植物对土壤干旱信号的感知、传递及其水分利用的控制[J].干旱地区农业研究,1999,17(2):72-78.
[19] Degenhardt B, Gimmler H, Hose E, Hartung W. Effect of alkaline and saline substrates on abscisic acid (ABA) content, transport, and distribution in plants[J].Plant and Soil., 2000,(225):83-94.
[20] Davies WJ, Zhang JH. Root signals and the regulation of growth and development of plants in drying soil[J].Annual Review of Plant Physiology and Plant Molecular Biology.,1991,(42):55-76.
[21] 牛帅科,杨丽丽,孙聪伟,等.葡萄调亏灌溉研究进展[J].中外葡萄与葡萄酒,2016,(5):128-130.
[22] Phogat V,Skewes M A,McCarthy M G,et al.Evaluation of crop coefficients, water productivity, and water balance components for wine grapes irrigated at different deficit levels by a sub-surface drip[J].Agricultural Water Management,2016:1-13.
[23] 刘团结,王 锐.水分胁迫对贺兰山东麓宁酒葡萄光和特性的影响[J].节水灌溉,2013,(7):1-3.
