大鼠脑组织高尔基染色三种制备方法的比较
2017-03-20汤仁仙张冠群牛海晨
王 蕾,张 芳,汤仁仙,张冠群,牛海晨
大鼠脑组织高尔基染色三种制备方法的比较
王 蕾1,张 芳1,汤仁仙1,张冠群2,牛海晨3
脑组织;高尔基染色法;冷冻切片;振动切片;石蜡切片
1873年意大利著名的神经解剖学家卡米洛·高尔基发明硝酸银染色法,从此可以定性定量地观察神经元的形态[1]。随后 Cox等[2-4]对高尔基染色法的固定液和染色液进行改良,提高结果的可视性,但初学者选择合适的染色方法仍较为困难。本实验采用相同的固定、染色和显色液,采用不同的制作方法(冷冻切片、石蜡切片、振动切片)进行大鼠脑组织高尔基染色,比较三种制作方法各自的优缺点,为科研实验和制作典型的教学示教切片提供可选方法。
1 材料与方法
1.1 动物SD大鼠 3只,体重220~240 g,实验操作经徐州医科大学动物伦理审查委员会批准。
1.2 取材首先SD大鼠经10%水合氯醛(国药30037516)腹腔注射进行常规麻醉;然后用生理盐水灌注,去除血液直至澄清;再立刻断头,小心取出3个脑组织,将脑组织根据所需部位,冠状切面修成0.5 cm厚的组织块。
1.3 固定本实验所采用的固定液、染色液和显色液均来自 Genmed的高尔基快速染色试剂盒。将修好的组织块立刻放入装有10 m L固定液 A和10 m L固定液 B的混合液离心管中,室温下避光浸泡、孵育2周。
1.4 制作方法(1)石蜡切片:将固定好的脑组织取出,用去离子水漂洗2次,放入装有 70%乙醇溶液的离心管中,依次梯度乙醇脱水,70%乙醇 24 h,80%乙醇溶液8 h,95%乙醇溶液Ⅰ6 h,95%乙醇溶液Ⅱ5 h,无水乙醇Ⅰ、Ⅱ、Ⅲ各2 h,用二甲苯Ⅰ、Ⅱ各 15 min透明[5]。用蜂蜡和石蜡以 1∶9比例的混合蜡浸蜡、包埋后用普通石蜡切片机冠状切片,切片厚度分别为20、40、60μm,漂片、摊片和烤片后,置于二甲苯脱蜡,梯度乙醇补水至去离子水,用滤纸吸干多余水分后,等待染色。(2)冷冻切片:2周后将组织块取出,用去离子水漂洗2次,放入装有30%的蔗糖溶液的离心管中,在4℃冰箱里浸泡孵育,直至组织块沉到离心管底,将组织取出。用去离子水稍加冲洗后,滴加包埋剂OTC适量于脑组织周围,待稍冷冻后进行冠状切片,切片厚度分别为60、80、100μm,将切好的脑片小心贴在事先挂好胶的明胶玻片上。将贴好的玻片用去离子水漂洗3次,每次5 min。用滤纸吸干多余水分后,等待染色。(3)振荡切片:将脑组织从固定液中取出,用去离子水漂洗2次后振荡切片,切片厚200μm,将切好的脑片收集在装有70%乙醇溶液的离心管中,用毛笔将所需部位的脑片捞出,小心贴在事先挂好胶的明胶玻片上,用滤纸吸干多余的70%乙醇溶液后,将贴好的玻片用去离子水漂洗3次,每次5 min。用滤纸吸干多余水分,等待染色。
1.5染色和封片在50 mL棕色滴瓶加入 10 mL去离子水,然后加入5 mL显色液 A和显色液 B,混匀,标记为显色工作液(有效期限 10天),然后进行以下操作,整个染色过程应避免光照:每块脑片小心滴加500μL显色工作液,铺满整个切片样本表面,室温下孵育30 min,小心用滤纸吸去切片上的染色液,将切片置入去离子水中孵育1 min,用滤纸吸去切片上的去离子水,每块脑片滴加500μL显色工作液,铺满整个切片样本表面,室温下孵育10~30 min,期间可在显微镜下观察,直至组织呈现黑色,即刻中止,避免光照。用滤纸吸去切片上的显色工作液,将切片置入去离子水中孵育1 min,常规乙醇梯度脱水,二甲苯透明,中性树胶封固。
2 结果
在光学显微镜下观察三种制片方法各自的染色结果并拍照。(1)石蜡切片:厚度分别为20、40、60μm,神经元数量依次增加,背景干净呈淡黄色,神经细胞的胞体及树突、轴突皆呈黑色或黑红色。大鼠大脑皮质6层结构层次显示不够清晰,锥体细胞主树突显示逐渐完整,树突数量逐渐增多,轴突逐渐显现,可见星形胶质细胞(图1)。(2)冷冻切片:厚度分别为60、80、100μm,神经元数量依次增加,背景干净呈浅黄色,神经细胞的胞体及树突、轴突皆呈黑色或黑红色。大鼠大脑皮质6层结构逐渐清晰明显,锥体细胞主树突、树突和轴突逐渐显示完整,星形胶质细胞也渐渐显示完整(图2)。(3)振荡切片:厚度分别为200、1 000μm,神经元数量丰富,背景干净呈黄色,神经细胞的胞体及树突、轴突皆呈黑色或黑红色。大鼠大脑皮质6层结构清晰明显,锥体细胞主树突、树突和轴突显示完整,树突棘丰富,星形胶质细胞显示完整(图3)。
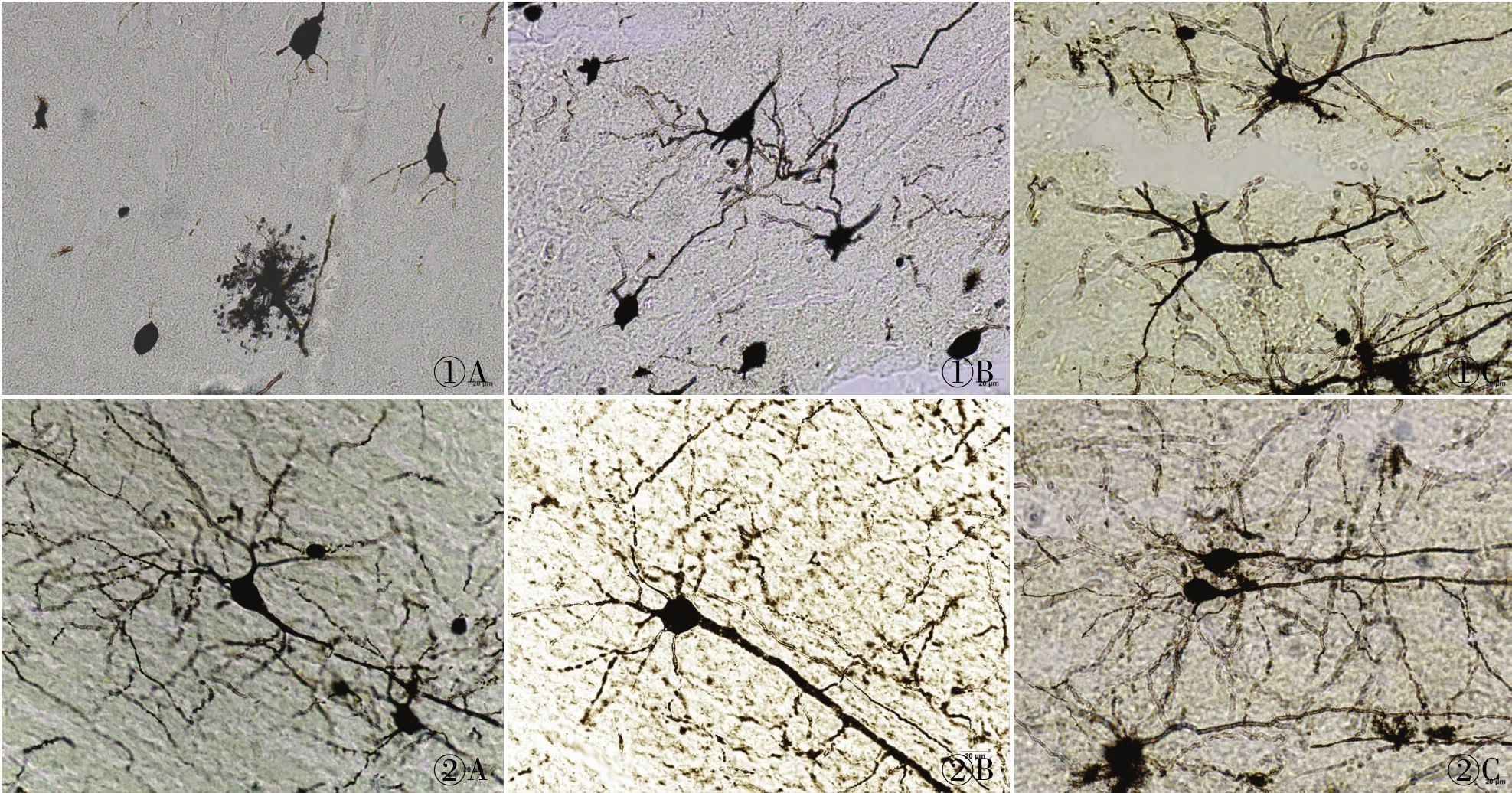
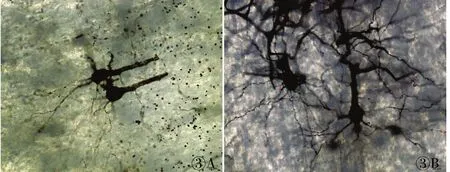
图1 石蜡切片不同厚度的放大效果:A.20 μm;B.40μm;C.60μm
图2 冷冻切片不同厚度的放大效果:A.20 μm;B.40μm;C.60μm
图3 振荡切片不同厚度的放大效果:A. 200μm;B.1 000μm
3 讨论
神经组织由神经细胞和神经胶质细胞组成,神经细胞也称为神经元[6]。大脑皮质的神经元都是多极神经元,根据细胞的形态可分为锥体细胞、颗粒细胞和梭形细胞三大类。(1)锥体细胞:数量较多,可分为大、中、小三型。胞体形似锥形,尖端发出一条较粗的顶树突,伸向皮质表面,沿途发出许多小分支,胞体还向四周发出一些水平走向的树突,轴突自胞体底部发出,长短不一,短的不超出所在的皮质,长的离开皮质进入白质,组成投射纤维和联合纤维。(2)梭形细胞:数量较少,大小不一,胞体为梭形,树突自胞体的上下两端发出,上端树突多伸达皮质表面。轴突从下端树突的主干发出,其终末分支可与锥体细胞形成突触。(3)颗粒细胞:数量最多,胞体较小,成颗粒状。它们的轴突通常较短,终止于附近的锥体细胞或梭形细胞[7]。
大脑皮质的神经元分布,除个别区域外,一般从表面至深层依次可分为6层。(1)分子层:神经元小而少,主要由水平细胞和星形细胞构成,还有许多与皮质表面平行的神经纤维;(2)外颗粒层:主要由许多星形细胞和少量小型锥体细胞构成;(3)外锥体细胞层:较厚,由许多中、小型锥体细胞和星形细胞组成;(4)内颗粒层:细胞排列紧密、多数是星形细胞;(5)内锥体细胞层:主要由中型和大型锥体细胞组成;(6)多形细胞层:以梭形细胞为主,还有锥体细胞和颗粒细胞[7]。
无论是进行科研试验还是制作典型的教学示教切片,观察大脑皮质的神经细胞及其突起、大脑皮质神经元的分层,我们最常用到高尔基染色法。近年来,高尔基染色法最常用的制作方法主要有石蜡[5,8]、冷冻[9]和振荡[10-11]。笔者对这三种方法进行比较,得出以下几点体会:(1)用振荡方法制作的切片,显示大鼠大脑皮质神经元的分层效果最好,层次清晰,神经元数量多,锥体细胞主树突、树突和轴突显示完整,树突棘丰富,星形胶质细胞显示完整,且1 000μm的切片比200μm的切片层次更清晰。(2)用石蜡方法制作的切片,背景最干净,但是受普通轮转切片机最大切片厚度60μm的限制,大鼠大脑皮质 6层结构层次不能清晰显示,锥体细胞的主树突、轴突及树突显示不完整,树突棘很难显示。星形胶质细胞显示不完整。(3)用冷冻方法制作的切片,与石蜡切片一样,受冷冻切片机最大切片厚度100μm的限制,大鼠大脑皮质6层结构层次清晰度介于石蜡切片和振荡切片之间,锥体细胞的主树突、轴突及树突显示较完整,树突棘稀疏;星形胶质细胞显示较完整。(4)石蜡切片和冷冻切片要经过脱水等过程,耗时较长,程序相对振荡,切片复杂,且不易切出完整的切片。(5)石蜡切片厚度经常出现裂片,本实验采用熔点在52~54℃的石蜡和熔点在54℃的蜂蜡以 9∶1的比例混合,浸蜡、包埋,以增加切片的润滑和粘滞性,切片刀和组织块的角度保持在10°以内,可减轻裂片的程度。大于10μm的石蜡切片切后易打卷,我们先把打卷的切片放在60℃温水上,切片会很快展开,接着捞出放入38℃温水上,待蜡片伸展平整后,用事先挂好胶的明胶玻片捞出,解决切片打卷后漂不开,浪费所需部位组织的问题。(6)冷冻切片也会经常出现裂片问题,把冻台温度控制在-17℃,箱内温度控制在 -20℃,且脑组织涂上包埋剂 OTC后,稍冻结后开始切片,能明显改善裂片的问题。(7)振荡切片由于组织较厚,为了背景更加清晰,高尔基染色后可以延长低浓度乙醇溶液的脱水时间,减少高浓度乙醇溶液的脱水时间,封片时由于切片较厚,需增加中性树胶的量才能将脑组织封固,并且能减少盖盖玻片时脑组织开裂。笔者认为振荡切片制作方法观察大鼠大脑皮质层次清晰,锥体细胞主树突、树突和轴突显示完整,树突棘丰富,星形胶质细胞显示完整,且操作简便,稳定性好,组织裂片率低,振动切片机属于特殊的切片机,价格贵,有些实验室不一定有振动切片机。
总而言之,高尔基染色法作为一种准确、可靠的神经组织染色,我们可以根据实验室现有条件,根据科研或者教学的需要选择不同的脑组织厚度,选择合适的切片制作方法。
[1] Golgi C.Sulla struttura della sostanza grigia dell cervello[J].Gazz Med Lombardia,1873,6:244-246.
[2] Cox W.Impragnation des centralen nervensystemsmit quecksilbersalzen[J].Arch Mikr Anat,1891,37:16-21.
[3] Kopsch F.Erfahrungenüber die verwendung des formaldehyds bei der chromsilber-imprägnation[J].Anat Anz,1896,11:727.
[4] Colonnier M.The tangential organization of the visual cortex[J].J Anat,1964,98:327.
[5] 康亚妮,王世忠,刘 皓,等.石蜡切片浸银染色显示大脑皮质神经元的Golgi改良法[J].天津医科大学学报,2006,12(2):294-295.
[6] 丁文龙,王祖承,陆钦池,等.神经、精神系统及感觉器官[M].上海:上海交通大学出版社,2010:16.
[7] 高英茂.组织学与胚胎学[M].北京:高等教育出版社,2010:77.
[8] 李 方,张新江,苏 明,等.改良Golgi-Cox染色法在大鼠脑缺血研究中的应用[J].西北国防医学杂志,2002,2:85-86.
[9] Koyama Y,Tohyama M.A modified and highly sensitive golgi-cox method to enable complete and stable impregnation of embryonic neurons[J].JNeurosci Methods,2012,209(1):58-61.
[10]张富兴,董加强,张卓超,等.一种快速简单显示神经元树突棘的Golgi-Cox法[J].神经解剖学杂志,2009,5:497-500.
[11]Levine ND,Rademacher D J,Collier T J,etal.Advances in thin tissue Golgi-Cox impregnation:fast,reliablemethods formulti-assay analyses in rodentand non-human primate brain[J].JNeurosciMethods,2013,213(2):214-227.
R 44
:B
1001-7399(2017)01-0113-03
10.13315/j.cnki.cjcep.2017.01.032
接受日期:2016-10-31
徐州医学院2015年度院科研课题立项(2015Kj05)
1徐州医科大学基础医学院形态学实验教学中心、3遗传学教研室,徐州 221004
2东南大学医学院附属徐州中心医院神经内科,徐州221009
王 蕾,女,硕士,实验师。E-mail:wawa831214@sina. com
