应激条件下的皮肤创面愈合及其与局部组织中血管紧张素系统的关系
2017-03-20陈阿梅扈瑞平武瑞兵叶纪诚
娜 琴,陈阿梅,扈瑞平,武瑞兵,叶纪诚,邓 凤,程 飚
(内蒙古医科大学基础医学院,内蒙古 呼和浩特 010110)
实验证实,皮肤是应激反应的周围靶器官之一,以前人们已经注意到周围神经、神经肽、神经激素等对皮肤的影响,而应激状态同样影响皮肤的功能[1]。应激可能造成神经内分泌系统稳定性改变,引起许多皮肤疾患,包括创面愈合的失调节[2]。但有关创面愈合方面的研究极少,缺乏机制的探讨和深入认识。本研究建立小鼠应激模型,并在其背部制作全层皮肤缺损创面,与未应激小鼠创面愈合过程进行对比,了解局部组织血管紧张素系统成分在应激状态下的变化特点和规律。为将来合理调控该系统,尽可能改善组织纤维化的愈合结局提供新思路和手段,目的是达到人类所期望的完美组织愈合。
1 材料与方法
1.1 材料
本实验采用6-8周龄的C57BL/6小鼠。皮肤打孔器为自制。束缚应激采用打孔的50 ml离心管进行。主要试剂:ACE,AT1抗体购自美国SantaCruz公司,AT2抗体购自abcam公司。
1.2 方法
1.2.1 小鼠应激模型的建立
应激模型制作方法参照Padgett等1998年制作的束缚应激模型[3],建立这一应激模型后小鼠血清中皮质醇水平是对照组的4倍[4]。
1.2.2 小鼠背部全层皮肤缺损模型的制作
将小鼠麻醉后,在小鼠背部脊柱两侧用特制打孔器(直径0.8 mm,面积0.64 mm2)切割2个圆形创面,深至皮下。手术时间均为上午10∶00,因为这时皮质醇分泌量最大,并且统一时间易于比较[5]。
1.2.3 小鼠创面愈合情况的观察
分别在在制作创面的第0、3、5、7天,于上午10∶00将小鼠麻醉后用半透明薄膜纸描记其背部创面[6]。将薄膜纸上的创面描记图扫描入电脑用photoshop软件计算每个创面的面积和再上皮化率。
2 结 果
2.1 小鼠创面愈合情况的观察
创面描记结果见图1左。描记后将薄膜纸扫描入电脑用photoshop软件计算每个创面的面积,并计算不同创面每个时间点的再上皮化率,结果见图1右。用SPSS13.0软件对创后第5天和第7天创面再上皮化率进行随机区组设计的方差分析,P值为0.005,P<0.01,未应激组和应激组间的差异有显著统计学意义。即,在创后一定时期,应激组的创面再上皮化率比未应激组高。
2.2 q-PCR
由图2右可见与正常对照相比,ACE、AT1、AT2mRNA的表达量在创后都升高,其中ACE和AT1的表达量在应激组都是先下调再升高,而AT2没有下调,在创后立即升高。应激组和未应激组三种mRNA表达的峰值在时间点上有所不同。从相对表达量上来看,在正常对照组织中,AT2的表达量比ACE和AT1都低,但在创伤后AT2表达量的上调值最高。


图1 创面描记与再上皮化率比较
2.3 免疫荧光法检测创面周围皮肤组织中ACE、AT1、AT2和Ki67的表达
图2左上为正常对照,由图可见,正常对照组小鼠皮肤中,ACE在表皮基底层和真皮结缔组织中稍有表达。AT2在表皮基底层和毛囊、汗腺中有表达。而AT1则没有表达。图2左下为创伤后ACE、AT1、AT2染色结果,由图可见与正常组织相比,在创伤后,不管是应激组还是未应激组,ACE、AT1、AT2的表达都增强。ACE主要在真皮结缔组织中表达。AT1的表达最弱,在毛囊外部表达相对较强。AT2在表皮基底及毛囊、汗腺都有表达。ACE和AT2的表达几乎没有重叠现象。图3为Ki67染色结果,由图可见,未应激组从创后第3天开始在表皮基底部与毛囊表达Ki67,直到创后第14天都有表达。而应激组从创后第一天开始即表达Ki67,直到创后第14天。应激组的Ki67表达似乎比未应激组强。


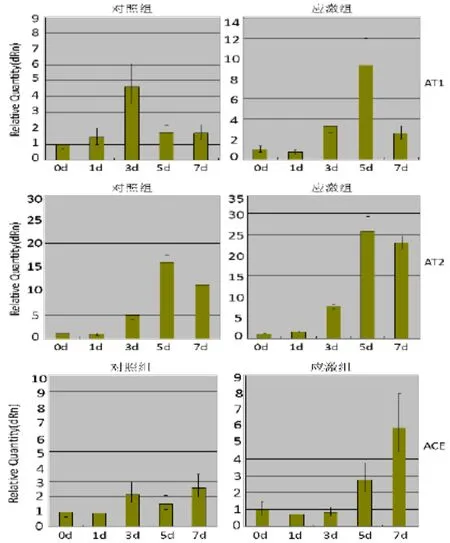
图2 对照组与应激组ACE、AT1、AT2的表达

图3 两组小鼠创伤后14天内,创周皮肤组织的Ki67表达情况
3 讨 论
RAS包括肾素、血管紧张素原、血管紧张素转化酶(angiotensin-converting enzyme,ACE)、Ang I、Ⅱ、Ⅲ。AngⅡ通过靶器官的相应受体而发挥生理效应。AngⅡ的受体主要有AT1和AT2两种亚型。在大鼠和小鼠,AT1受体有两种亚型,分别被命名为AT1a和AT1b。目前没有发现人和其他哺乳类动物的AT1受体有亚型存在。近年又发现有AT3、AT4受体[7]。
RAS激活过程的关键性限速酶之一是ACE,ACE的作用是将血管紧张素I转变为血管紧张素II,本实验PCR结果中创后ACEmRNA的表达升高说明皮肤中有血管紧张素的转换,即有Ang II的生成,说明在创面愈合的过程中血管紧张素及其受体和血管紧张素转换酶等RAS系统成分在局部合成并起作用。从免疫荧光实验结果可见,ACE主要表达在真皮结缔组织中,说明血管紧张素的转换是在真皮完成的,AngI在真皮中转换成AngII后再到毛囊、汗腺和表皮基底层的细胞表面作用于AT1和AT2受体。Sun等研究发现ACE可能通过调节与创伤修复有关物质的浓度来影响皮肤的损伤修复与再生[9]。而这里所说的与创伤修复有关的物质应主要为AngII。ACE主要表达在真皮结缔组织中的实验结果,与Morihara K等的研究结果有出入。他们的研究结果提示,合成Ang II的关键酶ACE存在于表皮的角质形成细胞的胞膜,可调控皮肤细胞的存活、创伤愈合和组织再生[8,9]。
实验中随着创后时间的延长,ACE、AT1、AT2mRNA的表达量都增加,提示他们在创面愈合过程中都是必须的。而且,AT2mRNA的表达量比AT1mRNA高很多。创后21天内应激组AT1mRNA的表达量峰值大约为正常组织AT1mRNA表达量的18倍,未应激组AT1mRNA的表达量峰值大约为正常组织AT1mRNA表达量的6倍,这说明应激状态影响AT1受体的活性。而在创后21天内不论是未应激组还是应激组,AT2mRNA的表达量峰值都达到正常组织AT2mRNA表达量的25倍左右。免疫荧光实验结果也显示AT2受体的表达更强,说明AT2受体在创面愈合中扮演非常重要的角色,血管紧张素主要是通过作用于AT2受体来发挥促进创面愈合的作用。这与Viswanathan等的实验结果很相符,Viswanathan等在2周龄的大鼠实验性皮肤创伤模型中发现AT1和AT2受体在皮肤组织都有表达,伤后第3天在创伤区周围的真皮组织其表达明显增加,主要的受体亚型是AT2受体[10]。De Gasparo M等的研究结果显示,尽管成年后AT2受体似乎被抑制,但在病理情况下,如皮肤损伤、血管损害、心肌损害、神经系统损伤如脑缺血、坐骨神经和视神经横断等,它的表达将明显增加[11]。本实验中AT2受体在创后表达量很高,与上述结果一致。但应激和未应激两组间的AT2mRNA表达量的差别不明显。
创面再上皮化率的实验结果显示,在创后第5至第14天,应激组小鼠的创面再上皮化率比未应激组高(64.4% v.s46.8%,74.2% v.s56.3%,94.6%v.s88.8%)。创周皮肤Ki67表达情况的免疫荧光实验结果显示,应激组从创后第一天即有Ki67的表达,即有增值的细胞,而未应激组在创后第3天开始表达Ki67,比应激组晚,且表达量也没有应激组多。说明应激组创伤愈合过程比未应激组发生的早,而且增值的细胞更多,愈合的更好。随着人类对应激的研究的深入,目前学者们普遍认为适当应激能增强动物对外界有害因素的免疫和防御能力,但应激负荷过强或应激时间过长,将导致机体生理功能紊乱或疾病的发生。
总之,局部组织RAS系统成分在创面愈合中扮演重要的角色。在应激状态下ACE,AT1,AT2等成分的表达在表达量和时间点上与未应激组是有区别的,说明局部组织RAS系统可能是应激反应的通路之一。本课题小组前期关于心理应激对整形美容外科手术前患者焦虑状况的影响及其全身血管紧张素系统的作用的研究结果显示,焦虑状态下的患者血中AngⅠ、AngⅡ和ACE的含量均高于正常对照组,且具有统计学意义。这说明,全身性血管紧张素确实在焦虑发生时产生变化,提示该系统参与机体的应激调控[12]。综上所述,全身性RAS系统和局部组织RAS系统可能都参与应激的调控,应激可能通过RAS系统成分调节创面愈合。
[1] Tausk FA.Stress and skin.Arch Dermatol,2001,137∶78-80
[2] Rattan SI,Sejersen H,Fernandes RA,et al.Stressmediated hormetic modulation of aging,wound healing,and angiogenesis in human cells.Ann N Y Acad Sci,2007,1119∶112-121
[3] David A.Padgett,Phillip T.Marucha,et al.Restraint Stress Slows Cutaneous Wound Healing in Mice.Brain,Behavior,and Immunity,1998,12∶64-73
[4] Pavlovic S,Daniltchenko M,Tobin DJ,et al.Further exploring the brain-skin connection∶stress worsens dermatitis via substance P-dependent neurogenic in fl ammation in mice.J Invest Dermatol,2008,128∶434-446.
[5] Hendrix S.Neuroimmune communication in skin∶far from peripheral.J Invest Dermatol,2008,128∶260-261
[6] Saavedra JM,Ando H,Armando I,et al.Anti-stress and anti-anxiety effects of centrally acting angiotensin II AT1 receptor antagonists.Regul Pept,2005,128∶227-238
[7] 刘宏伟,程 飚,付小兵,等.血管紧张素II受体在皮肤附件中的表达研究.中国医学美容,2006,15∶629-631
[8] Morihara K,Takai S,Takenaka H,et al.Cutaneous tissue angiotensin-converting enzyme may participate in pathological scar formation in human skin.Br J Dermatol,2006,54∶251-257
[9] Sun Y,Weber KT.Angiotensin-converting enzyme and wound healing in diverse tissues of the rat.J Lab Clin Med,1996,127∶94-101
[10] Viswanathan M,Saavedra JM.Expression of angiotensin II AT2 receptors in the rat skin during experimental wound healing.Peptides,1992,13∶783-786
[11] De Gasparo M,Catt KJ,Inagami T,et al.International Union of Pharmacology.XXIII.The Angiotensin II Receptor.Pharmacol.Rev.2000,52∶415-472
[12] 宣 力,聂 军,程 飚,等.整形美容患者术前血管紧张素系统的分析.中国美容医学,2010,4∶534-537.
