广藿香醇抑制幽门螺杆菌脲酶活性及其机制
2017-03-20连大卫许艺飞任文康扶丽君范平龙
连大卫+许艺飞+任文康+扶丽君+范平龙+操红缨+黄萍
[摘要]探讨广藿香醇对于幽门螺杆菌Helicobacter pylori脲酶活性的抑制及其相关基因的表达变化,为进一步研究廣藿香醇对幽门螺杆菌定植感染的影响奠定基础。培养幽门螺杆菌并采用革兰染色、快速尿素酶及PCR的方法鉴定后,在酸性条件(pH 5.3)和中性条件(pH 7.0)培养液中给予不同浓度的广藿香醇干预1 h,应用琼脂稀释法测定细菌的存活率;Berthelot显色法检测细菌的脲酶活性;RT-qPCR法检测细菌中ureA,ureB,ureE,ureH,ureI和nixA相关脲酶基因的表达变化。经过鉴定生长良好幽门螺杆菌在不同浓度的广藿香醇干预后, 细菌存活率没有明显变化;其脲酶活性出现了显著的下降;同时脲酶的相关基因ureA,ureB,ureE,ureH,ureI和nixA的表达均出现不同程度的降低。广藿香醇在酸性条件和中性条件下均可以抑制幽门螺杆菌脲酶的活性,可能与降低细菌脲酶相关的基因表达有关。
[关键词]幽门螺杆菌; 脲酶; 广藿香醇
[Abstract]To investigate the effect of patchouli alcohol on inhibiting Helicobater pylori urease activity, and its effect on expression levels of related genes, and lay the foundation for further research on the effect of patchouli alcohol on H. pylori colonization and infection. H. pyloriwas cultured and identified by gram staining, rapid urease test (RUT) and PCR method. Then agar dilution method was used to detect the bacterial survival after 1 h intervention by different concentrations of patchouli alcoholin the acidic (pH 5.3) and neutral (pH 7.0) conditions; berthelot method was used to detect urease activity and RT-qPCR method was used to detect the expression changes of ureA, ureB, ureE, ureH, ureI, and nixA related urease genes. The results showed that the survival rate of H. pyloriwas not significantly changed but the urease activity was obviously decreased after intervention by different concentrations of patchouli alcohol; meanwhile, the expression levels of ureA, ureB, ureE, ureH, ureI, and nixA were decreased to different degrees. Therefore, patchouli alcohol could inhibit H. pylori urease activity in both acidic and neutral conditions, and the mechanism may be related to down-regulation of urease gene expression.
[Key words]Helicobacter pylori; urease activity; patchouli alcohol
幽门螺杆菌(Helicobacter pylori)属于弯曲杆状的革兰阴性微需氧细菌,定植于宿主的胃部,是世界范围内最常见的传染性病原菌之一,全球有超过50%的人群感染。我国约有6亿以上人口感染,且有呈逐年上升的趋势[1-2]。正常情况下人体的胃内的pH大约在1~2,因此极少有细菌能够在胃中存活下来,而H.pylori能够在此环境下生存主要是依靠其能够产生具有强大活性的脲酶[3],该种酶即使在胃液中也可以充分发挥分解胃液中少量的尿素而产生氨的作用,在幽门螺杆菌周围形成一片“氨云”,中和胃酸保护细菌不被胃酸杀灭[4]。脲酶占据整个细菌可溶蛋白的10%~15%,其不仅是区别于其他胃肠道微生物的主要特征,也是重要的定植和致病因子[5-6]。广藿香是中医常用的芳香化湿类中药,其主要药效研究现多集中于其中的挥发油成分,广藿香醇为广藿香醇挥发油中含量最高的成分[7],各项研究显示了广藿香醇具有良好的抗菌、抗病毒、抗溃疡等方面的作用,具有多种生物活性[8]。本实验旨在观察广藿香醇对于H.pylori脲酶活性的抑制及其作用机制,为进一步研究开发提供依据。
1 材料
1.1 仪器和试剂 Campylobacter agar base(Oxoid,批号1589242);无菌脱纤维羊血[平睿生物科技(北京)有限公司,批号20150917];Brain-heart unfusion(Oxoid,批号1677862);胎牛血清(Gibco,批号730840);革兰染色液试剂盒(海博生物,批号HB8278);细菌基因组DNA提取试剂盒(天根生物,批号DP302-2);Super Real Pre Mix×Plus(天根生物,批号03120);FastQuant RT Kit(天根生物,批号03326);Trizol Reagent(Thermo Life technology,批号28218);麦氏比浊仪(珠海贝索生物技术有限公司); NU-5831E三气培养箱(Nuaire);生物安全柜(ESCO);全波长酶标仪(Thermo); BioSpec-nano核酸分析仪(岛京);CFX 96实时荧光定量PCR仪器(Bio-Rad)。
1.2 细菌 H.pylori(SS1)由澳大利亚莫纳什大学Richard Ferrero教授馈赠。
1.3 樣品的制备 广藿香醇(HPLC>98%),由广州中医药大学新药研究与开发中心苏子仁教授提供。临用前用溶解于DMSO,再配成20,10,5 mg·L-1的含药BHI培养液。
2 方法
2.1 幽门螺杆菌的复苏和传代 将冻存的幽门螺杆菌菌株从超低温冰箱(-80 ℃)取出,复苏于弯曲杆菌琼脂培养基为基础,含7%脱纤维新鲜羊血及联合抗生素(万古霉素10 mg·L-1,甲氧苄氨嘧啶5 mg·L-1、头孢磺啶5 mg·L-1、两性霉素5 mg·L-1) 的血平板上,其中平板分为pH 7的中性平板和pH 5.3的酸性平板。倒置平板置于37 ℃,5%O2,10%CO2,85%N2的培养箱中复苏48~72 h。待细菌长满平板后,使用一次性无菌棉签刮取并重悬于的PBS中接种于新的血平板上,再生长48~72 h。
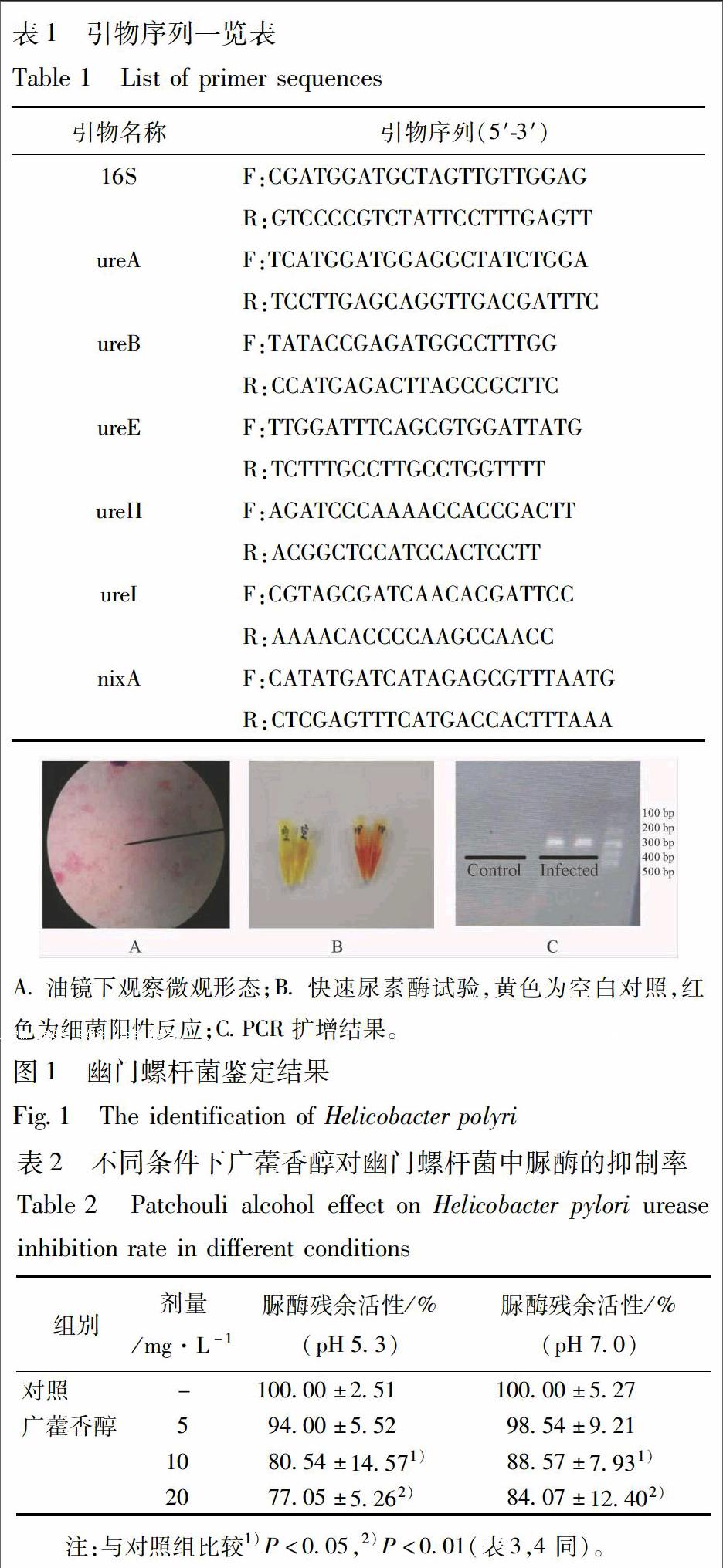
2.2 幽门螺杆菌菌株的鉴定 使用一次性接种环取部分细菌,于载玻片水滴上充分涂布均匀,酒精灯烤干。使用革兰染色试剂盒染色细菌,于显微镜下使用油镜观察细菌形态;取少量菌液置于快速脲素酶试剂里,37 ℃孵育4 h后观察试剂颜色变化;同时取少量单菌落,按照细菌DNA提取试剂盒说明书操作提取DNA,使用引物16 s:5′-TATGACGGGTATCCGGC-3′和5′-ATTCCACTTACCTCTCCCA-3′,扩增条件为94 ℃预变性2 min,94 ℃解链2 s,53 ℃退火2 s,72 ℃延伸30 s,35个循环。配制1.5%琼脂糖凝胶,100 V,35 min,5 μL上样量,对PCR扩增产物电泳检测。扩增产物目的长度为375 bp。
2.3 琼脂稀释法检测幽门螺杆菌存活率 分别收集传代生长的中性和酸性菌株于PBS之中,随后冷冻离心(4 ℃,5 000×g,15 min)去除上清液并重悬于PBS中再洗涤2次。将酸性和中性菌株分别置于对应的酸性(pH 5.3)和中性(pH 7)含10%血清的BHI培养液中,使用麦氏比浊仪调整细菌浓度均为1×108 CFU·mL-1。加入不同剂量的广藿香醇,使受试药物浓度最终分别为20,10,5 mg·L-1,对照组加入等体积的DMSO;放入微需氧环境中孵育1 h。随后取出部分菌液等比例稀释并涂板,再放入微需氧环境中培养3 d后进行菌落计数,观察广藿香醇对幽门螺杆菌存活率的影响。
2.4 Berthelot显色法检测幽门螺杆菌脲酶活性 取部分与不同浓度的广藿香醇共孵育的幽门螺杆菌菌液于离心管中,冷冻离心(4 ℃,5 000×g,15 min)洗涤3次后,置于-20 ℃保存过夜。第2天取出至室温解冻后,超声波振荡冰浴3 min,冷冻离心(4 ℃,15 000×g,10 min)取上清液混合等体积甘油,在离心管中加入等体积尿素溶液(10 mmol·L-1),混匀,室温避光反应20 min,然后加入依据参考文献方法配制的Berthelot显色液[8],混匀,室温显色10 min,吸取反应液在酶标仪上检测其A635,脲酶残余活性(residual activity)=(A样本-A空白)/(A对照-A空白)×100%。
2.5 RT-qPCR法检测幽门螺杆菌脲酶相关基因表达 取部分与广藿香醇共孵育后的幽门螺杆菌菌液,经过3次洗涤后去除上清液,加入1 mL Trizol试剂,参照Trizol说明书方法提取细菌的总RNA,在超紫外分光光度仪上测A260/A280达到1.8~2.0后,按逆转入试剂盒操作方法得到其cDNA。引物设计:委托Takara公司设计并合成引物,具体引物序列见表1。
实时荧光定量RT-qPCR扩增程序按照荧光定量检测试剂盒进行操作,在Bio-Rad荧光定量PCR仪上扩增。扩增条件:95 ℃预变性10 min,95 ℃变性5 s,60 ℃延伸30 s,40个循环。分析结果,得出各组内参基因和目的基因Ct,运用2-ΔΔCt公式计算。
2.6 统计方法 采用SPSS 20.0统计软件,数据以±s表示,组间比较采用单因素方差检验和最小显著性差异法(LSD)及Dunnett′s;以P<0.05或P<0.01作为具有统计学差异的标准。
3 结果
3.1 幽门螺杆菌鉴定结果 涂片经革兰染色后,在油镜下观察幽门螺杆菌形态呈红色弯曲杆状,没有发生球变。刮取菌株置于快速脲素酶反应试剂内,试剂变为紫红色;16s PCR扩增可见在375 bp处有明显的条带。综上表明该菌株为幽门螺杆菌且生长良好(图1)。
3.2 广藿香醇对幽门螺杆菌存活率的影响 与对照组相比,不管在酸性和中性条件下,广藿香醇20,10,5 mg·L-1均对幽门螺杆菌的存活率无明显影响。
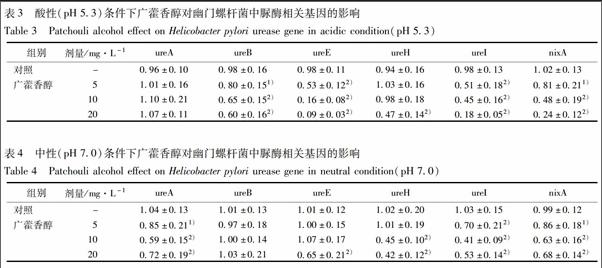
3.3 广藿香醇对幽门螺杆菌中脲酶活性的影响 与对照组相比,广藿香醇20,10 mg·L-1在酸性和中性条件下均可以对幽门螺杆菌中脲酶活性产生明显的抑制效果(表2)。
3.4 广藿香醇对幽门螺杆菌脲酶相关基因表达的影响 与对照组相比,在酸性条件下广藿香醇20,10,5 mg·L-1均可以使幽门螺杆菌中ureB,ureE,ureI和nixA的基因表达出现显著下降,广藿香醇20 mg·L-1可以明显降低ureH基因表达;在中性条件下广藿香醇20,10,5 mg·L-1均可以使ureA, ureI和nixA基因表达出现显著下降,广藿香醇20,10 mg·L-1可以使ureH基因表达明显降低,广藿香醇20 mg·L-1可以明显降低ureE的基因表达(表3,4)。
4 讨论与结论
幽门螺杆菌脲酶是一种六聚体镍金属酶,相对分子质量约为500~600 kDa[9],而脲酶基因簇由多个开放阅读框架构成,其中ureE,ureF,ureG,ureH 为辅助基因,编码脲酶辅助蛋白;ureI 为幽门螺杆菌脲酶特有的基因,编码脲酶特异性通道蛋白;ureA和 ureB 为结构基因,编码脲酶结构蛋白。细菌体内的脲酶成熟过程由细菌内膜上的高亲和力镍转运蛋白NixA独立从外界摄取Ni2+进入细菌体内开始,通过形成二聚体的辅酶蛋白UreE将Ni2+传递给由辅酶蛋白UreF,UreG和UreH组成的复合体,辅酶蛋白复合体携带Ni2+与脲酶前体蛋白(由结构蛋白UreA和UreB构成)的活性中心结合后将携带的Ni2+留在脲酶前体蛋白活性中心,促使其成熟并发挥分解尿素的生物学功能。UreI 为酸激活蛋白,在酸性条件下,UreI 被激活而开启通道,加速转运尿素进入细胞质,最大化脲酶活动水平[10-11]。活化的脲酶不仅其水解的产物可直接损害组织,同时也可以激活单核细胞,导致免疫炎性递质和超氧自由基的分泌,促使空泡的形成介导胃上皮细胞凋亡。
在前期实验中,课题组已经证实广藿香醇具有体外抑制脲酶活性的作用[12],本实验重点探讨广藿香醇是否具有抑制幽门螺杆菌脲酶活性并对脲酶相关基因表达的影响。与对照组相比,不管在酸性或中性的条件下,广藿香醇20,10,5 mg·L-1在与幽门螺杆菌其共孵育的1 h均没有抑菌或杀菌作用,但20,10 mg·L-1出现了明显的脲酶活性抑制效果,说明广藿香醇在酸性和中性的条件下都可以特异性抑制幽门螺杆菌脲酶的活性。为了探讨其作用机制是否与抑制脲酶成熟过程有关,本实验在不同的条件下检测广藿香醇对幽门螺杆菌的脲酶成熟过程所需相关基因表达变化的影响,结果显示酸性条件下广藿香醇对结构基因ureB的表达有显著的抑制作用,而在中性条件下能明显降低结构基因ureA的表达,同时不论条件如何,均可以不同程度的抑制脲酶辅酶基因ureE,ureH,镍离子转运基因nixA和尿素转运基因ureI的表达,其中以广藿香醇20,10 mg·L-1作用更加明显;因此表明广藿香醇具有抑制幽门螺杆菌脲酶活性,可能不仅通过影响脲酶结构基因ureA和ureB的表达,而且与抑制脲酶辅酶基因ureE,ureH以及镍离子转运基因nixA,从而阻断镍离子转运入脲酶前体的活性中心的途径,抑制其成熟有关;同时抑制尿素转运基因ureI,减少尿素与脲酶的接触,进而抑制其分解作用。
鉴于活化后的脲酶在幽门螺杆菌致病过程的重要作用,广藿香醇不仅作为植物源性的化合物具有较低的毒性[13],且具有下调与Ni2+转运的脲酶相关基因表达,阻断脲酶成熟过程,从而高选择性抑制其脲酶活性的作用。研究顯示,Ni2+及相关辅助蛋白对脲酶活性极其重要,阻断脲酶活性位点上的Ni2+与脲酶亚基的结合能有效抑制脲酶活性[14],因此继续对广藿香醇进行深入的结构改造及构效关系研究,有可能开发成新一代的脲酶抑制剂,为从中药中研发抗幽门螺杆菌感染及相关疾病的创新药物奠定重要的基础。
[参考文献]
[1]Bernard M, Josenhans C. Pathogenesis of Helicobacter pylori infection[J]. Helicobacter, 2014, 19(s1): 11.
[2]范竹萍,丁佳.幽门螺杆菌的治疗现状与进展[J]. 世界临床药物,2013,28(12):727.
[3]Kosikowska P, Berlicki L. Urease inhibitors as potential drugs for gastric and urinary tract infections: a patent review[J]. Expert Opin Ther Pat, 2011, 21(6): 945.
[4]Smolka A J, Backert S. How Helicobacter pylori infection controls gastric acid secretion[J]. J Gastroenterol, 2012, 47(6): 609.
[5]Follmer C. Ureases as a target for the treatment of gastric and urinary infections[J]. J Clin Pathol, 2010, 63(5): 424.
[6]Sachs G, Scott D R, Wen Y. Gastric infection by Helicobacter pylori[J]. Curr Gastroenterol Rep, 2011, 13(6): 540.
[7]王俊华, 符红. 广藿香挥发油化学成分气质联用技术分析[J]. 时珍国医国药, 2000(7):579.
[8]谢建辉. 广藿香醇抗幽门螺杆菌相关性胃炎机理研究[D]. 广州:广州中医药大学, 2014.
[9]Dunn B E, Campbell G P, Perez-Perez G I, et al. Purification and characterization of urease from Helicobacter pylori[J]. J Biol Chem, 1990,265(16):9464.
[10]Fong Y H, Wong H C, Yuen M H, et al. Structure of UreG/UreF/UreH complex reveals how urease accessory proteins facilitate maturation of Helicobacter pylori urease[J]. PLoS Biol, 2013,11(10):e1001678.
[11]Voland P, Weeks D L, Marcus E A, et al. Interactions among the seven Helicobacter pylori proteins encoded by the urease gene cluster[J]. Am J Physiol Gastrointest Liver Physiol, 2003,284(1):G96.
[12]Yu X D, Xie J H, Wang H Y, et al. Selective antibacterial activity of patchouli alcohol against Helicobacter pylori based on inhibition of urease[J]. Phytother Res, 2015, 29(1):67.
[13]何景进, 彭绍忠, 谢庆凤,等. 广藿香醇的急性毒性研究[J]. 时珍国医国药, 2012, 23(2):274.
[14]Modolo LV, de Souza A X, Horta L P, et al. An overview on the potential of natural products as ureases inhibitors: a review[J]. J Adv Res, 2015, 6(1): 35.
[责任编辑 张宁宁]
