还脑益聪方提取物含药血清对APP/PS1双基因转染细胞γ分泌酶活性及相关蛋白表达的影响
2017-03-17刘美霞梁晓东刘剑刚
韦 云,刘美霞,梁晓东,刘剑刚,李 浩,魏 芸
(中国中医科学院1.西苑医院、2.老年病研究所,北京 100091;3.北京化工大学化工资源有效利用国家重点实验室,北京 100029)
◇复方药物药理学◇
还脑益聪方提取物含药血清对APP/PS1双基因转染细胞γ分泌酶活性及相关蛋白表达的影响
韦 云1,2,刘美霞1,2,梁晓东1,刘剑刚1,李 浩1,2,魏 芸3
(中国中医科学院1.西苑医院、2.老年病研究所,北京 100091;3.北京化工大学化工资源有效利用国家重点实验室,北京 100029)
目的 观察中药复方-还脑益聪方提取物(Huannao Yicong decoction,HYD)含药血清对β-淀粉样前蛋白swe基因(APPswe)人类早老素(PSEN1dE9,PS1)和早老蛋白1dE9基因(PSEN1dE9)人鼠淀粉样前蛋白融合体(APPswe,APP)双基因转染人胚肾293(human embryonic kidney 293,HEK293)细胞γ分泌酶活性及相关蛋白的影响,分析含药血清影响γ分泌酶活性相关蛋白的作用机制。方法 以人APP/PS1双基因转染(HEK293)人胚肾细胞株为载体,将其分为5组,分别为空白组,7.5%HYD含药血清组,15%HYD含药血清组,HYD直接给药组,γ分泌酶抑制剂-DAPT组,复苏传代后采用细胞计数试剂盒CCK-8(cell counting kit-8,CCK-8)法检测HYD含药血清(大鼠灌胃10 d,取血清并进行血药成分检测)对人APP/PS1双基因转染细胞的生长活力和超微结构的影响;透射电镜观察各组细胞超微结构;双荧光素酶基因检测γ分泌酶活性;蛋白质印迹法(Western blot)检测γ分泌酶组件及相关蛋白早老素1(Presenilin 1,PS1)、鸟苷酸结合蛋白(GTP binding protein,CDC42)、热休克蛋白70羧基端作用蛋白(carboxyl terminus of Hsc70-interacting protein,CHIP)、前咽缺陷蛋白-1α(anterior pharynx defective-1α,Aph-1α)和低氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)的表达。结果 15%HYD含药血清组对细胞株的增殖作用高于其余各血清浓度组(P<0.05,P<0.01);透射电镜显示模型组线粒体膜不完整,有轻微肿胀,线粒体嵴模糊,胞质内有较多的脂褐素沉积,其余各组数量均有一定程度的好转和减轻。γ分泌酶活性结果,给药后24 h和48 h,与模型组比较,直接给药组、DAPT组差异有统计学意义(P<0.05或P<0.01);与DAPT组比较,15% HYD含药血清组差异有统计学意义(P<0.05)。γ分泌酶结果与模型组比较,各给药组的PS1蛋白、CDC42蛋白表达差异有统计学意义(P<0.05,P<0.01),CHIP蛋白表达和Aph-1α蛋白表达无统计学意义(P>0.05),而HYD直接给药组HIF-1α蛋白差异有统计学意义(P<0.05)。结论 HYD含药血清具有改善人APP/PS1双基因转染细胞超微结构、抑制γ分泌酶活性的作用,其机制涉及促进CDC42蛋白的表达,抑制PS1蛋白水解生成PS1 CTF/NTF 异二聚体,同时抑制HIF-1α蛋白的生成,进而降低γ分泌酶的活性。
阿尔茨海默病;γ分泌酶;还脑益聪方提取物;含药血清; 人APP/PS1双转基因细胞;中药复方
阿尔茨海默病(Alzheimer’s disease,AD)的主要病理特征包括大脑皮质弥漫性萎缩,颞叶和海马部位的神经元丢失,细胞内神经纤维缠结(neurofibrillary tangles,NFTs)、老年斑(senile plaques,SPs)形成和细胞外淀粉样斑块沉积等[1-2],是以进行性认知障碍和记忆力损害为主的中枢神经系统退行性疾病。有研究发现,淀粉样前体蛋白(amyloid precursor protein,APP)或早老蛋白-1(presenilin-1,PS1)/γ分泌酶发生突变时,都可以增加β淀粉样蛋白1-42(Aβ1-42)的生成,最终导致AD的发生[3],现代医学对AD的治疗药物主要包括改善脑循环药物、促脑代谢剂、乙酰胆碱酯酶抑制剂、M1胆碱受体激动剂、促乙酰胆碱释放剂等,虽然一定程度上能够减轻AD的症状,但对损伤和丢失的神经细胞作用有限,中药复方治疗AD具有多靶点、多途径、多层次的药效特点,更加楔合AD多因性的发病机制。课题组近年来研究发现,以何首乌(Fleeceflower Root,Radix Polygoni Multiflori)、人参(Panax ginseng,Panax Ginseng C.A.Meyer)、川芎(Ligusticum chuanxiong,Rhizoma Chuanxiong P.E)、黄连(Golden Thread,Rhizoma Coptidis)、石菖蒲(rhizoma acori graminei,Acorus tatarinowii)组成的还脑益聪方(Huannao Yicong Fang, HNYCF)可以明显提高AD模型小鼠的学习和记忆能力,抑制机体氧化应激反应,抑制海马神经细胞凋亡和抗炎等作用[4-5]。同时,课题组与北京化工大学合作,优化、固定了HNYCF的制备工艺[6]并制备了其提取物(Huannao Yicong Direction extract,HYD),使其有效组分的含量可控。
“Aβ毒性级联假说”认为,γ分泌酶是产生 Aβ的限速酶,直接关系到AD的发病与否,其相关调控通路在AD病机研究中已成为热点。为探讨HYD直接干预AD的药理作用,本研究以γ分泌酶中PS1(presenilin 1,PS1)和前咽缺陷蛋白-1α(anterior pharynx defective-1α,Aph-1α)蛋白两个组件为切入点,以人APP/PS1双基因转染细胞株(HEK293)为载体,通过中药血清药理学的方法观察HYD含药血清对AD细胞模型超微结构的影响,及γ分泌酶相关通路中PS1、鸟苷酸结合蛋白(GTP binding protein ,CDC42)、热休克蛋白70羧基端作用蛋白(carboxyl terminus of Hsc70-interacting protein ,CHIP)、Aph-1α和低氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)蛋白表达的变化,探讨HYD治疗AD的可能机制。
1 材料与方法
1.1 动物、细胞株与药物 健康大鼠(Sprague Dawley,SD)30只,♂,体质量(230±20)g,由北京维通利华实验动物有限公司提供,许可证编号:SCXX(京)2011-0004,饲养于清洁级动物室。实验前适应性饲养7d,室温(22~25)℃,湿度(50~70)%,灌胃过程中动物自由摄食和饮水。人APP/PS1双基因转染细胞株(批号:08795844564308)购自上海酶联生物科技有限公司。中药饮片由河北省安国市神农中药饮片有限公司提供,北京化工大学负责制备其提取物。
1.2 细胞的体外培养与传代 细胞接种于包被好的25 cm2细胞培养瓶中,37℃,5% CO2培养箱培养, 2~3 d换液1次。细胞融合至80%左右,吸去培养液,用PBS冲洗1次,轻轻加入1 mL 0.25% 胰酶消化液,消化1~2 min,待细胞变圆开始脱落时,立即加入2 mL含10%胎牛血清(Hyclone,批号:SV30087.02)的杜氏培养基(dulbecco’s modified eagle medium,DMEM)高糖(Hyclone,批号:SH30022.01B)终止消化并反复吹打至细胞悬液,离心1000 r·min-1,4 min,小心弃去上清液,加入DMEM(高糖)完全培养液3~4 mL,反复吹打,制成细胞悬液。将细胞悬液接种于2~3只包被好的T25培养瓶中传代培养。培养3~4代,取处于对数生长期细胞用于实验。
1.3 含药血清的制备 大鼠随机分为2组,即HYD组,20只,HYD按人临床等效剂量的5倍灌胃(18.9 g生药/kg体质量);空白对照组,10只,等量蒸馏水灌胃。每天1次,连续10 d。末次灌胃前12 h禁食不禁水,末次给药2 h[7-11]后水合氯醛(20%,0.9 mL·kg-1体质量)麻醉,腹主动脉取血,室温静置2 h,离心1 000 r·min-1,30 min,分离血清并同组混匀,过滤除菌,分装,放入-80℃冰箱中保存备用。随机取3管含药血清送检。实验动物的处理方法符合中华人民共和国科学技术部《关于善待实验动物的指导性意见》和《北京市实验动物福利伦理审查指南》的要求。
1.4 分组与给药 人APP/PS1双基因转染细胞株培养后分为5组。① 模型组:15%的空白血清孵育细胞株;②7.5%含药血清组:7.5%含药血清组孵育细胞株;③15%含药血清组:15%含药血清组孵育细胞株;④直接给药组:0.316 g·L-1HYD孵育细胞株,加15%的空白血清;⑤γ分泌酶抑制剂——(2S)-N[-N(-3,5-二氟苯乙酰基)-L-丙氨酰]-2-苯基甘氨酸叔丁酯{N-[N-(3,5-difluorophenacetyl)-L-alanyl]-S-phenylglycine t-butyl ester,DAPT}组:0.15 nmol·L-1DAPT(美国Selleck生物公司提供,批号:S2215)孵育细胞株,加15%的空白血清。
1.5 透射电镜观察 收集各组细胞,2.5%戊二醛磷酸缓冲液固定后,0.01 mol·L-1的PBS洗5 min,1% 锇酸固定1 h,0.01 mol·L-1的PBS洗5min,丙酮梯度(50%、70%、80%、90%、100%)逐级脱水,环氧树脂812(Epon812)浸渗,平板包埋,超薄切片(RM2235型,徕卡切片机,Leica slicer ,Germany),3% 醋酸双氧铀-柠檬酸铅双染。应用透射电镜100 kV (H7650型,透射电镜,HITACHI,Japan)进行观察,拍片。
1.6 γ分泌酶活性检测 细胞中加入250 μL的裂解缓冲液(passive lysis buffer),重悬细胞,摇床上摇15 min,离心机最大转速离心15 s,取上清至EP管中,-80℃冻存备用。检测时,首先加入100 μL的荧光素酶检测试剂Ⅱ(Luciferase Assay Buffer Ⅱ),再加入20 μL的样品,吹打混匀,仪器读数(即荧光素酶luciferase值);再加入100 μL停止缓冲液(stop & Glo Buffer),震荡混匀,仪器读数(即海肾renilla值)。两者的比值即为结果。
1.7 Western blot检测 各组细胞用放射免疫沉淀(radio immunoprecipitation assay,RIPA)裂解液(Pierce,美国)提取细胞总蛋白,经6%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳后转至聚偏氟乙烯膜,鸡PS1 IgG(1 ∶1 000,批号:AB5757,Millipore),兔抗鸟苷酸结合蛋白CDC42 IgG(1 ∶500,批号:07-1466,Millipore),兔多抗CHIP IgG(1 ∶500,批号:sc-66830,Santa),兔抗APH1 IgG (1 ∶500,批号:AB9214,Millipore),兔抗HIF-1αIgG(1 ∶200,批号:ab51608,Abcam)4℃孵育过夜,山羊抗兔(1 ∶5 000,批号:s004,凡星博奥),兔抗鸡IgG(1 ∶5 000,批号:E030180-01,EARTH)孵育1 h,采用凝胶成像系统进行吸光度(A)测定。以目的条带与内参β肌动蛋白(β-actin,1 ∶5 000,批号:TDY041,天德悦)的平均A比值表示PS1、CDC42、CHIP、APH1α、HIF-1α蛋白表达的水平。
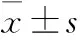
2 结果
2.1 HYD有效组分测定 采用水提醇沉合并醇提的方式并与挥发油混合获取HYD[12],每克HYD相当于生药3.2 g。高效液相色谱(high performance liquid chromatography,HPLC)法建立指纹图谱(Fig 1),发现HYD提取物中含有大黄素(Emodin)、二苯乙烯苷(stilbeneglycoside,THSG)、人参皂苷(ginsenoside,G)Re、Rb1、Rg1、阿魏酸(ferulic acid,FA)和小檗碱(berberine hydrochloride,BHC1)7种主要成分[13]。同时,我们检测了HYD含药血清的有效组分,在送检的3个含药血清样品中,HYD中的7种活性成分并没有全部检测出来。其中,Sample 1#中检测到了THSG、BHC1及Emodin,Sample 2#中检测到了G-Re,Sample 3#中只检测到了BHC1及G-Rb1,含量在10~100 ng·L-1之间(Tab 1)。
2.2 不同浓度HYD含药血清对细胞株活性的影响 据含药血清添加量的相关文献报道[14],设空白对照组(0%)及5个浓度组(2.5%、5%、l0%、15%、20%)对比观察。CCK-8法测定细胞活性。与空白血清组比较,仅15%含药血清明显增加细胞活性(P<0.01)。不同的含药血清浓度对细胞活性差异有统计学意义(F=4.737,P<0.01),见Fig 2。

Fig 1 HPLC fingerprint of HYD extract
1:FA;2:THSG;3:BHC1;4:G-Rg1;5:G-Rb1;6:G-Re;7:Emodin
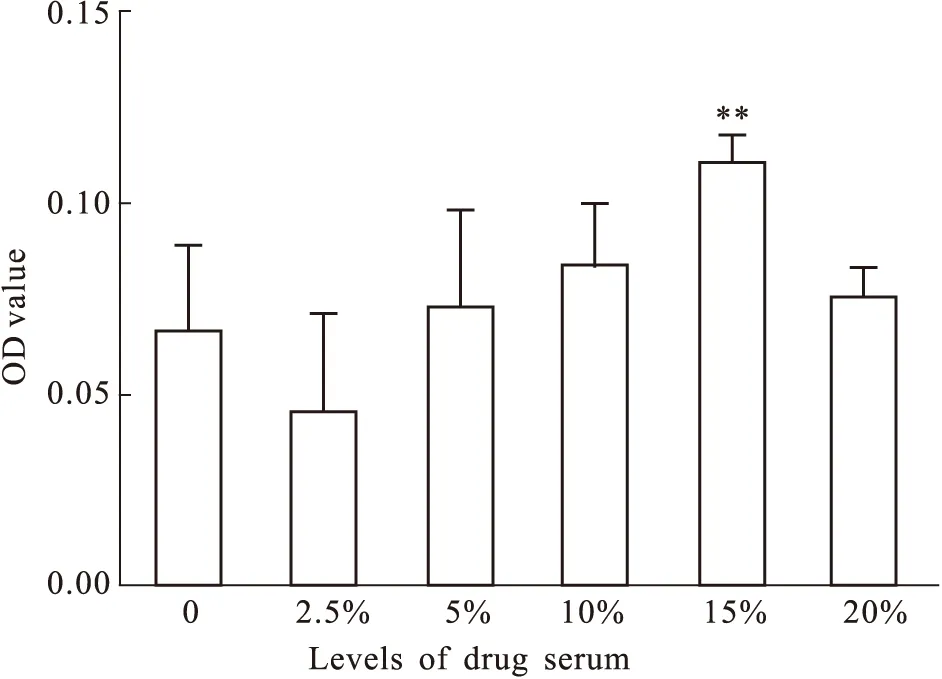
Fig 2 Cytotoxicity of different levels of drug
**P<0.01vsmodel group
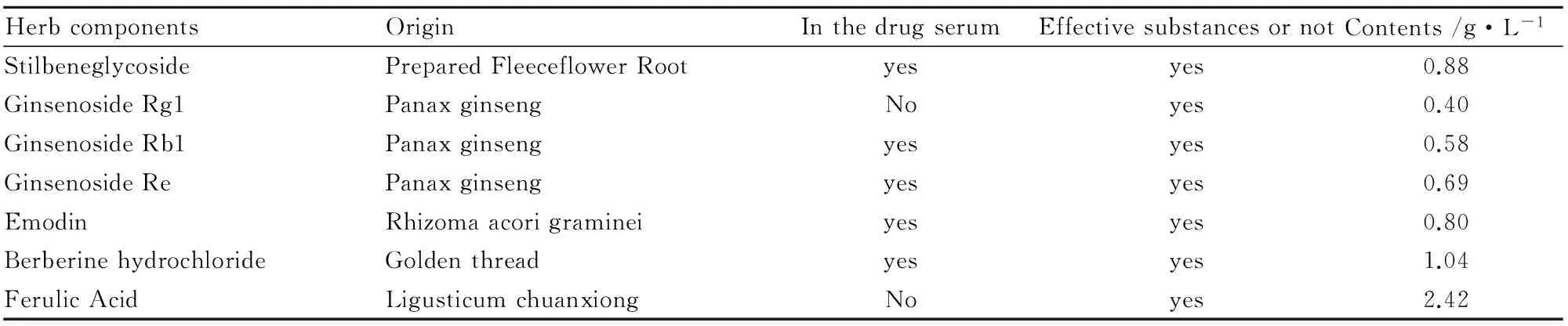
2.3 HYD含药血清对γ分泌酶活性的影响 给药24 h后,组间差异有统计学意义(F=3.583,P=0.017<0.05);与模型组比较,直接给药组、DAPT组差异有统计学意义(P<0.05);与DAPT组比较,15%含药血清组差异有统计学意义(P<0.05)。给药后48 h各组差异有统计学意义(F=13.028,P=0.000<0.01);与模型组比较,差异均有统计学意义(P<0.01);与DAPT组比较,差异均有统计学意义(P<0.05,P<0.01)。组内比较,与给药前比较,15%含药血清组给药48 h差异有统计学意义(P<0.05);直接给药组和DAPT组给药后24 h和48 h差异均有统计学意义(P<0.01)。见Fig 3。
Tab 1 Detection of HYD extract and Medicated serum
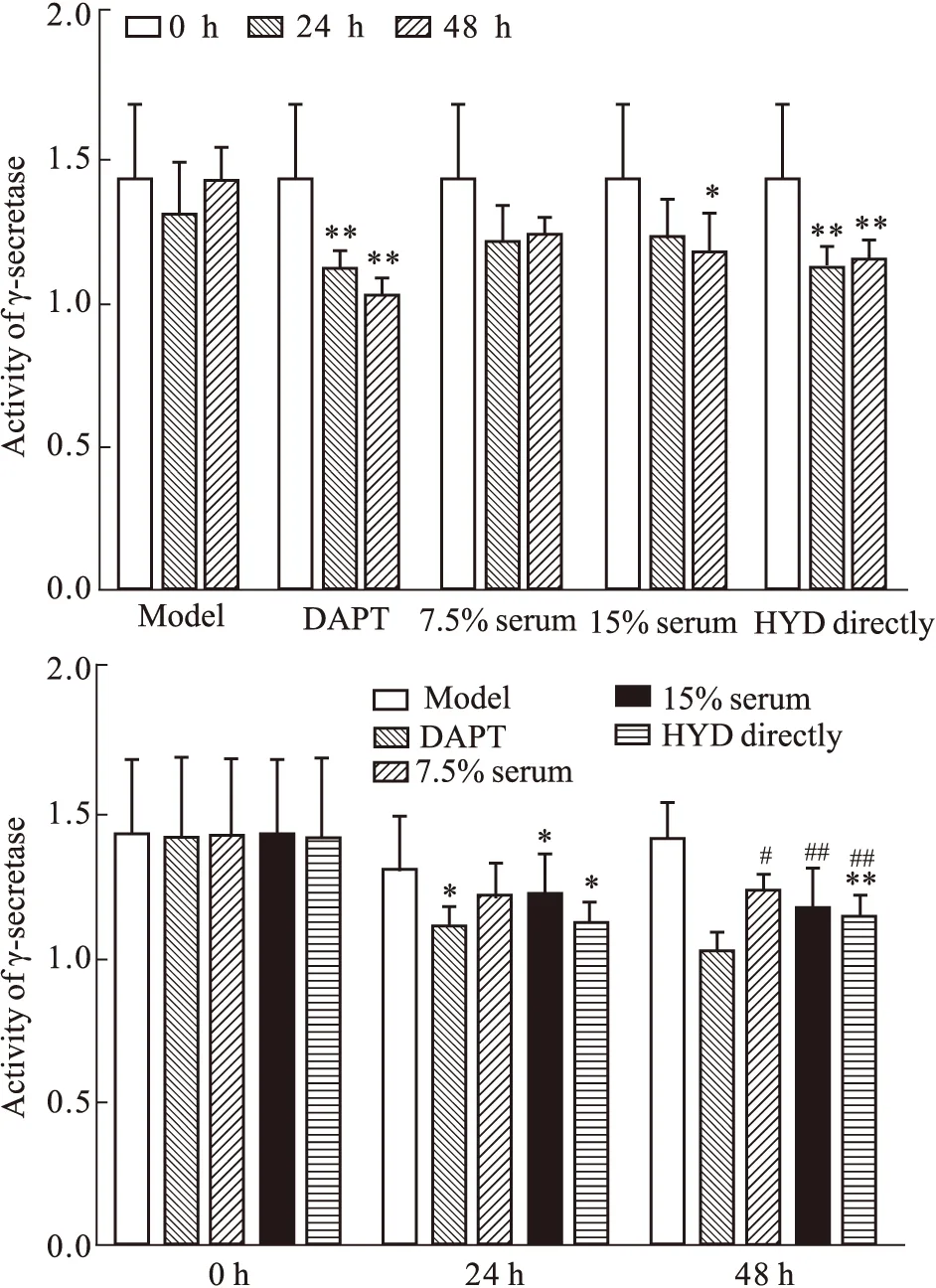

*P<0.05,**P<0.01vsmodel group;#P<0.05,##P<0.01vsDAPT group
2.4 HYD含药血清对γ分泌酶相关组件表达的影响
2.4.1 HYD含药血清对人APP/PS1双基因转染细胞株PS1蛋白表达电泳图的影响 PS1蛋白表达组间比较,给药后24 h组间差异无统计学意义(F=0.907,P=0.479>0.05)。给药后48 h组间差异有统计学意义(F=5.669,P=0.003<0.05);与模型组比较,差异均有统计学意义(P<0.05或P<0.01)。组内比较,与给药前比较,仅DAPT组48 h时差异有统计学意义(P<0.05)。见Fig 4。
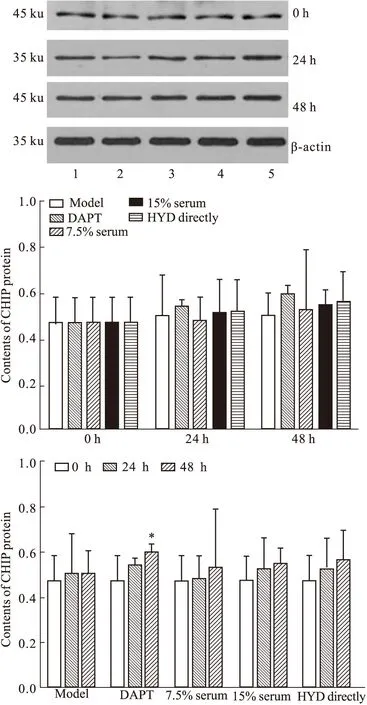
2.4.2 HYD含药血清对人APP/PS1双基因转染细胞株CHIP蛋白表达灰度值的影响 CHIP蛋白表达组间比较,给药后24 h组间差异无统计学意义(F=0.183,P=0.944>0.05)。给药后48 h组间差异无统计学意义(F=0.386,P=0.816>0.05)。组内比较,与给药前比较,仅DAPT组48 h时差异有统计学意义(P<0.05)。见Fig 5。
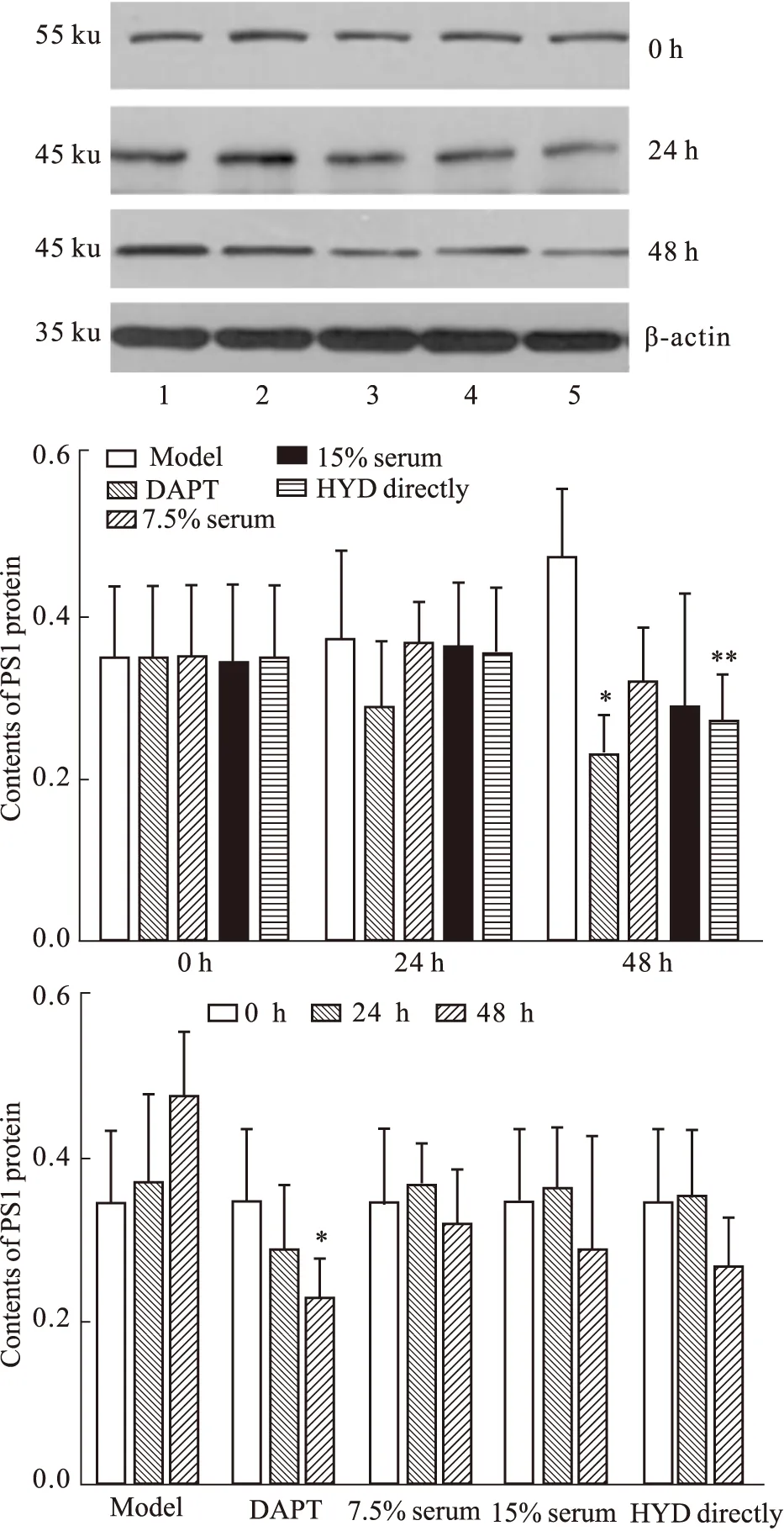

1: Model group;2: 7.5% Serum group;3: 15% Serum group;4: HYD directly group;5: DAPT group.*P<0.05,**P<0.01vsmodel group
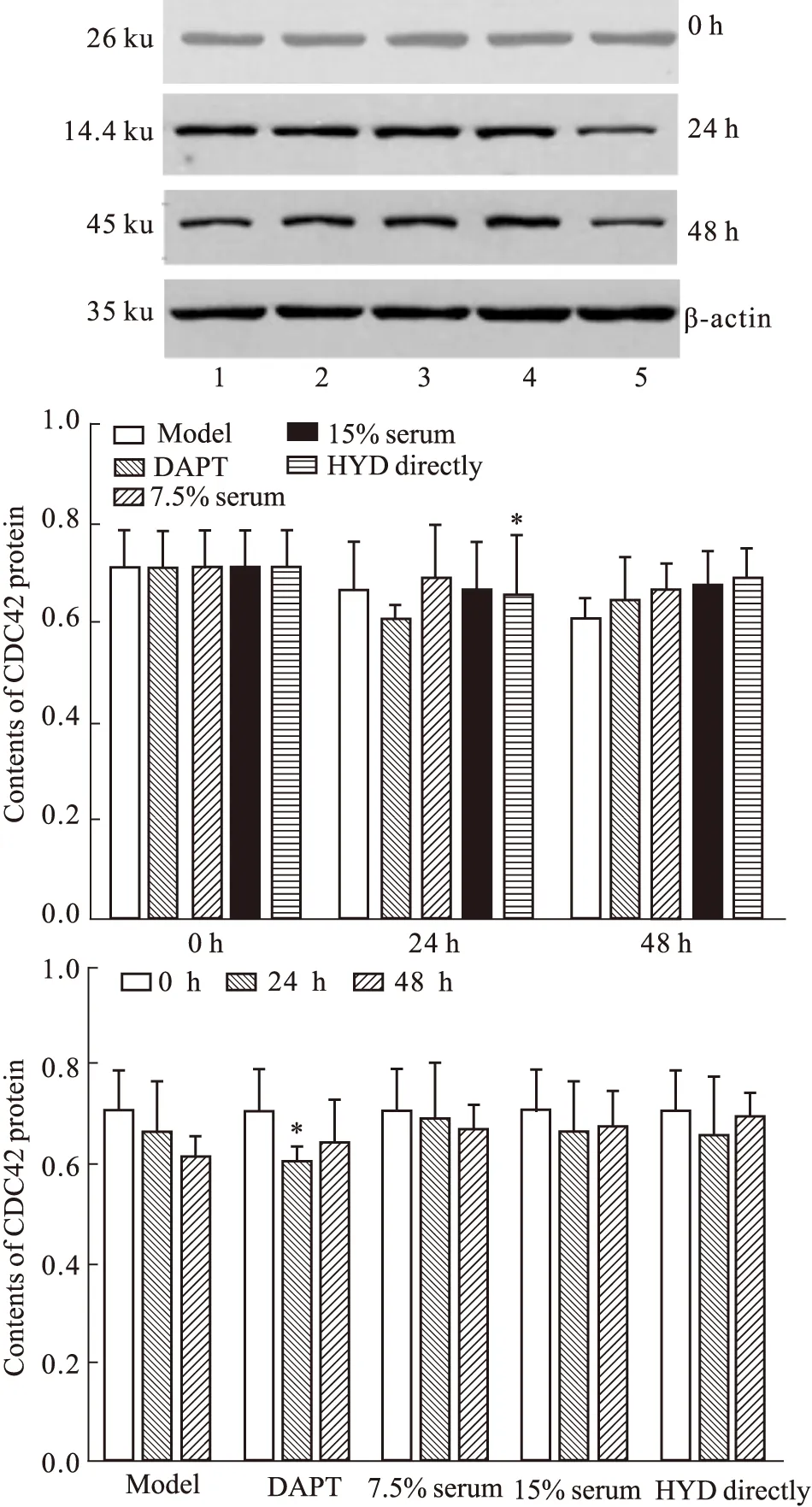
2.4.3 HYD含药血清对人APP/PS1双基因转染细胞株CDC42蛋白表达灰度值的影响 CDC42蛋白表达组间比较,给药后24 h组间差异无统计学意义(F=0.360,P=0.834>0.05)。给药后48 h组间差异无统计学意义(F=1.412,P=0.266>0.05);与模型组比较,直接给药组差异有统计学意义(P<0.05)。组内比较,仅DAPT组24 h较给药前差异有统计学意义(P<0.05)。见Fig 6。

1: Model group;2: 7.5% Serum group;3: 15% Serum group;4: HYD directly group;5: DAPT group.*P<0.05vsmodel group
2.4.4 HYD含药血清对人APP/PS1双基因转染细胞株Aph-1α蛋白表达灰度值的影响 Aph-1α蛋白表达组间比较,给药后24 h组间差异无统计学意义(F=0.175,P=0.949>0.05)。给药后48 h组间差异无统计学意义(F=0.660,P=0.627>0.05)。组内比较,差异均无统计学意义(P>0.05)。见Fig 7。
2.4.5 HYD含药血清对人APP/PS1双基因转染细胞株HIF-1α蛋白表达灰度值的影响 HIF-1α蛋白表达组间比较,给药后24 h组间差异无统计学意义(F=0.202,P=0.934>0.05)。给药后48 h组间差异无统计学意义(F=1.338,P=0.291>0.05);与模型组比较,仅直接给药组差异有统计学意义(P<0.05)。组内比较,仅DAPT组24 h较给药前差异有统计学意义(P<0.05)。见Fig 8。
1: Model group;2: 7.5% Serum group;3: 15% Serum group;4: HYD directly group;5: DAPT group.*P<0.05vsmodel group
2.5 APP/PS1双基因转染细胞株超微结构的改变
2.5.1 线粒体 模型组线粒体膜不完整,有轻微肿胀,线粒体嵴模糊不清;其余各组线粒体膜基本完整,肿胀均有一定改善,线粒体嵴较前清晰。见Fig 9。
2.5.2 脂褐素 模型组胞质内有较多的脂褐素沉积;其余各组数量均有一定程度的减少。见Fig 10。
3 讨论
自从1984年美国国立神经病、语言交流障碍和卒中研究所—老年性痴呆及相关疾病学会 (NINCDS-ADRDA)提出AD的诊断和治疗标准以来,直至2013年第5版精神障碍诊断与统计手册第5版(Diagnostic and Statistical Manual of Mental Disorders , fifth edition,DSM-5)才问世,可见AD相关研究进展的缓慢,已成为医务工作者急需要解决的难题。迄今为止,尚没有一项临床研究被证实是有效的疗法,不是因为没有达到预期的疗效,就是选择了不合适的临床评估方法[15]。随着系统生物学的不断发展,人们发现AD并不是由单一信号通路所介导的,调控疾病网络某一节点的单靶点药物不能满足AD的治疗需求,中药复方的多靶点、多角度、多途径的治疗特点在此极具优势。HNYCF作为治疗AD的有效处方,复方药物不仅立法契合中医药“虚损-瘀毒”的病因病机,相应的作用靶点也针对性的指向AD的主要病理因素,从神经保护到突触可塑性的调节、从神经炎症到调节神经递质的分布都有涉及[4-5,13],同时,制备工艺稳定,有效组分明确及含量相对固定。本实验在明确含药血清中的药物组分的基础上,采用含药血清对细胞株进行干预,避免了HYD自身的理化性质对实验造成的干扰,更利于从分子水平阐明HYD作用机制。研究中HYD与其含药血清检测出的有效组分不尽一致,可能与动物肠胃黏膜的吸收消化,或者化合物在体内以化合物键连接的方式形成了复合物,抑或与药物代谢的周期相关。


1: Model group;2: 7.5% Serum group;3: 15% Serum group;4: HYD directly group;5: DAPT group.
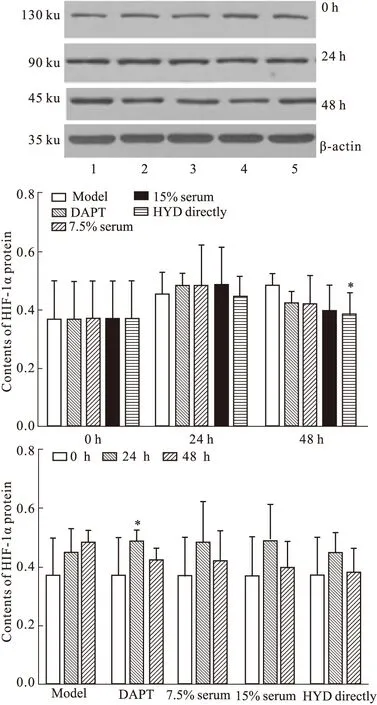

1: Model group;2: 7.5% Serum group;3: 15% Serum group;4: HYD directly group;5: DAPT group.*P<0.05vsmodel group
虽然参与AD发病的病因是多元的,但是“Aβ毒性级联假说”[16]始终占据着重要的位置,此假说认为脑组织中β-淀粉样蛋白(Aβ)聚集而成的老年斑是导致AD的首要原因[17],因此抑制Aβ生成是AD最重要的治疗措施之一[15]。γ分泌酶是一个至少由PS、单过性跨膜蛋白(nicastrin,NCT)、Aph-1、早老蛋白增强子-2(presenilin enhancer-2,Pen-2)等4个亚基按照1 ∶1 ∶1 ∶1的比例组合而成的复合物[18],是催化Aβ生成的终末水解酶,在Aβ产生中起着关键的作用,γ分泌酶活性及相关调控通路可能成为AD中药干预疗效的良好评价体系。本研究发现空白组细胞的γ分泌酶活性在24 h有下降的趋势,与文献报道相符[19],但是48 h时γ分泌酶活性又出现反弹,可能与细胞的持续增殖有关。药物干预后,与给药前比较,15%血清组48 h差异有统计学意义(P<0.05),而直接给药组24 h和48 h差异均有统计学意义(P<0.01),提示HYD可抑制γ分泌酶的活性。
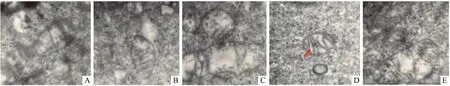
Fig 9 Changes of mitochondrial structure observed in different groups
A: Model group;B: 7.5% Serum group;C: 15% Serum group;D: HYD directly group;E: DAPT group

Fig 10 Changes of lipofuscin among different groups
A: Model group;B: 7.5% Serum group;C: 15% Serum group;D: HYD directly group;E: DAPT group
本次研究仅围绕PS1和Aph-1两条蛋白通路进行分析。目前已证实PS1 水解生成的PS1 CTF/NTF 异二聚体是γ分泌酶的催化活性中心,其发生突变,会使γ分泌酶活性明显下降或完全丧失[20-21]。CHIP和CDC42蛋白是由厦门大学生物医学研究院神经退行性疾病及衰老研究中心用酵母双杂交法筛选出来的与PS1有相互作用的重要细胞信号转导蛋白,CHIP兼有辅助伴侣分子和E3泛素连接酶活性,能够稳定PS1蛋白,进而增强γ分泌酶活性,致Aβ总量增多;CDC42可能与在PS1、APP的转运及调控PS1的转录等过程中起重要调节作用,具体作用机制还需进一步研究。本研究发现,模型组细胞分泌的PS1、CHIP蛋白含量随着时间的延长逐渐增多,而CDC42蛋白有逐渐减少的趋势,拟合AD随年龄增长脑内神经元进行性减少,错误折叠的蛋白进行性增加,病情进行性加重的病理特征。给药48 h后,各给药组的PS1蛋白含量较空白组均明显降低(P<0.05或P<0.01),直接给药组CDC42蛋白表达较空白组下降(P<0.05),CHIP蛋白表达没有差异。APH1是γ分泌酶复合体组装过程中的“支架”,能够稳定有活性的PS蛋白,其中APH-1α在有活性的PS/γ分泌酶复合体形成中发挥重要的作用,其缺失可引起Aβ的生成减少。HIF-1的激活是APH-1α影响γ分泌酶活性的重要转录调控途径[22],APH-1α启动子含有HIF-1的结合位点,HIF-1α亚基的活性和表达决定了HIF-1的生理活性。本研究发现,模型组细胞株分泌的APH-1α和HIF-1α蛋白表达随时间延长逐渐增加,提示细胞内的血氧循环进行性失调,虽然细胞内有自身的保护机制但是不足以抵抗疾病的病理进展,γ分泌酶活性升高,Aβ的产生相应增加,两者作用相互促进。给药48h后,直接给药组的HIF-1α蛋白表达较空白组明显降低(P<0.05),提示HYD可以通过改善AD 细胞模型的血氧循环,影响PS1的稳定性,进而降低γ分泌酶的切割活性以及与酶底物间的有效结合。
同时,本研究也对细胞的超微结构进行了观察。近年来的研究发现[23],AD 患者的认知能力与神经纤维缠结、老年斑的形成并没有直接的关系,而是与脑内线粒体等细胞器超微结构的变化有密切关系。研究发现,APP存在于线粒体膜的表面,而Aβ主要分布在线粒体的基质和嵴上,也可与线粒体外膜和线粒体内膜相互作用[24],这提示AD脑组织的病理改变与Aβ的异常分泌密切相关,Aβ可能通过未知的机制进入线粒体并与相关的蛋白结合,引起线粒体功能的紊乱,损伤神经元的轴突转运,从侧面也验证了“Aβ毒性级联假说”的重要性。通过各组超微结构的比较也可发现,模型组中线粒体嵴溶解断裂,线粒体肿胀数量减少,胞质内脂褐素增加,用药后细胞异常的超微结构都有不同程度的恢复,线粒体嵴增加,脂褐素减少等等,说明HYD对人APP/PS1双基因转染细胞的超微结构有明显的改善作用,可能与减少Aβ的异常分泌,进而增强脑的能量代谢,抑制脂质过氧化反应,提高神经细胞活力有关。
本研究发现,HYD含药血清具有改善人APP/PS1双基因转染细胞超微结构、抑制γ分泌酶活性,其机制可能与促进γ分泌酶相关CDC42蛋白的表达,抑制PS1蛋白水解生成PS1 CTF/NTF 异二聚体,同时抑制HIF-1α蛋白的生成有关,进而降低γ分泌酶的活性有关。
(致谢:本实验在中国中医科学院医学实验中心王毅博士、马淑桦博士指导下完成,谨致谢意!)
[1] Serrano Pozo A, Frosch M P, Masliah E, et al.Neuropathological alterations in Alzheimer disease[J].ColdSpringHarbPerspectMed,2011,1(1):a006189.
[2] Reitz C, Mayeux R. Alzheimer disease: epidemiology,diagnostic criteria, risk factors and biomarkers[J].BiochemPharmacol,2014,88(4): 640-51.
[3] 韦 云,刘剑刚,李 浩,等. γ-分泌酶、淀粉样前体蛋白和早老蛋白1在阿尔采末病中相关性的研究进展[J].中国药理学通报,2014,30(2):167-9.
[3] Wei Y, Liu J G, Li H, et al. Research progress on interactions among γ-secretase,amyloid precusor protein and presenilin-1 in Alzheimer’s disease[J].ChinPharmacolBull, 2014,30(2):167-9.
[4] 李 浩,刘明芳,刘剑刚,等.还脑益聪方提取物对APP转基因小鼠脑组织Aβ生成相关因子和学习记忆行为的影响[J].中国中西医结合杂志,2013,33(10):90-4.
[4] Li H, Liu M F, Liu J G,et al. Effects of Huannao Yicong recipe extract on the learning and memory and related factors of Aβ generation in the brain of APP transgenic mice[J].ChinJIntegrTraditWestMed, 2013,33(10):90-4.
[5] 田 芳,梁 琳,刘剑刚,等. 还脑益聪方对快速老化小鼠脑组织氧化应激及炎性因子的影响[J].北京中医药大学学报,2013,36(11):752-6.
[5] Tian F, Liang L, Liu J G,et al. Influences of Huannao Yicong Fang on oxidative stress and inflammatory factors of hippocampus in rapid aging mice[J].JBeijingUnivTraditChinMed,2013,36(11):752-6.
[6] 李 浩,刘剑刚,刘龙涛,等.一种防治阿尔茨海默病的中药及其制备方法.201110007105.6.[P].中国发明专利,2011-06-01
[6] Li H, Liu J G, Liu L T, et al. A kind of traditional Chinese medicine help to protect against Alzheimer’s disease and its preparation method.201110007105.6.[P]. China’s invention patent, 2011-06-01
[7] 李东薇,窦德强.原人参三醇组皂苷和人参皂苷-Re对MPP+诱导的SH-SY5Y细胞损伤的保护作用[J].神经药理学报,2011,1(5):1-7.
[7] Li D W, Dou D Q. Protective effect of PPT and ginsenoside-Re in MPP+-treated SH-SY5Y cells[J].ActaNeuropharmacol, 2011,1(5):1-7.
[8] 吴 丽,徐春雷,李易彦,等.大黄及大黄蒽醌类有效成分对胰腺腺泡细胞损伤的保护作用[J].中药新药与临床药理,2014,25(5):590-4.
[8] Wu L, Xu C L,Li Y Y,et al. Protective effects of Radix et Rhizoma Rhei and its anthraquinone effective components on pancreatic acinar cell injury[J].TraditChinDrugResClinPharmacol, 2014,25(5):590-4.
[9] 李彩虹,彭 罡,王效军,等.盐酸小檗碱含药血清与血浆抗鼻咽癌CNE-1细胞作用的比较分析[J].医学研究生学报,2013,26(7):676-9.
[9] Li C H,Peng G ,Wang X J,et al. Anti-tumor effect of berberine hydrochloride in the serum and plasma on nasopharyngeal carcinoma CNE-1 cells:a comparative study[J].JMedPostgrad, 2013,26(7):676-9.
[10]黄忠仕,谢海源,张树球,等.含二苯乙烯苷大鼠血清对NG108-15痴呆模型细胞的影响[J].中国药房,2009,20(25):1939-41.
[10]Huang Z S, Xie H Y, Zhang S Q, et al. Effect of TSG-containing rat’s serum on NG108-15 cells model of Alzheimer’s disease[J].ChinaPharm, 2009,20(25):1939-41.
[11]金 红,李 雅,凌 晓,等.健康大鼠服用益肾通络方后血清中阿魏酸的RP-HPLC测定[J].湖南师范大学学报(医学版),2007,4(4):9-10,13.
[11]Jin H, Li Y, Ling X, et al. Determination of ferulic acid in serum of Yishentongluo decoction by RP-HPLC in healthy rats[J].JHunanNormUniv(MedSci), 2007,4(4):9-10,13.
[12]Yanzhen Lu, Hao Li, Jiangang Liu,et al. Simultaneous and sensitive quantification of seven active compounds in Huan-Nao-Yi-Cong-Fang and rat serum by UFLC-ESI/MS[J].AnalyticalMethods,2014,6:5727-33.
[13]刘美霞,刘剑刚,李 浩,等.还脑益聪方提取物对淀粉样前体蛋白/早老蛋白1双转基因痴呆模型小鼠学习记忆能力的改善作用及其机制[J].中国药理学与毒理学杂志,2014,28(1):10-7.
[13]Liu M X,Liu J G, Li H, et al. Effect and mechanism ofHuannao Yicong decoction extract on learning and memory ability of dementia model of amyloid precursor protein/ presenilin 1double transgenic mice[J].ChinJPharmacolToxicol, 2014,28(1):10-7.
[14]Solomon A, Mangialasche F, Richard E,et al. Advances in the prevention of Alzheimer’s disease and dementia[J].JInternMed,2014, 275(3): 229-50.
[15]Schneider L S,Mangialasche F, Andreasen N,et al. Clinical trials and late-stage drug development for Alzheimer’s disease: an appraisal from 1984 to 2014[J].JInternMed,2014,275(3): 251-83.
[16]Hardy J, Allsop D.Amyloid deposition as the central event in the aetiology of Alzheimer’s disease[J].TrendsPharmacolSci,1991,12(10):383-8.
[17]Braak H, Del Tredici K.The pathological process underlying Alzheimer’s disease in individuals under thirty[J].ActaNeuropathol,2011,121(2):171-81.
[18]Nishimura M, Nakamura S, Kimura N,et al. Age-related modulation of γ-secretase activity in non-human primate brains[J].JNeurochem,2012, 123(1):21-8.
[19]De Strooper B,Vassar R,Golde T. The secretases: enzymes with therapeutic potential in Alzheimer disease[J].NatRevNeurol,2010,6(2):99-107.
[20]Brunkan A L,Martinez M,Wang J,et al. Two domains within the first putative transmembrane domain of presenilin 1 differentially influence presenilinase and gamma-secretase activity[J].JNeurochem,2005,94:1315-28.
[21]De Strooper B.Loss- of- function presenilin mutations in Alzheimer disease[J].EMBORep,2007,8(2):141-6.
[22]Wang R, Zhang Y W, Zhang X, et al.Transcriptional regulation of APH-1A and increased gamma-secretase cleavage of APP and Notch by HIF-1 and hypoxia[J].FASEBJ,2006,20(8):1275-7.
[23]Reddy P H, Beal M F. Amyloid beta, mitochondrial dysfunction and synaptic damage: implications for cognitived ecline in aging and Alzheimer’s disease[J].TrendsMolMed, 2008,14(2):45-53.
[24]Pavlov P F, Wiehager B, Sakai J, et al. Mitochondrial γ-secretase participates in the metabolism of mitochondria-associated amyloid precursor protein[J].FASEBJ, 2011, 25(1):78-88.
Effect of Huannao Yicong Decoction extract on activity of γ secretase and γ secretase-related regulation pathway of human APP/PS1 double transgenic cell line
WEI Yun1,2,LIU Mei-xia1,2,LIANG Xiao-dong1,LIU Jian-gang1,LI Hao1,2,WEI Yun3
(1.XiyuanHospitalofChinaAcademyofChineseMedicalSciences,Beijing100091,China;2.InstituteofGeriatricsofChinaAcademyofChineseMedicalSciences,Beijing100091,China;3.StateKeyLaboratoryofChemicalResourceEngineering,BeijingUniversityofChemicalTechnology,Beijing100029,China)
Aim To observe the effect of concise prescriptions of Chinese medicine Huannao Yicong Decoction(HYD) on regulatory pathway of secretase in APP/PS1 double transgenic cell line(HEK293),and to investgate its mechanism. Methods The proliferation of AD cell model and the toxicity of each investigational drugs were ebserved by CCK-8; the changes in microscopic structure of each group were observed by(Transmission electron microscope,TEM); the activities of gamma-secretes was observed by Dual Luciferase Reporter Gene Assay Kit ,and then the expression of presenilin 1(PS1),carboxyl terminus of Hsc70-interacting protein(CHIP),GTP binding protein(CDC42), anterior pharynx defective-1α(APH-1α),Hypoxia inducible factor-1α(HIF-1α) were detected by Western blot. Results 15% HYD serum increased the cell activity compared to blank serum(P<0.01).Under TEM,human APP/PS1 Double Transgenic cell line’s mitochondria showed swelling and degenerat, and lipofuscin was deposited;after 48 h of medication,the swelling of mitochondria was reduced and crista was clear, and the number of lipofuscin was reduced. For the activity of γ secretase, after 24 h medication, compared to control group, HYD directly group and DAPT group obviously inhibited the activity of γ secretase(P<0.05 orP<0.01), compared to DAPT group,only 15% serum containing HYD group had significant difference(P<0.05); after 48 h medication, compared to control group,the other group all showed significant difference(P<0.05 orP<0.01).For the influence of PS pathway, after 48 h medication, compared to control group,the other group all inhibited the PS1protein expression(P<0.05 orP<0.01), HYD directly group could activate the CDC42 protein expression(P<0.05); compared to 0 h midicaiton,DAPT group inhibited the CHIP protein expression at the point of 48 h(P<0.05) and activated the CDC42 protein expression at the point of 24 h. For the influence of Aph-1 pathway, there was no significant difference for Aph-1α(P>0.05); compared to control group,HYD directly group inhibited the HIF-1α protein expression after 48h medication(P<0.05); compared to 0h midicaiton, DAPT group inhibited the HIF-1α protein expression at the point of 24 h(P<0.05).Conclusions HYD can treat AD through protecting the mitochondrial function,reducing the formation of lipofuscin,inhibiting the activity of γ secretase by down-regulating the activity of HIF-1α,decreasing the stability and activity of PS1 by promoting the expression of CDC42. This shows that HYD has good research and development prospect as an effective drug for prevention and treatment of AD.
Alzheimer’s disease(AD);γ secretase;extract of Huannao Yicong Decoction;serum containing drug;human APP/PS1 double transgenic cell line;Chinese medicine compound
时间:2017-3-4 11:50
http://kns.cnki.net/kcms/detail/34.1086.R.20170304.1150.048.html
2016-10-12,
2016-12-19
国家自然科学基金资助项目(No 81573819);北京市科技计划课题“十病十药”研发项目资助课题(No Z141100002214003);北京市自然科学基金项目(No 7162169)
韦 云(1981-),女,博士后,主治医师,研究方向:老年病的中西医结合临床研究,E-mail:weiyun_0913@163.com; 李 浩(1965-),男,博士,主任医师,研究方向:老年病的中西医结合临床研究,通讯作者,E-mail:xyhplihao1965@126.com
10.3969/j.issn.1001-1978.2017.03.024
A
1001-1978(2017)03-0417-10
R-332;R285.5;R322.81;R338.64;R341;R394.2;R745.7;R977.6
