LC-MS/MS法测定家兔血浆中卤米松浓度及其药动学研究
2017-03-17刘静媛武丽南杨元辉魏广力司端运
刘静媛,武丽南,杨元辉,谷 元,魏广力,司端运
(1.天津医科大学研究生院,天津 300070;2.天津药物研究院释药技术与药代动力学国家重点实验室,天津 300193)
LC-MS/MS法测定家兔血浆中卤米松浓度及其药动学研究
刘静媛1,2,武丽南2,杨元辉2,谷 元2,魏广力2,司端运2
(1.天津医科大学研究生院,天津 300070;2.天津药物研究院释药技术与药代动力学国家重点实验室,天津 300193)
目的 建立测定家兔血浆中卤米松浓度的LC-MS/MS方法,研究卤米松乳膏经皮给药后家兔体内卤米松的药代动力学特征。方法 以地塞米松为内标,血浆样品采用甲基叔丁基醚液-液萃取的处理方法,以Diamonsil C18柱(100 mm×4.6 mm,5 μm)分离,甲醇、2 mmol·L-1乙酸铵为流动相进行梯度洗脱,通过电喷雾电离源进行负离子检测,检测离子对为m/z503.1→413.0(卤米松),m/z391.0→361.0(地塞米松,内标);以经过严格方法学验证的LC-MS/MS法测定家兔单次经皮给药(1 g/100 cm2)后血浆中卤米松的浓度。结果 家兔血浆中卤米松的线性范围为0.02~20 μg·L-1,低、中、高质控浓度的批内、批间精密度(RSD)介于3.72%~7.87%之间,准确度在99.1%~103%之间。家兔单次经皮给予卤米松乳膏后的主要药代动力学参数Tmax、Cmax、AUC0-t、T1/2分别为:(7.38±1.06)h、(1.16±0.527)μg·L-1、(18.8±7.23)h·μg·L-1、(13.8±3.70)h。结论 该LC-MS/MS分析方法灵敏度高且样品处理方法简便,通过了严格的方法学验证,可用于卤米松乳膏皮肤给药后,家兔体内卤米松的药代动力学研究。
卤米松;LC-MS/MS;家兔;药代动力学;血药浓度;经皮给药
皮质激素用于治疗局部皮炎湿疹具有较好的效果,目前仍是临床治疗的首选药物[1-2]。卤米松是一种强效含卤基的外用糖皮质类固醇药物,0.05%卤米松乳膏可减轻皮炎的皮肤瘙痒等临床症状,在抗炎、抗毒、抗过敏和免疫抑制等方面发挥重要作用[3]。临床研究表明,卤米松可用于治疗多种皮肤炎症,与其他强效的皮质类固醇药物具有同等的治疗效果,具有良好的耐受性和安全性,0.05%卤米松乳膏已经广泛用于中国和其他东南亚国家的临床治疗[4]。
目前,卤米松或其它糖皮质激素类含量测定的技术主要有:微分脉冲极谱法(differential pulse polarography, DPP)、高效液相色谱法(high performance liquid chromatography, HPLC)[5-7]和气相-质谱联用检测法(gas chromatography-mass spectrometer, GC-MS)[8]等,但这些方法易受内源性糖皮质激素影响、灵敏度低或样品处理过程较为复杂。秦慧[9]在研究糖皮质激素的检测新方法中,对比传统方法,其建立了灵敏度为0.1 μg·L-1的超声辅助浊点萃取-HPLC检测方法,而本文建立的LC-MS方法灵敏度更高,最低定量下限为0.02 μg·L-1,且经方法学验证无内源性干扰。卤米松药代动力学的相关研究还未见报道,已经发表的文献主要是有关于皮质类固醇药物局部皮肤给药后的药理学评价[10-13],所以建立一种快速、简便、灵敏度高的体内卤米松浓度测定方法,考察经皮给药家兔后卤米松的药代动力学特征,对于糖皮质激素类药物的研究以及皮肤外用药的研究、临床用药和临床评价具有重要参考价值。
本文建立的LC-MS/MS方法,色谱分离度高,特异性、灵敏度高,所用血浆样品体积小(100 μL),样品处理简便,并可用于考察0.05%卤米松乳膏经皮给药后家兔体内卤米松的药代动力学特征。
1 材料
1.1 药品与试剂 卤米松(纯度99.6%,批号20150301)、地塞米松(纯度99.1%,批号NUD150202)均由天津药业研究院有限公司提供。卤米松乳膏(含量0.5 mg·g-1,规格15 g,批号1406530)由中国香港澳美制药厂生产。甲醇(色谱级,美国Fisher公司);乙酸铵(分析级,天津市光复科技发展有限公司);甲基叔丁基醚(色谱级,美国Tedia公司)。
1.2 仪器 Prominence 30 A液相色谱仪(日本Shimadzu公司),配有LC-30AD二元梯度泵,SIL-30AC自动进样器,CTO-30A柱温箱,DGU-20A5脱气机;Sciex TRIPLE QUADTM 5500型三重四级杆串联质谱仪(美国Applied Biosystems公司),配有电喷雾离子化源(ESI)及Analyst 1.5.2数据处理软件;XS105型分析天平(瑞士METTER TOLEDO公司);Sorvall Legend Micro 17R台式高速冷冻离心机(Thermo Scientific公司);样品浓缩仪(Turbo Vap LV型,美国Caliper公司);纯水制备系统(BM-40型,北京中盛茂源科技发展有限公司)。
1.3 实验动物 8只健康日本大耳白兔,普通级,♀♂各半,体质量2.1 kg~2.7 kg,购于北京隆安实验动物养殖中心,生产许可证号:SCXK(京)2014-0003,动物质量合格证号:No.11401400000479。
2 方法
2.1 色谱与质谱条件 色谱条件:色谱柱:Diamonsil C18柱(100 mm×4.6 mm, 5 μm);柱温:40℃;流动相A:甲醇;流动相B:2 mmol·L-1乙酸铵(含5%甲醇);梯度洗脱方案如下:0~3.5 min(30% B)→3.6~7.0 min(5% B)→7.1~10 min(30% B),流速为0.5 mL·min-1,仪器运行时间为10 min;进样量:10 μL。
质谱条件:离子化源:电喷雾离子化源(ESI),负离子检测;喷雾电压:-4 000 V;源温度:500℃;卷帘气:20 psi;碰撞气:6 psi;入口电压:-10 V。用于定量分析卤米松和地塞米松的离子对分别为m/z503.1→413.0(卤米松),碰撞能为-22 V;m/z391.0→361.0(IS:地塞米松),碰撞能为-18 V,卤米松和地塞米松(内标)的质谱图见Fig 1。
2.2 标准品溶液配制 精确称取卤米松标准品适量,用甲醇溶解定容配制成浓度为0.1 g·L-1的储备液。再用甲醇进一步依次稀释成系列标准溶液,浓度为1、2.5、10、50、250、1 000 μg·L-1,质控溶液浓度为2.5、50和800 μg·L-1。
精确称取地塞米松(内标)标准品适量,用甲醇溶解定容配制成浓度为0.1 g·L-1的储备液。取适量上述储备液,用甲醇稀释为50 μg·L-1的内标工作液。
2.3 血浆校正曲线及质控样品配制 精密吸取系列标准溶液10 μL,用空白家兔血浆按1 ∶50比例稀释成系列血浆校正曲线样品,血浆药物浓度范围为0.02~20 μg·L-1;同样,制备血浆低、中、高浓度(0.05、1、16 μg·L-1)质控样品。然后,按样品处理方法处理样品。
2.4 样品处理方法 向100 μL含药家兔血浆样品中加入50 μL内标工作液(50 μg·L-1)和1 mL甲基叔丁基醚,涡旋1 min后4℃ 12 000 r·min-1离心5 min,取上清液800 μL于干净玻璃试管,40℃氮气吹干后残留物用100 μL 70%甲醇-水溶液复溶,将该复溶液取出置于内插管中,4℃ 12 000 r·min-1离心10 min后,进样10 μL进行LC-MS/MS定量分析。
2.5 方法学验证
2.5.1 特异性 分别取6个不同来源的家兔空白血浆,除不加内标外(改加同体积甲醇溶液),其余按“2.4”项下操作,制备空白样品。通过比较家兔空白血浆样品、LLOQ样品和家兔经皮给药后的生物样品的色谱图,考察本研究方法的特异性。
2.5.2 线性 按“2.4”项方法处理血浆校正曲线样品后进样分析。用加权最小二乘法(权重为1/χ2),以待测物与内标物的峰面积比值(Y)和待测物浓度(X)进行回归运算,求得的直线回归方程即为血浆校正曲线。
2.5.3 灵敏度、精密度与准确度 按“2.3”项下配制浓度为0.02、0.05、1、16 μg·L-1的灵敏度及质控血浆样品,按“2.4”项方法处理分析,每个浓度6样本,连续进行3个批次,应用校正曲线计算出各浓度,考察批内、批间精密度和准确度。
2.5.4 基质效应和提取回收率 对卤米松低、中、高3个浓度进行生物样品中基质效应和提取回收率测定,每个浓度6样本。
取20 μL质控溶液(2.5、50、800 μg·L-1)和500 μL内标工作液混合,40℃水浴氮气吹干后以1250 μL 70%甲醇-水溶液复溶,进样分析记录卤米松和地塞米松的色谱峰面积A;取100 μL空白家兔血浆除不加内标外(改加同体积甲醇溶液),按“2.4”项提取样品后,用100 μL上述样品A复溶,进样分析记录卤米松和地塞米松的色谱峰面积B;按“2.3”项配制质控血浆样品(0.05、1、16 μg·L-1),然后按照“2.4”项操作,记录卤米松和地塞米松的色谱峰面积C。
色谱峰面积比B/A×100%为卤米松和IS的基质效应;色谱峰面积比C/B×100%为卤米松和IS的提取回收率。
2.5.5 稳定性 精密吸取低、高质控溶液(2.5、800 μg·L-1) 10 μL,用空白家兔血浆按1 ∶50比例稀释成浓度为0.05、16 μg·L-1的稳定性血浆样品,每个浓度6样本。考察样品室温(25℃)放置24 h,-80℃循环冻融3次以及-80℃长期冻融12 d稳定性,并将按“2.4”项处理后的样品于进样器放置48 h,考察处理后样品进样器放置的稳定性。
2.6 家兔体内的药代动力学方案 健康家兔于给药前剃掉背部及两侧兔毛,将1 g(含卤米松0.5 mg)卤米松乳膏均匀涂布在家兔100 cm2(10 cm×10 cm)皮肤表面,药物持续涂敷6 h后清洗。于给药后1、3、6、7、9、12、15、24、48、72 h各时间点于耳缘静脉收集血样1 mL(肝素抗凝),4℃ 12 000 r·min-1离心5 min收集血浆,-80℃冻存直至进行血浆样品测定。
2.7 数据处理与药动学参数计算 应用Analyst 1.5.2数据处理软件,对待测物卤米松和内标地塞米松进行积分,得出峰面积。以待测物浓度(X)为横坐标,待测物与内标物的峰面积比值(Y)为纵坐标,用加权最小二乘法(权重为1/χ2)进行回归运算,求得的直线回归方程即为血浆校正曲线。采用计算机软件默认的四舍五入规则,对所有小于1 000的测定与计算数据保留3位有效数字。采用WinNonlin 6.3药代软件,选择非房室模型统计矩法计算血浆药代动力学参数。
3 结果
3.1 家兔血浆中卤米松含量分析方法学验证 严格按照化学药物非临床药代动力学研究技术指导原则[14],对建立的LC-MS/MS进行方法学验证,评价方法的可行性。
3.1.2 灵敏度、精密度与准确度 卤米松在低、中、高质控浓度批内、批间RSD值分别介于3.72%~4.95%和3.99%~7.87%,准确度在99.1%~103%之间,在LLOQ(0.02 μg·L-1)浓度下的批内、批间RSD值分别为6.40%和19.4%,准确度为94.2%,结果见Tab 1,均符合样品分析要求。
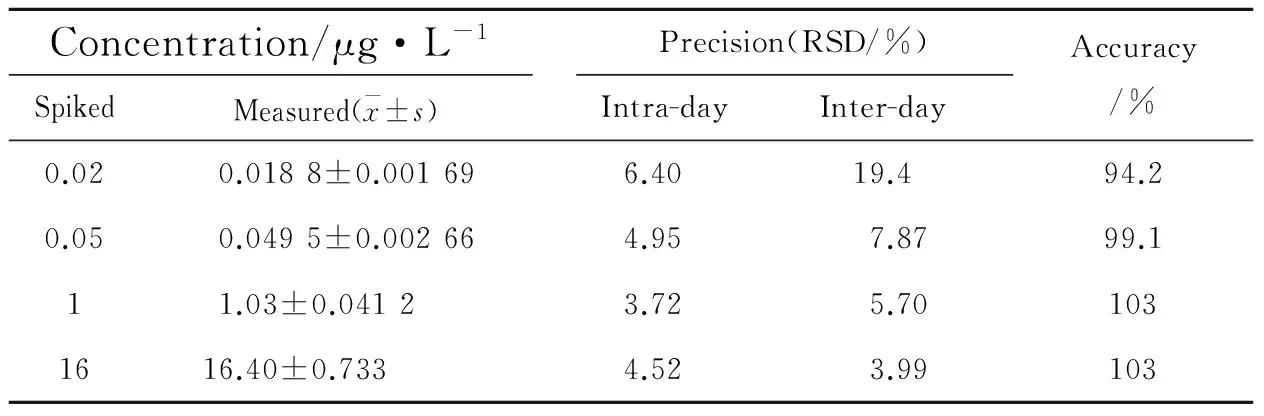
Tab 1 Precision and accuracy of halometasonein rabbit plasma by LC-MS/MS(n=6)
3.1.3 提取回收率和基质效应 在0.05、1、16 μg·L-13个质控水平上卤米松的提取回收率在91.8%~101%之间,基质效应范围介于99.6%~110%之间;内标的提取回收率和基质效应分别在93.0%~100%和99.1%~105%之间。结果如Tab 2所示,卤米松、内标提取回收率和基质效应均满足样品分析的要求。


Recovery/%AnalytesHalometasoneISMatrixeffect/%HalometasoneISLQC95.9±2.3996.0±3.00106±3.70104±1.18MQC92.7±0.8796.8±3.13102±1.51100±0.91HQC99.0±2.1097.0±3.21101±1.43102±0.98
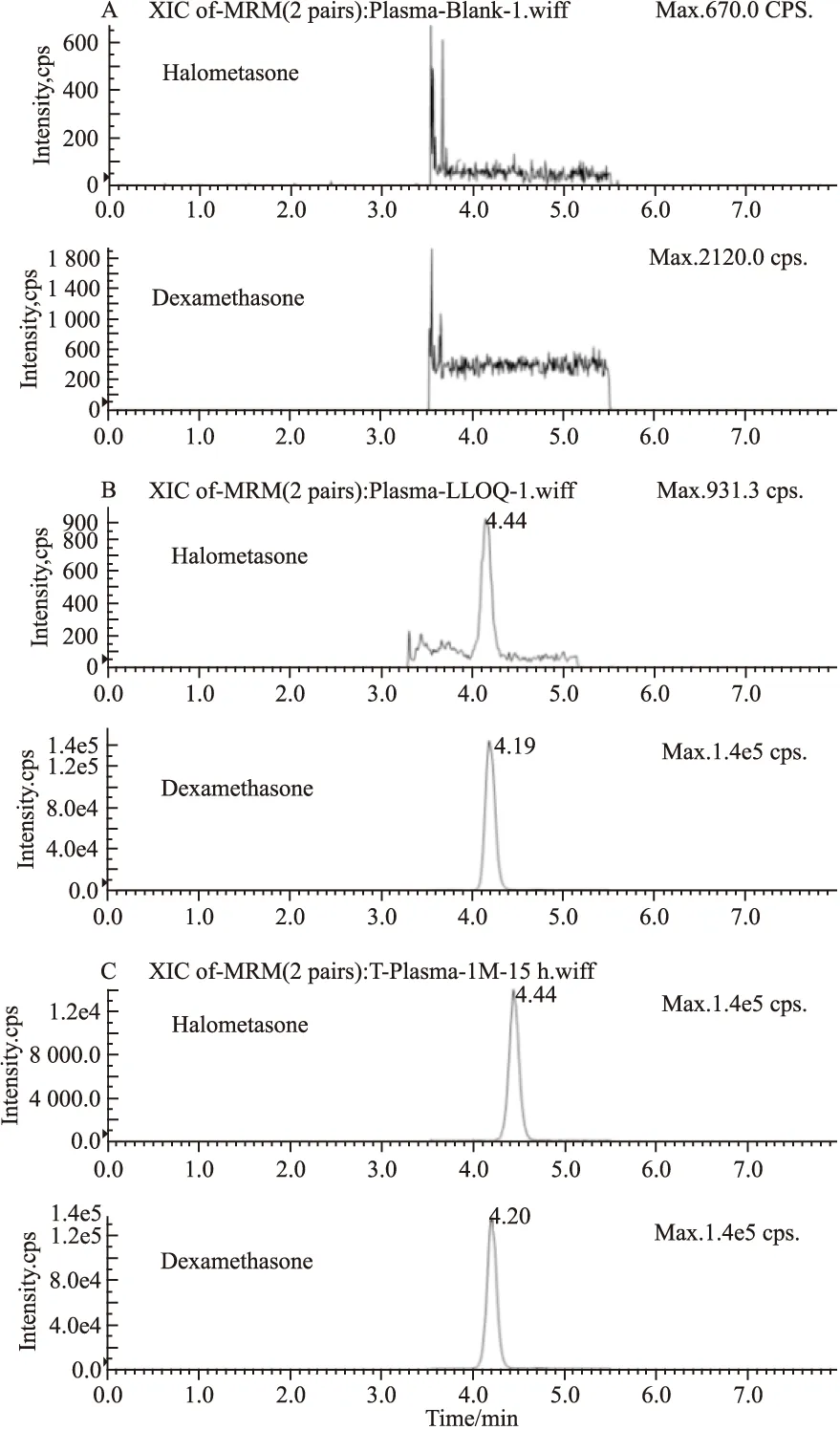
Fig 2 Typical MRM chromatograms of halometasoneand dexamethasone(IS) in rabbit plasma by LC-MS/MS
A:A blank rabbit plasma sample;B:A rabbit plasma spiked with halometasone(0.02 μg·L-1) and dexamethasone(50 μg·L-1);C:A rabbit plasma sample from 15 h after dermal topical administration of 1 g/100 cm2Halometasone Cream spiked with IS
3.1.4 稳定性 按“2.5.5”项下处理制备稳定样品,应用随行曲线和质控样品测得稳定性样品的浓度,结果如Tab 3所示,卤米松浓度为0.05、16 μg·L-1的血浆样品室温放置24 h、-80℃循环冻融3次、-80℃长期冻存12 d,样品处理后进样器放置48 h均稳定。
3.2 药代动力学研究 实验测定了8只健康家兔,卤米松乳膏单次经皮给药(1 g/100 cm2)后,72 h内血浆中卤米松浓度。采用WinNonlin 6.3软件,非房室模型计算药代动力学参数,血浆样品中卤米松的平均药时曲线如Fig 3所示,药代动力学参数如Tab 4所示。
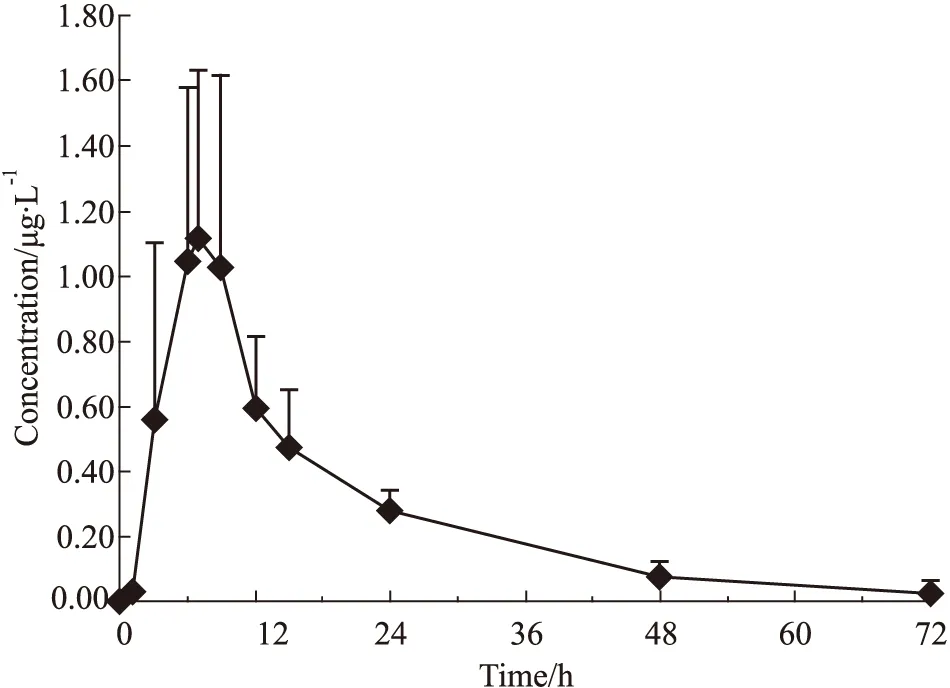
Fig 3 Mean plasma concentration-time profile of halometasoneafter dermal topical administration of 1 g/100 cm2
卤米松乳膏经皮给药后,家兔血浆中卤米松的主要药代动力学参数如下:Tmax为(7.38±1.06)h,Cmax为(1.16±0.527)μg·L-1,AUC0-t为(18.8±7.23)h·μg·L-1,T1/2为(13.8±3.70)h。
4 讨论
为建立一种简便、选择性好、灵敏度高的LC-MS/MS方法,在本研究中进行了一系列的条件摸索与优化。选择了响应高、特异性强的负离子扫描、多反应检测模式,进一步优化了分子离子、碎片离子及各质谱条件;并在液相条件摸索过程中,比较不同色谱柱的色谱分离效果(如不同填料、不同柱长、不同粒径或不同厂家),考察不同流动相成分(甲醇、乙酸铵、水、其他缓冲液或不同比例等)和不同pH值条件的影响,确定最佳色谱柱和流动相以获得合适保留时间,更高的色谱分离度,更高灵敏度和更好的峰型。最终,选择Diamonsil C18柱(100 mm×4.6 mm, 5 μm),甲醇为流动相A,2 mmol·L-1乙酸铵(含5%甲醇)为流动相B,采用梯度洗脱;同时考察合适的样品处理方法,比较不同沉淀剂(如甲醇、乙腈)和不同提取溶剂(如乙醚、甲基叔丁基醚、正己烷)的效果,结果甲基叔丁基醚提取回收率较好,达到91.8%~101%,无内源性干扰且卤米松受基质效应影响小。
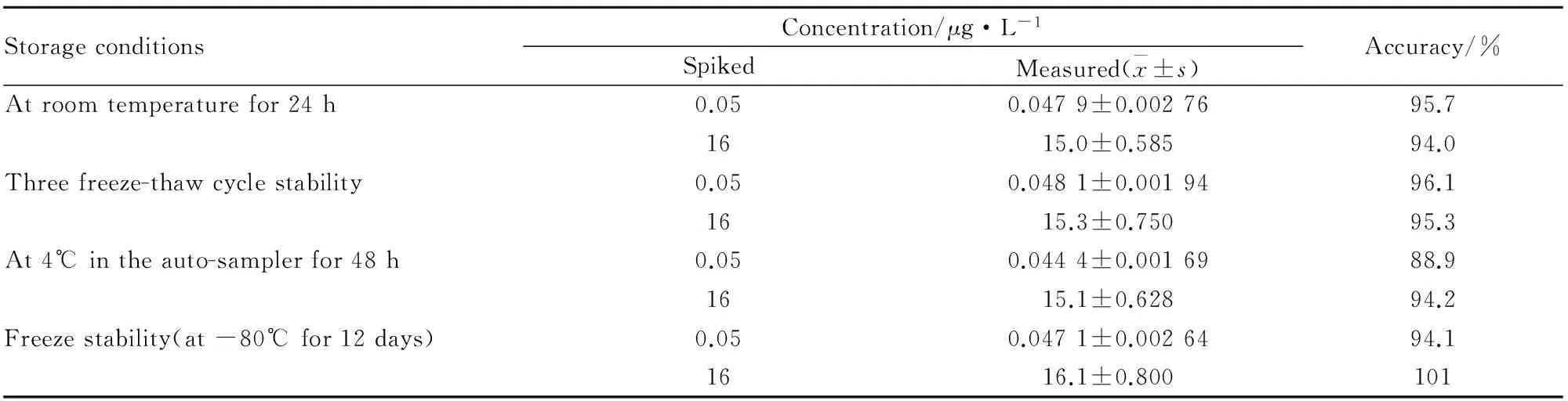
Tab 3 Stability of halometasone under different conditions(n=6)

Tab 4 Main pharmacokinetic parameters of halometasone after dermal topical administration of 1 g/100 cm2 Halometasone Cream to rabbits(n=8)
根据文献报道[12,14-16]、FDA相关指导原则[17],确定采用健康的日本大耳白兔为实验动物,设定给药部位为家兔背部,考虑脱毛剂对皮肤的刺激可能影响经皮给药的药物吸收,故采用给药前电动剃须刀剃毛。依据文献[15],预试验时,按0.01 g/cm2剂量给药,则1只家兔背部涂药面积为100 cm2(10 cm×10 cm),药物均匀涂抹的涂敷量为1 g,作用时间为6 h,此试验条件下的血浆Cmax约为(1~2)μg·L-1,而要求卤米松定量分析的检测限为0.02 μg·L-1,且基本能够达到LC-MS/MS方法的灵敏度要求,故设计给药剂量为卤米松乳膏1 g/100 cm2(即含卤米松0.5 mg)。
根据药物非临床药代动力学研究指导原则[14]要求,研究给药后药物进入体循环程度,设定给药后血浆样品采集点需包括吸收相、分布相、消除相,根据预试验结果,设置时间点为1、3、6、7、9、12、15、24、48、72 h,实验结果显示家兔皮肤涂敷卤米松乳膏(1 g/100 cm2)后,卤米松的血浆浓度变化为7 h左右达峰,随后血药浓度开始下降,至给药后72 h已下降到峰浓度的1/40以下。
乳膏剂相比较于口服制剂,可以直接作用于皮肤病灶,起效快,且用药方便,顺应性好,但其不易经皮吸收,体内血浆浓度低。本文建立的高灵敏度LC-MS/MS法成功应用于卤米松乳膏用药后家兔体内卤米松药代动力学特征的分析,且此前还未有相关报道,将有助于皮肤外用药的研究,为临床用药的评价及更好的合理用药提供研究基础。
[1] Jacob S E, Steele T. Corticosteroid classes: a quick reference guide including patch test substances and cross-reactivity[J].JAmAcadDermatol, 2006, 54(4):723-7.
[2] The Execare Working Group. Halometasone 0.05% cream in eczematous dermatoses[J].JClinAesthetDermatol, 2013, 6(11):39-44.
[3] Wiederserg S, Leopold C S, Guy R H. Bioavailability and bioequivalence of topical glucocorticoids[J].EurJPharmBiopharm, 2008, 68: 453-66.
[4] Jerajani H R, Kumar A S, Kuruvila M, et al. Efficacy and safety of topical halometasone in eczematous dermatoses in Indian population: an open label, noncomparative study[J].IndianJDermatol, 2011, 56(6): 652-6.
[5] Goswami N, Gupta V R, Jogia H A. Development and validation of a novel stability-indicating RP-HPLC method for the simultaneous determination of halometasone, fusidic acid, methylparaben, and propylparaben in topical pharmaceutical formulation[J].SciPharm, 2013, 81: 505-18.
[6] 陆 烨, 梁建英. HPLC法测定人血浆和尿样中9中激素的含量[J]. 中国临床药学杂志, 2013, 22(4): 220-5.
[6] Lu H, Liang J Y. Determination of 9 steroid hormones in human plasma and urine by HPLC[J].ChinJClinPharm, 2013, 22(4): 220-5.
[7] Earla R, Boddu S H, Cholkar K, et al. Development and validation of a fast and sensitive bioanalytical method for the quantitative determination of glucocorticoids—quantitative measurement of dexamethasone in rabbit ocular matrices by liquid chromatography tandem mass spectrometry[J].JPharmBiomedAnal, 2010, 52(4): 525-33.
[8] Shibasaki H, Nakayama H, Furuta T, et al. Simultaneous determination of prednisolone, prednisone, cortisol, and cortisone in plasma by GC-MS: estimating unbound prednisolone concentration in patients with nephrotic syndrome during oral prednisolone therapy[J].JChromatogrB, 2008, 870: 164-9.
[9] 秦 慧. 糖皮质激素的检测新方法研究[D]. 昆明:昆明理工大学, 2013.
[9] Qin H. Research on the determination of glucocorticoids[D]. Kunming:Kunming University of Science and Technology, 2013.
[10]Herrero M T, Estrada C, Maatouk L, et al. Inflammation in Parkinson′s disease: role of glucocorticoids[J].FrontNeuroanat, 2015, 9:32.
[11]陈 晨, 李 霞, 董琦鑫, 等. 4种前处理方法对LC-MS/MS测定人血浆中卤米松基质效应的影响[J]. 中国临床药理学杂志, 2013, 22(4): 216-20.
[11]Chen C, Li X, Dong Q X, et al. Influence of four pretreatment methods on matrix effect of halometasone in human plasma by LC-MS/MS[J].ChinJClinPharmacol, 2013, 22(4): 216-20.
[12]王 晖. 经皮给药的药代动力学研究进展[J]. 中国临床药理学与治疗学, 2008, 12(11): 1216-20.
[12]Wang H. Progress in pharmacokinetic of transdermal drugs[J].ChinJClinPharmacolTher, 2008, 12(11): 1216-20.
[13]祝逸平, 王遂泉, 卢良君, 许爱娥. 卤米松、黄岑提取物联合用药对白癜风小鼠模型的影响[J]. 中国药理学通报, 2014, 30(4):554-8.
[13]Zhu Y P, Wang S Q, Lu L J, Xu A E. Effect of halometasone in combination with scutellaria baicalensis georgi on the vitiligo mice[J].ChinPharmacolBull, 2014, 30(4):554-8.
[14]化学药物非临床药代动力学研究技术指导原则[S]. 国家食品药品监督管理局, 2014.
[14]The Guidance Principles for Research Methods of Non-Clinical Pharmacokinetics of Chemical Drugs[S]. State Food and Drug Administration, 2014.
[15]邓 泮. 两种糖皮质激素类药物新剂型的药动学研究[D]. 沈阳:沈阳药科大学, 2008.
[15]Deng P. Pharmacokinetic study of new formulations of two synthetic glucocorticoids[D]. Shenyang:Shenyang Pharmaceutical University, 2008.
[16]张永江, 陈洪岩, 夏长友. 实验研究中实验动物的选择及其相关干扰因素[J]. 中国实验动物学杂志,2002,12(5):316-9.
[16]Zhang Y J, Chen H Y, Xia C Y. The choice of experimental animals and its related interference factors in experimental study[J].ChinJLabAnimSci, 2002, 12(5):316-9.
[17]Guidance: topical dermatologic corticosteroids:invivobioequivalence[S]. U.S. Department of health and human services, food and drug administration, 1997.
Determination of halometasone and its pharmacokinetics study in rabbit plasma by LC-MS/MS
LIU Jing-yuan1,2, WU Li-nan2, YANG Yuan-hui2, GU Yuan2, WEI Guang-li2, SI Duan-yun2
(1.GraduateSchool,TianjinMedicalUniversity,Tianjin300070,China;2.StateKeyLaboratoryofDrugDeliveryTechnologyandPharmacokinetics,TianjinInstituteofPharmaceuticalResearch,Tianjin300193,China)
Aim To develop and validate a LC-MS/MS assay to quantify halometasone in rabbit plasma and study pharmacokinetics of halometasone after dermal topical administration of Halometasone Cream.Methods The plasma sample was submitted to liquid-liquid extraction using methyl tertiary butyl ether, with dexamethasone as the internal standard(IS). Chromatographic separations were performed on a Diamonsil C18column(100 mm×4.6 mm, 5 μm) with a linear gradient of methanol and 2 mmol·L-1ammonium acetate. Halometasone and dexamethasone(IS) were ionized with an ESI source operated in negative ion mode, and the detected ions werem/z503.1→413.0(halometasone),m/z391.0→361.0(dexamethasone). The test article could be monitored in rabbit plasma when following single dermal topical administration of Halometasone Cream at 1 g/100 cm2to rabbits by using a validated LC-MS/MS assay.Results Calibration curve was linear over the concentration range of 0.02~20 μg·L-1in rabbit plasma. For low, medium, high concentration of QC solutions, the intra-and inter-day precision was in the range of 3.72%~7.87%, and the accuracy was within 99.1% to 103%. The pharmacokinetic parameters in rabbits were as follows:Tmax,Cmax,AUC0-t,T1/2was (7.38±1.06)h,(1.16±0.527)μg·L-1,(18.8±7.23)h·μg·L-1,(13.8±3.70)h, respectively.Conclusions This LC-MS/MS analysis method has high sensitivity, and sample processing method is simple, which has been rigorously validated. The method could be successfully applied to the pharmacokinetic study of halometasone after skin administration of Halometasone Cream to rabbits.
halometasone;LC-MS/MS;rabbit;pharmacokinetics;plasma concentration;dermal topical administration
时间:2017-3-4 11:50
http://kns.cnki.net/kcms/detail/34.1086.R.20170304.1150.046.html
2016-10-31,
2016-12-28
国家自然科学基金青年基金项目(No 81503154)
刘静媛(1991-),女,硕士生,研究方向:药代动力学,E-mail: tyliujy8070@163.com; 司端运(1965-),男,博士,研究员,研究方向:药代动力学,通讯作者,E-mail:sidy@tjipr.com
10.3969/j.issn.1001-1978.2017.03.023
A
1001-1978(2017)03-0411-06
R-332;R452;R969.1;R977.11
