苦荞叶总黄酮提取纯化工艺研究
2017-03-16韩雪梅许效群王缘苗灵香赵文婷
韩雪梅, 许效群,王缘,苗灵香,赵文婷
(山西农业大学 食品科学与工程学院,山西 太谷 030801)
苦荞叶总黄酮提取纯化工艺研究
韩雪梅, 许效群*,王缘,苗灵香,赵文婷
(山西农业大学 食品科学与工程学院,山西 太谷 030801)
[目的]合理开发利用苦荞麦生物资源,延伸苦荞产业链,提高其经济效益;探索适合苦荞叶黄酮工业化生产的工艺方法。[方法]以盛花期的苦荞叶为原料,采用超声波辅助法提取总黄酮,并通过大孔树脂吸附法进行纯化,对提取、纯化工艺进行了优化。[结果]总黄酮最佳提取工艺为:以60%的乙醇为提取剂,提取温度为72 ℃,料液比为1∶32 g·mL-1,超声波处理时间为31 min,超声波功率为101 W,此工艺条件下苦荞叶总黄酮得率为10.2523%;AB-8树脂对苦荞叶总黄酮纯化效果最好,最佳纯化工艺为:上样液pH为5,浓度为1.50 g·L-1,流速为1.00 mL·min-1,上样量为33 mL·g-1树脂,洗脱液为75%乙醇,洗脱液pH为5,流速为1.50 mL·min-1,洗脱液用量为10 mL·g-1树脂,测得苦荞叶黄酮的回收率为77.01%,黄酮纯度为90.6%,是纯化前的3.02倍。[结论] 苦荞叶中总黄酮的含量高,且易纯化;该提取、纯化工艺可满足工业化生产高效益、低成本、简单易操作的需求,为其工业化生产提供理论依据。
苦荞叶;黄酮化合物; 超声波; 大孔树脂; 提取纯化工艺
苦荞(Fagopyrumtataricum(L.) Gaertn)为蓼科双子叶药食兼用植物,营养丰富,含有大量的黄酮类化合物(Flavonoids)[1]。黄酮类化合物具有很好的药理及保健作用[2~6],在化妆品领域也具有非常大的应用前景[7]。盛花期的苦荞叶子中黄酮含量极高[8,9],若能从中提取黄酮类化合物,不仅可以开发生物黄酮新资源,开发相关功能性食品、药品和化妆品,而且可以延伸苦荞产业链,大大提高苦荞产业经济效益。
植物黄酮的提取方法包括回流提取法、超声提取、微波提取和超临界流体萃取法等[6,10,11]。综合考虑,利用超声波处理,可加快黄酮物质进入溶剂,大大缩短提取时间,减少溶剂用量,并且可以大幅降低提取温度,避免高温对黄酮的破坏。总黄酮粗提物的纯化方法有酸碱法、吸附法、色谱法等[6,10]。较其他纯化法,树脂吸附具有生产容量较大、生产周期短、成本低廉、精制效果突出等优点,有较高的工业生产应用价值[8]。已有文献报道采用超声波法从五爪金龙叶[12]、菊芋叶[13]、黑果悬钩子茎、叶[14]等中提取黄酮类物质,采用树脂吸附法对蛹虫草[15]、樱桃叶[16]等植物粗黄酮进行精制,但有关超声波法提取苦荞叶总黄酮和树脂吸附法纯化苦荞叶粗黄酮的研究报道很少。本试验对苦荞叶总黄酮的超声辅助提取工艺及大孔树脂纯化工艺进行了研究,旨在为苦荞叶总黄酮的工业化生产提供理论依据。
1 材料与方法
1.1 材料
苦荞叶,采自于山西农业大学,盛花期采摘, 50 ℃下鼓风干燥,粉碎过100目筛,用石油醚脱脂,干燥,装袋密封,低温避光保存。
1.2 试剂
标准品芦丁:上海迈坤化工有限公司;大孔吸附树脂(D-101,AB-8,S-8,HPD600,DA-201)均购自天津欧瑞生物科技有限公司;硝酸铝、盐酸、亚硝酸钠、无水乙醇、氢氧化钠、石油醚等均为国产分析纯。
1.3 仪器与设备
101-3-BS-Ⅱ电热恒温鼓风干燥箱:上海跃进医疗机械厂;高速万能粉碎机:温岭市林大机械有限公司;723可见分光光度计:上海菁华科技仪器有限公司; KQ5200DE型数控超声波清洗器:昆山市超声仪器有限公司;JDG-0.2真空冻干试验机:兰州科近真空冻干技术有限公司;SHZ-Ⅲ型循环水式真空泵:上海亚荣生化仪器;RE-5203旋转蒸发器:上海亚荣生化仪器厂;SHZ-B水浴恒温振荡器:上海跃进医疗机械厂;HL-1数显恒流泵:上海泸西生化仪器厂有限公司。
1.4 试验方法
1.4.1 黄酮标准曲线的绘制
参照文献[12]绘制标准曲线(图1)。
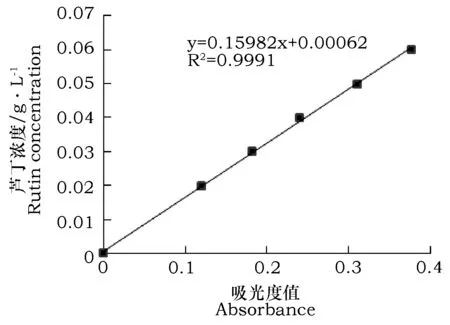
图1 芦丁标准曲线Fig.1 Standard curve of rutin
1.4.2 总黄酮得率的测定
准确称取样品2 g进行提取,获得的提取液经减压抽滤后用60%乙醇定容,510 nm处测定吸光度,计算总黄酮得率。
式中,C为样液中黄酮的浓度/g·L-1;V为提取液稀释定容体积/mL;N为提取液测定稀释倍数;W为苦荞叶粉末的质量/g。
1.4.3 总黄酮的提取
1.4.3.1 超声波辅助提取苦荞叶总黄酮的单因素试验
在王丽娟[11]研究的基础上,考察提取剂浓度、提取温度、料液比、超声波辅助提取时间、超声波功率对苦荞叶总黄酮得率的影响。
1.4.3.2 Box-Behnken试验设计
在单因素试验的基础上,使用Design Expert 8.0.5.0设计四因素三水平的Box-Behnken响应面试验,选取提取温度、时间、料液比、超声波功率为自变量,以总黄酮得率为响应值,对苦荞叶总黄酮的提取工艺进行优化。试验因素及水平设计见表1。
1.4.4 黄酮的纯化
1.4.4.1 苦荞叶粗黄酮的制备
苦荞叶粉末→最佳工艺下提取→减压抽滤→蒸发浓缩→真空冻干→装袋密封,低温避光保存。
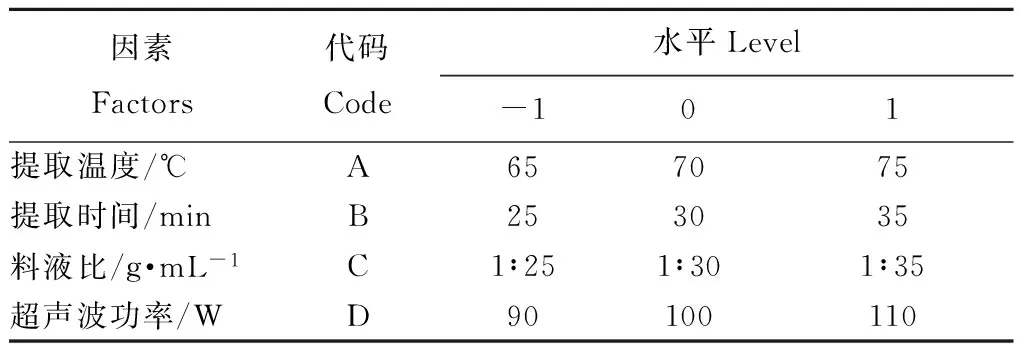
表1 Box-Behnken试验因素水平表
1.4.4.2 树脂的筛选
分别称取AB-8、S-8、D-101、HPD-600、DA-201大孔树脂2 g,参照文献[15]确定不同型号树脂的吸附率、解吸率及黄酮回收率。
回收率/%=吸附率×解吸率×100
1.4.4.3 苦荞叶黄酮纯化工艺的优化
考察上样液pH、上样液浓度、上样流速、吸附容量、洗脱液pH、洗脱液浓度、洗脱液流速、 洗脱液用量对苦荞叶总黄酮纯化效果的影响,并确定最佳工艺条件。
2 结果与分析
2.1 苦荞叶总黄酮提取结果分析
2.1.1 单因素试验结果分析
从图2可以看出,乙醇浓度为60%时,黄酮提取得率最大,这与物质极性有关。 当温度超过70 ℃后,黄酮得率开始降低,这是因为温度过高其中的活性成分易受到破坏[8],杂质的溶出量增加。料液比大于1∶30后,黄酮得率不再提高,从提取效益方面考虑,料液比以1∶30为最佳。超声波处理时间为30 min时,黄酮提取得率达到最大,功率为100 W时最大,故选100 W为最佳。
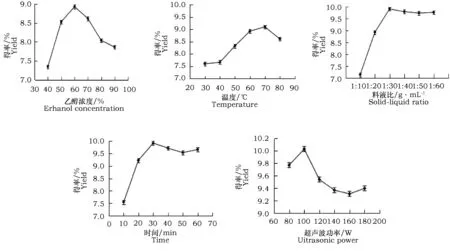
图2 乙醇浓度、温度、料液比、时间和超声波功率对总黄酮得率的影响Fig.2 The influence of ethanol concentration, temperature, solid-liquid ratio,time and Ultrasonic power on flavonoids yield
2.1.2 Box-Behnken试验结果分析
2.1.2.1 回归模型的建立与检验
对表2实验数据用多元回归拟合,得到总黄酮得率(Y)与提取温度(A)、提取时间(B)、料液比(C)和超声波功率(D)的回归方程为:
Y=10.147+0.469A+0.1392B+0.2398C+0.0468D-0.313AB-0.052AC+0.137AD+0.0528BC+0.0983BD-0.0353CD-0.673A2-0.2507B2-0.4642C2-0.3702D2
由表3可知该模型达到极显著水平(P<0.000 1),失拟项不显著(P>0.05),决定系数R2为0.995 6,校正决定系数R2Adj为0.9913,信噪比(Adeq Precision)为52.512>4,表明方程的拟合度和可信度极高,CV=0.53%,表明本试验有较高的可靠性及精密度。因此,可用该模型来分析和预测苦荞叶黄酮的提取工艺。且由F检验可以得出四因素对黄酮得率的影响为:提取温度(A)>料液比(C)>提取时间(B)>超声波功率(D)。
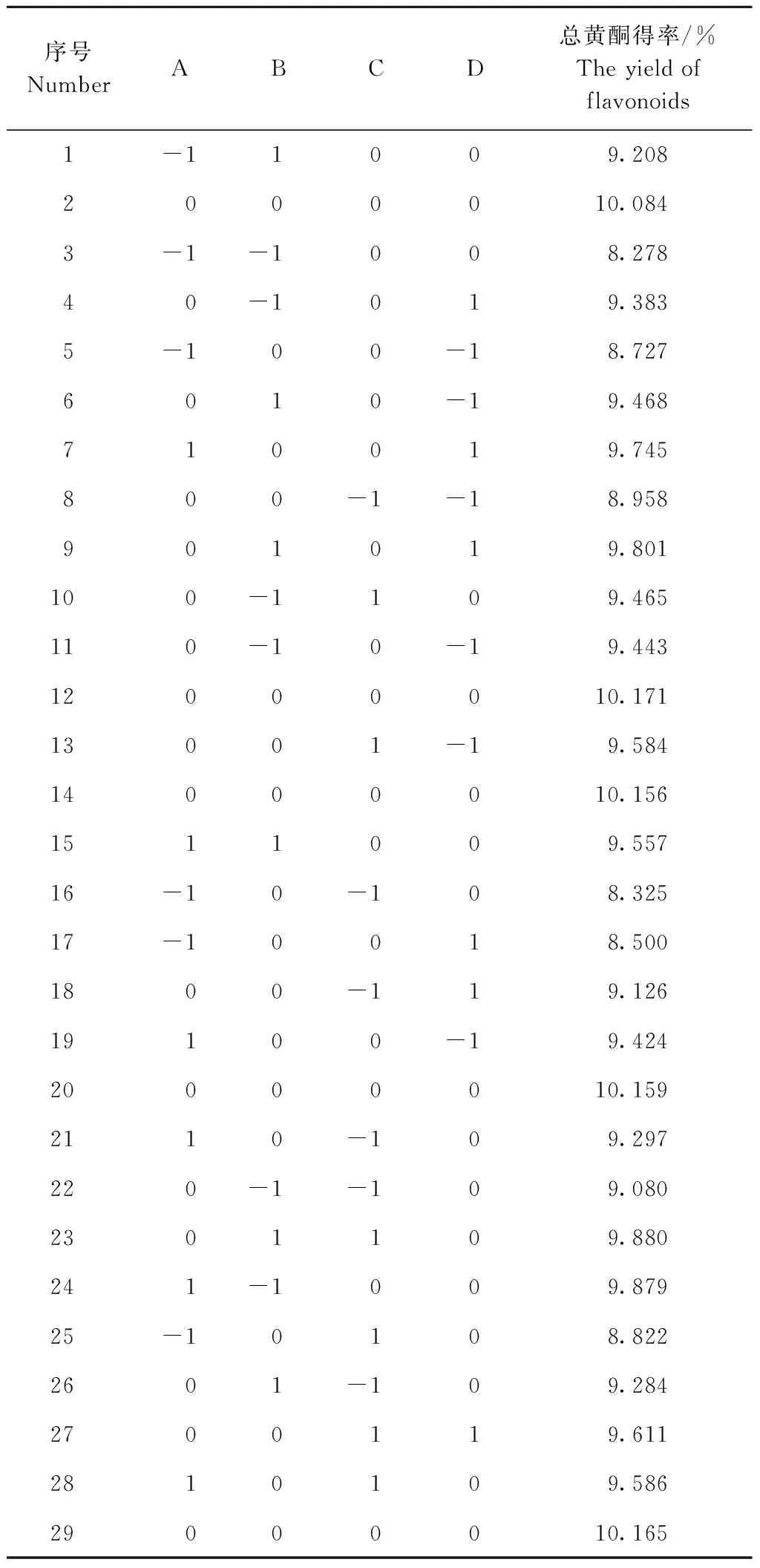
表2 试验设计与结果
2.1.2.2 两因素间的交互效应的分析
由回归模型的方差分析可知,AB、AD和BD之间存在着极显著的交互作用(P<0.01),其他因素之间的两两交互效应不显著(P>0.05), 因此只分析AB、AD和BD的交互作用对苦荞叶黄酮得率的影响,其响应面图见图3~5。AB、AD间交互作用的响应面图曲面较陡,影响较大,BD的曲面较为平缓,影响小于前两者。从图3~5中可以看出,响应值Y(苦荞叶总黄酮得率)均随因素变化先增高后降低,在试验水平范围内出现了一个最高点,即为苦荞叶黄酮得率较高点。
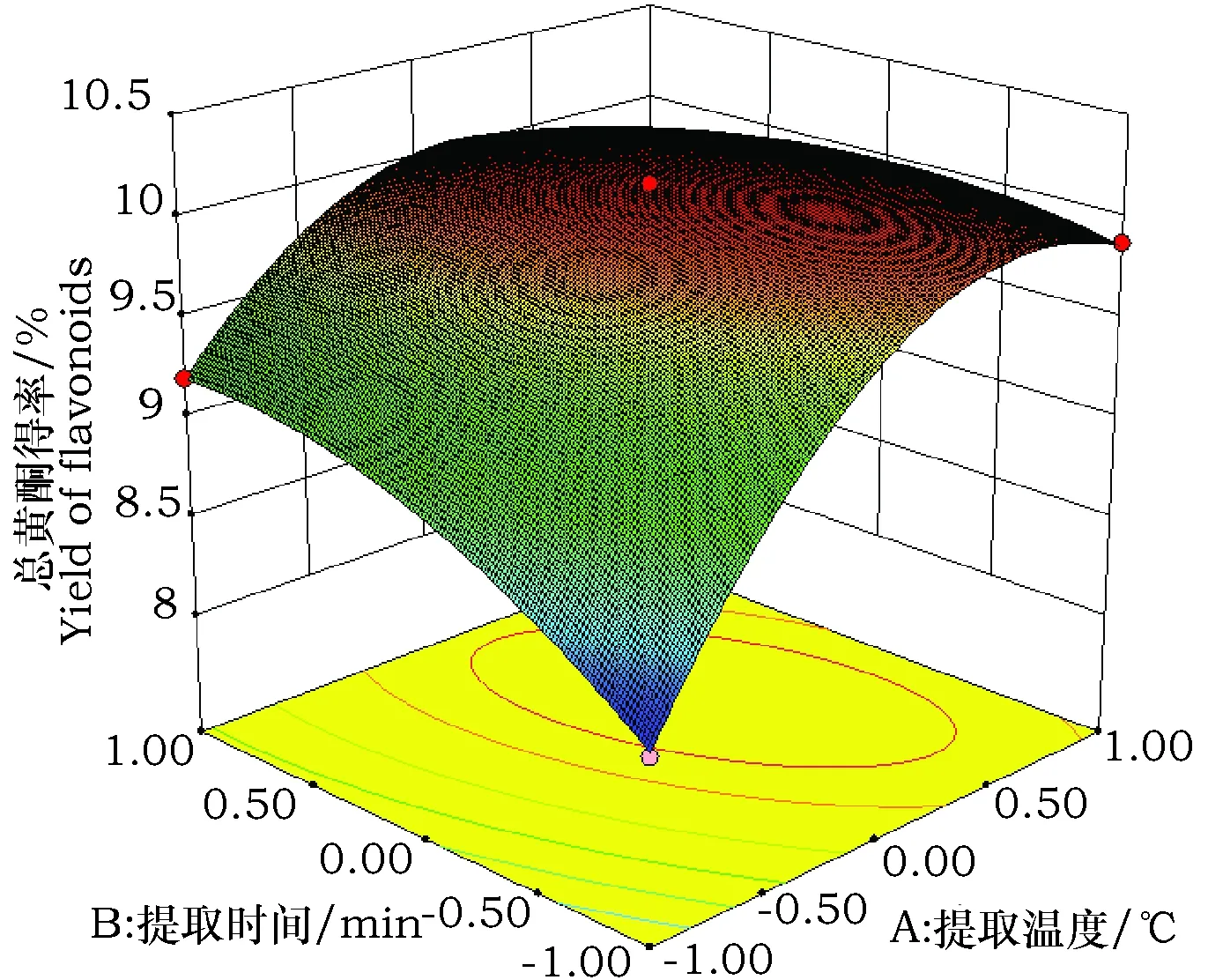
图3 Y=f(A,B)响应面图Fig.3 Responsive surfaces of Y=f(A,B)
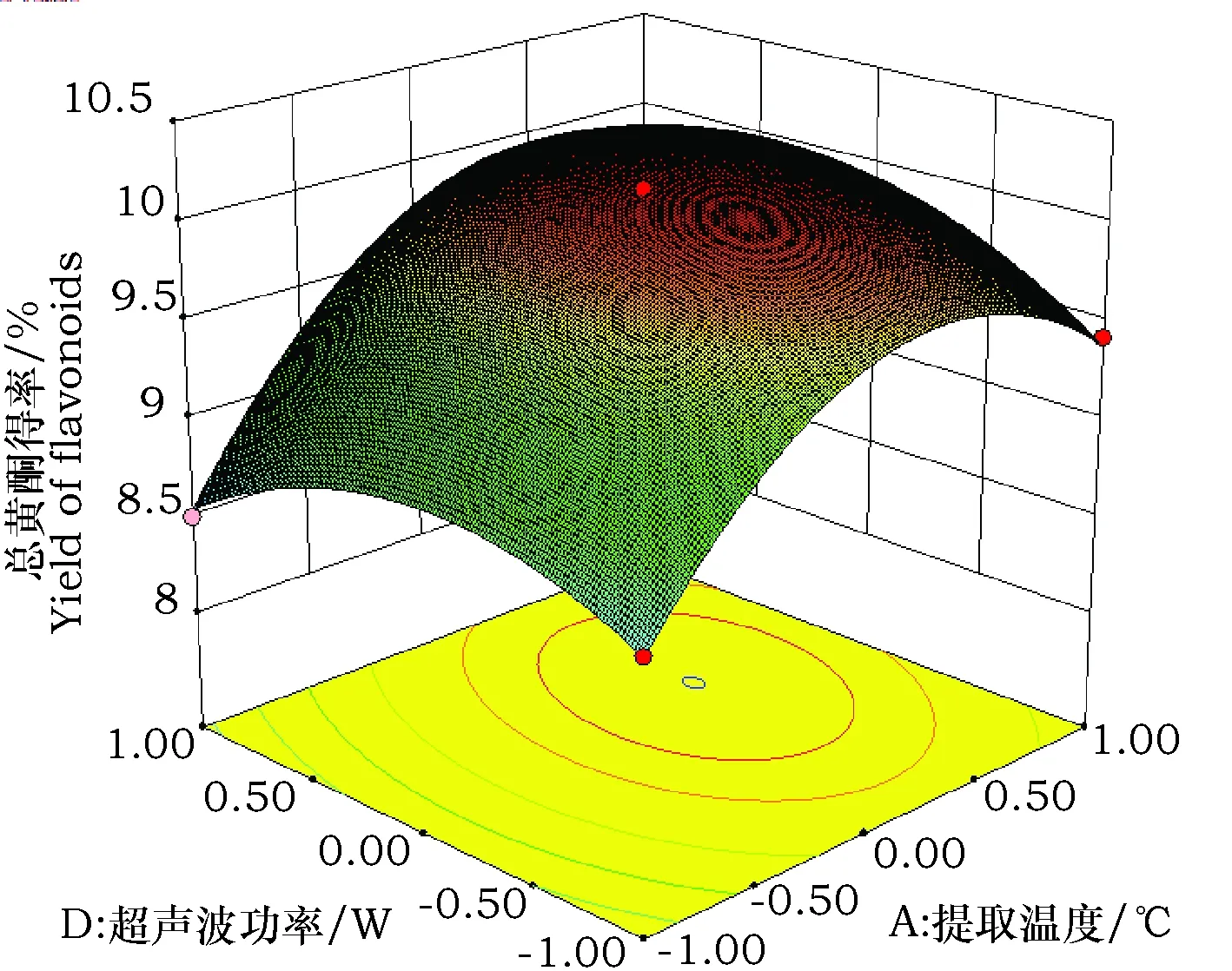
图4 Y=f(A,D)响应面图Fig.4 Responsive surfaces of Y=f(A,D)
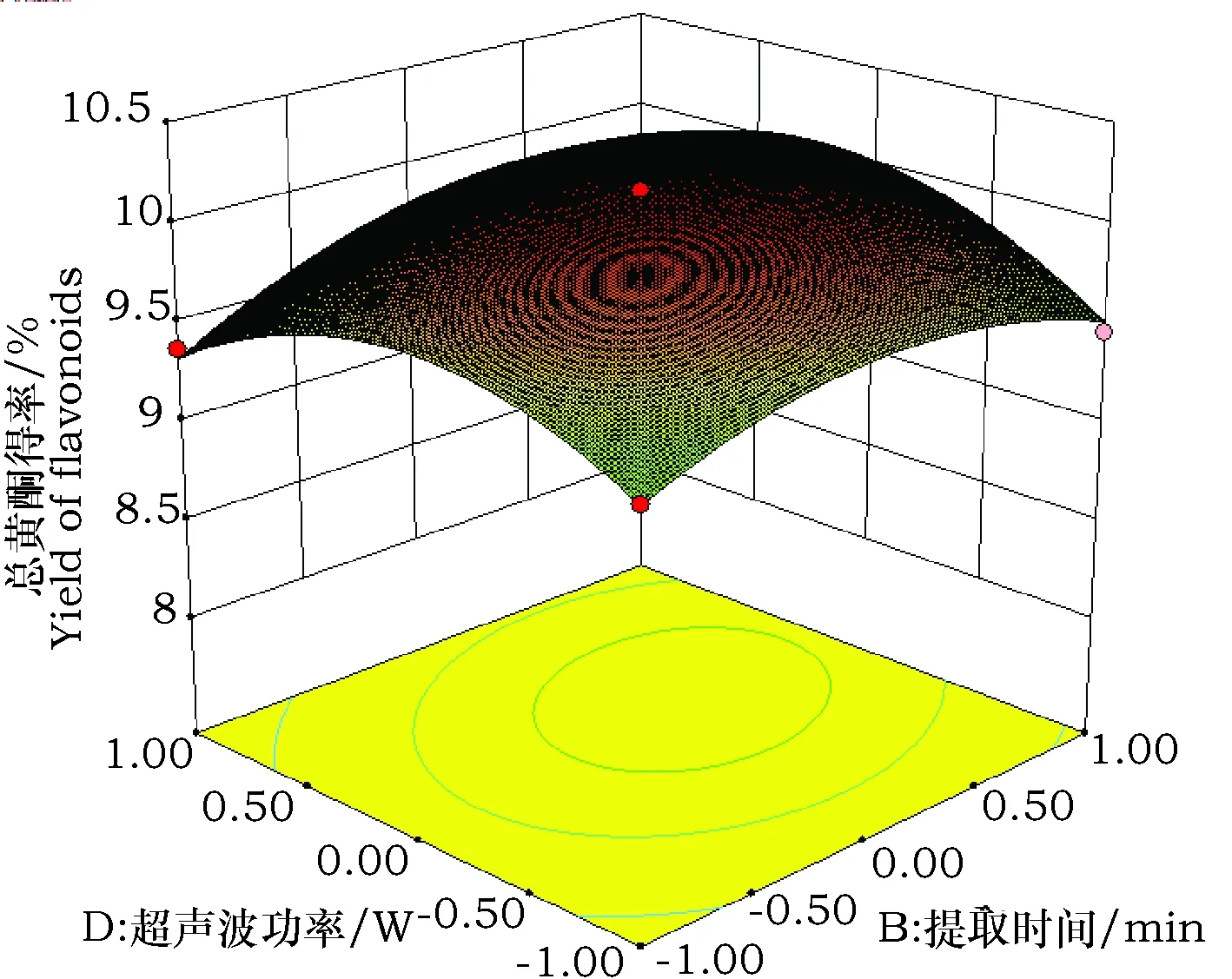
图5 Y=f(B,D)响应面图Fig.5 Responsive surfaces of Y=f(B,D)
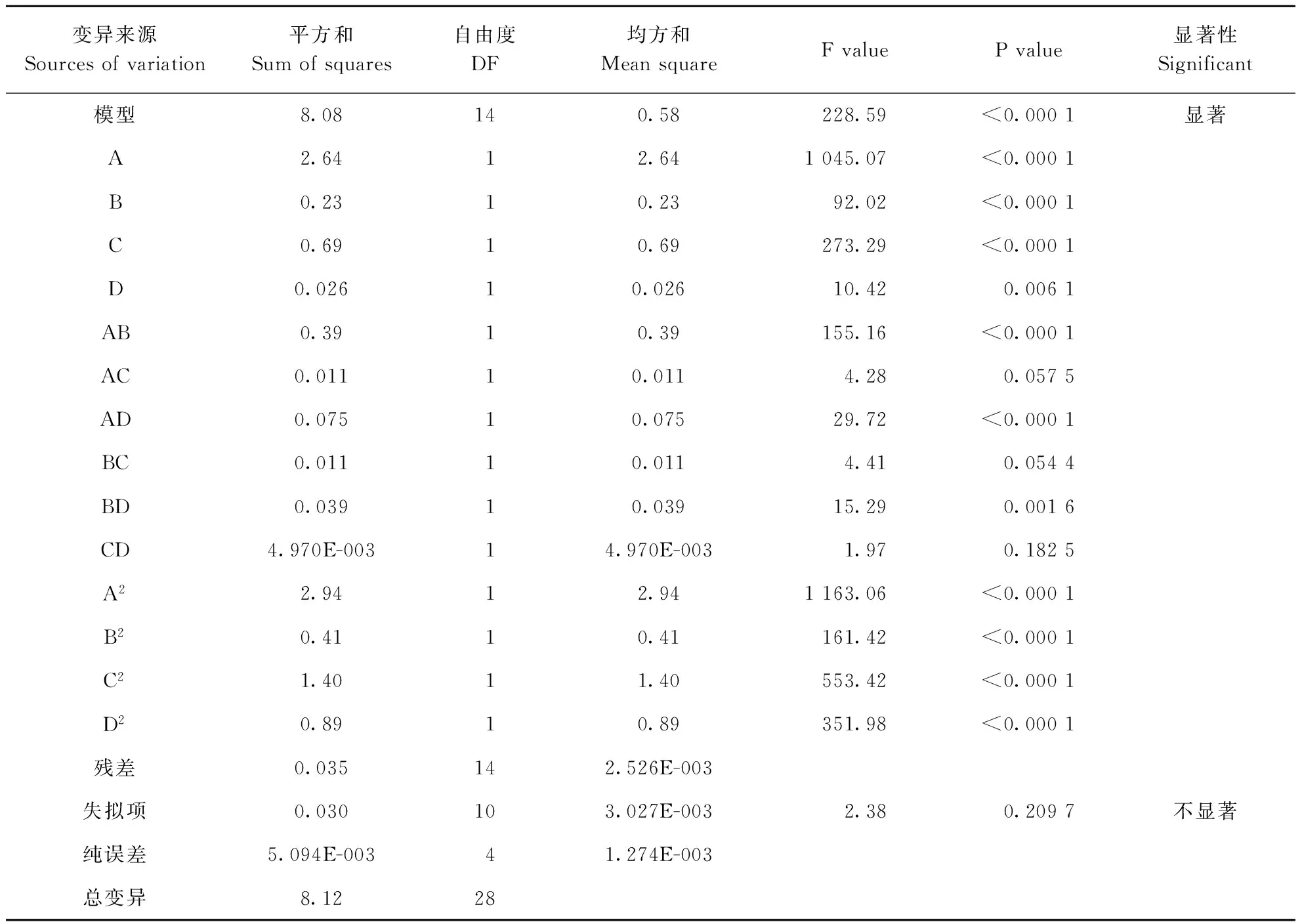
变异来源Sourcesofvariation平方和Sumofsquares自由度DF均方和MeansquareFvaluePvalue显著性Significant模型8.08140.58228.59<0.0001显著A2.6412.641045.07<0.0001B0.2310.2392.02<0.0001C0.6910.69273.29<0.0001D0.02610.02610.420.0061AB0.3910.39155.16<0.0001AC0.01110.0114.280.0575AD0.07510.07529.72<0.0001BC0.01110.0114.410.0544BD0.03910.03915.290.0016CD4.970E-00314.970E-0031.970.1825A22.9412.941163.06<0.0001B20.4110.41161.42<0.0001C21.4011.40553.42<0.0001D20.8910.89351.98<0.0001残差0.035142.526E-003失拟项0.030103.027E-0032.380.2097不显著纯误差5.094E-00341.274E-003总变异8.1228
注:p>0.05,差异不显著;p<0.05,差异显著;p<0.01,差异极显著
Note:p>0.05,the difference was not significant;p<0.05,the difference was significant;p<0.01,the difference was extremely significant
2.1.2.3 最佳工艺参数的确定及验证
由软件分析结果可知,苦荞叶黄酮的最佳工艺参数为:乙醇浓度60%,提取温度71.6 ℃,料液比1∶31.51 g·mL-1,超声波辅助时间30.65 min,超声波功率101.3 W,此工艺参数下预测黄酮得率为10.263 6%。在此条件下确定乙醇浓度60%,提取温度72 ℃,,料液比1∶32 g·mL-1,超声波辅助时间31 min,超声波功率101 W进行验证试验,重复三次得平均值为10.252 3%,RSD=0.11%,表明该模型对苦荞叶总黄酮的提取工艺具有实际应用价值。
2.2 苦荞叶中总黄酮纯化结果分析
2.2.1 树脂的筛选
从表4可以看出,纯化后黄酮回收率AB-8最大,因此选AB-8 树脂对苦荞叶黄酮进行纯化。
表4 不同树脂对黄酮的纯化效果对比
Table 4 Comparison on purification of total flavones by different kinds of resins
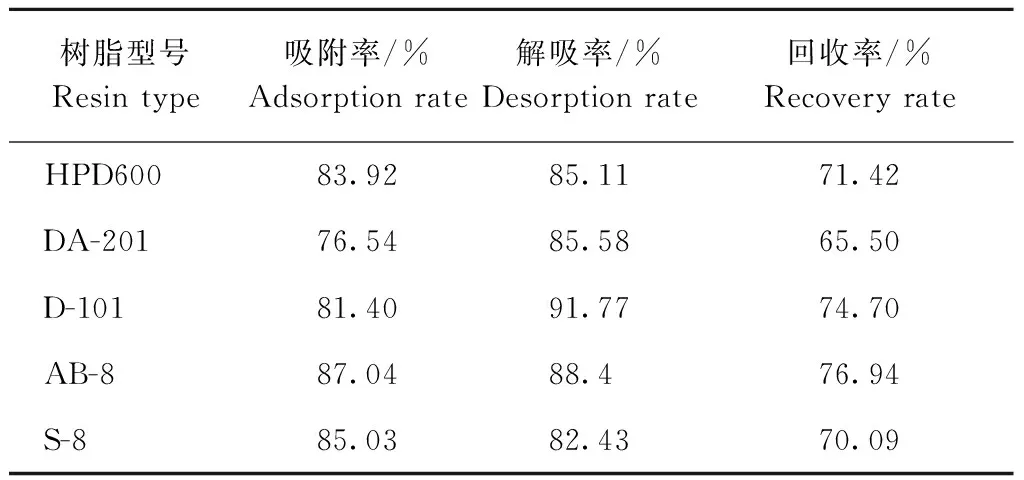
树脂型号Resintype吸附率/%Adsorptionrate解吸率/%Desorptionrate回收率/%RecoveryrateHPD60083.9285.1171.42DA-20176.5485.5865.50D-10181.4091.7774.70AB-887.0488.476.94S-885.0382.4370.09
2.2.2 上样液pH对吸附率的影响
准确称取6份2.000 g预处理好的AB-8大孔树脂,置于250 mL具塞三角瓶中,加入1.00 mg·mL-1的样液50 mL,依次调节pH值为3、4、5、6、7、8,放入25 ℃、120 r·min-1的恒温振荡水浴锅中,吸附6 h后测得黄酮吸附率依次为:79.14%、82.92%、85.73%、83.29%、83.1%、80.12%。在pH为5时,吸附效果最好。由此可知,苦荞叶总黄酮在酸性较弱的环境中易被树脂吸附,这可能与黄酮化合物分子中多有酚羟基呈酸性有关。
2.2.3 上样液浓度对吸附率的影响
将30 g预处理好的AB-8树脂湿法上柱,将浓度为0.50、1.00、1.50、2.00、2.50、3.00 g·L-1的样液(pH为5),以同一流速上柱,测得吸附率依次为:84.73%、86.01%、85.96%、82.55%、78.93%、73.52%。黄酮浓度较低时,未达到吸附所需的密度,增大黄酮浓度,增加了黄酮与树脂的接触机会,使得吸附率上升,但当浓度超过某一值时,此时树脂表面的黄酮分子单分子层吸附饱和,同时浓度过高易出现沉淀等堵塞层析柱,从而降低吸附率。黄酮吸附率在浓度为1.00 g·L-1和 1.50 g·L-1时相差极小,但后者用时较少,综合考虑,选取1.50 g·L-1为最佳浓度。
2.2.4 上样流速对吸附率的影响
将1.00 g·L-1的样液100 mL(pH为4)通过恒流泵分别以0.50、1.00、1.50、2.00、2.50、3.00 mL·min-1的流速上柱,测得吸附率依次为:86.52%、86.08%、84.72%、80.59%、76%、70.26%。流速加快导致吸附时间减短,吸附不充分。但流速过低使生产周期延长,提高生产的成本,综合考虑,宜选上样液流速为1.00 mL·min-1。
2.2.5 吸附容量的确定
将30 g预处理好的AB-8树脂湿法上柱,将1.00 g·L-1样液(pH为4),以1.00 mL·min-1的流速上样,每100 mL收集1 管,连续接取。
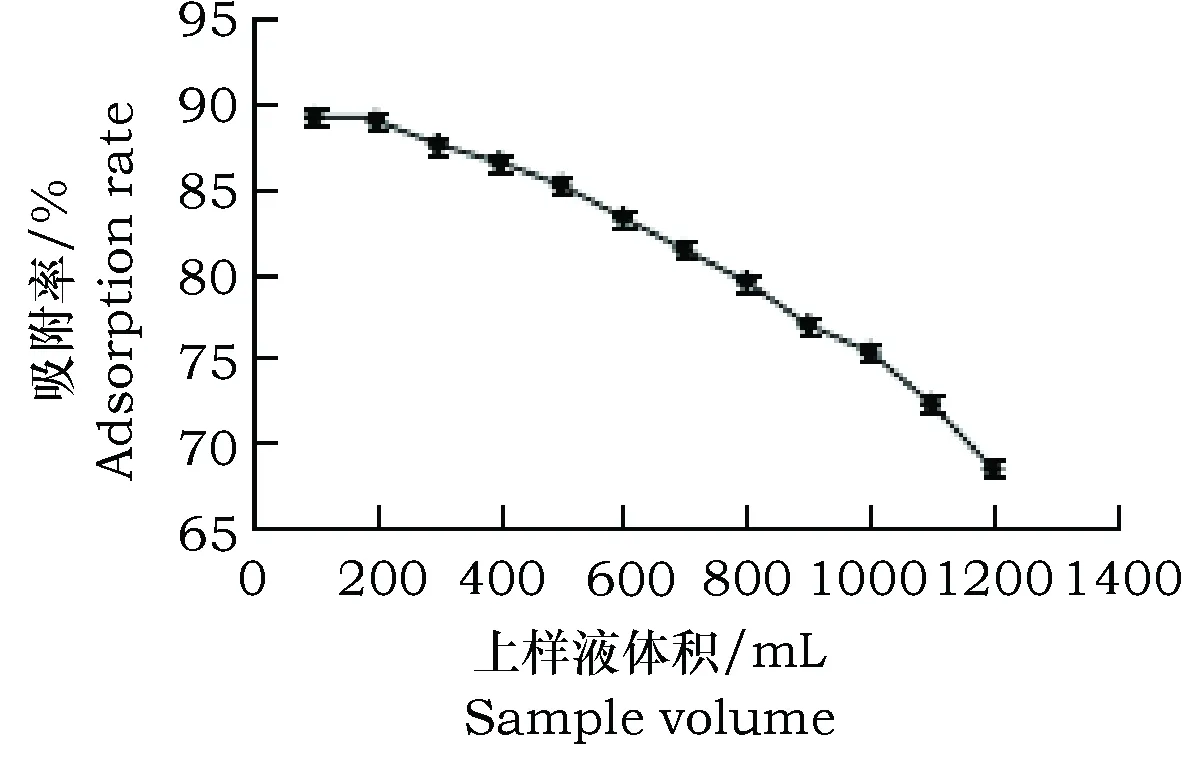
图6 AB-8树脂上样吸附曲线Fig.6 Adsorption curve of AB-8 macroporous resin
由图6 知,上样量在600~1 000 mL时,吸附率保持在较高水平75%以上,增加上样量至1 000 mL以上时,吸附率出现明显下降,表明树脂已接近饱和,吸附能力大大下降。为避免样液中总黄酮大量流出而降低纯化得率,同时考虑经济效益,选取1 000 mL 为最佳上样量,即33 mL·g-1树脂。
2.2.6 洗脱液pH对解吸率的影响
按最佳条件上样吸附后,分别用pH 为3、4、5、6、7、8 的70%乙醇洗脱,测得解吸率依次为:84.35%、86.65%、87.97%、86.43%、83.24%、79.33%。可以看出吸附率在pH为5时达到最大。这与黄酮化合物的弱酸性有关。
2.2.7 洗脱液浓度对解吸率的影响
按最佳条件上样吸附后,分别用pH 为5的60%、65%、70%、75%、80%、85%的乙醇洗脱,测得解吸率依次为:83.64%、86.03%、87.92%、89.74%、89.28%、87.33%。乙醇浓度为75%和80%时黄酮的解吸率较大,两者相差极小,前者乙醇用量较少,可降低生产成本,综合考虑,选75%的乙醇更为合适。
2.2.8 洗脱液流速对解吸率的影响
按最佳条件上样吸附后,用pH 为5的75%的乙醇分别以0.50、1.00、1.50、2.00、2.50、3.00 mL·min-1的流速洗脱,测得解吸率依次为:90.03%、89.83%、89.5%、86.85%、83.33%、78.59%。这是因为速度慢时黄酮能从树脂上被充分的洗脱,当速度加快时有一部分黄酮来不及被洗脱下来。洗脱速率为0.50、1.00、1.50 mL·min-1时三者的解吸率差异极小,洗脱速率为1.5 mL·min-1可大大缩短洗脱时间,节约成本。
2.2.9 洗脱液用量的确定
按最佳条件上样吸附后,用pH 为5的75%乙醇以1.50 mL·min-1的流速洗脱,每20 mL收集1 管,连续接取。
由图7知,乙醇用量达到80 mL时,苦荞叶黄酮开始被大量洗脱下来,在 140 mL时洗脱量达到最大,乙醇用量达到300 mL 时,树脂中总黄酮已基本洗脱完全。若继续则会使杂质也洗脱出来,影响黄酮纯度,且提高成本,因此,选取300 mL 为最佳洗脱液用量,即10 mL·g-1树脂。
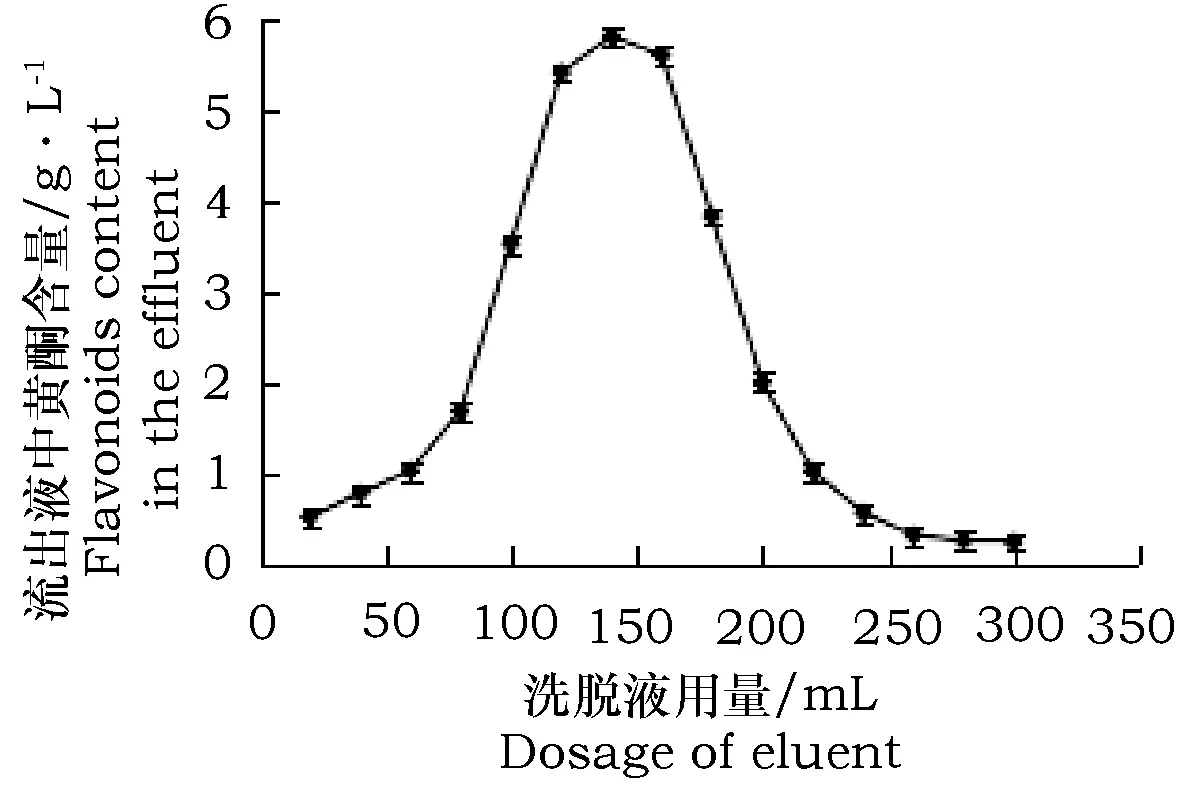
图7 AB-8树脂洗脱曲线Fig.7 Elution curve of AB-8 macroporous resin
2.2.10 AB-8最佳工艺的验证
按以上所得最佳工艺条件进行吸附,解吸,浓缩冻干,测得苦荞叶黄酮的纯度为90.6%,是纯化前的3.02倍,黄酮回收率为77.01%。
3 结论与讨论
超声法提取苦荞叶中总黄酮的最佳提取工艺为:以60%的乙醇为提取剂,提取温度为72 ℃,料液比为1∶32 g·mL-1,超声波处理时间为31 min,超声波功率为101 W,此工艺用时短、效率高、方法简便、易于操作、可大量提取,且乙醇作为提取剂可
回收再利用,成本较低,可满足工业化生产需求,该条件下苦荞叶总黄酮得率高达10.2523%。
AB-8大孔吸附树脂对苦荞叶黄酮有较好的纯化效果,其最佳纯化工艺为:上样液pH为5,浓度为1.50 g·L-1,流速为1.00 mL·min-1,上样量为33 mL·g-1树脂,洗脱液为75%乙醇,洗脱液pH为5,流速为1.50 mL·min-1,洗脱液用量为10 mL·g-1树脂,测得苦荞叶黄酮的回收率为77.01%,黄酮纯度为90.6%,是纯化前的3.02倍。AB-8大孔树脂用于苦荞叶黄酮的纯化,除去了大量的多糖、蛋白质、色素等物质,仅吸附-洗脱一步工艺即可得到纯度高达90.6%的苦荞叶总黄酮,且收效高、成本低、操作简便、洗脱液可再生,适于工业化规模生产,为工业纯化苦荞叶黄酮提供理论依据。
[1]尤玲玲,刘幻幻,李晓雁,等.苦荞黄酮的纯化及抗氧化活性的研究[J].中国粮油学报,2014,29(8):23-27.
[2]Birt D F, Jeffery E. Flavonoids[J].Adv Nutr,2013,4(5):576-577.
[3]Majewska-Wierzbicka M,Czeczot H.Flavonoids in the preventing and treatmet of cardiovascular diseases[J].Polski Merkuriuse Lekarski,2012,32(187):50-54.
[4]Czaplińska M,Czepas J,Gwodziński K.Structure,antioxidative and anticancer properties of flavonoids[J].Postepy Biochem,2012,58(3):235-244.
[5]Akachi T,Shiina Y,Ohishi Y,etal.Hepatoprotective effect of flavonoids from shekwasha(Citrus depressa)against Dgalactosamine-induced liver injury in rats[J],2010,56(1): 60-67.
[6]田晓冬,吴卫国.苦荞黄酮类化合物研究进展[J].农产品加工,2012(6):86-91.
[7]方向,周小理,张婉萍.苦荞萌发物中黄酮的防晒性研究[J].日用化学工业,2013,43(5):362-366.
[8]焦钰.苦荞花期植株中总黄酮浸提条件的研究[J].湖北农业科学,2014,53(15):3613-3616.
[9]邵美红,林兵,孙加焱,等.不同品种苦荞麦不同器官总黄酮含量的比较分析[J].植物资源与环境学报,2011,20(1):86-87.
[10]李二冬,黄丽珍,李波,等.苦荞黄酮的提取分离及生理活性研究进展[J].农产品加工,2014(7):61-67.
[11]王丽娟,魏涛,尹何南,等.超声波辅助提取黑苦荞黄酮类化合物及其抗氧化活性研究[J].粮食与油脂,2014,27(9):26-29.
[12]易运红,吕君亮,刘淑娜.五爪金龙叶总黄酮的提取、纯化及抗氧化活性研究[J],中国食品添加剂.2015(5):86-92.
[13]郑晓涛.菊芋叶总黄酮含量变化及其提取、纯化、抗氧化性研究[D].南京:南京农业大学,2012.
[14]郭寒,葛娟,李鑫,等.正交试验优化黑果悬钩子茎、叶总黄酮的提取纯化及其抗氧化活性[J].食品科学,2015,36(14):10-16.
[15]陈晓侠,宋渊,张纪柏,等.吸附树脂对蛹虫草黄酮纯化工艺条件优化[J].食品科学,2015,36(4):68-73.
[16]姜丹,胡文忠,姜爱丽,等.樱桃叶中黄酮类物质和樱桃籽油的提取纯化研究进展[J].食品工业科技,2015,43(5):362-366.
(编辑:马荣博)
Study on the extraction and purification of total flavonoids from leaves ofFagopyrumtataricum(L.) Gaertn
Han Xuemei, Xu Xiaoqun*, Wang Yuan, Miao Lingxiang, Zhao Wenting
(CollegeofFoodScienceandEngineering,ShanxiAgriculturalUniversity,Taigu030801,China)
[Objective]In order to develop and useFagopyrumtataricum(L.)Gaertnwisely, improve its economic value, explore the industrialization technology for extraction and purification of total flavones from leaves ofFagopyrumtataricum(L.) Gaertn,.[Methods]The full flowering leaves which contained the hightest flavonoids as the materials, use the Ultrasonic technology to extract flavonoids and Macroporous resin adsorption method to purify.[Results]The optimum extraction conditions were: using 60% ethanol solution as extract, temperature was 72 ℃, liquid to solid ratio of 1∶32 g·mL-1, extraction time was 31 min, ultrasonic power was 101W,the extraction yield was 10.2523%. the AB-8 resin in the purification of flavonoids had good effect. The optimum purification conditions were: sample pH was 5, sample concentration was 1.50 g·L-1, flow rate of sample was 1.00 mL·min-1, sample volume was 33 mL·g-1resin, eluted by75% ethanol, eluent pH was 5, flow rate of elution was 1.50 mL·min-1, eluent volume was 10 mL·g-1resin. The recovery rate of flavonoids is 77.01%.The purity of flavonoids in the purified product was 90.6%.It was 3.02 times of the raw material.[Conclusion]The leaves has high content of flavonoids which was easy to be puritied. The technology can meet the requirements of high benefit, low cost and easy-to-handle in industrialized production, It can provide theoretical basis for its industrialized production.
Leaves ofFagopyrumtataricum(L.)Gaertn, Flavonoids, Ultrasonic technology, Macroporous resin, Extraction and purification
2016-07-11
2016-10-19
韩雪梅(1990-),女(汉),山西吕梁人,硕士研究生,研究方向:粮油食品科学
*通信作者:许效群,副教授,硕士生导师。Tel:0354-6288325;E-mail:13935447190 @163.com
TS210.9
A
1671-8151(2017)02-0134-07
