外源NO对盐胁迫下玉竹氧化损伤缓解效应
2017-03-16闫永庆赵奕翔杜玉玲李丹阳潘晨慧高梦蕾
闫永庆,赵奕翔,杜玉玲,李丹阳,潘晨慧,高梦蕾
(东北农业大学园艺园林学院,哈尔滨 150030)
外源NO对盐胁迫下玉竹氧化损伤缓解效应
闫永庆,赵奕翔,杜玉玲,李丹阳,潘晨慧,高梦蕾
(东北农业大学园艺园林学院,哈尔滨 150030)
为探究NO对玉竹[Polygonatum odoratum(Mill.)Druce]耐盐调节机理,以盆栽玉竹为试验材料,硝普钠(Sodium nitroprusside,SNP)作NO供体,研究施加不同浓度外源SNP对盐胁迫下玉竹叶片氧化损伤影响。结果表明,盐浓度不高于150 mmol·L-1时施加外源NO(SNP≤100 μmol·L-1)可提高叶片肉质化程度和超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)活性,减少丙二醛(MDA)含量,增加可溶性蛋白、脯氨酸、抗坏血酸(ASA)和还原型谷胱甘肽(GSH)积累。说明低浓度NO(SNP浓度≤100 μmol·L-1)可有效缓解盐胁迫(NaCl≤150 mmol·L-1)对玉竹伤害。而高浓度NO(SNP>100 μmol·L-1)对玉竹各生理指标均表现不同程度抑制作用,影响玉竹正常代谢。高盐胁迫下外施NO,对抗氧化保护酶作用不明显,表现为抑制作用,但对非酶抗氧化物含量积累有促进作用。
盐胁迫;一氧化氮;抗氧化系统;玉竹
全球20%耕地和近半数灌溉土地均受到不同程度盐胁迫[1],我国盐渍土地总面积约3 600万hm2,占全国可利用土地面积4.88%[2]。盐渍环境破坏植物与环境离子分布和水势平衡状态,离子分布和水势平衡强烈变化可导致植物生长抑制甚至死亡[3]。
盐胁迫下,植物细胞产生大量活性氧(Reactiveoxygen species,ROS),如O2-、OH·、H2O2等自由基,降低或破坏活性氧清除物质SOD、POD、APX、CAT、GSH、ASA等含量和结构活性,使细胞膜透性增大,膜脂过氧化、代谢紊乱、离子平衡失调等,可使植物受损[4]。活性氧清除系统包括酶系统(如SOD、APX、CAT等)和非酶系统(如GSH和ASA)两大类,在逆境胁迫和衰老过程中,活性氧清除系统可清除体内过量活性氧,维持活性氧代谢平衡,保护膜结构,使植物在一定程度上减缓或抵抗逆境胁迫,延缓植物器官衰老过程[5]。
一氧化氮(Nitric oxide,NO)是一种生物活性小分子,对植物表现毒害和保护双重效应,这种效应与细胞内生理条件和NO有效浓度有关。非生物胁迫下,适宜浓度NO可减缓活性氧积累和伤害,缓解非生物胁迫造成的氧化损伤,提高植物适应能力[6-7]。
玉竹[Polygonatumodoratum(Mill.)Druce]为百合科(Liliaceae)植物。最早以萎蕤之名载于神农本草经,是我国常用中药材,性平、味甘,具有养阴润燥、生津止渴功能[8],亦作为园林地被植物,具有固土护坡功能。目前玉竹研究主要为药用成分开发与提取[9-11],NO对玉竹盐胁迫下缓解作用鲜有研究。本研究以玉竹为试验材料,探究不同浓度外源NO供体SNP对盐胁迫下玉竹生理生化指标影响,探讨NO对玉竹耐盐性调控作用,以期为盐渍土栽培玉竹相关研究奠定基础。
1 材料与方法
1.1 材料培养
试验材料繁殖体采用玉竹根茎。2015年4月,将玉竹根茎经消毒后,于东北农业大学园艺站田间种植培养。2016年4月露地挖出玉竹休眠茎,挑选肥大、幼芽饱满度一致根茎,定植于口径20 cm、高20 cm圆形塑料花盆内,每盆三段根茎且每段根茎2~3个饱满幼芽,基质采用高温消毒处理后蛭石,1/2 Hoagland全营养液浇灌培养,置于东北农业大学连栋温室内培养45 d,玉竹完全展叶后处理。
1.2 材料处理
玉竹经NaCl胁迫处理,胁迫浓度设为0、50、100、150、200 mmol·L-1四个梯度,并设浓度为0、50、100、150 μmol·L-1SNP作为缓解处理。SNP采用叶片喷施,不作胁迫处理为对照。共设20个处理。每盆为一个处理,每个处理3个重复,共计60盆。为防止盐激效应,NaCl浓度每日递增50 mmol·L-1。达到预设浓度后,按各处理NaCl及SNP浓度连续处理20 d,浇灌1次·d-1。浇灌量为每盆300 mL,约有2/3溶液流出,洗掉前1次积累于蛭石中的盐,保持盐浓度恒定。处理结束后第2天,取样测定相关指标。
1.3 相关指标测定方法
参照高俊凤方法[12],烘干称重法测定叶片相对含水量,叶片肉质化程度,硫代巴比脱酸法测定MDA含量;参考李合生方法测定可溶性蛋白含量[13],磺基水杨酸法测定脯氨酸含量Pro;参考张志良方法采用过氧化氢还原法测定CAT活性,愈创木酚法测定过氧化物酶(POD)活性[14];参考陈建勋方法[15],测定ASA含量与APX活性,利用疏基试剂DTNB测定GSH含量,NBT法测定SOD活性。每个指标重复测定3次。
数据采用Excel 2007数据处理并绘图,SPSS 21.0作显著性分析。
2 结果与分析
2.1 外源NO对盐胁迫下玉竹叶片肉质化程度与相对含水量影响
由图1与表1可知,盐浓度≤100 mmol·L-1时,叶片肉质化程度随盐浓度升高略有增加,说明低盐胁迫下玉竹叶片可通过增加肉质化程度稀释植物体内盐浓度,以降低植物体内盐浓度水平适应盐环境。当NaCl浓度高于100 mmol·L-1时,玉竹叶片肉质化程度有所降低,在取样过程中发现玉竹叶片有卷曲甚至枯黄现象,其中盐浓度为200 mmol·L-1最明显,说明高NaCl胁迫对植物产生一定伤害。同一盐浓度下,随SNP浓度升高,叶片肉质化程度有所增加,100 μmol·L-1SNP促进玉竹叶片肉质化程度最明显。说明在盐胁迫下,施加外源NO供体SNP可在一定程度上增加玉竹叶片肉质化水平,降低玉竹体内盐浓度,提高植物抗盐性。
由图2可知,在不添加外源SNP时相对含水量随盐浓度升高而降低,盐浓度为200 mmol·L-1时降至最低72.6%,显著低于其他盐浓度处理。添加外源SNP后,相对含水量随盐浓度升高也呈降低趋势。同一盐浓度下,随外源SNP浓度升高,玉竹叶片相对含水量均有不同程度增加,这种趋势在盐浓度为0和50 mmol·L-1时较明显。说明盐胁迫下外援NO可增加叶片相对含水量。
2.2 外源NO对盐胁迫下玉竹可溶性蛋白含量影响
由图3可知,在不添加外源SNP处理组中,可溶性蛋白含量随盐浓度增加呈显著上升趋势,盐浓度200 mmol·L-1时达最大值5.96 mg·g-1FW,且各处理组间差异显著(P<0.05)。当NaCl≤150 mmol·L-1时,外源SNP显著促进各盐处理下叶片可溶性蛋白合成。各处理蛋白含量在SNP浓度为100 μmol·L-1时达最大值,分别比不加SNP处理高28.9%、18.4%、28.5%、23.8%。盐浓度为200 mmol·L-1时,可溶性蛋白随SNP浓度升高而降低,且低于对照组。由此表明,在一定浓度NaCl胁迫下,玉竹可有效积累可溶性蛋白,参与渗透调节,维持细胞内外渗透压平衡,提高细胞保水能力,且外源NO能有效促进可溶性蛋白合成与积累,降低盐胁迫对玉竹伤害。
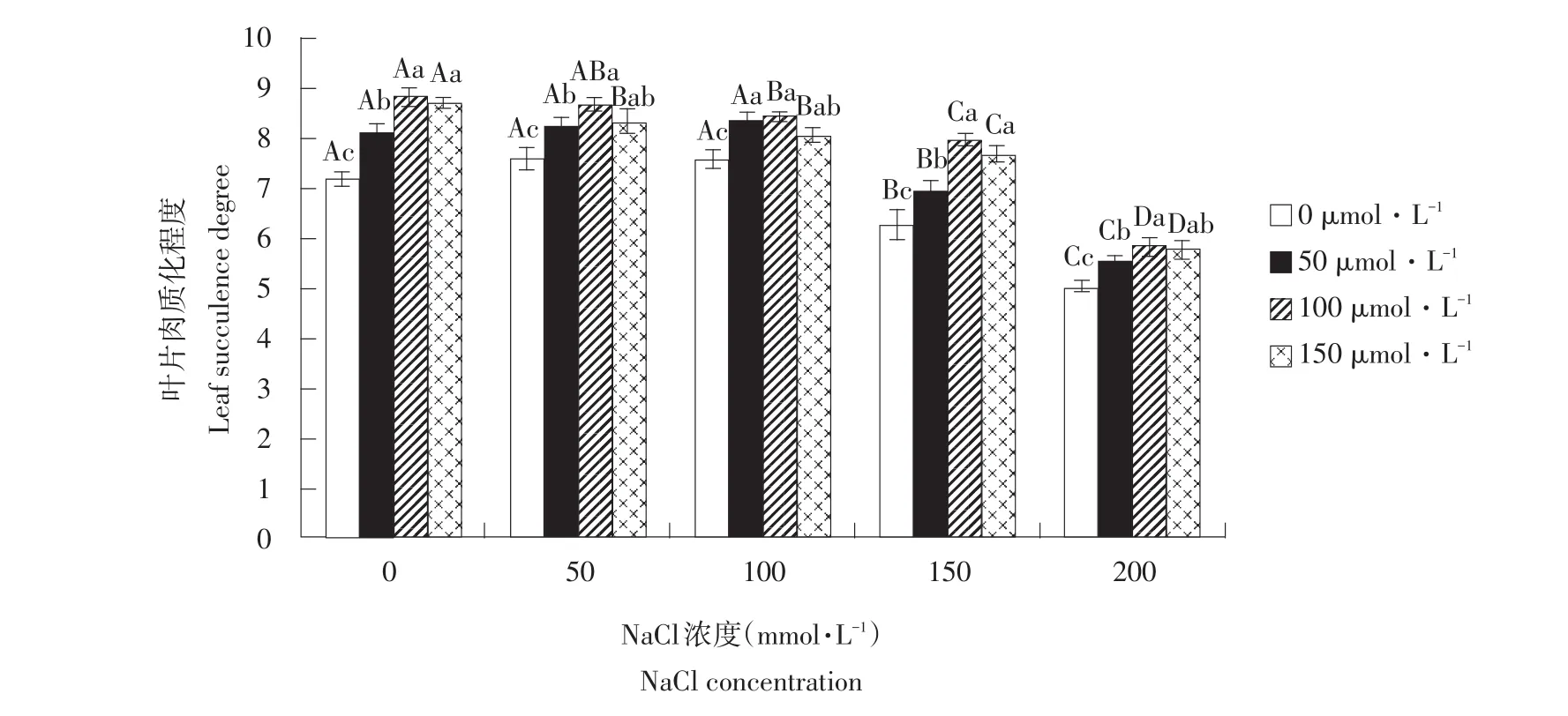
图1 外源NO对盐胁迫下叶片肉质化程度影响Fig.1Effect of exogenous NO on the leaf succulence degree of Polygonatum odoratum under salt stress
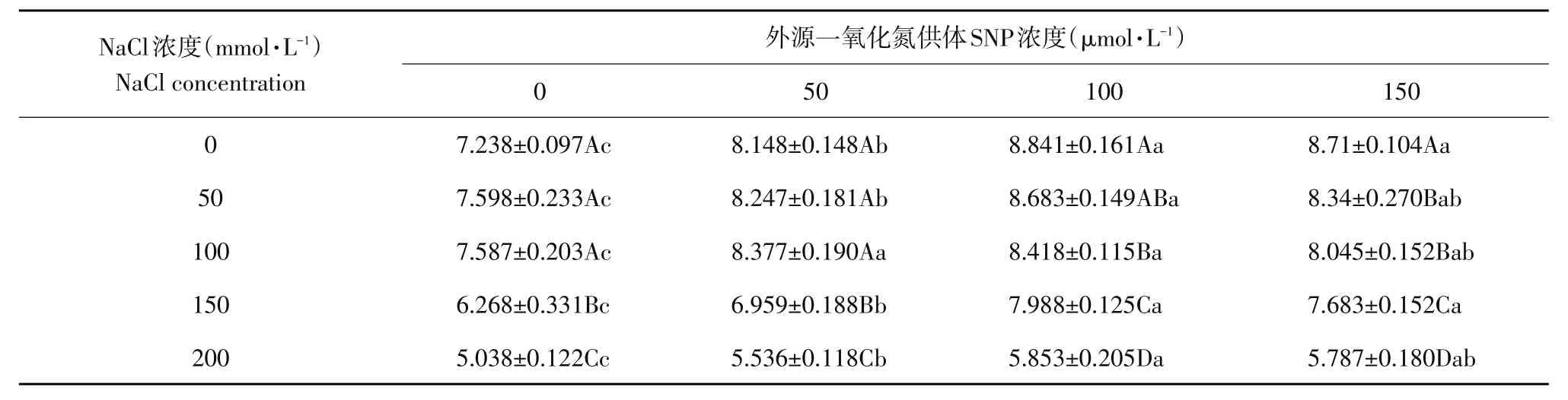
表1 盐胁迫及外源SNP对玉竹叶片肉质程度化影响Table 1Effect of salt stress and exogenous SNP on succulent degree of Polygonatum odoratum leaves
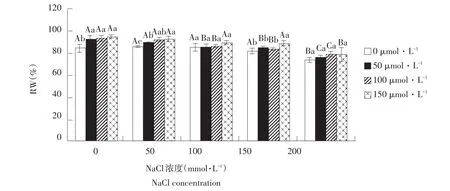
图2 外源NO对盐胁迫下叶片相对含水量影响Fig.2Effect of exogenous NO on the leaf relative water content of Polygonatum odoratum under salt stress
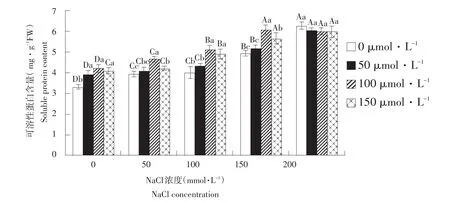
图3 外源NO对盐胁迫下叶片可溶性蛋白含量影响Fig.3Effect of exogenous NO on the leaf soluble protein content of Polygonatum odoratum under salt stress
2.3 外源NO对盐胁迫下玉竹脯氨酸含量影响
由图4可知,随NaCl浓度升高,脯氨酸含量显著增加,玉竹耐盐性提高。随外源NO供体SNP浓度升高,不同NaCl处理下脯氨酸含量均有不同程度升高。200 mmol·L-1NaCl处理下,外施一定浓度SNP后,脯氨酸含量积累速率高于其他处理。由此说明,随胁迫加剧,脯氨酸不断积累,参与渗透调节。外源NO可有效促进渗透调节物质脯氨酸合成与积累,降低盐胁迫对植物伤害。
2.4 外源NO对盐胁迫下玉竹丙二醛含量影响
由图5可知,丙二醛含量随盐浓度升高而呈上升趋势,外源NO明显降低盐胁迫下MDA含量。在各盐浓度下,MDA含量在SNP浓度为100 μmol· L-1时降到最低,随后升高,分别比不添加外源SNP时降低34.1%、17.8%、25.1%、26.6%、14.9%,由此说明一定浓度外源NO供体SNP可降低NaCl胁迫下膜脂受损害程度,增强玉竹对非生物胁迫环境抗性。
2.5 外源NO对盐胁迫下玉竹超氧化物歧化酶活性影响
由图6可知,各NaCl浓度处理下SOD活性随外源SNP浓度升高而呈先升后降趋势。NaCl浓度≤150 mmol·L-1时,SNP浓度为100 μmol·L-1时达峰值,分别为30.2、32.1、32.5、37.4 U·g-1FW,且NaCl浓度150 mmol·L-1时,SOD活性增加幅度最高。200 mmol·L-1NaCl处理下,浓度为50和100 μmol·L-1外源SNP对SOD活性有一定促进作用,而150 μmol·L-1SNP对SOD活性促进不明显。由此说明,一定浓度外源NO供体SNP可有效提高NaCl胁迫下玉竹叶片内SOD活性,清除植物体内过量氧自由基,提高抗盐性,以100 μmol·L-1SNP效果最佳。
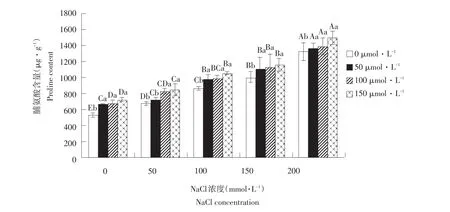
图4 外源NO对盐胁迫下叶片脯氨酸含量影响Fig.4Effect of exogenous NO on the leaf proline content of Polygonatum odoratum under salt stress
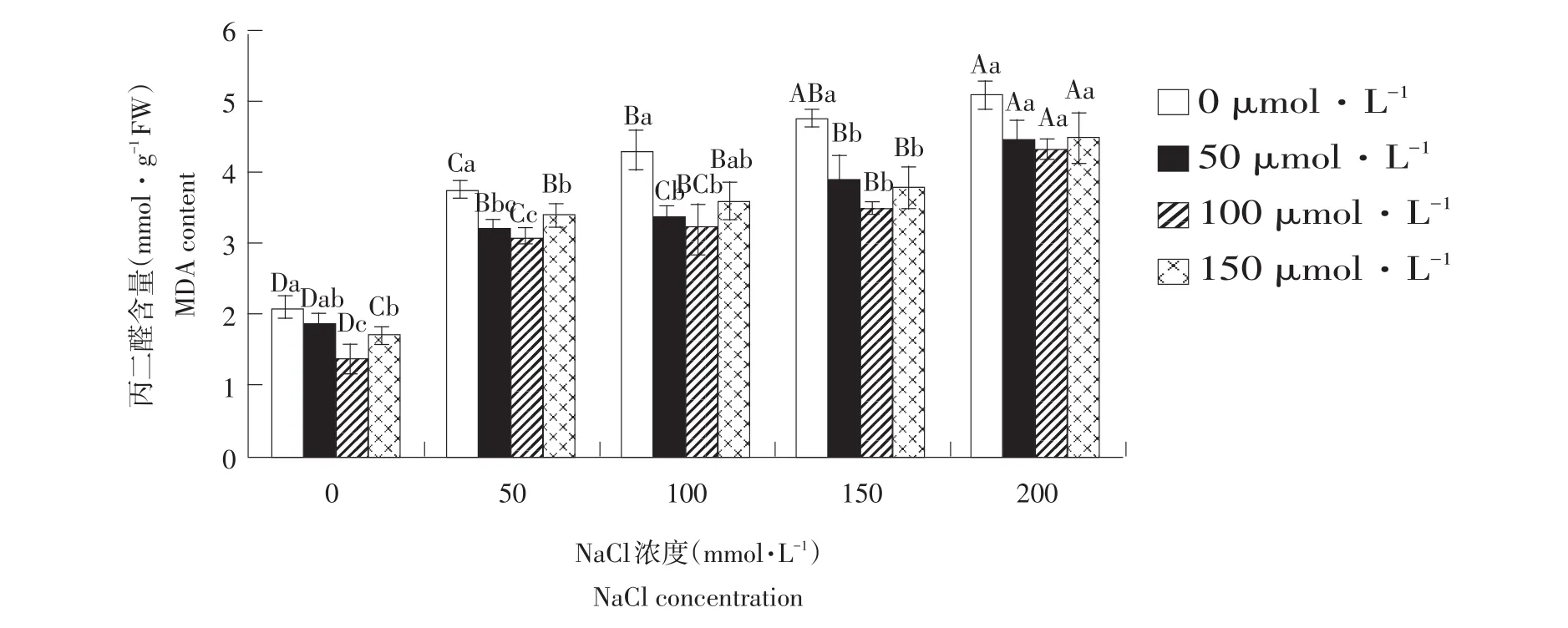
图5 外源NO对盐胁迫下叶片丙二醛含量影响Fig.5Effect of exogenous NO on the leaf MDA content of Polygonatum odoratum under salt stress
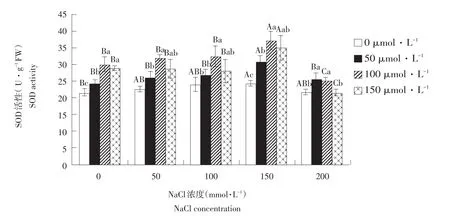
图6 外源NO对盐胁迫下叶片超氧化物岐化酶活性影响Fig.6Effect of exogenous NO on the leaf SOD activity of Polygonatum odoratum under salt stress
2.6 外源NO对盐胁迫下玉竹过氧化物酶活性影响
由图7可知,随SNP浓度升高,不同浓度NaCl处理下玉竹叶片POD活性呈先升后降趋势,NaCl≤150 mmol·L-1时,不同盐浓度下POD活性在SNP浓度为100 μmol·L-1时达最大值,盐浓度200 mmol· L-1、SNP浓度50 μmol·L-1时POD活性达到最大值,后又略降。
由此说明,一定浓度NO供体SNP可有效提高盐胁迫下玉竹体内POD活性,抑制细胞膜内不饱和脂肪酸过氧化作用,以维持玉竹细胞膜稳定性和完整性。SNP处理浓度为100 μmol·L-1时效果最佳。
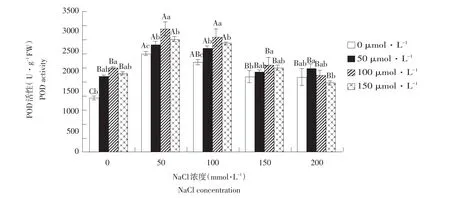
图7 外源NO对盐胁迫下叶片过氧化物酶活性影响Fig.7Effect of exogenous NO on the leaf POD activity of Polygonatum odoratum under salt stress
2.7 外源NO对盐胁迫下玉竹过氧化氢酶活性影响
由图8可知,在不添加SNP时,随盐浓度增加,玉竹叶片CAT活性呈升高趋势,说明玉竹通过提高CAT活性,抵御一定浓度胁迫。添加外源SNP后,NaCl浓度≤150 mmol·L-1时,各处理随SNP浓度增加而CAT活性呈先升后降趋势,且高于对照组。200 mmol·L-1盐浓度下,随SNP浓度升高而呈降低趋势。说明一定浓度盐胁迫下外源NO可提高植物体内CAT活性,有效清除植物体内O2-,降低ROS对植物体伤害。
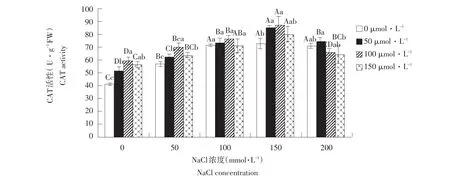
图8 外源NO对盐胁迫下叶片过氧化氢酶活性影响Fig.8Effect of exogenous NO on the leaf CAT activity of Polygonatum odoratum under salt stress
2.8 外源NO对盐胁迫下玉竹抗坏血酸过氧化物酶活性影响
由图9可知,在不添加外源SNP情况下,随盐浓度升高,玉竹叶片APX活性呈显著降低趋势。说明盐胁迫产生ROS可降低玉竹叶片APX活性。在添加外源SNP后,当NaCl浓度≤150 mmol·L-1时APX活性呈先升后降趋势,且各处理显著高于对照组(P<0.05),SNP浓度为100 μmol·L-1时达各盐浓度处理最大值,比不添加SNP时分别增加20.2%、18.1%、22.8%、25.1%。盐浓度为200 mmol·L-1时APX活性随外源SNP含量升高而升高。由此可知,NO参与提高叶片内APX活性,清除体内活性氧增强非生物胁迫下植株抗性。
2.9 外源NO对盐胁迫下玉竹抗坏血酸含量影响
由图10可知,不添加外源SNP情况下,随NaCl浓度升高,玉竹叶片中ASA含量呈下降趋势。添加外源SNP后,当NaCl浓度≤150 mmol·L-1时,随SNP浓度升高,玉竹叶片中ASA含量先升后降,在SNP浓度为100 μmmol·L-1时出现峰值为2.69、2.65、2.53、2.44 μg·g-1,当NaCl浓度为200 mmol·L-1时,ASA含量呈上升趋势。说明外源NO促进玉竹叶片中ASA合成,提高玉竹体内ASA积累。
2.10 外源NO对盐胁迫下玉竹还原型谷胱甘肽含量影响
由图11可知,随盐胁迫加剧,GSH含量呈降低趋势,当NaCl浓度≤100 mmol·L-1时,其含量下降不明显,随后显著下降。对玉竹添加外源SNP后,盐浓度≤150 mmol·L-1时,GSH含量随SNP浓度升高而先升后降,SNP浓度100 μmol·L-1时达到最大,分别为38.8、36.46、36.4、31.99 μg·g-1,高于其他处理。当NaCl浓度200 mmol·L-1时,GSH含量达到最低值,在添加SNP时,随浓度升高而呈升高趋势。由此表明,一定浓度外源NO可促进GSH含量升高,提高玉竹对非生物胁迫抗性。
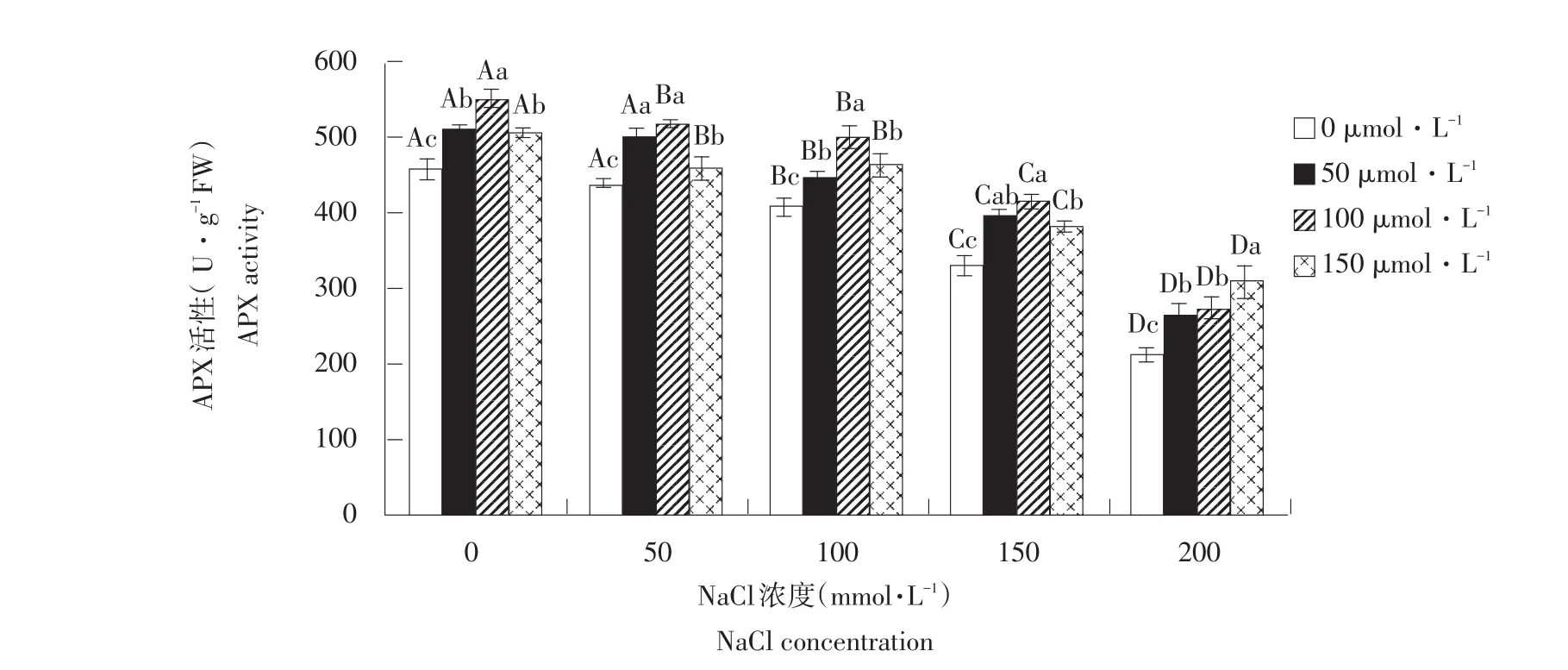
图9 外源NO对盐胁迫下叶片抗坏血酸过氧化物酶活性影响Fig.9Effect of exogenous NO on the leaf APX activity of Polygonatum odoratum under salt stress
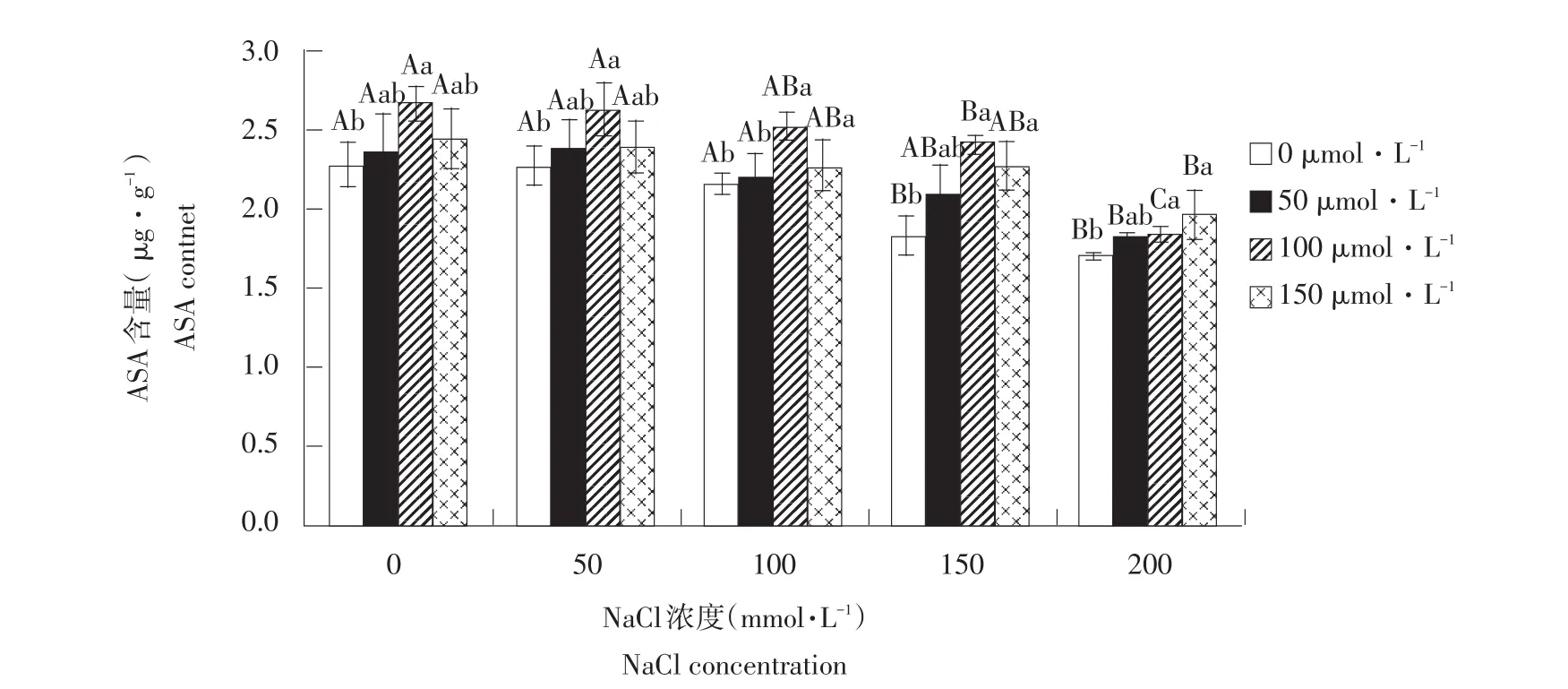
图10 外源NO对盐胁迫下叶片抗坏血酸含量影响Fig.10Effect of exogenous NO on the leaf ASA content of Polygonatum odoratum under salt stress
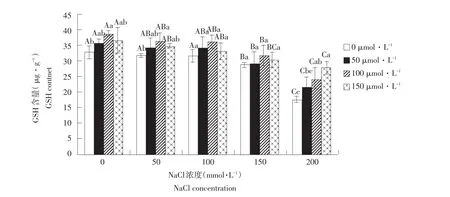
图11 外源NO对盐胁迫下叶片还原性谷胱甘肽含量影响Fig.11Effect of exogenous NO on the leaf GSH content of Polygonatum odoratum under salt stress
3 讨论与结论
自由基学说认为,盐胁迫首先造成植物体内离子失衡和渗透压增高,致使活性氧过量积累,膜系统是盐胁迫对植物伤害最敏感部位和起始位点,随活性氧氧积累,植物膜结构完整性被破坏,导致叶绿素降解、蛋白质变性及核酸断裂,甚至细胞死亡[16]。
Arasimowicz等指出NO作为重要信号分子,可调节植物体内多种生理过程[17]。本研究结果表明NaCl≤100 mmol·L-1时,施加一定浓度NO供体SNP,可提高玉竹叶片肉质化程度,而叶片相对含水量随施加NO浓度升高而呈上升趋势,减轻NaCl胁迫导致水分亏缺及次生伤害。
NaCl胁迫产生大量ROS无法被清除系统及时清除时,ROS在植物体内不断积累,破坏细胞膜选择透性,导致膜质过氧化,致使细胞代谢失衡,影响植株正常生长发育[18]。积累的氧自由基首先破坏膜系统,将膜脂肪酸中不饱和键过氧化,形成MDA[19],丙二醛与细胞内各种成分发生强烈反应,破坏和影响膜结构及生理机能。其含量反映细胞膜脂过氧化作用和质膜被破坏程度[20]。本试验结果表明盐胁迫显著降低玉竹叶片中MDA含量,而外施一定浓度SNP可有效抑制丙二醛积累,即抑制膜质过氧化作用。此结果与黑麦草[21]、番茄[22]、水稻[23]等研究结果一致。说明NO对玉竹具有相同调控作用,一定浓度NO供体SNP可明显缓解NaCl胁迫对植物伤害,提高植物抗性。
植物通过积累可溶性蛋白、脯氨酸有机物缓解盐胁迫不利影响[24],其中可溶性蛋白除代表植物器官功能变化外,在一定程度上参与渗透调节[25],增加脯氨酸含量,调控植物渗透势,提高植物耐性[26-27]。本试验中盐胁迫显著提高玉竹叶片中可溶性蛋白、游离脯氨酸含量,说明为抵御盐胁迫,玉竹大量积累渗透调节物质维持叶片细胞内渗透调节平衡,在NaCl≤150 mmol·L-1时,外施SNP处理显著提高玉竹叶片中可溶性蛋白和游离脯氨酸含量,表明施加一定浓度NO供体SNP可促进植物蛋白合成,提高脯氨酸含量,有助于维持叶片渗透压平衡。
非生物胁迫下,植物细胞产生活性氧主要部位是线粒体和叶绿体,在线粒体和叶绿体中,ROS主要通过将电子传递链上的电子传递给氧,即产生活性氧ROS,同时植物体内也存在一系列清除活性氧保护酶,如超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、抗坏血酸氧化酶(APX)、过氧化物酶(POD)等。这些酶对活性氧ROS综合清除能力与植物耐胁迫能力正相关,在抗氧化系统中,SOD能直接将O2-转变为H2O2;CAT、APX等是清除细胞内H2O2关键酶[28]。本试验表明盐胁迫下玉竹保护酶SOD、POD、CAT、APX活性除APX随盐浓度升高而呈降低趋势外,其他均呈先升后降趋势。除200 mmol·L-1盐浓度外,外援NO浓度为100 μmol·L-1时酶活性高。说明100 μmol·L-1SNP相比其他浓度可提高保护酶活性,有利于清除生物体内过量氧自由基,降低膜脂过氧化,当盐浓度为200 mmol·L-1时,添加外源SNP,SOD、POD、CAT活性随NO浓度升高呈持续降低趋势。这与Valderrama等提出NO对水稻抗氧化保护酶活性影响有差异,可能是高浓度Na+与NO共同作用提高植物体内S-亚硝基谷胱甘肽(S-GSNO)和S-亚硝基硫醇(RSNO)等硝基化合物含量,而这种硝基化合物与金属蛋白中过渡金属发生反应,亚硝酰化,导致酶活性下降[29],但相关机理有待进一步研究。
GSH作为植物体内抗氧化剂及金属硫蛋白与植物螯合态前体,直接参与自由基猝灭,ASA直接与活性氧发生作用[24]。GSH和ASA也是ROS清除系统非酶物质及ASA-GSH循环重要组成部分。本试验结果表明,盐胁迫降低GSH和ASA含量。在盐浓度低于150 mmol·L-1时,其含量随NO浓度变化呈先升后降趋势,而GSH是催化ASA合成关键酶双脱氢抗坏血酸还原酶底物,这是造成ASA变化趋势与GSH相近原因之一。APX活性变化趋势与其抗氧化保护酶变化趋势不同,而与ASA含量变化趋势相近。推测玉竹叶片中ASA可作为催化底物引起APX活性变化。盐胁迫对玉竹叶片抗氧化系统影响与苜蓿根系[24]研究结果不同。原因是玉竹叶片抵御非生物胁迫时更多依赖抗氧化保护酶而不是非酶抗氧化物,盐胁迫产生大量ROS对玉竹叶片组织产生伤害影响非酶抗氧化物合成,导致非酶抗氧化物含量下降。
综上所述,盐胁迫时,施加一定浓度外源NO供体SNP可提高叶片肉质化程度,叶片相对含水量。抗氧化物保护酶和非酶抗氧化物含量提高增强胁迫抗性,但当提供较高浓度NO供体SNP时,对玉竹各生理指标产生抑制作用,影响正常代谢活动。高浓度盐胁迫下,外源SNP对非酶抗氧化物有促进作用,对抗氧化物保护酶作用不明显。
[1]Li J G,Pu L J,Zhu M,et al.The Present situation and hot issues in the salt-affected soil research[J].Acta Geographica Sinica, 2012,67(9):1233-1245.
[2]Wang J,Huang X,Zhong T,et al.Review on sustainable utilization of salt-affected land[J].Acta Geographica Sinica,2011,66 (5):673-684.
[3]Zhang X,Lu G,Long W,et al.Recent progress in drought and salt tolerance studies in Brassica crops[J].Breeding Science,2014, 64(1):60-73..
[4]魏湜,张翯,顾万荣,等.DCPTA对盐胁迫下玉米叶片渗透调节生理生化特征影响[J].东北农业大学学报,2015,46(9):1-8.
[5]吴雪霞.外源一氧化氮对盐胁迫下番茄幼苗生理特性影响的研究[D].南京:南京农业大学,2007.
[6]夏海威,施国新,黄敏,等.一氧化氮对植物重金属胁迫抗性的影响研究进展[J].生态学报,2015,35(10):3139-3147.
[7]Verma K,Mehta S K,Shekhawat G S.Nitric oxide(NO)counteracts cadmium induced cytotoxic processes mediated by reactive oxygen species(ROS)in Brassica juncea:cross-talk between ROS,NO and antioxidant responses[J].Bio Metals,2013,26(2): 255-269.
[8]刘塔斯,杨先国,龚力民,等.药食两用中药玉竹的研究进展[J].中南药学,2008,6(2):216-219.
[9]卜静,李登武,王冬梅.玉竹品质与主要生态因子的相关性[J].应用生态学报,2012,23(6):1447-1454.
[10]陈双,陈雪梅,唐仲华.玉竹糖蛋白的微波提取及抗氧化作用研究[J].安徽农业科学,2016(9):116-118.
[11]郑爽,李新华,杨强,等.玉竹多糖纯化工艺的优化研究[J].食品工业科技,2016,37(4):322-336.
[12]高俊凤.植物生理学实验指导[M].北京:高等教育出版社, 2006.
[13]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[14]张志良.植物生理学实验指导[M].北京:高等教育出版社, 1990.
[15]陈建勋.植物生理学实验指导[M].广州:华南理工大学出版社,2002.
[16]Zhu J K.Salt and Drought Stress Signal Transduction in Plants[J]. Plant Biology,2002,53(53):247.
[17]Arasimowicz M,Floryszak-Wieczorek J.Nitric oxide as a bioactive signalling molecule in plant stress responses[J].Plant Science,2007,172(5):876-887.
[18]徐小玉,张凤银,曾庆微.NaCl和Na2SO4盐胁迫对波斯菊种子萌发的影响[J].东北农业大学学报,2014,45(4):55-59.
[19]Yang S L,Chen K,Wang S S,et al.Osmoregulation as a key factor in drought hardening-induced drought tolerance inJatropha curcas[J].Biologia Plantarum,2015,59(3):529-536.
[20]王瑞,马凤鸣,李彩凤,等.低温胁迫对玉米幼苗脯氨酸、丙二醛含量及电导率的影响[J].东北农业大学学报,2008,39(5):20-23.
[21]刘建新,胡浩斌,王鑫.外源NO对盐胁迫下黑麦草幼苗根生长抑制和氧化损伤的缓解效应[J].植物研究,2008,28(1):7-13.
[22]吴雪霞,朱月林,朱为民,等.外源一氧化氮对NaCl胁迫下番茄幼苗生理影响[J].中国农业科学,2006,39(3):575-581.
[23]Uchida A,Jagendorf A T,Hibino T,et al.Effects of hydrogen peroxide and nitric oxide on both salt and heat stress tolerance in rice [J].Plant Science,2002,163(3):515-523.
[24]周万海,冯瑞章,师尚礼,等.NO对盐胁迫下苜蓿根系生长抑制及氧化损伤的缓解效应[J].生态学报,2015,35(11):3606-3614.
[25]Cernusak L A,Aranda J,Marshall J D,et al.Large variation in whole-plant water-use efficiency among tropical tree species[J]. New Phytologist,2007,173(2):294-305.
[26]Wang X,Wang H,Fengzhi W U,et al.Effects of cinnamic acid on the physiological characteristics of cucumber seedlings under salt stress[J].Frontiers of Agriculture in China,2007,1(1):58-61.
[27]闫永庆,朱虹,刘兴亮,等.盐胁迫对紫穗槐生长发育及生理特性的影响[J].东北农业大学学报,2008,39(12):31-35.
[28]Han B,Sun J,Guo S R,et al.Effects of calcium on antioxidant enzymes activities of cucumber seedlings under salt stress[J].Acta Horticulturae Sinica,2010,37(12):1937-1943.
[29]Valderrama R,Corpas F J,Carreras A,et al.Nitrosative stress in plants[J].Febs Letters,2007,581(3):453-461.
Effect of exogenous nitric oxide on oxidative damage inPolygonatum
odoratumunder NaCl stress
YAN Yongqing,ZHAO Yixiang,DU Yuling,LI Danyang,PAN
Chenhui,GAO Menglei(School of Horticulture and Landscape Architecture,Northeast Agricultural University,Harbin 150030,China)
In order to investigate the regulating effect of NO against salt tolerance ofPolygonatum odoratum,the study,where pottedPolygonatum odoratumand sodium nitroprusside were adopt as experimental material and NO donor,was carried on for exploring the influence ofPolygonatum odoratum leaves oxidative damage,under salt stress and different concentration of exogenous SNP.The results indicated that,with the NaCl concentration no higher than 150 mmol·L-1,appropriate concentration NO(SNP concentration≤100 μmol·L-1)could be effectively adopt to reduce injury ofPolygonatum odoratum,which manifested as follow variations,rising leaves succulence level,enhancing the activity of SOD,POD,CAT, APX,reducing MDA content and increasing the accumulation of soluble protein,proline,ASA and GSH. However,high concentration of NO(SNP>100 μmol·L-1)was shown to inhibit the different physiological indices,affecting the normal metabolic activity.Meantime,with NaCl concentration higher than 150 mmol·L-1, exogenous NO was not obvious and high concentration NO was even shown to inhibit anti-oxidant enzymes, nonetheless,it had some positive effect to accumulateASAand GSH,etc.
salt stress;nitric oxide;antioxdant system;Polygonatum odoratum
Q945
A
1005-9369(2017)01-0023-10
2016-11-02
黑龙江省自然科学基金项目(C201427)
闫永庆(1966-),男,教授,博士,研究方向为园林植物逆境生理生态等。E-mail:yanyongqing1966@163.com
时间2017-1-9 15:46:06[URL]http://www.cnki.net/kcms/detail/23.1391.S.20170109.1546.008.html
闫永庆,赵奕翔,杜玉玲,等.外源NO对盐胁迫下玉竹氧化损伤缓解效应[J].东北农业大学学报,2016,48(1):23-32.
Yan Yongqing,Zhao Yixiang,Du Yuling,et al.Effect of exogenous nitric oxide on oxidative damage inPolygonatum odoratumunder NaCl stress[J].Journal of Northeast Agricultural University,2016,48(1):23-32.(in Chinese with English abstract)
