石油降解菌筛选鉴定及耐受性分析
2017-03-16刘宇程王姗镒马丽丽陈明燕张红杰杨国通
刘宇程,王姗镒,马丽丽,陈明燕,张红杰,杨国通
(1.西南石油大学化学化工学院,成都 610500;2.中联煤层气有限责任公司,北京 100011;3.中海油能源发展股份有限公司工程技术分公司油田作业支持公司,天津 300000)
石油降解菌筛选鉴定及耐受性分析
刘宇程1,王姗镒1,马丽丽1,陈明燕1,张红杰2,杨国通3
(1.西南石油大学化学化工学院,成都 610500;2.中联煤层气有限责任公司,北京 100011;3.中海油能源发展股份有限公司工程技术分公司油田作业支持公司,天津 300000)
试验从污泥中筛选3株高效石油烃降解菌m1,m2,m3,对原油最高降解效率达73%,16S rDNA鉴定结果表明,m1为Citrobacter柠檬酸细菌属,m2为Tatumella塔特姆菌属,m3为Kluyvera克吕沃尔氏菌属。分析3株石油降解菌耐受性,结果表明,m2耐强碱性;m1、m2耐较高浓度盐;m2在高浓度Cr中生长;m3在高浓度Hg、Cd、Pb中较好生长。
石油降解菌;筛选;鉴定;耐受性分析
油气泄露等废弃物无害化处理产生大量污泥[1-2],污泥中含苯系物、酚类、蒽、芘等恶臭有毒物质[3],对环境危害明显[4],如不及时处理,有害物质渗入土壤,破坏土壤结构、通透性及土壤微生物群种类和分布[1,3]。目前此类污泥处理主要有物理、化学和生物处理法[5]。物理处理法仅降低污泥浓度,无法彻底去除污染物[6]。化学处理法有溶液淋洗萃取法[7-8]、电化学法[9]和化学氧化法等[10-11],污泥处理效率高,但会产生二次污染物,处理成本较高[7]。生物处理技术发展较晚[12-13],但成本低、无二次污染、处理效果好,是污泥处理首选[14-15]。
生物处理技术主要利用微生物处理,石油降解菌利用污染物中石油类物质作为营养物质生长,达到降解石油类物质作用。对石油类物质有分解能力菌种包括细菌、放线菌、霉菌、酵母菌等[16]。石油类污染物具有疏水特性,不利于细菌对污染物分解。革兰氏阴性菌细胞壁外层含有丰富多糖、类脂和脂多糖等物质,细胞壁周围有两亲分子层,利于油类物质吸附和降解。革兰氏阳性菌细胞壁主要成分是肽聚糖,无脂类物质,不利于油类物质吸附,无法使油类物质进入细胞内被降解。石油类污染物降解细菌多属革兰氏阴性菌,主要包括产碱杆菌属(Alcaligenes)[17],黄杆菌属(Flavobacterium)[18],芽孢杆菌属(Bacillus)[19]等。
彭鸽威等筛选一株高效原油降解菌X3,比较不同浓度下原油对细菌生长和降解率影响,研究pH和盐浓度对该菌株降解原油能力影响,对原油有72.6%降解率[20]。陈梅梅等筛选一株耐盐石油降解菌,高盐度条件下对石油具有较好降解效果,达56.12%[21]。试验表明,复合菌种比单一菌种降解石油类物质效率更高。Khanna等从受原油污染土壤中筛选一株石油降解菌YSL28,对原油降解率为46.9%,降解效率较低[22]。Verma等筛选一株石油降解菌Bacillus sp.SV9,对含油污泥降解率为59%,降解率较低,不利实际应用[23]。
本文针对石油降解率低、菌种单一等问题,筛选污水处理厂污泥,并观察筛选的高效石油降解菌形态,通过生理生化鉴定和16S rDNA分离鉴定,研究3株石油降解菌盐含量、pH、Hg、Cd、Pb、Cr、As耐受能力,探究筛选菌种处理污染物适应能力,进一步选育修复污染物优势菌株。
1 材料与方法
1.1 样品采集
污泥取自于陕西省榆林市神木县大牛地气田污水处理厂。石油污染土壤和老化油均取自吐哈油田。城镇生活污水厂污泥取自四川省成都市新都区金海污水处理厂活性污泥。土壤取自四川省新都市西南石油大学校内。
1.2 试验主要药品和培养基
主要药品:牛肉膏,蛋白胨,氯化钠,Tris,DNA小量试剂盒,琼脂糖,50×TAE缓冲液等。
主要培养基:牛肉膏蛋白胨培养基:用于筛选后菌种富集和培养,主要成分牛肉膏3 g,蛋白胨10 g,氯化钠5 g,蒸馏水1 000 mL,用于保存菌种和稀释涂布等制备固体培养基时加入15~20 g琼脂;筛选(基础)培养基:NH4NO34.0g,K2HPO4·3H2O 5.2 g,KH2PO46.0 g,MgSO4·7H2O 0.2 g,微量元素溶液1 mL(CaCl2755 mg,FeSO4·7H2O 1 000 mg,EDTA 1 400 mg),适量原油,去离子水1 000 mL。所有培养基均于121℃下灭菌20 min。
1.3 石油降解菌筛选和鉴定
1.3.1 石油降解菌驯化筛选
称取10 g污泥、石油污染土壤、老化油、活性污泥、土壤分别加到装有100 mL无菌水250 mL锥形瓶中,于28℃、160 r·min-1恒温振荡培养箱中培养24 h。制成污泥悬浊液后静置。配置500、1 000、1 500、2 000 mg·L-1石油浓度梯度,依次对菌株驯化。
移取10 mL土壤悬浊液接种于石油梯度为500 mg·L-1100 mL富集培养基中,28℃、160 r·min-1恒温震荡培养箱中培养7 d。然后取10 mL加入石油浓度为1 000 mg·L-1培养基中,转接3次。得到在高浓度石油污染环境中生长菌株,选取具有良好降解性能菌种[24]。将所得菌种活化后接至以石油为唯一碳源无机盐培养基中,转速180 r·min-1,温度30℃,培养7 d后,观察三角瓶中原油降解情况,选出降解率较高菌株作复筛试验。再将初筛中降解率较高菌种活化后接至以石油为唯一碳源无机盐培养基中,转速180 r·min-1,温度30℃,培养7 d后,测定菌株原油降解率。
1.3.2 石油降解菌鉴定
鉴定3株石油降解菌形态及生理生化特性。生理生化鉴定包括革兰氏染色、M-R试验、V-P试验、淀粉水解试验、明胶试验、吲哚试验、硝酸盐还原试验。
本文采用16S rDNA鉴定细菌种属:使用Axy-Prep细菌基因组DNA小量试剂盒(DNeasy,Qiagen,德国)提取菌株DNA,具体步骤详见说明书,采用引物27F(5'AGAGTTTGATC CTGGCTCAG 3')和1492R(5'GGTTACCTTGTTACG ACTTT 3')扩增DNA,PCR反应体系为50 μL,具体试验步骤和程序采用:DNA模板1 μL,Colorless Master Mix 25 μL(Promega公司,美国),Primer 27 F和Primer 1492 R引物各1 μL(10 μmol·L-1)和22 μL无核酸酶纯水[25]。PCR扩增条件如下:94℃下预变性10 min,进入循环,94℃变性1 min 10个循环,65~55℃变性1 min(每个循环降低1℃),53℃退火90 s,72℃延伸2 min;94℃变性1 min 30个循环;55℃退火1 min,72oC延伸2 min,最后4℃保存。PCR产物提交成都飞腾博川(瑞信)生物公司DNA测序。NCBI数据库(http://www.ncbi.nlm.nih. gov)对比测得基因序列,找出与该序列相似同源序列,使用MEGA 6.0对基因序列构建和分析系统发育树。
1.4 菌种耐受性分析
1.4.1 菌株对盐含量耐受性试验
将三株菌株分别制成菌悬液,取100 μL菌悬液分别接种于50 mL含NaCl液体培养基,NaCl含量分别为0、2%、4%、5%、6%、7%、8%、10%,于30℃、140 r·min-1恒温振荡培养3 d,可见光分光光度计于波长600 nm处测定细菌悬浮液光密度(OD600),确定三株菌株耐盐性。
1.4.2 菌株对pH耐受性试验
将三株菌株分别制成菌悬液,取100 μL菌悬液分别接种于50 mL不同pH液体培养基中;由于在工业生产中,被污染土壤多为碱性土壤,通过添加1 mol·L-1NaOH溶液使液体培养基pH分别为8、8.5、9、9.5、10、10.5、11、11.5,于30℃、140 r·min-1下恒温振荡培养3 d,可见光分光光度计于波长600 nm处测定细菌悬浮液OD值,确定三株菌株对pH耐受性。
1.4.3 菌株对Hg、Cd耐受性试验
将三株菌株分别制成菌悬液,取100 μL菌悬液分别接种于50 mL含Hg、Cd液体培养基中,Hg、Cd含量分别为0~5 mg·L-1,于30℃、140 r·min-1恒温振荡培养3 d,可见光分光光度计于波长600 nm处测定细菌悬浮液光密度值(OD600),确定三株菌株对Hg、Cd耐受性。
1.4.4 菌株对Pb、Cr耐受性试验
将三株菌株分别制成菌悬液,取100 μL菌悬液分别接种于50 mL含Pb、Cr液体培养基中,Pb、Cr含量分别为0、20、40、60、80、100 mg·L-1,于30℃、140 r·min-1恒温振荡培养3 d,可见光分光光度计于波长600 nm处测定细菌悬浮液光密度值(OD600),确定三株菌株对Pb、Cr耐受性。
1.4.5 菌株对As耐受性试验
将三株菌株分别制成菌悬液,取100 μL菌悬液分别接种于50 mL含As液体培养基中,As含量分别为0、5、10、20、25、30 mg·L-1,于30℃、140 r·min-1恒温振荡培养3 d,可见光分光光度计于波长600 nm处测定细菌悬浮液光密度值(OD600),确定三株菌株对As耐受性。
2 结果与分析
2.1 石油降解菌筛选
挑选不同来源(污泥、钻井泥浆、老化油、土壤)驯化后在石油无机盐平板上长势较好32株菌作初筛(见图1)。菌株编号1~10为大牛地污水厂污泥,11~12为油田钻井泥浆,13~14为石油污染土壤,15为老化油,16为土壤。通过原油降解试验,筛选出16株能将石油作为唯一营养源、生长迅速,原油降解明显菌株进一步复筛。
按正常工作条件选择电气设备时,需要考虑电气设备的安装环境条件以及相关电气设备要求。包括电气装置所处位置、环境温度、防火防爆等要求,此外,还包括电气装置对电流、电压等方面的要求,最后还需对其进行短路校验。
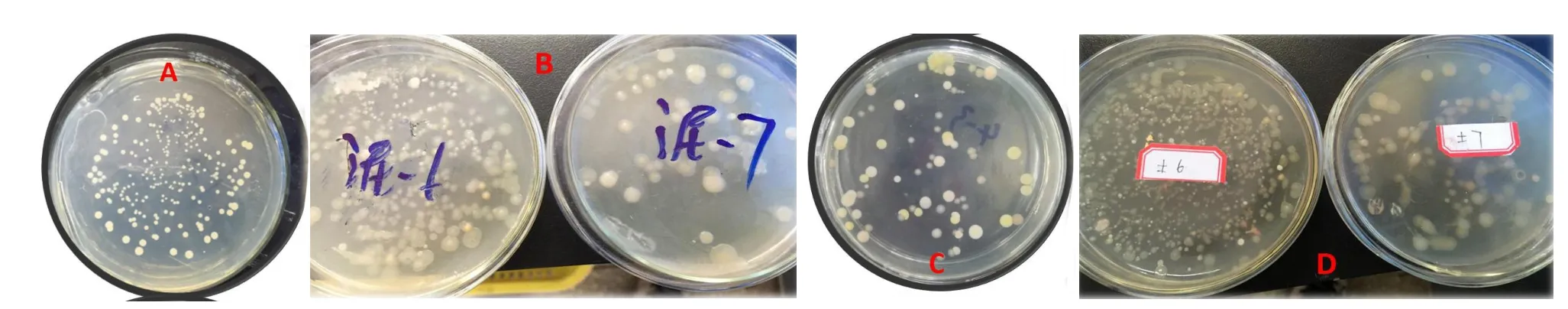
图1 菌株初筛平板Fig.1Strain screening plate
将初筛菌株分别接入原油无机盐培养基中培养,均能以不同程度在以原油为唯一碳源环境中生长,培养7 d后,测定菌株编号1~16原油降解率分别为73%、66%、60%、6%、4%、60%、66%、29%、11%、71%、39%、41%、46%、48%、50%和54%。复筛试验所用16株石油降解菌中,大牛地污泥选10株,钻井泥浆、石油污染土壤和老化油中各选2株,由于城镇污水厂活性污泥在初筛试验中效果相对较差,复筛时未选取该样品。
经复筛试验结果表明,试验污泥筛分细菌1#和细菌10#对石油烃降解效果良好,7 d降解率达70%以上,另有2株降解率达66%,从老化油来源样品中筛分细菌15#和16#,原油降解率相对较好,但仍小于大牛地污泥筛分菌种,综合考虑降解率和菌种环境适应性,挑选3株试验污泥中筛分出高效石油降解菌(1#、2#和10#)作下一步试验。
2.2 石油降解菌鉴定
2.2.1 石油降解菌初步鉴定
对三株石油降解菌形态及生理生化鉴定结果见表1。
2.2.2 石油降解菌16S rDNA鉴定
对三株石油烃降解菌作16S rRNA基因序列分析结果得到各菌株序列进化树,菌m1(1#)属Klebsiella柠檬酸细菌属,菌m2(2#)属Tatumella塔特姆菌属,菌m3(10#)属Kluyvera克吕沃尔式菌属。如图2所示。
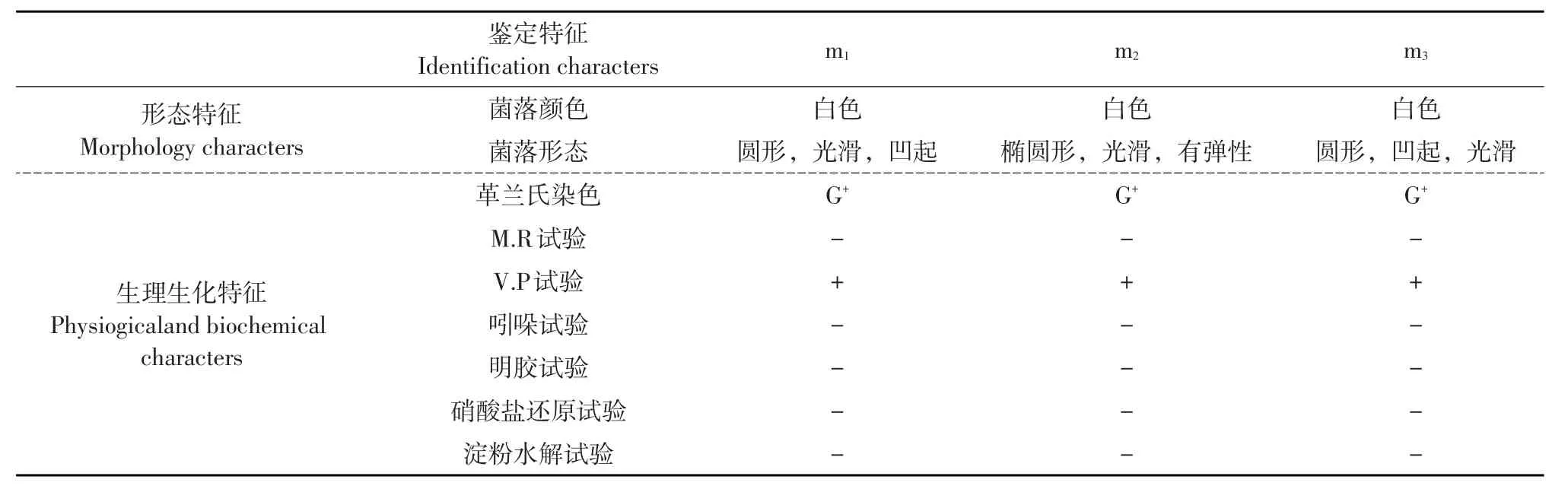
表1 石油降解菌形态和生理生化鉴定Table 1Morphology and physiogicaland biochemical characters of petroleum degrading bacteria
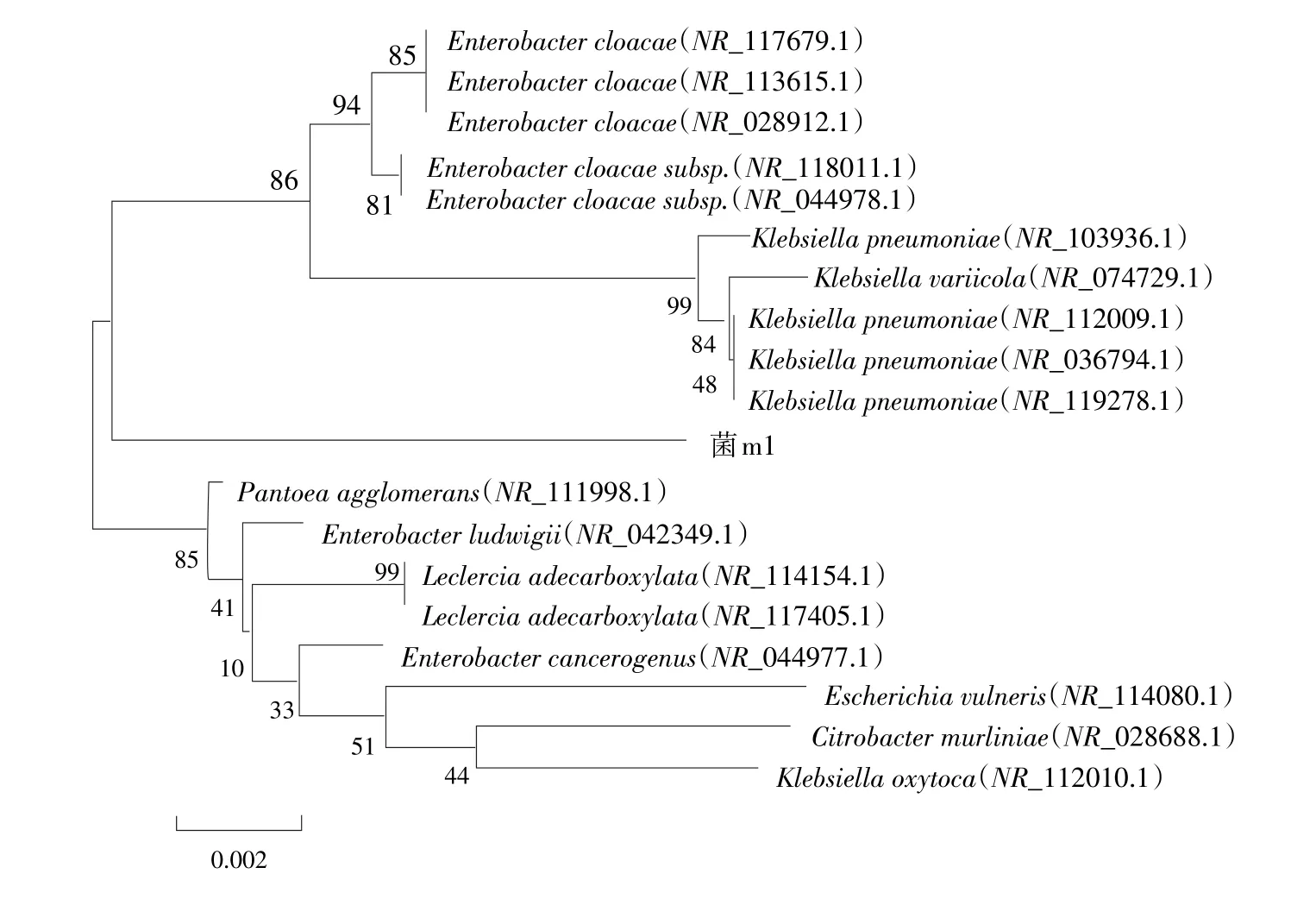
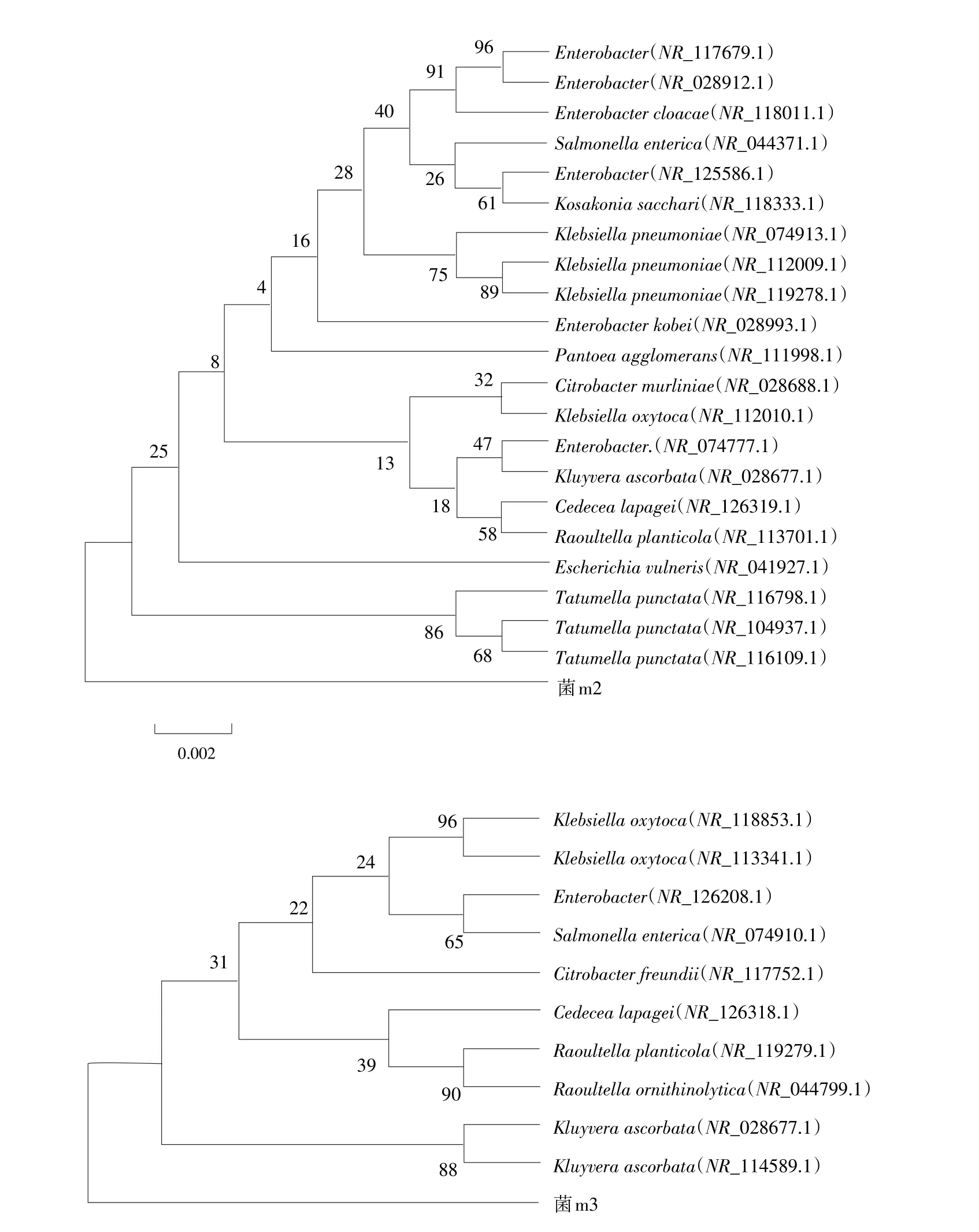
图2 三种菌进化树构建Fig.2Three kinds of bacteria to construct phylogenetic tree
2.3.1 菌株对盐类环境耐受能力分析
微生物生长环境中盐类物质过高改变微生物细胞渗透压,影响微生物吸收水分及排放废物,微生物失水过多而死亡[26]。钻井废弃物中盐类物质均过高,限制微生物生长。试验结果表明,菌株m1、m2和m3对盐类耐受浓度分别为8%、8%和7%。
菌株对不同盐浓度耐受能力如图3所示,三株菌株均可在高浓度盐含量中生长;在盐含量浓度低于2%时,菌株生长数量随盐浓度升高而增加,是因NaCl提供菌株生长所需元素,促进菌株生长;浓度超2%时,菌株生长数量随盐浓度增加而减少;原因是高浓度盐含量造成菌株渗透压失衡脱水,抑制菌株生长繁殖。m3菌株最高耐受浓度达7%,m1和m2菌株最高耐受浓度达8%。由试验结果可见,这三种菌株对盐类环境均具有耐受能力,其中菌株m1、m2耐盐性能最高,耐受盐浓度最高达8%。微生物仅保证自身需要盐类物质时才主动从外界吸收盐类物质,当环境中耐盐菌大量生长时才能改变油气田废弃物盐性环境。复筛菌株对盐类物质高耐受性决定其可在油气田废弃物中生长。本文菌株盐耐受性达8%,可在油气田废弃物环境生长。
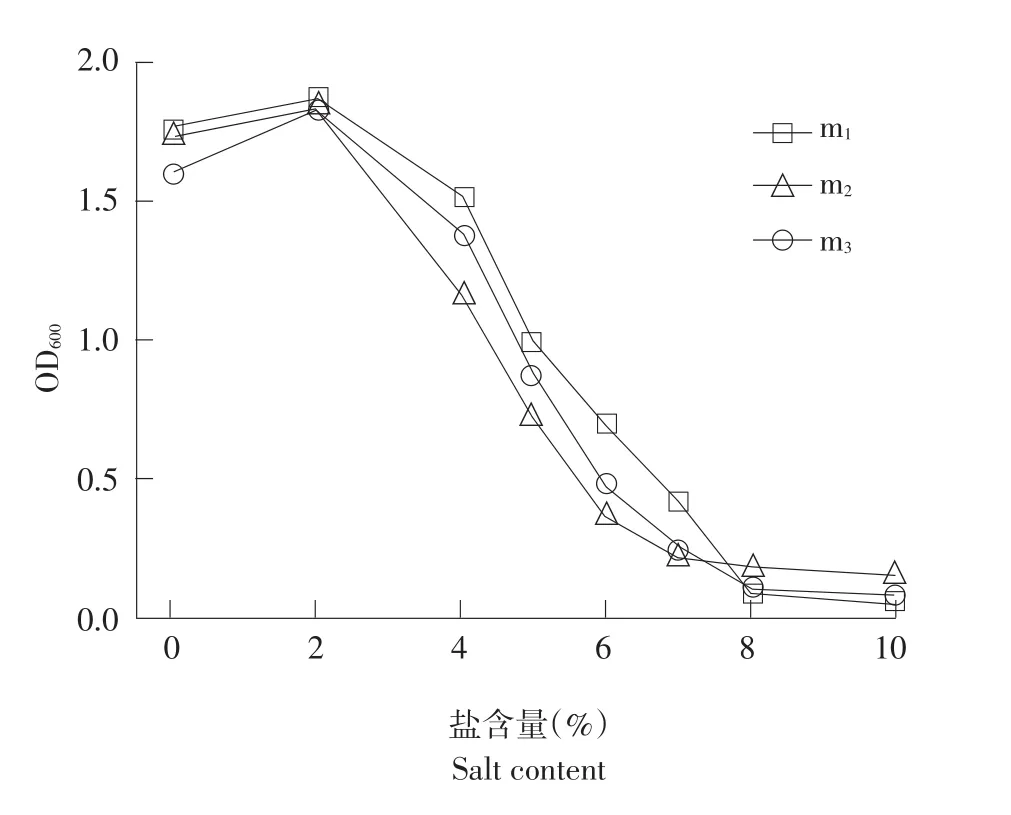
图3 菌株在不同盐含量培养基中生长情况Fig.3Strains in different salt medium for growth
2.3.2 菌株对碱性环境耐受能力试验
适宜酸碱度是微生物生长繁殖必要条件之一。虽然大部分微生物对环境适应性极强,但需较长时间驯化。油气田开发钻井过程会添加碱性物质控制井内酸碱度,油气田废弃物碱性很强,一般情况下呈强碱性[27]。强碱性环境极大程度阻碍微生物生长。探究污染物降解菌株对碱性环境耐受能力尤为必要。选用1 mol·L-1NaOH作为碱性物质加入液体培养基,试验结果为菌株m1、m2和m3最高耐受pH分别为11、11.5、11。
菌株在不同碱性培养基中生长情况如图4所示,m1和m3随pH增加生长数量下降;在pH<9.5时,pH对m1和m3菌株抑制作用稍小,在pH为9.5时依然保持旺盛生长能力,最高耐受pH达11。高碱性环境对生物所需营养物质转运、吸收利用有强烈抑制作用,直接阻碍生物生长繁殖;不同种属菌种对pH耐受程度不同,m2在pH<10时,菌株生长数量随pH增加而增加,pH为10是该菌株最适宜生长pH,当pH>10时;菌株生长数量急剧下降,最高耐受pH达11.5。由试验数据可知三种菌株对碱性环境耐受力均较高,其中m2菌株耐受力明显高于其他两种,菌株最高耐受碱性环境值高达11.5。这三株菌株可在油气田废弃物碱性环境生长,随处理过程各种有害物质减少,一些产酸菌生长并分泌酸性物质,将油气田废弃物环境调整到适宜各种微生物生存的条件。
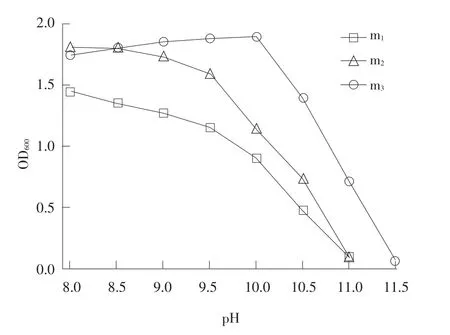
图4 菌株在不同碱性培养基中生长情况Fig.4Strains in different alkalinity medium for growth
2.3.3 菌株对重金属离子抗性试验
油气田废弃物中存在大量重金属离子,例如铬、铅、镉等,重金属离子多以有毒性化合态存在,危害微生物生长和繁殖。石油类降解菌对重金属离子耐受能力是保证油气田污染物彻底处理关键。本试验选用5种主要环境污染重金属离子,用不同浓度重金属离子培养液检测三种石油降解菌对其耐受能力。试验结果见表2。
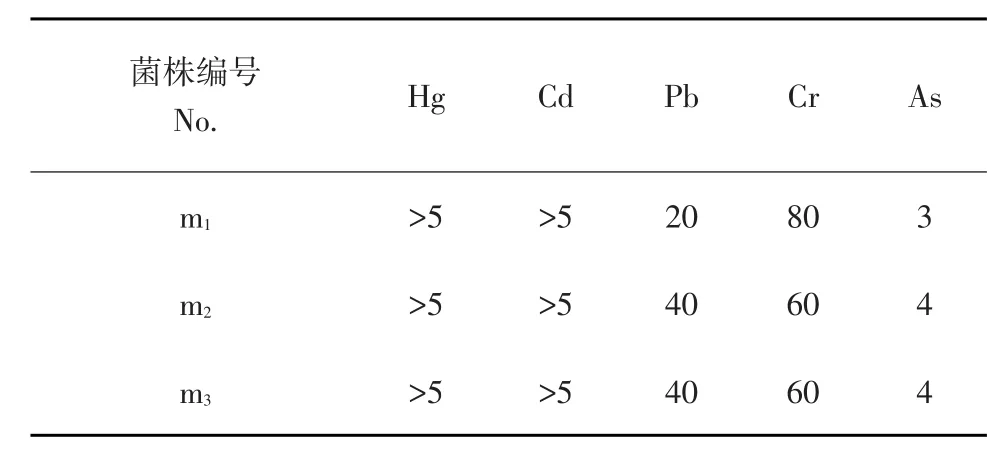
表2 菌株对重金属耐受能力试验结果Table 2Experimental results of heavy metal tolerance strains(mg·L-1)
Hg是一种生物毒性极强重金属,进入生物体后很难排出。Hg对三株菌株生长影响情况见图5。
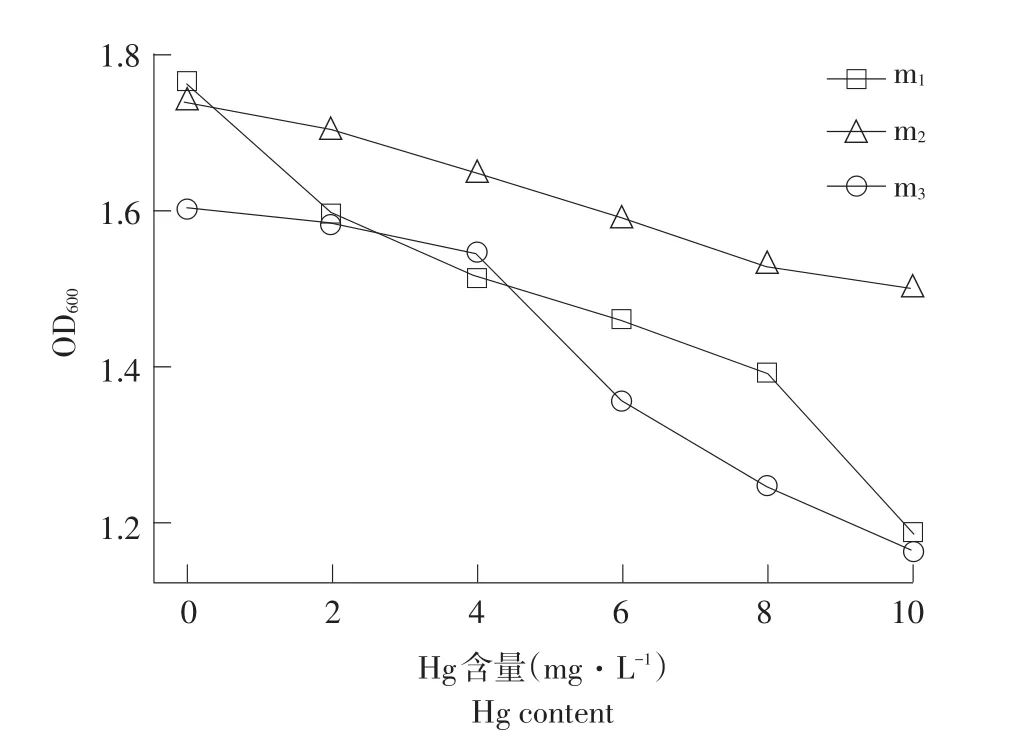
图5 菌株在不同质量浓度Hg培养基中生长情况Fig.5Strains in different Hg medium for growth
由图5可知,m1、m2和m3生长数量随Hg浓度增加而呈下降趋势。Hg浓度达5 mg·L-1时,三株菌株均具有较强生长能力,m3菌株在高浓度Hg环境中生存能力较强。刘红娟等发现,菌株细胞壁-OH、-NH4化学官能团与重金属发生缔合,菌m3菌体及分泌物可能存在着如羧基、羟基等大量阴离子基团,与Hg离子相互作用,选择性结合环境中Hg,所以m3在高浓度时也表现出较高生长数量[28]。
镉在人体内生物半衰期长达10~30年,为已知最易在体内蓄积有毒物质。Cd对3株菌株生长影响情况如图6所示。
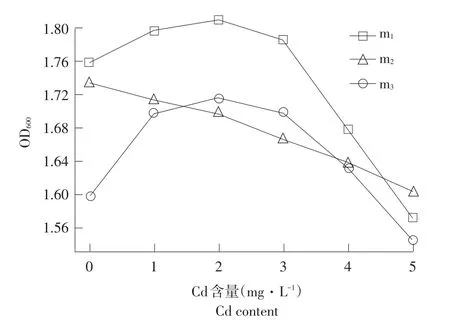
图6 菌株在不同质量浓度Cd培养基中生长情况Fig.6Strains in different Cd medium for growth
由图6可知,菌株m1和m2菌株在Cd质量浓度<2 mg·L-1时,Cd能促进菌株m1和m2生长,菌株生长数量呈上升趋势。当Cd质量浓度>2 mg·L-1时,菌株生长数量随Cd质量浓度增加而下降,菌株生长受抑制。m3菌株生长数量随Cd质量浓度增大而下降。但这三株菌株在5 mg·L-1Cd溶液中保持较高生长数量,与张玉秀等分离筛选到耐Cd浓度高达8.89 mol·L-1细菌ZGKD2结果相一致[29],这可能是三株菌株通过胞壁上有机基团将Cd直接结合在细胞表面发生吸附,同时通过细胞代谢向细胞内转移运送Cd,在高浓度下仍有较高生长数量,具有较大耐Cd开发潜力。
Pb、Cr污染对动植物和人体均产生极大生态和健康风险,某些Cr(VI)化合物在体内具有致癌作用[30],浓度稍高即可抑制微生物生长代谢。Pb、Cr对菌株生长情况影响见图7、8。
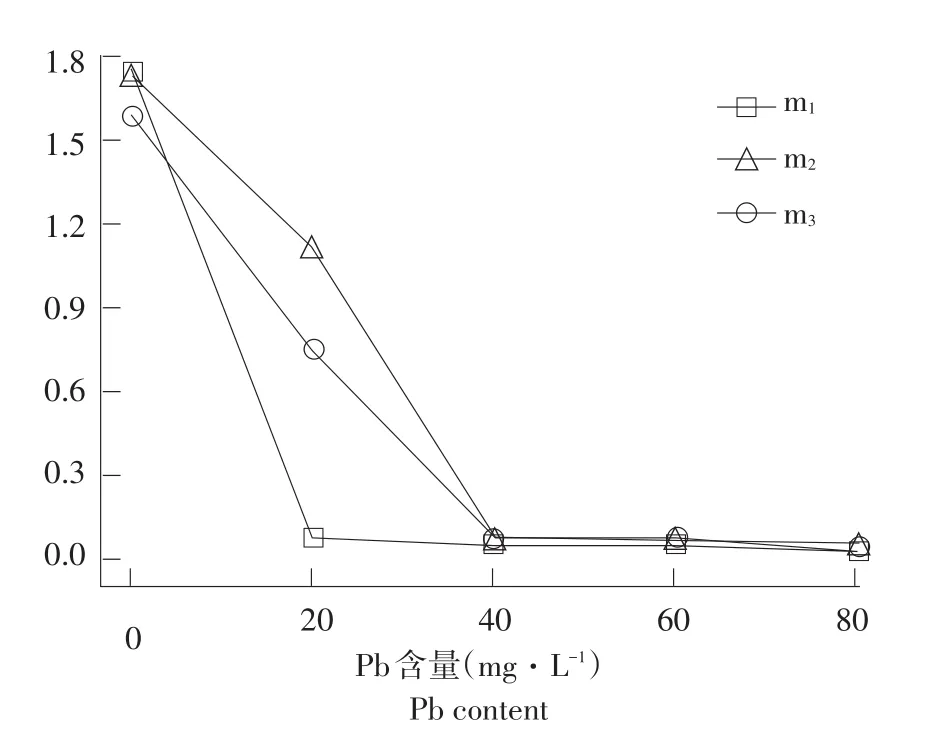
图7 菌株在不同质量浓度Pb培养基中生长情况Fig.7Strains in different Pb medium for growth
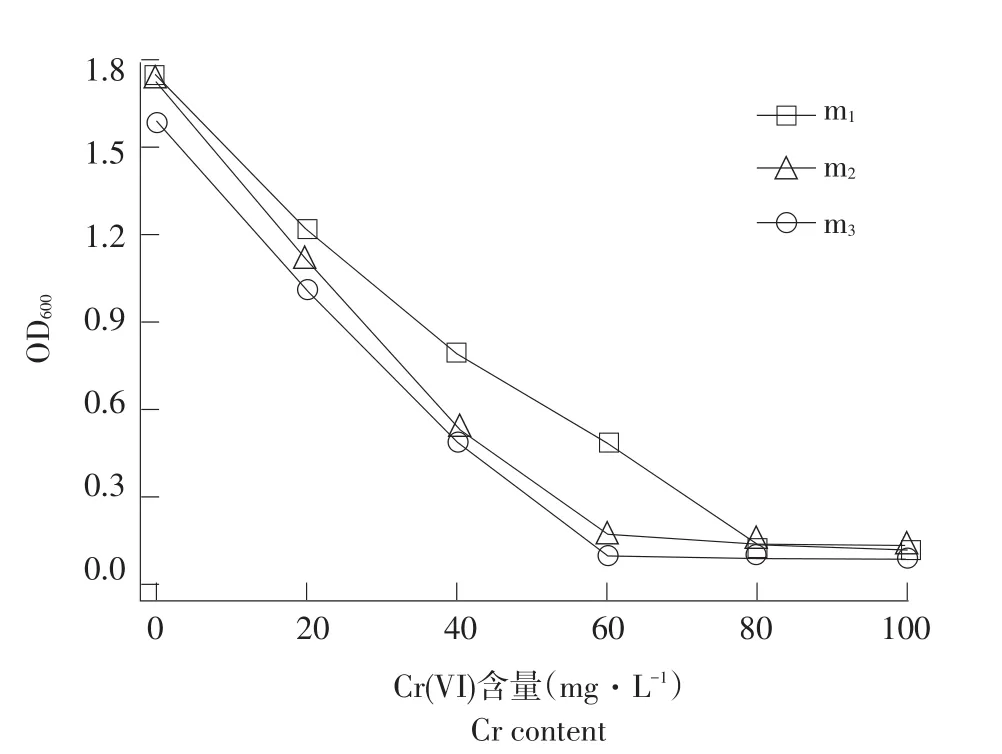
图8 菌株在不同质量浓度Cr培养基中生长情况Fig.8Strains in different Cr medium for growth
三株菌株生长受Pb、Cr影响趋势一致,随Pb、Cr质量浓度增加菌株生长数量下降。菌株m1最高耐Pb质量浓度<20 mg·L-1,菌株m2和m3最高耐受浓度>40 mg·L-1。张汉波等用“吸附+细胞膜传输”模型解释两种细菌生长过程中对Zn离子吸附作用增加但对Cd吸附大幅度下降现象,认为Pb毒性较大,菌株不会主动运输,溶液中重金属减少主要是在细胞表面累积,与本文Pb对三株菌生长影响一致[31]。m1、m2和m3菌株最高耐Cr质量浓度为80、60和60 mg·L-1。土壤重金属Cr污染微生物修复机理包括微生物还原作用、生物吸附;菌株可通过改变重金属化合价改变重金属稳定性及络合能力,降低其生物可利用性和毒性[32]。
As是菌体生长非必需元素,较高浓度As对菌体生长有抑制作用(见图9)。由图9可知,当As浓度<4 mg·L-1时,对菌株m2和m3无明显抑制作用;在As浓度<2 mg·L-1时,m2生长数量呈增长趋势,说明菌株m2在低浓度下可利用As作营养物质生长,这可能与菌株m2细胞壁化学基团有关[33];当As浓度达5 mg·L-1时,菌株m2和m3仍可生长。当As浓度<2 mg·L-1时,菌株m1生长情况未受明显影响,当As浓度>2 mg·L-1时,菌株生长开始受严重抑制,在浓度4 mg·L-1时,菌株m1生长数量极少。
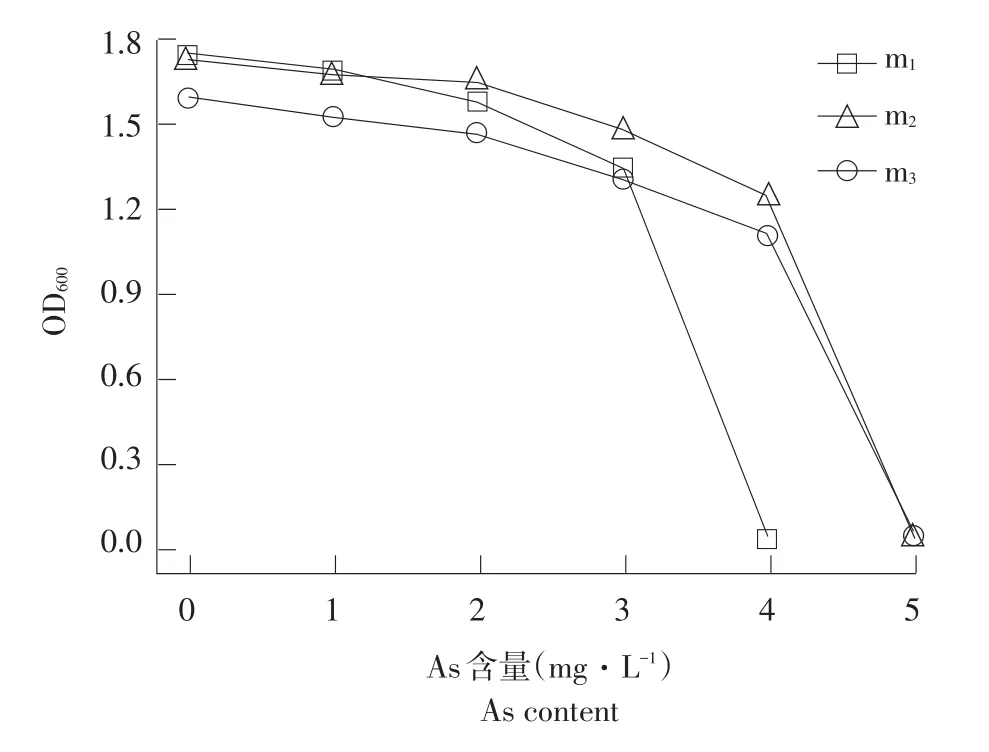
图9 菌株在不同质量浓度As培养基中生长情况Fig.9Strains in different As medium for growth
微生物对重金属解毒作用并非将其分解,而是通过转化有毒离子化合价,将重金属离子毒性减低,如有些微生物可将六价铬离子转变为低毒三价铬离子;或将重金属离子吸附到菌体上在胞内累积从而降低周围环境中重金属离子浓度。研究表明微生物对重金属抗性可能源自微生物可通过阳离子外流系统使阳性重金属离子排出体外,或自身合成一些类金属硫蛋白和螯合重金属肽类,降低重金属对自身伤害。三种菌株对重金属离子抗性效果良好,可在不同浓度重金属离子中生长,对后期污泥无害化处理试验具有指导意义。
3 讨论
本文针对传统生物处理技术菌种单一和处理效率较低问题,筛选三株石油降解菌,原油降解效率均达65%,降解效率提高。与国内外多数研究采用单一菌种相比,利用复合菌种降解原油,菌株在大部分原油污染土壤中可生存,避免菌株受外界极端环境干扰而降低处理效果。结果表明,三株Klebsiella克雷伯氏杆菌属、Tatumella塔特姆菌属、Kluyvera克吕沃尔氏菌属复合菌种降解石油类物质效果显著,与Sathishkumar等筛选的四株复合石油降解菌Bacillus sp.IOS1-7,Corynebacterium sp.BPS2-6,Pseudomonas sp.HPS2-5和Pseudomonas sp.BPS1-8结果一致[34]。
4 结论
a.从含油污泥中筛选出三株石油烃降解菌并经16S rDNA测序,序列分析鉴定表明,菌株m1、m2和m3分别是Klebsiella克雷伯氏杆菌属、Tatumella塔特姆菌属、Kluyvera克吕沃尔氏菌属。
b.筛选高效石油降解菌,原油降解率最高可达73%。
c.三株石油降解菌耐受性试验表明,m2耐强碱性;m1,m2耐较高浓度盐;m2可在高浓度Cr中生长;m3可在高浓度Hg,Cd,Pb中生长。
[1]左丽敏,马晓阳,李智民,等.土壤中石油烃与讲解菌群相互作用研究[J].安全与环境工程,2015,22(4):63-68.
[2]欧阳威,刘红,于勇勇,等.生物强化处理油田含油污泥试验研究[J].农业环境科学学报,2005,24(2):349-352.
[3]刘志林,完石光,于莹.石化含油污泥资源化利用[J].环境保护与循环经济,2010,12(5):58-61.
[4]宋华.石油烃类污染物微生物修复技术[J].环境科学与管理, 2013,38(2):83-88.
[5]郭绍辉,彭鸽威,闫光绪,等.国内外石油污泥处理技术研究进展[J].现代化工,2008,28(3):36-39.
[6]Yang G,Kang D.Enhancing the biodegradation of total petroleumpollutants in oily sludge by a modified bioaugmentation strategy[J]. International Biodeterioration&Biodegradation,2011,65(1): 130-134.
[7]韦朝海,廖建波,刘浔,等.PBDEs来源特征、环境分布及污染控制[J].环境科学学报,2015,35(10):3025-3041.
[8]于勇,谢天强,蔺延项.受石油污染地下水臭氧处理技术研究,工业用水与废水[J].2001,32(2):14-15.
[9]郑安平,田静.臭氧氧化地下水石油污染物动态模拟试验[J].环境科学,1998,19(2):31-34.
[10]王晓玉,葛树生.利用电化学技术处理含油污泥[J].油气田地面工程,2014,3(6):62.
[11]Xu J,Pancras T,Grotenhuis T.Chemical oxidation of cable insulating oil contaminated soil[J].Chemosphere,2011,84(2):272-277.
[12]任华锋,单德臣.石油污染土壤微生物修复技术研究进展[J].东北农业大学学报,2004,35(3):373-376.
[13]朝华扬,李正魁,王浩,等.伊乐藻固定化脱氮微生物技术对入贡湖河道脱氮机制影响[J].环境科学,2016,37(4):1397-1403.
[14]张晓慧,葛芳洲,董玉婧,等.过硫酸盐强化微生物处理石油污染土壤研究[J].应用化工,2015,44(10):1811-1815.
[15]唐广顺,刘亚光.影响土壤中异噁草酮生物修复效果因子研究[J].东北农业大学学报,2008,39(5):53-57.
[16]吴小菁,刘宇,毛彦青,等.共基质生物刺激技术去除城市河道底泥难降解有机物研究[J].水利水电技术,2015,46(2):48-52.
[17]刘明,孙鹏,张祥胜.原油降解菌YSL28分离鉴定及降解特性研究[J].东北农业大学学报,2013,44(5):47-50.
[18]Cai Z,Zhou Q,Peng S,et al.Promoted biodegradation and microbiological effects of petroleum pollutants by Impatiens balsamina L.with strong endurance[J].Journal of Hazardous Materials, 2010,183(1-3):731-737.
[19]Lal B,Khanna S.Degradation of crude oil by Acinetobacter calcoaceticus and Alcaligenes odorans[J].The Journal of Applied Bacteriology,1996.81(4):355-362.
[20]彭鸽威,阎光绪,刘晓春,等.原油降解菌的分离及其降解性能[J].化工进展,2008,27(4):531-534.
[21]陈梅梅,钱文,田生,等.耐盐石油降解菌性能及降解条件优化[J].油气田环境保护,2012,22(3):7-9.
[22]Khanna P,Goyal D,Khanna S.Pyrene degradation by Bacillus pumilus isolated from crude oil contaminated soil[J].Polycyclic Aromatic Compounds,2011,31(1):1-15.
[23]Verma S,Bhargava R,Pruthi V.Oily sludge degration by bacteria from Ankleshwar.India[J].Internantional Biodeterioration& Biodegration,2006,57:207-213.
[24]屠明明,王秋玉.石油污染土壤生物刺激和生物强化修复[J].中国生物工程杂志,2009,29(8):129-134.
[25]Crisafi F,Enaro R D,Genovese M,et al.Comparison of 16SrDNA and toxR genes as targets for detection of Vibrio anguillarum in Dicentrarchus labrax kidney and liver[J].Research In Microbiology,2011,162(3):223-230.
[26]陈美标,郭建华,姚青等.大宝山矿区耐Cd2+细菌分离鉴定及其生物学特性[J].微生物学通报,2012,39(12):1720-1733.
[27]陈立.陕北地区油气田钻井混合废弃物微生物原位修复技术研究[D].西安:西北大学,2009.
[28]刘红娟,张慧,党志,等.一株耐镉细菌分离及其富集Cd机理[J].环境工程学报,2009,3(2):367-371.
[29]张玉秀,宋小庆,黄琳等.煤矿区耐镉细菌筛选鉴定和重金属耐性研究[J].煤炭学报,2010,35(10):1735.
[30]孟庆恒,刘文静,赵东风.土著微生物-玉米对Cr污染联合修复初步研究[J].农业环境科学学报,2007,26(5):1870-1873.
[31]张汉波,郑月,曾凡,等.几株细菌重金属抗性水平和吸附量[J].微生物学通报,2005,32(3):24-29.
[32]王凤花,罗小三,林爱军,等.土壤铬(Ⅵ)污染及微生物修复研究进展[J].生态毒理学报,2010,5(2):153-161.
[33]杨春艳,颜立敏,徐炎华.一株能耐受高浓度As(Ⅲ)菌株耐As特性研究及耐受机制[J].南京工业大学学报:自然科学版,2012, 34(1):61-65.
[34]Sathishkumar M,Binupriya A R,Baik S H,et al.Biodegradation of crude oil by individual bacterial strains and a mixed bacterial consortium isolated from hydrocarbon contaminated areas[J]. Clean-Soil,Air,Water,2008,36(1):92-96.
Screening and identification of oil degrading bacteria and tolerance
analysis
LIUYucheng1,WANG Shanyi1,MALili1,CHEN Mingyan1,ZHANG Hongjie2,YANG Guotong3
(1.Schoolof Chemistry and Chemical Engineering,Southwest Petroleum University,Chengdu 610500,China;2.China United Coalbed Methane Corporation,Ltd.,Beijing 100011,China;3. CNOOC Energy Development Limited by Share Ltd.Engineering and Technology Branch Oil Field Operations Support Company,Tianjin 300000,China)
Three strains of efficient hydrocarbon degrading bacteria m1,m2,m3,were screened from sludge,the highest degradation efficiency of crude oil can reach 73%,and through the 16S rDNA identification,the identification results showed m1was similar to theCitrobacter,m2was similar to the Tatumella,m3was similar to theKluyvera.Then tolerance analysis of the three strains was followed and the results showed that m2could resist strong alkaline,m1,m2were resistant to high concentration of salt,m2could grow in high concentration of Cr,and m3grew well in high concentration of Hg,Cd,Pb.
petroleum degrading bacteria;screening;identification;tolerance analysis
X172
A
1005-9369(2017)01-0049-09
2016-10-31
四川省教育厅科研项目(16ZA0074)
刘宇程(1977-),男,教授,硕士生导师,研究方向为油气田污染治理。E-mail:449669537@qq.com
时间2017-1-9 15:46:04[URL]http://www.cnki.net/kcms/detail/23.1391.S.20170109.1546.006.html
刘宇程,王姗镒,马丽丽,等.石油降解菌筛选鉴定及耐受性分析[J].东北农业大学学报,2017,48(1):49-57.
Liu Yucheng,Wang Shanyi,Ma Lili,et al.Screening and identification of oil degrading bacteria and tolerance analysis[J]. Journal of Northeast Agricultural University,2017,48(1):49-57.(in Chinese with English abstract)
