肝脏局灶性病变的超声造影误诊分析
2017-03-16唐小凤黄惠吴少虹咸孟飞徐作峰
唐小凤 黄惠 吴少虹 咸孟飞 徐作峰
·经验交流·
肝脏局灶性病变的超声造影误诊分析
唐小凤 黄惠 吴少虹 咸孟飞 徐作峰
目的 探讨肝脏局灶性病变的超声造影误诊原因,提高其诊断价值。方法回顾性分析8例超声造影误诊为肝细胞肝癌的肝脏局灶性病变患者的声像图特征,并分析其误诊原因。结果误诊的8例患者中,病理结果提示肝脏局灶性结节增生、肝内胆管细胞癌及血管瘤各2例,炎性假瘤和不典型结节增生各1例。所有误诊病灶超声造影均表现为动脉相呈高或等增强,门脉相或延迟相减退为低增强。结论不同病理类型的病灶具有相似的增强模式是超声造影误诊的原因,仔细观察超声造影图像特征,紧密结合临床检查结果,必要时行穿刺活检,可提高超声造影对肝脏局灶性病变诊断的准确率。
超声检查;造影剂;肝脏局灶性病变;肝细胞肝癌;误诊
超声造影(contrast-enhanced ultrasonography,CEUS)因其客观反映组织病灶微血管的血流灌注,可提高对肝脏局灶性病变的检出率、鉴别诊断及病灶介入治疗后疗效评估的能力。目前,肝脏已成为CEUS重要的应用领域。我国是肝细胞肝癌(hepatocellular carcinoma,HCC)的高发区,多由乙型病毒性肝炎演变而来[1],其典型超声造影表现为病灶动脉相呈等或高增强,门脉相或延迟相减退为低增强的增强模式[2],但部分非HCC的肝脏局灶性病变也有相同的超声造影增强表现,极易误诊。本研究回顾性总结误诊为HCC的肝脏局灶性病变的CEUS表现,分析其误诊原因,旨在进一步提高CEUS对其的诊断准确率。
资料与方法
一、临床资料
选取2014年6月至2015年10月在我院被CEUS误诊为HCC的肝脏局灶性病变患者8例(共8个病灶),其中男6例,女2例,年龄21~74岁,平均(52.1±20.0)岁。病灶大小为1.9~13.7 cm,平均(6.6±5.4)cm。所有病灶均经手术或穿刺活检病理结果证实。
二、仪器与方法
使用东芝Aplio 500彩色多普勒超声诊断仪,PVT-375 BT探头,频率2~5MHz,机械指数0.05~0.07,配备造影谐波成像技术。造影剂选用SonoVue(意大利Bracco公司)。使用前注入5.0m l生理盐水后振荡配制成混悬液,造影时抽取2.4m l经肘部浅静脉团注,随后用5.0ml生理盐水冲注。先行常规超声扫查肝脏,观察病灶的大小、数目、位置、边界、回声强度及其血流特征,选择病灶的最佳扫查位置及最大切面,固定探头位置,切换成造影模式注入造影剂,连续实时观察病灶及周围肝组织6~8min,存储造影动态图像于机器硬盘中。造影后由两名医师共同读片并做出诊断。
将8例误诊患者的CEUS动态图像进行回放,观察病灶的增强程度、增强形态及增强随时间的变化等特点,分析误诊原因。

表1 8例误诊患者肝局灶性病变的CEUS特征
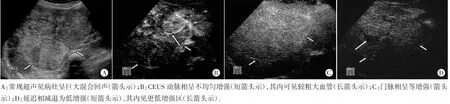
图1 同一肝局灶性结节增生病灶常规超声及CEUS声像图
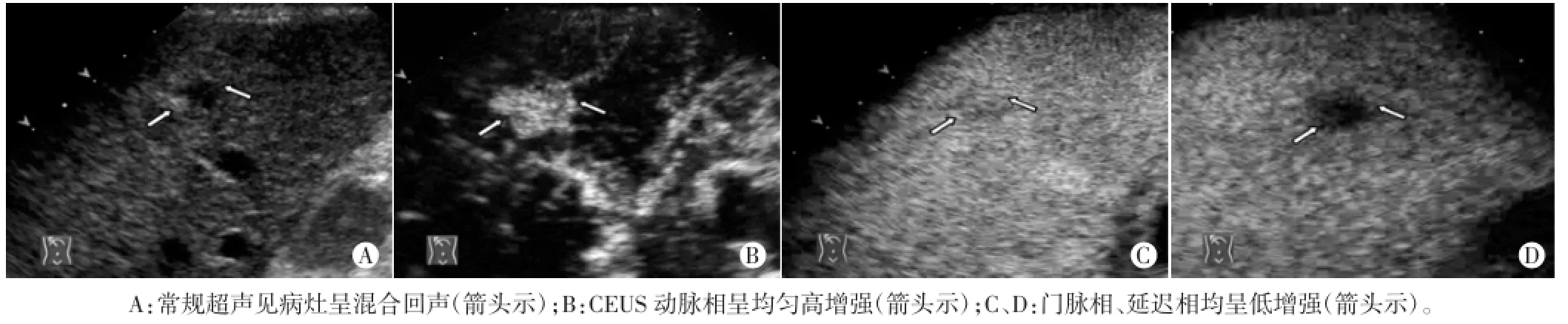
图2 同一肝内胆管细胞癌病灶常规超声及CEUS声像图
结果
本组8例患者共8个病灶CEUS均误诊为HCC,病理结果显示,肝局灶性结节增生、肝内胆管细胞癌及肝血管瘤各2例,肝炎性假瘤和典型增生结节各1例。8例误诊患者肝局灶性病变的CEUS特征见表1。
2例肝局灶性结节增生患者均无肝炎病史,血清甲胎蛋白均阴性。其中1例常规超声示右肝发现低回声病灶;CEUS动脉相呈均匀高增强,门脉相减退呈低增强,延迟相继续减退呈更低增强,边界不清。另1例常规超声示右肝巨大混合回声病灶;CEUS动脉相呈不均匀高增强,内见粗大血管,门脉相呈等增强,延迟相减退呈不均匀低增强,边界模糊(图1);术后5个月,余肝可见一复发灶,直径约5 cm,增强模式同原发病灶。
2例肝内胆管细胞癌患者均无肝炎病史,血清甲胎蛋白阴性。其中1例常规超声示右肝混合回声病灶,边界不清;CEUS动脉相呈均匀高增强,边界清;门脉相减退呈低增强,边界不清,延迟相呈更低增强(图2)。另1例常规超声示右肝低回声病灶,边界欠清;CEUS动脉相呈均匀高增强,门脉相及延迟相减退呈低增强,边界欠清。
2例肝血管瘤患者中,其中1例有乙型肝炎小三阳病史,血清甲胎蛋白阴性;常规超声于右肝见一巨大稍高回声肿物,边界清;CEUS动脉相呈不均匀高增强,似有包膜增强,门脉相病灶中央可见低增强区,延迟相病灶中央呈更低增强,CEUS误诊为高分化HCC。另1例无肝炎病史,血清甲胎蛋白阴性;常规超声于右肝发现一稍高回声小病灶,边界清;CEUS动脉相呈均匀高增强,门脉相、延迟相继续廓清均呈低增强,边界不清(图3)。
1例炎性假瘤患者,无肝炎病史,血清甲胎蛋白阴性。常规超声于左肝见一巨大混合回声肿物,边界欠清;CEUS动脉相呈周边环状厚壁高增强,中央见无增强区,门脉相、延迟相周边继续减退均呈低增强,边界欠清(图4)。
1例不典型结节增生患者,有乙型肝炎小三阳病史,血清甲胎蛋白阴性。常规超声于右肝见一低回声结节,边界不清;CEUS动脉相呈均匀等增强,门脉相呈低增强,延迟相病灶继续廓清呈低增强。

图3 同一肝血管瘤病灶常规超声及CEUS声像图
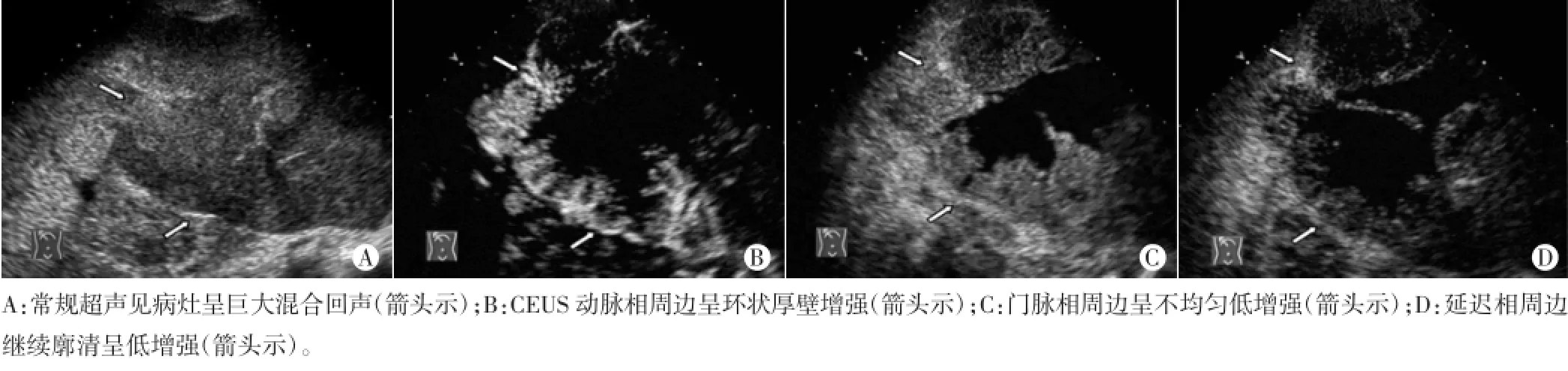
图4 同一炎性假瘤病灶常规超声及CEUS声像图
讨论
肝局灶性结节增生是常见肝脏良性占位性病变,CDFI发现绝大多数病灶内见丰富条状血流信号,多为轮辐状。其典型增强模式为动脉相离心性高增强、门脉相高增强、延迟相高或等增强[3]。陈立达等[4]研究发现肝局灶性结节增生可出现多种CEUS增强模式,如“高-等-等”,“高-高-高”,“高-低-低”。多种非典型的增强模式导致肝局灶性结节增生易发生误诊。本研究中2个肝局灶性结节增生病灶因表现出“高-低-低”的非典型CEUS增强模式,而误诊为HCC。肝局灶性结节增生在门脉早期开始表现为低增强,并延续至实质期,分析其原因,可能与其纤维瘢痕内血管发育异常相关[5];另外病灶内血流直接引流至肝静脉也可能导致其门脉相呈低回声[6]。其中1例患者右肝发现巨大包块并靠近包膜,由于病灶位置较浅,造成微泡破坏增多,导致延迟期呈低增强,这也是误诊的一个重要原因。
2例误诊的肝内胆管细胞癌,常规超声缺乏特异性表现,且不伴肝内胆管扩张及胆管结石等,其CEUS表现出“快进快退”的类似HCC的增强模式。肝内胆管细胞癌CEUS特点为动脉相有多种增强模式,门脉相低或无增强,延迟相无增强[3]。孔文韬等[7]认为肝内胆管细胞癌CEUS动脉相增强模式与病灶大小存在一定相关性,小病灶CEUS动脉相呈均匀性高增强,而大病灶倾向于不均匀性增强或环形增强。瘤体较小时,内部肿瘤细胞丰富而纤维组织少;当瘤体增大时,病灶内部纤维组织增多,血管减少甚至出现坏死[8]。虽然肝内胆管细胞癌可出现与HCC的 CEUS类似的增强模式,但其在门脉相及延迟相较HCC更早出现造影剂的廓清并且廓清得更加彻底[9]。
肝血管瘤是肝脏最常见良性肿瘤,一般在体检行影像检查时偶然发现。其典型CEUS表现为动脉期增强,门脉相和延迟相持续性增强,呈“慢进慢出”的特点[10]。本研究误诊的2例肝血管瘤患者,造影剂在门脉相早中期即消退,延迟相持续廓清,表现为恶性肿瘤增强模式。分析其原因,可能由于造影剂在血液中逐渐被稀释,微泡浓度降低,越来越少的微泡进入瘤体内所致;或与瘤内血流缓慢,相对静止的微泡持续受声波的作用导致微泡爆破、微泡减少有关[11];血管瘤内如果存在较大的流出静脉或动静脉瘘也可能导致瘤体门脉相和延迟相呈低增强。
肝脏炎性假瘤主要是大量慢性炎性细胞浸润伴纤维组织增生的良性病变。随着病程进展,瘤体内部纤维化以及炎性细胞浸润的比例变化会导致肝炎性假瘤出现不同的影像学改变,其CEUS表现为多种增强模式[12]。本研究中1例炎性假瘤CEUS表现呈“快进快出”,误诊为恶性肿瘤,可能与瘤体内主要以动脉供血有关[13]。另外肝脏炎性假瘤在门脉相及延迟相“快出”可能由于瘤体内缺乏正常的肝脏结构,造影剂不进入细胞间隙,无法在瘤体内停留导致病灶早于周围正常肝组织廓清。当肝炎性假瘤CEUS表现为“高-低-低”的增强模式时,与HCC等恶性肿瘤鉴别困难。
不典型增生结节是在肝硬化背景下边界相对清晰的肝内占位性病变,被认为是一种癌前病变。其CEUS表现与肝硬化和HCC不同,但仍有部分不典型增生结节与HCC鉴别困难。本研究中误诊的不典型增生结节呈非典型CEUS表现,其动脉相等增强,门脉相及延迟相呈低增强。研究[14]表明不典型增生结节尤其是高度不典型增生结节具有很高的恶变倾向,应该将其等同认为具有如HCC一样的侵袭性。即使CEUS诊断为不典型增生结节,也应该密切随访观察结节变化,一旦结节发生变化,除了结合影像学检查及血清肿瘤标记物,还应穿刺活检或手术切除,以便获得早期诊断及治疗。
HCC发生与肝硬化相关,是一个多阶段的发生发展过程。但非肝硬化背景上也可发生肝癌,约占全部肝癌的20%[15]。近年来多名超声学者对指南进行解读,认为由于我国HCC患者肝炎背景(乙型肝炎为主)与欧洲HCC患者(丙型肝炎为主)不同,我国HCC患者典型的CEUS表现是“高-低-低”的增强模式。HCC的增强模式与其病理分化程度密切相关,低分化HCC的CEUS以“快进快出”的典型表现居多,而中、高分化HCC多有非典型CEUS表现[13],即门脉相和延迟相造影剂的廓清缓慢仍可呈等或高增强。且该类患者合并有慢性肝炎或肝硬化时加大了准确诊断的难度。具有慢性肝炎或肝硬化病史患者CEUS呈“高-低-低”增强模式并非全都是HCC,还可能是肝内局灶性病变的非典型CEUS表现。本研究误诊的8例患者中2例患有乙型肝炎小三阳病史,所有AFP均为阴性,故诊断考虑存在部分患者是非肝硬化、AFP阴性肝癌的可能。
综上所述,不同病理类型的病灶具有相似的增强模式是CEUS误诊的原因,对于复杂病灶的诊断及鉴别诊断,需要仔细观察造影图像特征,紧密结合临床检查结果,必要时行穿刺活检,以提高CEUS对肝脏局灶性病变诊断的准确率。
[1]Cao Y,Chen J,Wang D,et al.Upregulated in hepatitis B virusassociated hepatocellular carcinoma cells,mir-331-3p promotes proliferation of hepatocellular carcinoma cells by targeting ING5[J]. Oncotarget,2015,6(35):38093-38106.
[2]刘广健,吕明德.超声造影在肝脏肿瘤的临床运用[J].中国癌症防治杂志,2012,4(2):106-109.
[3]Claudon M,Dietrich CF,Choi Bi,et al.Guidelines and good clinical practice recommendations forcontrastenhanced ultrasound(CEUS)in the liver-update 2012:AWFUMB-EFSUMB in itiative in cooperaton with representatives of AFSUMB,AIUM,ASUM,FLAUS and ICUS[J].Ultrasound Med Biol,2013,32(9):187-210.
[4]陈立达,王伟,刘广健,等.肝脏局灶性结节增生的超声造影表现及相关因素[J].中国医学影像学技术,2013,29(9):1473-1476.
[5]包中涛,李海英,叶青,等.超声造影对肝脏局灶性病变误诊分析[J].中国介入影像与治疗学,2015,12(7):428-431.
[6]裴小青,陈敏华,刘隆忠,等.肝细胞癌与肝局灶性结节增生的超声造影动态灌注曲线对比分析[J].中国超声医学杂志,2010,26(5):444-448.
[7]孔文韬,王文平,张炜炜,等.肝内胆管细胞癌超声造影增强模式探讨[J].临床超声医学杂志,2013,15(11):762-765.
[8]Chen LD,Xu HX,Xie XY,et al.Intrahepatic cholangiocarcinoma and hepatocellular carcinoma:differential diagnosis with contrastenhanced ultrasound[J].Eur Radiol,2010,20(3):743-753.
[9]Han J,Liu Y,Han F,etal.The degree of contrastwashout on contrastenhanced ultrasound in distinguishing intrahepatic cholangiocarcinoma from hepatocellular carcinoma[J].Ultrasound Med Biol,2015,41(12):3088-3095.
[10]韦虹,周显礼,孙爱霞,等.超声造影对肝脏局灶性病变的诊断价值[J].临床超声医学杂志,2013,15(5):337-339.
[11]Giannetti A,Franci L,Grechi C,et al.Contrast-enhanced sonography in the diagnosis of hepatic hemangiomas:atypical appearance due to thewashoutofmicrobubbles[J].JClin Ultrasound,2013,41(6):361-365.
[12]KongWT,WangWP,CaiH,etal.The analysisofenhancementpattern of hepatic inflammatory pseudotumor on contrast-enhanced ultrasound[J].Abdom Imaging,2014,39(1):168-174.
[13]魏凌琳,陈晓宇,叶真.超声造影误诊肝脏局灶性病变原因分析[J].中国医学影像技术,2011,27(4):787-790.
[14]Xu HX,Lu MD,Liu LN,etal.Discrimination between neoplastic and non-neop lastic lesions in cirrhotic liver using contrast-enhanced ultrasound[J].Br JRadiol,2012,85(1018):1376-1384.
[15]Trevisani F,Frigerio M,Santi V,et al.Hepatocellular carcinoma in non-cirrhotic liver:a reappraisal[J].Dig Liver Dis,2010,42(5):341-347.
M isdiagnosisanalysisof contrast-enhanced ultrasonography for focal liver lesions
TANGXiaofeng,HUANGHui,WUShaohong,XIANMengfei,XUZuofeng
DepartmentofUltrasound,the Eastern Hospitalof the FirstAffiliated Hospital,Sun Yat-Sen Unirersity,Guangzhou 510700,China
Objective Toanalyze themisdiagnosis reasonsofcontrast-enhanced ultrasonography(CEUS)for focal liver lesions,and to improve its diagnostic value.Methods The images in 8 focal liver lesions cases which were m isdiagnosed as hepatocellular carcinoma(HCC)by CEUSwere reviewed retrospectively,and the reasons ofmisdiagnosis were analyzed. Resu lts Eight lesions in 8 patientswere pathologically confirmed as non-hepatocellular carcinoma,including 2 cases of focal nodular hyperplasia,2 cases of intrahepatic cholangiocarcinoma,2 cases of hemangiomas,1 case of inflammatory psudotumor and 1 caseofdysplasticnodule.All themisdiagnosed lesionsshowed hyper-enhancementor iso-enhancementduringarterialphaseand hypo-enhancement during portal or delayed phase.Conclusion Misdiagnosis occurred for different lesions with similar enhancement pattern of CEUS,so the image features of CEUS should be analyzed carefully and combined with clinical findings tightly.When necessary,a percutaneous liver biopsy shoud be performed to improve the diagnostic accuracy of CEUS for focal liver lesions.
Ultrasonography;Contrastagent;Focal liver lesions;Hepatocellular carcinoma;Misdiagnosis
R575;R445.1
A
2016-10-11)
国家自然科学基金青年科学基金项目(81201104)
510700广州市,中山大学附属第一医院东院超声科
徐作峰,Email:xuzuofeng77@aliyun.com
