超声引导经食道起搏电极定位建立大鼠快速心房起搏房颤模型的实验研究
2017-03-16景远文李海瑞黄驰雄何翔宾建平
景远文 李海瑞 黄驰雄 何翔 宾建平
·实验研究·
超声引导经食道起搏电极定位建立大鼠快速心房起搏房颤模型的实验研究
景远文 李海瑞 黄驰雄 何翔 宾建平
目的 探讨应用超声引导经食道起搏电极定位建立大鼠快速心房起搏房颤模型的可行性。方法分别应用超声和食道心电图(心房A波振幅大小和形态)引导经食道起搏电极定位建立大鼠快速心房起搏诱导房颤模型,即为超声引导定位组(US组)和食道心电图引导定位组(ECG组),比较两组的房颤诱导成功率、平均房颤持续时间、平均定位耗时、平均起搏阈值及无关肌肉刺激评分。结果与ECG组比较,US组房颤诱导成功率高(80%vs.60%),平均定位耗时短[(2.3±0.5)min vs.(5.3±0.9)min],平均起搏阈值低[(0.350±0.048)mV vs.(0.570±0.057)mV],无关肌肉刺激评分小[(0.79±0.58)vs.(1.32±0.46)分],差异均有统计学意义(均P<0.05);两组平均房颤持续时间比较差异无统计学意义。结论超声引导经食道起搏电极定位建立大鼠快速心房起搏房颤模型有效、安全。
超声引导;食道电极;心房起搏,快速;房颤模型;大鼠
目前房颤模型主要在大动物(猪、羊、狗等)体内建立,但大动物价格高、需要的药物剂量大,不适用于全新药物的筛选研究。因此,构建小动物(大鼠、小鼠)房颤模型具有十分重要的意义。基因修饰、药物注射及快速心房起搏是建立小动物房颤模型的主要方法[1],以快速心房起搏最常用,其电极的置入方式包括开胸、经颈静脉及经食道三种,其中经食道置入起搏电极最为无创、操作简单[1-2]。超声无创、实时,能快速、准确地提供起搏电极与食道和心房解剖关系的信息,可以准确引导经食道起搏电极定位。本实验旨在探讨超声引导经食道起搏电极定位建立大鼠心房起搏房颤模型的可行性,并与经食道心电图引导定位进行比较。
材料与方法
一、实验动物
SPF级雄性Sprague Dawley(SD)大鼠40只,体质量250~300 g,购于南方医科大学实验动物中心,动物许可证号:SCXK(粵)2015~0005。
二、实验仪器与试剂
西门子Sequoia512彩色多普勒超声诊断仪;3%戊巴比妥(Sigma Aldrich,美国);Power Lab 4/35多导生理记录仪[埃德仪器国际贸易(上海)有限公司];JL-C2电刺激器(上海嘉龙教仪厂)。
40只大鼠随机分为超声引导定位组20只(US组)和食道心电图引导定位组20只(ECG组)。两组大鼠均用3%戊巴比妥(50mg/kg)行腹腔注射诱导麻醉,模型建立过程中每小时补充维持量0.1m l/100 g,麻醉过程中密切观察大鼠情况,避免麻醉不足或过量。大鼠左侧胸部备皮,取仰卧位,多导生理记录仪连续记录大鼠体表心电图(标准Ⅱ导联)。
US组:经大鼠口插入5 F双极起搏电极,保持起搏电极前端的自然弯曲向前以确保其紧贴左房。使用二维超声(15L8探头,频率7MHz)于胸骨旁左室长轴切面分别观察当电极前端位于心房上部、中部及下部时的图像,同时保存相应部位的食道心电图,当起搏电极位于心房中部时固定电极,记录从电极插入至固定的时间。
ECG组:经大鼠口插入5 F双极起搏电极,保持起搏电极前端的自然弯曲向前以确保其紧贴左房。常规插入深度约7 cm,根据大鼠食道心电图A波形态作适当调整,当A波形态提示电极位于心房中部时固定电极,并记录从电极插入至固定的时间。判断电极位置的标准参考经食道心电图A波形态与振幅[3]:①心房上部以负向为主,Qr型;②心房中部为正负双向,振幅大,Qr或QR型;③心房下部为正负双向或直立,Qr或 QR型。
四、建立大鼠快速心房起搏模型及相关参数测量
待大鼠稳定10min后行心房快速起搏,具体参数如下:①刺激波形为方波;②刺激阈值为0.3~0.6mV(约舒张阈值电压的2倍),并根据个体调整以确保心房捕获;③刺激脉冲宽度为6ms;④刺激频率>1200次/min;⑤刺激时间3 h。
心房成功快速起搏标准[4]:正常心房P波消失,被高尖起搏波形所代替;心室率较起搏前明显加快且RR间期绝对不整。
分别记录两组平均房颤持续时间、平均定位耗时及平均起搏阈值,计算房颤诱导成功率,并进行无关肌肉刺激(EMS)评分,评分标准[5]:0分,无皮肤和肌肉抽动;1分,仅皮肤轻微抽动;2分,膈肌受刺激(呼吸频率与起搏频率一致)或前肢抽动;3分,全身抽动。
五、统计学处理
考虑到ADAMS的实体建模功能不完善,采用Solidworks建立机械手的三维模型,并通过与ADAMS的软件接口,将模型导入至ADAMS。在机械手的关节处添加约束,并观察各个关节受到的驱动力矩大小。设定仿真时间t=30s,步长为0.01。给定手端标记点在笛卡儿空间的轨迹方程为x2+y2=0.9,预计该圆所在平面与连杆5坐标系的z轴方向垂直。假设末端执行器标记点从(0.9,0,0.3)出发做角速度为0.8rad/s的等速回转。
结果
一、两组电极定位情况
US组大鼠于左侧卧位下通过超声引导经食道起搏电极定位,二维超声可见电极头端分别与心房上、中、下部接触,见图1;当电极位于心房中部时电极与心房壁接触较好,此时心房快速起搏体表心电图见图2。
ECG组大鼠经食道心电图引导起搏电极定位,电极在不同部位的食道心电图见图3;当电极位于心房中部时A波正负双向,振幅大,呈Qr或QR型,此时心房快速起搏体表心电图见图4。
二、两组房颤诱导成功率、平均房颤持续时间、平均定位耗时、平均起搏阈值及EMS评分比较
1.两组均能诱导典型房颤发作,US组房颤诱导成功率为80%,ECG组房颤诱导成功率为60%,两组比较差异有统计学意义(P<0.05)。见图5,6。
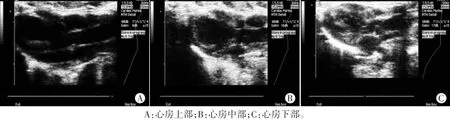
图1 US组起搏电极位于心房不同部位的二维超声图像
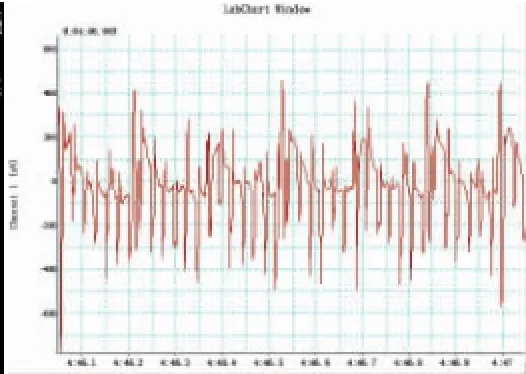
图2 US组电极位于心房中部时快速起搏心房心电图
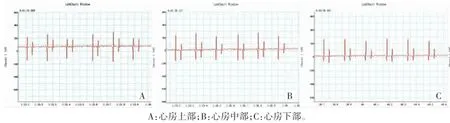
图3 ECG组起搏电极位于心房不同部位的心电图
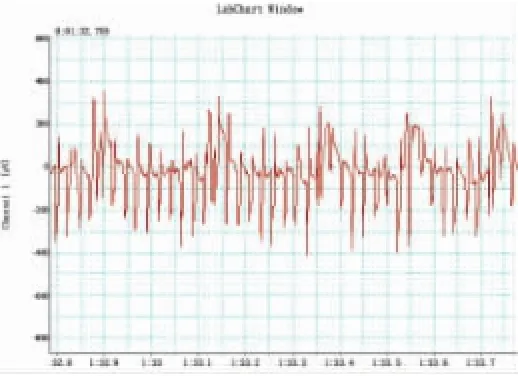
图4 ECG组电极位于心房中部时快速起搏心房心电图
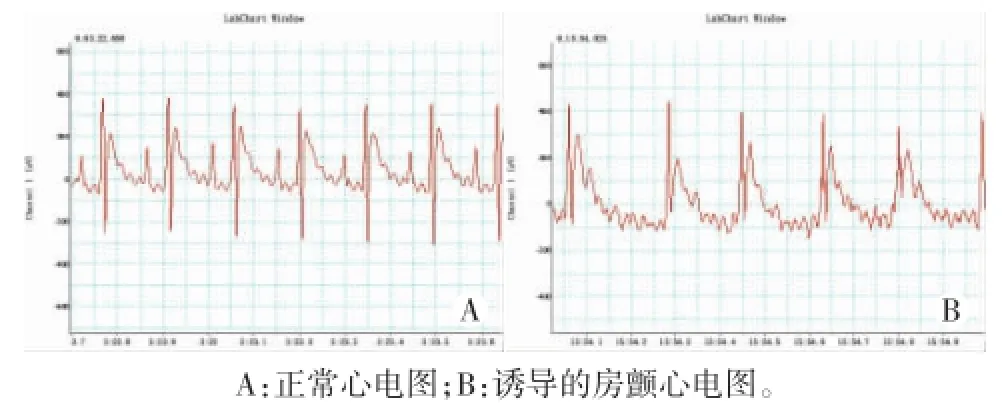
图5 US组正常及诱导的房颤心电图

图6 ECG组正常及诱导的房颤心电图
2.US组平均房颤持续时间为(1.9±0.2)min,ECG组平均房颤持续时间为(1.8±0.6)min,两组比较差异无统计学意义。
3.US组电极平均定位耗时为(2.3±0.5)min,ECG组电极平均定位耗时为(5.3±0.9)min,两组比较差异有统计学意义(P<0.05)。
4.US组平均起搏阈值为(0.350±0.048)mV,ECG组平均起搏阈值为(0.570±0.057)mV,两组比较差异有统计学意义(P<0.05)。
5.US组平均EMS评分为(0.79±0.58)分,ECG组平均EMS评分为(1.32±0.46)分,两组比较差异有统计学意义(P<0.05)。
讨论
由于大鼠心房相对较小,不利于房颤折返波形成及维持,故房颤诱导成功率相对较低[6]。传统方法通过应用胆碱能药物或诱导缺氧虽可提高房颤诱导成功率[7],但这两种方法均具有较大局限性:胆碱能药物可影响离子通道功能,不利于抗心律失常药物的研究[8];而短暂窒息除可能导致实验动物死亡率增高外,亦可引起其病理、生理及血流动力学的改变[9]。本实验通过应用经食道电极定位诱导大鼠房颤,有望成为一种建立理想的大鼠房颤模型的替代方法。
经食道置入起博电极的位置是决定快速心房起搏效果及其相关副反应(如EMS)的最主要因素[10]。研究[5,10]表明,当电极位于心房中部时起搏效果最佳。目前起搏电极的定位主要由经食道心电图指导,当A波正负双向、振幅大、呈Qr或QR型时即提示起搏电极位于心房中部[3,5]。但研究[9-10]显示,在动物心电图监护仪所测量A波的最大振幅与最小振幅差异较小,仅凭肉眼难以判断,从而影响判断起搏电极最佳置入位置的准确性,进而影响起搏效果和模型成功率。超声能实时、准确地提供关于起搏电极与食道、心房解剖关系的信息,引导经食道起搏电极定位。
本实验应用超声引导经食道起搏电极定位建立大鼠快速心房起搏房颤模型,结果发现,与ECG组比较,US组房颤诱导成功率明显提高(60%vs.80%,P<0.05),但两组平均房颤持续时间无明显差异[(1.8±0.6)min vs.(1.9±0.2)min],这可能与超声引导经食道起搏电极定位更准确,起搏电极至心房距离缩短有关。从理论上来说,起搏电极与心房壁的距离决定起搏效果(起搏阈值大小、能否捕获心房),当起搏电极位于最佳起搏位置时,其能以最低起搏电压持续稳定地快速起搏心房,从而提高房颤诱导成功率。本实验发现,超声引导经食道起搏电极定位可直接观察电极与心房壁的相对位置,能确保起搏电极紧贴心房壁中部,从而克服了经食道心电图引导起搏电极定位准确性不足的缺陷。经食道心电图引导起搏电极定位因其耗时较长,且起搏阈值相对较高,若反复对心房进行电刺激,有可能在房颤发生前已引起心房的炎性反应或内皮损伤,对于研究房颤并发症如心房早期血栓形成可能产生较大的影响。本实验中US组平均定位耗时较ECG组更短[(2.3±0.5)min vs.(5.3±0.9)min],平均起搏阈值更低[(0.350±0.048)mV vs.(0.570±0.057)mV],平均EMS评分更低[(0.79±0.58)分vs.(1.32±0.46)分],两组比较差异均有统计学意义(均P<0.05)。结果说明超声引导经食道起搏电极定位建立大鼠快速心房起搏房颤模型快速、准确,减少了对心房的反复刺激,对于研究房颤并发症如心房早期血栓形成具有良好的应用前景。
综上所述,与经食道心电图引导定位比较,超声引导经食道起搏电极定位用于建立大鼠快速心房起搏房颤模型更有效和安全。
[1]陈雯雯,罗章源,陈颖敏.心房颤动动物模型建立的方法学[J].中国心脏起搏与心电生理杂志,2010,24(5):390-393.
[2]KamelH,Okin PM,Elkind MS,etal.Atrial fibrillation andmechanisms ofstroke:time foranewmodel[J].Stroke,2016,47(3):895-900.
[3]Haeberlin A,Niederhauser T,Marisa T,et al.The optimal lead insertion depth for esophageal ECG recordings with respect to atrial signalquality[J].JElectrocardiol,2013,46(2):158-165.
[4]Hauqan K,Lam HR,Kundsen CB,et al.Atrial fibrillation in rats induced by rapid transesophageal atrial pacing during brief episodes of asphyxia:a new in vivomode[J].JCardiovasc Pharmacol,2004, 44(1):125-135.
[5]Sanders RA,Chapel E,Garcia-Pereira FL,et al.Utility of transesophageal electrocardiography to guide optimal placement of a transesophagealpacing catheter in dogs[J].Vet Anaesth Analg,2015,42(1):99-102.
[6]JanseMJ,Rosen MR.History ofarrhythmias[J].Handb Exp Pharmacol,2006,171(1):1-39.
[7]Yu P,Qi Z.Drug-induced atrial fibrillation complicates the results of flap surgery in a ratmodel[J].Ann PlastSurg,2016,76(2):244-248.
[8]Liang F,Fan P,Jia J,et al.Inhibitions of late INa and CaMKⅡact synergistically to prevent ATX-Ⅱ-induced atrial fibrillation in isolated rat rightatria[J].JMolCellCardiol,2016,94(6):122-130.
[9]殷忠,许如意,李田昌,等.长期间歇性低氧对大鼠血压及心血管内皮系统的影响[J].中华老年心脑血管病杂志,2013,15(11):1189-1190.
[10]Sanders RA,Chapel EH.Effects of catheter shape,interelectrode spacing,and electrode sizeon transesophagealatrialpacing in dogs[J]. Am JVetRes,2016,77(3):275-279.
Establishmentof atrial fibrillationmodel in rats induced by rapid atrial pacing via ultrasound-guided esophageal pacing catheter placement
JING Yuanwen,LIHairui,HUANGChixiong,HEXiang,BIN Jianping
DepartmentofCardiology,Nanfang Hospital,Southern MedicalUniversity,Guangzhou 510515,China
Objective To investigate the feasibility of ultrasound-guided esophageal pacing catheter placement for establishing atrial fibrillationmodel in rats.Methods Establish atrial fibrillationmodel in rats via rapid atrial pacing with the guidance of ultrasound and esophageal electrocardiogram(atrial A-wave amplitude and form),and the ratswere divided into ultrasound-guided(US)group and esophagealelectrocardiogram-guided(ECG)group,respectively.Then a comparison wasmade between USand ECG group in induced efficacy of atrial fibrillation,mean duration of atrial fibrillation,mean catheter placement time,mean pacing threshold and less extra muscular stimulation.Results Compared with ECG group,ultrasound-guided esophageal pacing catheter placement resulted in higher atrial fibrillation rate(80%vs.60%),shortermean catheter placement time[(2.3±0.5)min vs.(5.3±0.9)min],lowermean pacing threshold[(0.350±0.048)mV vs.(0.570±0.057)mV]and less extra muscular stimulation[(0.79±0.58)min vs.(1.32±0.46)min],therewere significantdifferencesamong these indexes(all P<0.05). While there was no significant difference ofmean duration of atrial fibrillation between two groups.Conclusion Ultrasoundguided esophagealpacing catheter placementisan effectiveand safemethod for theestablishmentofatrial fibrillationmodel in rats.
Ultrasound-guided;Esophagealelectrode;Atrial pacing,rapid;Atrial fibrillationmodel;Rats
R322;R540.45
A
2016-08-23)
国家自然科学基金面上项目(81571689);国家重大科研仪器设备研制专项(81227801)
510515广州市,南方医科大学南方医院心内科
宾建平,Email:jianpingbin@126.com
