利用PiggyBac系统在家蝇中表达蜜蜂王浆蛋白MRJP1
2017-03-16熊佳福张鉴清刘桂清韩日畴
熊佳福,张鉴清,刘桂清,韩日畴*
(1. 中国科学院大学华南植物园,广州 510650;2. 广东省生物资源应用研究所,广东省动物保护与资源利用重点实验室,广东省野生动物保护与利用公共实验室,广州 510260)
利用PiggyBac系统在家蝇中表达蜜蜂王浆蛋白MRJP1
熊佳福1,2,张鉴清2,刘桂清2,韩日畴2*
(1. 中国科学院大学华南植物园,广州 510650;2. 广东省生物资源应用研究所,广东省动物保护与资源利用重点实验室,广东省野生动物保护与利用公共实验室,广州 510260)
家蝇Muscadomestica是一种重要的资源昆虫,作为饲料蛋白已广泛应用于动物养殖产业。MRJP1蛋白(Major Royal Jelly Proteins 1, MRJP1)是蜂王浆的主要蛋白成分,具有营养作用和跨物种促细胞增殖作用。构建表达意大利蜜蜂Apismellifera王浆蛋白基因Ammrjp1的家蝇可望提高家蝇幼虫的应用价值。本研究构建了携带Ammrjp1基因的重组转座质粒pBac[fa PUb-mrjp1-DsRed],显微注射家蝇胚胎,成功建立Ammrjp1转基因家蝇品系,RT-PCR证明Ammrjp1基因在转基因家蝇中正常转录;SouthernBlot证实Ammrjp1基因是以单拷贝的形式插入到家蝇基因组内;利用Inverse-PCR技术获得Ammrjp1基因在家蝇基因组上插入位点侧翼序列。与野生型家蝇比较,G8代Ammrjp1转基因家蝇4龄幼虫的百头重增加8.6%。家蝇遗传转化体系的成功构建,为建立新型转基因生物反应器和开发高值动物蛋白饲料提供技术支持。
Ammrjp1基因;PiggyBac;显微注射;转基因家蝇
家蝇Muscadomestica属于昆虫纲Insecta双翅目Diptera蝇科Muscidae,具有繁殖能力强、世代周期短和耐高密度养殖等优良特点,是昆虫蛋白饲料的重要来源。家蝇主要的利用阶段是幼虫期—蝇蛆,蝇蛆体内含有丰富蛋白质、脂肪酸、氨基酸、几丁质、维生素、矿物元素和抗菌肽等多种活性物质(吴青华等,2006)。家蝇蝇蛆在蛋白饲料、医药和工农业等领域具有良好的应用价值。
蝇蛆粉作为一种可代替鱼粉的蛋白饲料,具有很大的市场应用价值。用不同比例的蝇蛆粉饲料饲喂体重相同的青鱼8周,发现在饲料中添加4.2%-5.0%的蝇蛆粉能促进青鱼的生长、提高鱼体内胰脏消化酶的酶活力,并能改善青鱼的鱼肉口感(刘黎等,2014)。鲜蝇蛆可直接作为饵料,用于畜禽、鱼类和其它特种养殖的活饵料。鲜蝇蛆在水中存活的时间相对较长,饲喂对虾能够显著提高对虾的抗杆状病毒感染能力,并激活对虾的酚氧化酶系统(王娓等,2002)。在饲料中添加适量鲜蝇蛆饲养清远鸡,鸡群死亡率明显低于仅使用商业饲料的鸡群,氨基酸含量也显著提高,说明家蝇幼虫作为一种蛋白饲料可提高鸡的抗病能力以及改善鸡肉的口感(常斌等,2007)。加强对家蝇的开发利用,将为蛋白资源提供更加丰富的来源,有利于蛋白质原料工业的可持续发展。
蜂王浆作为一种混合物,包含多种蛋白质、脂肪酸、糖、维生素等有机成分和无机成分(Chen and Chen,1995)。其中蛋白质是蜂王浆中含量最丰富的有机成分,占蜂王浆总量的11%-14%。蜂王浆中的蛋白质分为水溶性蛋白和非水溶性蛋白,水溶性蛋白占总蛋白含量的46%-89%,为蜂王浆中蛋白质的主要成分,称为主要王浆蛋白(Major Royal Jelly Proteins,MRJPs)(Schmitzovaetal.,1998;Quetal.,2008)。研究发现MRJP1是主要王浆蛋白中含量最多的一种主蛋白,不仅在工蜂各阶段表达而且在蜂王和雄峰体内也有表达(Drapeauetal.,2006;Huangetal.,2012)。并且MRJP1富含的必须氨基酸达48%之多,它可能是一种潜在的功能性食品(Rosmilahetal.,2008)。用MRJP1饲喂果蝇能增加果蝇个体大小和增强繁殖能力,延长寿命并缩短发育时间,而这些果蝇形态上的变化是用450 kDa蛋白和酪蛋白饲养所观察不到的,结果与用MRJP1诱导蜜蜂幼虫发育成为蜂王的实验结果一致,这说明该蛋白对生物特征的影响是可以跨物种的(Kamakuraetal.,2011)。
本研究采用的PiggyBac转座子质粒能够携带目的基因进入新的基因组特定靶标位点TTAA,并能在宿主基因组中表达;能携带的约15 kb的外源基因片段,远远超过传统病毒载体的携带容量(Dingetal.,2005);转座子的转座作用也不受物种限制,在真核生物许多物种中均能实现转座。目前,PiggyBac转座子已在鳞翅目、双翅目和鞘翅目等多类昆虫中成功进行了高效、稳定的转座(Kuwayamaetal.,2006;Martinsetal.,2012;Schetelig and Handler,2013)。PiggyBac转座子在转基因家蚕丝腺生物反应器中表达有价值的外源蛋白起到了非常重要的作用,Wen等(2010)研究发现利用PiggyBac载体构建蜘蛛丝基因Masp1转基因家蚕,与野生蚕丝相比转基因蚕丝的强度与韧性增加约1.2倍。本论文中为获得Ammrjp1转基因家蝇品系,建立转基因家蝇新型生物蛋白反应器,开发具有重大经济价值的动物蛋白饲料的研究提供技术支撑。
1 材料与方法
1.1 实验昆虫
意大利蜜蜂Aprsmellifera哺育蜂和野生型家蝇,由广东省生物资源应用研究所资源昆虫与生物工程研究中心饲养。
1.2 质粒和菌株
感受态细胞Trans1-T1、DH5α、Transsetta(DE3)以及克隆质粒pEASY-T1-simple,购自广州全式金公司。克隆质粒pSL[fa1180fa],转座辅助质粒pSL[Dmhsp70-hyPBase]和转座载体pBac[faPUb-DsRed]由中国农业科学院植物保护研究所万方浩实验室馈赠。表达质粒pET-32a(+)由本实验室保存。
1.3 主要试剂药品
限制性内切酶EcoRI、NotI、BamHI、NcoI、BglII、AscI和MbiI,1 kb、2 kb、5 kb DNA Marker购自宝生物工程(大连)有限公司。EasyScript One-Step gDNA Removal and cDNA Synthesis SuperMix试剂盒购自北京全式金有限公司。Roche试剂盒(Dig High Prime DNA Lablling and Detection Starter Kit I)购自广州齐云生物技术有限公司。
1.4Ammrjp1基因的克隆及原核表达
1.4.1 哺育蜂总RNA提取与cDNA的合成
采集的哺育蜂样本液氮速冻后,用振动球磨仪磨碎后直接加入1 mL Trizol(Invitrongen)试剂中,按照试剂盒的说明提取总RNA。并用DNase I酶(RNase-free DNase I, Fermentas Inc)处理,去除残留基因组DNA的污染。以处理后的RNA为模板,经PCR扩增家蝇GAPDH内参基因(引物见表1)。未出现GAPDH的特异性条带,符合下一步实验要求。按照EasyScript One-Step gDNA Removal and cDNA Synthesis SuperMix试剂盒的说明,取1 μg RNA进行逆转录合成cDNA。
1.4.2mrjp1基因的PCR扩增
按照实验室常规PCR方法,反应体系为50 μL,取2 μL cDNA为模板,2×TransTaq® HiFi Super Mix 25 μL,Forward and Reverse primer各1 μL,32个循环(94℃,30 s;55℃,30 s;72℃,1 min),进行mrjp1的PCR扩增。获得目的条带,切胶回收后连接至克隆载体pEASY-T1-simple,转化大肠杆菌DH5α,挑取阳性单菌落测序分析。测序结果与已经公布的mRNA序列(登录号NM_001011579)进行Blast比对。
1.4.3 意大利蜜蜂mrjp1的原核表达载体构建
取测序鉴定成功的pEASY-T1-mrjp1菌株,扩大培养后提取质粒,双酶切(NotI/EcoRI)获得目的片段,同时双酶切原核pET-32a(+)载体,获得相应末端的pET-32a(+)载体片段。将回收的目的基因片段与原核表达载体片段用T4连接酶连接,转化大肠杆菌Transetta(DE3)感受态细胞,获得pET-32a(+)-mrjp1原核表达系统。表达菌株转接到带Car+抗性液体LB中,37℃,200 rpm,培养至OD约为0.4-0.6 h,加入IPTG至终浓度1 mM诱导培养6 h后,离心收集菌体,加入PBS冰上超声破碎、离心(4℃,12000 rpm,15 min),收集总蛋白样。SDS-PAGE电泳检测。
1.5Ammrjp1的转座载体构建
1.5.1 启动子PUb克隆载体构建
取经酶切验证成功的转座载体pBac[faPUb-DsRed]菌株,扩大培养后提取质粒,双酶切(BglII/BamHI)后获得PUb启动子片段,同时双酶切克隆载体pSL[fa1180fa]获得相应末端的载体片段。然后将启动子PUb与载体片段进行回收、连接,转化大肠杆菌DH5α,酶切和测序鉴定。
1.5.2 目的基因mrjp1与启动子PUb连接
取经测序与表达验证成功的pEASY-T1-mrjp1菌株,扩大培养后提取质粒,双酶切(NcoⅠ/BamHⅠ)后获得目的基因mrjp1片段,同时双酶切克隆载体pSL[fa1180fa]-PUb获得相应末端的载体片段。然后将mrjp1与载体片段进行回收、连接,转化大肠杆菌DH5α,酶切鉴定。
1.5.3 目的基因mrjp1与转座质粒连接
取经测序验证成功的pSL[fa1180fa]-PUb-mrjp1菌株,扩大培养后提取质粒,单酶切(BglII)质粒后获得PUb-mrjp1片段,单酶切(BglII)转座载体pBac[fa PUb-DsRed](BglII)获得相应末端的载体片段。然后将PUb-mrjp1与载体片段进行回收、连接,转化大肠杆菌DH5α,酶切及测序鉴定。
1.6 显微注射及转基因家蝇的建立
1.6.1 转基因家蝇品系建立
将经过验证的重组质粒pBac[fa PUb-mrjp1-DsRed]菌株和pSL[Dmhsp70-hyPBase]辅助质粒菌株,扩大培养后,提取质粒后分别按照最终浓度600 ng/μL和400 ng/μL的量进行共沉淀混合,用于显微注射。收集20 min内生产的新鲜家蝇胚胎,每个胚胎(注射前覆盖一层薄石蜡油,维持内外渗透压)注入0.05-0.1 μL DNA溶液至极区,在1 h内完成该批次胚胎的显微注射。注射完成后的胚胎连同载玻片放在人工气候箱中(25℃, RH 75%)培养16 h,胚胎即可发育成幼虫。用毛笔将幼虫挑至幼虫饲料(麦麸25 g, 葡萄糖2 g, 全脂奶粉3 g, 纯水50 mL)中,放置在室温条件下即可。蝇蛹羽化后,在显微镜下(λ=510-560 nm)观察鉴定。筛选表达荧光的阳性转基因家蝇个体(G0代)。将G0代转基因雌、雄虫分别与野生家蝇杂交,筛选转基因纯合子。
1.6.2 转基因家蝇鉴定
提取取经过荧光显微镜鉴定的纯合转基因G2代成蝇的总RNA,RT-PCR方法检测目的基因转录,按照试剂盒提供的方法,提取家蝇的总RNA,合成cDNA。分别用DsRed-F/R引物和Ammrjp1-F/R引物(表1)检测合成的cDNA,电泳检测;Southern Blot技术检测目的基因在基因组上的拷贝数,按照试剂盒说明提取家蝇的总DNA,PCR检测。取50 μg DNA经BamHI 37℃、2 h酶切,30 V电泳3 h。虹吸转膜36 h,将转有DNA的硝酸纤维素膜放在紫外交联仪(Stratagene 1800)中交联40 s,按照Roche试剂盒说明,取5 ngmrjp1 PCR产物制作探针,在杂交炉中预杂交和杂交(41℃)孵育,进行严谨性洗脱(室温下洗膜液I振荡洗脱2×5 min;洗膜液II,于68℃水浴摇床中洗脱2×15 min),免疫检测和显色观察。利用Inverse-PCR技术检测出目的基因在基因组上的插入位点,方法步骤如下:用限制性内切酶EcoRI消化1 μg家蝇基因组DNA,在500 μL产物片段体系中,使产物终浓度为1-5 ng/μL,T4连接过夜。根据设计的反向引物1(表1)进行第一轮扩增,用第一轮产物作为模板,以反向引物2(表1)进行第二轮扩增,测序分析。测定外源Ammrjp1基因对家蝇生长的影响,各取G8代转基因和野生型家蝇新鲜胚胎(1 h内)300头,在相同条件下(饲料、温度和湿度)培养至4龄幼虫,重复3次。分别称取每组幼虫的百头重,比较两者之间的差异显著性。

表1 本研究用到的引物
2 结果与分析
2.1 意大利蜜蜂mrjp1基因的克隆
通过NCBI找到了mrjp1的完整开放阅读框(Open Reading Frame,ORF),根据ORF设计带有酶切位点(表1下划线部分)的引物对mrjp1进行扩增(图1-A),并构建出重组克隆质粒pEASY-T1 simple-Ammrjp1。挑取经菌液PCR初步鉴定的大肠杆菌转化子,少量扩增培养后提取质粒,提取的质粒通过双酶切鉴定(图1-B),将已经PCR鉴定和酶切鉴定的克隆送英潍捷基公司测序,测序结果与已公布的基因序列一致。
2.2 意大利蜜蜂mrjp1基因的原核表达
重组质粒pET-32a(+)-Ammrjp1转化表达宿主大肠杆菌Transetta(DE3)后,经过IPTG诱导表达,在64 kDa附近有一条特异性条带(图2泳道3);而在未诱导的对照中,没有相应大小的蛋白表达带出现。说明重组MRJP1蛋白的表达受到IPTG的诱导调控。重组蛋白的分子量大小为67 kDa,其中包含了约20 kDa His-tag等标签蛋白。
2.3 启动子PUb克隆载体构建
将pBac[fa PUb-DsRed]和pSL[fa1180fa]同时用BglII和BamHI酶切(图3-A),分别获得PUb启动子和粘性末端载体pSL[fa1180fa],用T4连接液连接后获得pSL[fa1180fa]-PUb重组质粒,用BglII和BamHI单、双酶切后(图3-B),均在Marker 2000 bp位置获得目的条带,说明重组质粒pSL[fa1180fa]-PUb构建成功。
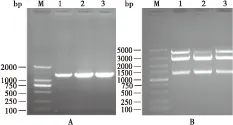
图1 Ammrjp1基因的扩增和pEASY-T1 simple-Ammrjp1质粒鉴定Fig.1 Amplification product of Ammrjp1geneand analysis of pEASY-T1 simple-Ammrjp1 vector注: M, DNA Marker; A, Ammrjp1基因的扩增结果; 1-3, 意大利蜜蜂cDNA; B, pEASY-T1 simple-Ammrjp1质粒酶切分析; 1-3, pEASY-T1 simple-Ammrjp1质粒酶切。Note: M, DNA Marker; A, Amplification product of Ammrjp1 gene; 1-3, cDNA of Apis mellifera; B, Analysis of pEASY-T1 simple-Ammrjp1 vector; 1-3, Restriction enzyme analysis of pEASY-T1 simple-Ammrjp1.
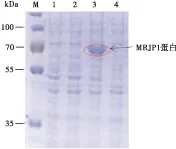
图2 pET-32a(+)-Ammrjp1的诱导表达Fig.2 Expression of recombinant pET-32a(+)-Ammrjp1 induced 注: M, 蛋白Marker; 1, 加入IPTG 诱导的Transetta(DE3)/pET-32a(+)对照菌总蛋白; 2, 未加入IPTG 诱导的Transetta(DE3)/pET-32a(+)对照菌总蛋白; 3, 加入IPTG 诱导的Transetta(DE3)/pET-32a(+)-Ammrjp1重组菌总蛋白; 4, 未加入IPTG诱导的Transetta(DE3)/pET-32a(+)-Ammrjp1重组菌总蛋白。Note: M, Protein Marker; 1, Transetta(DE3)/pET-32a(+)induced; 2, Transetta(DE3)/pET-32a(+)uninduced; 3, Transetta(DE3)/pET-32a(+)-Ammrjp1 induced; 4, Transetta(DE3)/pET-32a(+)-Ammrjp1 uninduced.
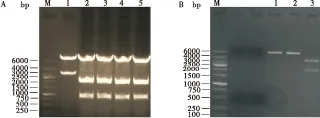
图3 启动子PUb的克隆载体构建Fig.3 Cloning vector of PUb promoter注: M, DNA Marker; A, pBac[fa PUb-DsRed]酶切电泳分析; 1, BamH I酶切; 2-5, Bgl II/BamH I双酶切; B, pSL[fa1180fa]-PUb酶切电泳分析; 1-2, Bgl II、BamH I单酶切; 3, Bgl II/BamH I双酶切。Note: M, DNA Marker; A, Restriction enzyme analysis of pBac[fa PUb-DsRed]; 1, Restriction enzyme analysis of BamH I; 2-5, Restriction enzyme analysis of Bgl II/BamH I; B, Restriction enzyme analysis of pSL[fa1180fa]-PUb; 1-2, Restriction enzyme analysis of Bgl II or BamH I; 3, Restriction enzyme analysis of Bgl II/BamH I.
2.4 目的基因mrjp1与启动子PUb连接
将保种的pEASY T1 simple-Ammrjp1质粒和pSL[fa1180fa]-PUb分别酶切后获得大目的基因mrjp1片段和载体片段,连接重组后挑取阳性克隆DH5α/pSL[fa1180fa]-PUb-Ammrjp1扩大培养后提取质粒。用BamHI和BglII 两种酶分别单酶切质粒鉴定(图4)。均能得到相应大小的目的条带,说明载体与片段连接方向正确。
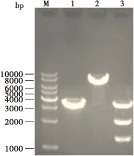
图4 pSL[fa1180fa]-PUb-Ammrjp1质粒的酶切分析Fig.4 Restriction enzyme analysis of pSL[fa1180fa]-PUb-Ammrjp1 vector注: M, DNA Marker; 1, Bgl I酶切; 2, BamH I酶切; 3, Bgl I和BamH I酶切。Note: M, DNA Marker; 1, Restriction enzyme analysis of BglII; 2, Restriction enzyme analysis of BamH I; 3, Restriction enzyme analysis of Bgl II/BamH I.
2.5 目的基因mrjp1与转座质粒连接
连接后的重组转座质粒长度为12560 bp,用
酶切和测序的方法鉴定片段与载体的连接顺序。用NotI和BglI分别酶切重组质粒均能获得与预期大小一致的目的条带,用BamHI和AscI 双酶切后在Marker 7000 bp、3500 bp、2000 bp和900 bp位置附近获得3条目的条带(图5-A,5泳道),与预期的正向连接结果一致。经过测序验证,证明PUb-Ammrjp1与pBac[fa PUb-DsRed]连接正确(图5-B)。
2.6 荧光显微镜鉴定
显微注射2566头家蝇胚胎,利用荧光标记筛选从513头成蝇中筛选出3头Ammrjp1转基因家蝇,转座效率约0.6%。筛选的G0代个体分别与野生家蝇杂交,当G1代成蝇羽化12 h内在荧光显微镜下(λ=510-560 nm)筛选出荧光G1代个体,将G1代雌雄虫相互杂交,筛选红色荧光个体(G2代)。根据图6图片可以看出,与野生型成蝇对照后发现转基因家蝇的红色荧光主要在腹部、胸部以及头部表达。同时与野生型家蝇的蛹相比较,转基因家蝇蛹的末端有相对明显的发光现象。
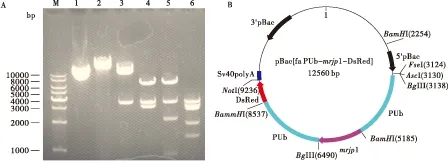
图5 重组转座质粒的酶切分析及图谱Fig.5 Restriction enzyme analysis of recombinant vector and map of plasmid注: A, 质粒的酶切分析。M, DNA Marker; 1, pBac[fa PUb-mrjp1-DsRed]质粒; 2, Not I 酶切; 3, Bgl I酶切; 4, BamH I 酶切; 5, BamH I和Asc I酶切; 6, BamH I和Mbi I酶切。 B, pBac[fa PUb-mrjp1-DsRed]重组质粒图谱。Note:A, Restriction enzyme analysis of recombinant vector. M, DNA Marker; 1, pBac[fa PUb-mrjp1-DsRed] plasmid; 2, Restriction enzyme analysis of Not I; 3, Restriction enzyme analysis of Bgl I; 4, Restriction enzyme analysis of BamH I; 5, Restriction enzyme analysis of BamH I and Asc I; 6, Restriction enzyme analysis of BamH I and Mbi I. B, Map of recombinant pBac[fa PUb-mrjp1-DsRed] plasmid.

图6 荧光在家蝇体内的表达分析Fig.6 Expression of fluorescence in housefly注: A, 转基因G1代与野生家蝇的白光; B, 转基因G1代与野生家蝇的荧光; C, 转基因G2与野生家蝇蛹的白光; D, 转基因G2代与野生家蝇蛹的荧光; E, 转基因G2代家蝇的白光;F, 转基因G2代家蝇的荧光。Note: A, Normal photos of nontransformed and transformed G1 flies; B, Fluorescence photos of nontransformed and transformed G1 flies; C, Normal photos of nontransformed and transformed G1 flies pupae; D, Fluorescence photos of nontransformed and transformed G1 flies pupae; E, Normal photos of transformed G2 flies; F, Fluorescence photos of transformed G2 flies.
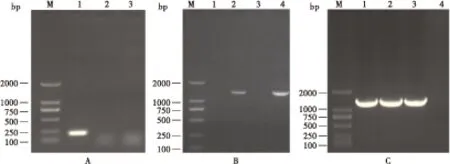
图7 转基因家蝇PCR分析Fig.7 PCR analysis of transgenic housefly 注:A, 家蝇DNA和cDNAPCR; M, DNA Marker; 1, 野生家蝇DNA; 2, 野生家蝇cDNA; 3, 转基因家蝇cDNA。 B, 家蝇cDNA PCR; 1和3, 野生型家蝇cDNA; 2, 转基因家蝇cDNA; 4, pBac[fa PUb-mrjp1-DsRed]质粒。 C, 家蝇DNA PCR; 1-2, 转基因家蝇基因组DNA; 3, pBac[fa PUb-mrjp1- DsRed]质粒; 4, 野生型家蝇基因组DNA。Note: A, PCR of housefly DNA / cDNA; M, DNA Marker;1, DNA of wild housefly; 2, cDNA of wild housefly; 3, cDNA of transgenic housefly. B, PCR of housefly cDNA; 1 and 3, cDNA of wild housefly; 2, cDNA of transgenic housefly; 4, pBac[fa PUb-mrjp1-DsRed] plasmid. C, PCR of housefly DNA; 1-2, DNA of transgenic housefly; 3, pBac[fa PUb-mrjp1-DsRed] plasmid; 4, DNA of wild housefly.
2.7 转基因家蝇鉴定
利用家蝇的内参基因GAPDH引物PCR检测逆转录合成的cDNA是否有基因组DNA污染,如图7-A所示,只有野生型家蝇提取的DNA出现GAPDH条带,其余均没有条带,说明合成的cDNA样品中无DNA污染。图7-B所示以Ammrjp1基因F/R为引物PCR鉴定,转基因家蝇cDNA样品和pBac[fa PUb-mrjp1-DsRed]质粒样品有目的条带,证明Ammrjp1基因能在家蝇体内正常转录。分别以野生型家蝇基因组DNA、G2代转Ammrjp1家蝇基因组DNA和pBac[fa PUb-mrjp1-DsRed]质粒为模板,以Ammrjp1-for、Ammrjp1-rev引物进行PCR扩增(如图7-C),获得特异性目的产物,证明Ammrjp1已整合至家蝇基因组中。Southern Blot 检测证明Ammrjp1基因以单拷贝的形式插入家蝇基因组中(图8)。Inverse-PCR技术获得Ammrjp1基因在家蝇基因组上插入位点侧翼序列(图9),由于家蝇基因组基因标记信息不完整,无法准确定位插入染色体位置。通过分析野生型和G8代转基因型4龄幼虫百头重的显著性差异(图10),发现两者差异显著,说明Ammrjp1基因的插入能够促进家蝇的生长发育。
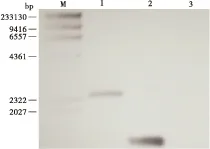
图8 Southern Blot检测转基因家蝇插入拷贝数Fig.8 Southern Blotting analysis of transgenic housefly genomic DNA注: M, DNA Marker; 1, 转基因基因组DNA; 2, mrjp1 PCR产物; 3, 野生型基因组DNA。Note: M, DNA Marker; 1, DNA of transgenic housefly; 2, mrjp1; 3, DNA of wild housefly.

图9 Inverse-PCR检测转基因家蝇插入位点Fig.9 Inverse-PCR analysis of transgenic housefly genomic DNA注: 下划线(直线), 转座质粒序列; 下划线(波浪线), 家蝇基因组DNA序列(Sequence ID:gb|AQPM01090136.1| 2084-1377; Sequence ID:gb|AQPM01013585.1|229-603)。Note: Underline (straight line), sequences of the pBac plasmid; Underline (break line), sequences of the transgenic housefly genomic DNA (Sequence ID:gb|AQPM01090136.1| 2084-1377; Sequence ID:gb|AQPM01013585.1| 229-603).

图10 G8转基因和野生家蝇幼虫百头重Fig.10 One hundred larval weight of G8 transgenic flies and wild type flies注:不同小写字母表示不同类型差异在P<0.05水平显著。Note: Different lowercase letters indicate significant differences between treatments (P<0.05).
3 结论与讨论
本研究为了获得有完整生物学功能的蜜蜂主要王浆蛋白1(mrjp1)转基因家蝇,构建含有该基因的转座重组质粒pBac[fa PUb-mrjp1-DsRed]具有以下特点:(1)带有PUb组成型启动子,该启动子具有启动效率高、甲基化程度相对较低和遗传稳定等特点,同时能在中肠、脂肪体、马氏管和飞行肌等组织中高度表达(Barrioetal.,1994),便于后续实验的筛选;(2)带有PiggyBac转座元件,能特异性识别靶序列TTAA位点;(4)DsRed作为一种常用的荧光标记基因,已经在地中海实蝇Ceratitiscapitata、埃及伊蚊Aedesaegypti以及墨西哥按实蝇Anastrephaludens等昆虫转基因筛选中成功应用(Fuetal.,2007;Smithetal.,2007;Zimowskaetal.,2009)。(5)同时注射的pSL[Dmhsp70-hyPBase]辅助质粒,利用果蝇来源的hsp70强启动子,能在温度诱导环境下促进外源基因整合进目标生物基因组内,并启动下游基因的转录和调控,实现目的基因的稳定遗传。通过显微注射技术获得转基因昆虫需要解决成功率不高的问题,往往需要技术员增大显微注射的胚胎基数来增加阳性个体的几率。瑞士苏黎世大学动物研究中心的研究人员在构建转基因家蝇过程中,总共注射了1668头家蝇胚胎,最终存活244头,存活率约为14%。造成存活率低的原因除了机械损伤外,还有一些是非受精卵,不能发育成成蝇(Hedigeretal.,2001)。造成转基因阳性个体概率较低的可能原因:(1)外源基因整合至家蝇重要功能基因上,影响家蝇的正常发育;(2)外源基因转座时以多拷贝的形式插入到基因组上,影响家蝇的正常代谢或生理活动;(3)转座质粒以线状DNA形式比较容易插入基因组上,而注射时质粒是以环状的形式注入胚胎内,在胚胎内未经有效酶切成线状而影响基因的整合效率。在以上因素的影响下,造成了阳性转基因个体概率偏低的现象。由于家蝇新鲜胚胎卵壳比较软,在本研究中未采用果蝇常用的次氯酸钠溶液浸泡脱卵壳方法,直接用极细的玻璃针注射家蝇胚胎,有利于减少对胚胎的机械伤害,家蝇胚胎的存活率提高至30%左右。
本研究利用荧光显微镜(λ=510-560 nm)初步筛选转基因家蝇个体G1,提取G2代转基因家蝇基因组DNA和总RNA,分别进行PCR和RT-PCR验证,均能获得特异性目的基因Ammrjp1条带,证明目的基因mrjp1已经插入到家蝇基因组上,并且能够在家蝇体内正常转录。利用Southern Blot杂交技术证明Ammrjp1是以单拷贝的形式插入家蝇基因组上。基于PiggBac的转基因方法是以随机方式整合至家蝇基因组上,利用Inverse-PCR技术获得Ammrjp1基因在家蝇基因组上插入位点侧翼序列,由于家蝇基因组信息的不完善,无法准确获得外源基因在染色体上的位置。比较野生型家蝇与G8代转基因家蝇4龄幼虫百头重显著性差异,发现Ammrjp1插入家蝇基因组能够促进家蝇的生长发育,比野生家蝇幼虫增加8.6%的重量,但是具体机制还不明确,需要经过进一步的实验才能验证。
References)
Barrio R, Arco A, Cabrera HL,etal. Structure and expression of theDrosophilaubiquitin-80-amino acid fusion protein gene [J].Biochem.J., 1994, 302: 237-244.
Chang B, Han RC, Cao L,etal. Effect ofMuscadomesticamaggot and pupae as feed additives on the quality and flavor of Qingyuan chickens [J].ChineseBulletinofEntomology, 2007, 44(6): 882-886. [常斌, 韩日畴, 曹莉, 等. 家蝇作为饲料添加剂对清远良种鸡肉质和风味的影响[J]. 昆虫知识, 2007, 44(6): 882-886]
Chen C, Chen SY. Changes in protein-components and storage stability of royal jelly under various conditions [J].FoodChem., 1995, 54(2): 195-200.
Ding S, Wu X, Li G,etal. Efficient transposition of the PiggyBac(PB)transposon in mammalilan cells and mice [J].Cell, 2005, 122(3): 473-483.
Drapeau MD,Albert S,Kucharski R,etal. Evolution of the Yellow / Major Royal Jelly Protein family and the emergence of social behavior in honey bees [J].GenomeRes., 2006, 16(11): 1385-1394.
Fu G, Condon KC, Epton MJ,etal. Female specific insect lethality engineered using alternative splicing [J].Nat.Biotechnol., 2007, 25: 353-357.
Hediger M, Niessen M, Wimmer EA,etal. Genetic transformation of the houseflyMuscadomesticawith the lepidopteran derived transposon PiggyBac [J].InsectMol.Biol., 2001, 10(2): 113-119.
Huang CY,Chi LL,Huang WJ,etal. Growth stimulating effect on queen beelarvae of histone deacetylase inhibitors [J].J.Agricul.FoodChem., 2012, 60: 6139-6149.
Kamakura M. Royalactin induces queen differentiation in honeybees [J].Nature, 2011, 473(7348): 478-483.
Kuwayama H, Yaginuma T, Yamashita O,etal. Germ-line transformation and RNAi of the ladybird beetle,Harmoniaaxyridis[J].InsectMol.Biol., 2006, 15: 507-512.
Liu L, Ye JY, Wu CL,etal. Effect of maggot meal on growth performance, body composition and digestive enzymes activities of black carp (Mylopharyngodonpiceus)[J].JournalofShanghaiOceanUniversity, 2014, 23(1): 43-50. [刘黎, 叶金云, 吴成龙, 等. 饲料中蝇蛆粉用量对青鱼生长、体成分和消化酶活力的影响[J]. 上海海洋大学学报, 2014, 23(1): 43-50]
Martins S, Naish N, Walker AS,etal. Germline transformation of the diamondback moth,PlutellaxylostellaL., using the PiggyBac transposable element [J].InsectMol.Biol., 2012, 21: 414-421.
Qu N, Jiang J, Sun L,etal. Proteomic characterization of royal jelly proteins in Chinese (Apiscerana)and European (Apismellifera)honeybees [J].Biochemistry, 2008, 73(6): 676-680.
Rosmilah M, Shahnaz M, Patel G,etal. Characterization of major allergens of royal jellyApismellifera[J].Trop.Biomed., 2008, 25: 243-251.
Schetelig MF, Handler AM. Germline transformation of the spotted wing drosophilid,Drosophilasuzukii, with a PiggyBac transposon vector [J].Genetica, 2013, 141: 189-193.
Schmitzova J, Klaudiny J, Albert S,etal. A family of major royal jelly proteins of the honeybeeApismelliferaL[J].CellularandMolecularLifeSciences, 1998, 54: 1020-1030.
Smith RC, Walter MF, Hice RH,etal. Testis-specific expression of theβ2-tubulinpromoter ofAedesaegyptiand its application as a genetic sex-separation Marker [J].InsectMol.Biol.,2007, 16: 61-71.
Wang W, Zhou XM, Wang N. Preliminary study on shrimp,s capacity of anti-baculovirus infection induced by housefly larva [J].JournalofNortheastNormalUniversity, 2002, 34(1): 54-57. [王娓, 周晓梅, 于宁. 蝇蛆提高对虾抗杆状病毒感染能力的初步研究[J]. 东北师大学报自然科学版, 2002, 34(1): 54-57]
Wen H, Lan X, Zhang Y,etal. Transgenic silkworms (Bombyxmori)produce recombinant spider dragline silk in cocoons [J].MolecularBiologyReports, 2010, 37(4): 1815-1821.
Wu QH, Tian H, Su LS,etal. Advances in the development and utilization of housefly larvae and its Products [J].ChinaFeedIndustry, 2006, 27(16): 63-64. [吴青华, 田河, 苏立申, 等. 家蝇幼虫及其产品开发利用研究进展[J]. 饲料工业, 2006, 27(16): 63-64]
Zimowska GJ, Nirmala X, Handler AM. Theβ2-tubulingene from three tephritid fruit fly species and use of its promoter for sperm marking [J].InsectBiochem.Mol.Biol., 2009, 39: 508-515.
Kelly B. Miller & Johannes Bergsten. Diving Beetles of the World-Systematics and Biology of the Dytiscidae[M]. Baltimore: Johns Hopkins University Press, 2016, 1-320.
Expression of honey bee royal jelly protein MRJP1 in houseflyMuscadomesticawith a transposon PiggyBac
XIONG Jia-Fu1,2, ZHANG Jian-Qing2, LIU Gui-Qing2, HAN Ri-Chou2*
(1. University of Chinese Academy of Sciences, South China Botanical Garden, Guangzhou 510650, China; 2. Guangdong Key Laboratory of Animal Conservation and Resource Utilization, Guangdong Public Laboratory of Wild Animal Conservation and Utilization, Guangdong Institute of Applied Biological Resources, Guangzhou 510260, China)
HouseflyMuscadomesticais an important resource insect, which is widely applied as feed protein in animal breeding industry. MRJP1 (Major Royal Jelly Proteins 1, MRJP1)is the main protein components in the honey bee royal jelly, with the function of nutrition and promotion of cell proliferation across species. With an aim to improve the application value of the housefly larvae, a transgenic housefly strain withAmmrjp1 gene inApismelliferawas constructed. In this study, the pBac[fa PUb-mrjp1-DsRed] recombinant plasmid withAmmrjp1 gene was constructed, and successfully microinjected into housefly embryos. RT-PCR showed thatAmmrjp1 was normally transcribed. Southern Blot indicated thatAmmrjp1 was inserted into the housefly genome with a single copy. The insert site sequence ofAmmrjp1 in the genome was cloned by Inverse-PCR. Compared to the non-transgenic houseflies, the weight of one hundred fourth instar G8 transgenic houseflies was 8.6% higher. This construction of genetic transformation system in housefly would provide technical support for the establishment of new transgenic bioreactors and the development of high-value animal protein feedstuffs.
Ammrjp1 gene; PiggyBac; microinjection; transgenic housefly
广东省科技计划项目(2015B070701019);广东省科学院科研平台环境与能力建设专项(2016GDASPT-0107);国家科技支撑计划课题(2012BAD14B16)
熊佳福,男,1989年生,湖南常德人,硕士研究生,研究方向为转基因家蝇的研究,E-mail: jiafuxiong163@163.com
*通讯作者Author for correspondence, E-mail:hanrc@giabr.gd.cn
Received:2016-12-27;接受日期Accepted:2017-01-20
Q963
A
1674-0858(2017)01-0075-10
熊佳福,张鉴清,刘桂清,等.利用PiggyBac系统在家蝇中表达蜜蜂王浆蛋白MRJP1 [J].环境昆虫学报,2017,39(1):75-84
