不同移虫日龄蜂王卵巢中hexamerin110、hexamerin70b的差异表达分析
2017-03-16张文文
庞 倩,王 莹,王 康,张文文,吉 挺
(扬州大学动物科学与技术学院,江苏扬州 225009)
不同移虫日龄蜂王卵巢中hexamerin110、hexamerin70b的差异表达分析
庞 倩,王 莹,王 康,张文文,吉 挺*
(扬州大学动物科学与技术学院,江苏扬州 225009)
为探究不同移虫日龄的西方蜜蜂蜂王卵巢中hexamerin110、hexamerin70b的表达及其调控机理,以β-actin为内参基因,运用qRT-PCR技术检测不同移虫日龄蜂王卵巢中hexamerin110、hexamerin70b mRNA的表达水平,用Western blot方法检测hexamerin110、hexamerin70b蛋白的表达。结果显示,hexamerin110、hexamerin70无论是在mRNA水平还是蛋白水平,随着移虫日龄的增加,其表达量均呈降低的趋势。1日龄移虫培育的蜂王卵巢hexamerin110基因表达量显著高于其他组(P<0.05),1日龄移虫培育的蜂王卵巢的hexamerin70b基因的表达量极显著高于其他组(P<0.01)。Hexamerin110、hexamerin70b在1日龄移虫发育的蜂王卵巢中的表达水平最高,推测其可能与蜂王生殖发育以及级型分化有关。
移虫日龄;卵巢;hexamerin110;hexamerin70b;级型分化
蜜蜂是以群体为单位的社会性昆虫,包括蜂王、雄蜂以及工蜂。蜂王和工蜂都是由受精卵发育而来的雌性蜂,两者的遗传组成完全一致,但它们在外部形态、生理结构和行为上都存在巨大的差异。蜂王个体大、寿命长并且繁殖力极强,而工蜂个体小、寿命极短,没有繁殖能力(Hartfelder and Engels, 1998;Page and Peng, 2001),这种现象称为蜜蜂的级型分化,是现今蜜蜂研究的热点问题。研究发现幼虫摄取的食物会影响其级型分化,决定其发育成具有繁殖力的蜂王或无繁殖性能的工蜂(陈璇和胡福良,2011;石元元,2011)。
昆虫储存蛋白(hexamerin)在昆虫的变态发育过程中具有至关重要的作用,其通常在幼虫的脂肪体内合成,在血淋巴内储存,化蛹时重新进入脂肪体,在昆虫变态发育期间被利用(Burmester and Scheller, 1999)。一直以来,hexamerin都被当作是非进食期昆虫生长发育的氨基酸来源,然而,研究发现hexamerin家族的蛋白除了与变态、蛹的生长发育有关,可能还与级型分化有关(Martinsetal., 2008)。
卵巢作为雌性蜜蜂生殖系统的重要功能组织,其大小和发育程度代表着蜂王的繁殖能力,其发育受到移虫日龄的影响,沈芳(2015)研究发现不同移虫日龄所培育的蜂王在生长发育和繁殖性能方面存在显著差异。而不同移虫日龄培育的蜂王卵巢中hexamerin的表达是否有差异尚不清楚,国内关于hexamerin对蜜蜂级型分化的影响的研究也比较少。有研究在发育中的卵巢和睾丸中检测到hexamerin110和hexamerin70b的转录本(Martinsetal., 2010)。因此,为了揭示不同移虫日龄对蜜蜂hexamerin的影响,本研究以hexamerin110、hexamerin70b为研究对象,利用qRT-PCR方法以及Western blot方法比较不同移虫日龄蜂王卵巢内hexamerin110 、hexamerin70b在mRNA及蛋白水平的表达,探究不同移虫日龄对其的影响,为hexamerin110、hexamerin70b对蜜蜂级型分化的调控提供理论依据。
1 材料与方法
1.1 实验材料
1.1.1 实验蜂群
处女王(西方蜜蜂)出房后8 d人工注射单只雄蜂的精液,获得单雄授精的蜂王,组织单雄授精蜂王进行产卵。单雄受精蜂王及组织蜂群工作均在吉林蜜蜂研究所实验蜂场进行。
1.1.2 主要试剂
Trizol购自Invitrogen公司;氯仿,异丙醇,75%乙醇,DEPC水,FastQuant RT Kit(with gDNase)FastQuant cDNA第一链合成试剂盒(KR106)购自北京天根生化科技有限公司;荧光定量PCR试剂盒(cw0956)购自北京康为世纪生物科技有限公司;RIPA裂解液、BCA蛋白浓度测定试剂盒购自碧云天公司;β-actin小鼠单克隆抗体购自上海艾博抗贸易有限公司;辣根过氧化物酶标记山羊抗兔IgG、hexamerin110单克隆抗体、hexamerin70b单克隆抗体购自艾比玛特生物医药(上海)有限公司;ECL显色试剂盒、硝酸纤维素膜购自伯乐生命医学产品(上海)有限公司;低分子量蛋白Marker购自Thermo Scientific公司。
1.1.3 主要仪器
高灵敏蛋白印迹成像和多色荧光定量分析系统,ABI7500荧光定量PCR仪,台式冷冻离心机,酶标仪,普通PCR仪,均质器。
1.2 实验方法
1.2.1 蜂王的培育
灭菌后的空巢脾,放入限王产卵器中,经工蜂清理24 h后,控制蜂王产卵6 h,将空脾转移到继箱中孵育。98 h后移取巢脾上的幼虫为1日龄幼虫,122 h后移取巢脾上的幼虫为2日龄,146 h后移取巢脾上的幼虫为3日龄。培育至蜂王出房的前一天,全部转移到昆虫培养箱等待蜂王出房。
1.2.2 引物设计与合成
根据Genebank中hexamerin110的序列(NM_001101023.1)、hexamerin70b的序列(NM_001011600.1),按照荧光定量引物设计原则,设计引物,hexamerin110上游:5′-AACGTGCCAGGC GCAGTTGT-3′,下游:5′-TTCACCAGCATGGAGGT TCTGGA-3′;hexamerin70b上游:5′-TGCCG CCAATGTACGAGGTG-3′,下游:5′-GCTCGGGCAC GTTGTGTTTG-3′,以β-actin作为内参基因,上游:5′-TCCTGCTATGTATGTCGC-3′,下游:5′-AGT TGCCATTTCCTGTTC-3′,引物由上海生工生物工程有限公司合成。
1.2.3 qRT-PCR
实验分为3组,每组3个重复,每个重复取2头西方蜜蜂蜂王的双侧卵巢,混池,将卵巢组织样品匀浆后按试剂说明书操作,用Trizol提取卵巢总RNA,根据各样品总RNA浓度,对RNA样品进行稀释,使其终浓度为200 ng/μL,然后按照FastQuant RT Kit(with gDNase)FastQuant cDNA第一链合成试剂盒(KR106)操作程序进行反转录。根据荧光定量PCR试剂盒(cw0956)说明书进行操作,所有步骤均在冰上进行,qRT-PCR反应体系为20 μL体系:2×UltraSYBR Mixture(With ROX)10 μL,上游引物1 μL,下游引物1 μL,DNA模板2 μL,RNase-Free Water 6 μL,PCR扩增程序为95℃10 min;95℃15 s,60℃1 min,共40个循环,PCR反应在ABI7500荧光定量PCR仪上进行,最后用2-ΔΔCt的方法计算基因的表达量。
1.2.4 Western Blot检测
实验分为3组,每组3个重复,每个重复取2头西方蜜蜂蜂王的双侧卵巢,混池,加入裂解液后,匀浆、超声破碎、离心,用BCA法测定蛋白浓度后,将蛋白在沸水中水浴煮沸5 min,使蛋白变性,用10%的聚丙烯酰胺凝胶电泳分离蛋白后,将蛋白转移到硝酸纤维素膜上,封闭液封闭,TBST冲洗后,分别与一抗、二抗杂交,ECL法于暗室中显色,运用高灵敏蛋白印迹成像和多色荧光定量分析系统观察Western blot结果。
1.2.5 蛋白结构预测
利用ProtParam tool软件分析蛋白质序列的理化性质,利用SOPMA软件预测蛋白质的二级结构,利用Tmpred对蛋白质跨膜区进行分析。
1.2.6 数据分析和处理
利用SPSS 17.0软件对不同移虫日龄蜂王卵巢内hexamerin110、hexamerin70b基因的表达量进行统计分析,用ANOVA的LSD法进行显著性分析,以0.05为显著性水平。
2 结果与分析
2.1 qRT-PCR的结果
2.1.1 不同移虫日龄蜂王卵巢中hexamerin110基因的表达
从图1可以看出,随着移虫日龄的增加,hexamerin110基因的表达量呈现降低趋势,1日龄移虫培育的蜂王卵巢的hexamerin110基因的表达量最高,显著高于2日龄和3日龄移虫所培育的蜂王卵巢的hexamerin110基因的表达量(P<0.05),2日龄和3日龄移虫培育的蜂王卵巢的hexamerin110基因的表达量相近,差异不显著(P>0.05)。

图1 不同移虫日龄hexamerin110基因的表达量Fig. 1 Expression level of hexamerin110 of different grafted instar注:相同字母代表差异不显著,不同字母代表差异显著(P<0.05)。Note: The same letters represent no significant difference, the different letters represent significant difference (P<0.05).
2.1.2 不同移虫日龄蜂王卵巢中hexamerin70b基因的表达

图2 不同移虫日龄的hexamerin70b基因表达量Fig.2 Expression level of hexamerin70b of different grafted instar注:相同字母代表差异不显著,不同字母代表差异显著(P<0.05)。Note: The same letters represent no significant difference, the different letters represent significant difference (P<0.05).
从图2可以看出,随着移虫日龄的增加,hexamerin70b基因的表达量呈现降低趋势,1日龄移虫培育的蜂王卵巢的hexamerin70b基因的表达量最高,而且极显著高于2日龄和3日龄移虫培育的蜂王卵巢的hexamerin70b基因的表达量(P<0.01),2日龄和3日龄移虫培育的蜂王卵巢的hexamerin70b基因的表达量相近,差异不显著(P>0.05)。
2.2 Western Blot的结果
如图3所示,Western Blot的结果表明,随着移虫日龄的增加,1日龄、2日龄、3日龄移虫所培育的蜂王卵巢中hexamerin110、hexamerin70b蛋白的表达水平均呈现降低趋势。
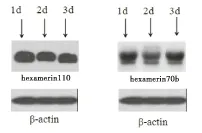
图3 不同移虫日龄hexamerin110蛋白和hexamerin70b蛋白的表达Fig.3 Expression levels of hexamerin110 and hexamerin70b of different grafted instar
2.3 蛋白结构预测结果
用ProtParam tool软件分析蛋白质序列的理化性质,结果显示hexamerin110蛋白分子量112.2 kDa,等电点6.43,负电荷氨基酸残基总数64,正电荷氨基酸残基总数57,总平均疏水性;hexamerin70b蛋白分子量79.5 kDa,等电点6.72,负电荷氨基酸残基总数70,正电荷氨基酸残基总数66,总平均疏水性。利用SOPMA软件预测蛋白质的二级结构,结果表明,hexamerin110含有α螺旋(h)38.89%,延伸链(e)17.66%,β转角(t)9.92%,无规卷曲(c)33.53%;hexamerin70b含有α螺旋(h)39.39%,延伸链(e)23.43%,β转角(t)8.93%,无规卷曲(c)28.26%(图4、图5)。利用Tmpred对蛋白质跨膜区进行分析,发现hexamerin110可能的8个跨膜螺旋区,分别为:29-47,100-122,236-260,383-409,664-684,776-794,900-925,939-961。膜外到膜内5个,分别为:29-47,100-123,664-684,774-792,939-957。发现hexamerin70b可能的1个跨膜螺旋区,为32-52,膜外到膜内1个,为30-52。

图4 hexamerin110蛋白二级结构预测Fig.4 Secondary structure prediction of hexamerin110 protein

图5 hexamerin70b蛋白二级结构预测Fig.5 Secondary structure prediction of hexamerin70b protein
3 结论与讨论
Hexamerin110基因有9个外显子,编码1008个氨基酸,其编码的蛋白富含谷氨酰胺,hexamerin110在幼虫血淋巴含量特别高,在结茧期减少,在成蜂中再一次升高(Bitondietal., 2006)。Hexamerin110除了为变态和蛹的发育提供氨基酸,还参与雌性昆虫的产卵(Wheeler and Buck, 1995; Pan and Telfer, 1996; Seoetal., 1998; Wheeleretal., 2000; Pan and Telfer, 2001),并且在产卵蜂王卵巢中高表达(Martinsetal., 2010)。qRT-PCR和Western blot的结果显示,随着移虫日龄的增加,hexamerin110的表达量无论是在mRNA水平还是蛋白水平,均呈现降低趋势,可能是因为移虫日龄会对蜂王的生长发育以及繁殖性能产生影响,随着移虫日龄的增加,蜂王的卵巢重显著减轻,卵巢管数显著减小(沈芳, 2015),移虫越晚,人工培育的蜂王的卵巢发育的越不完全,从而导致与产卵有关的hexamerin110表达量的降低。也可能是因为高产蜂王的卵巢发育和产卵需要更多的能量与蛋白质的供给,从而诱导了与产卵有关的hexamerin110的高表达。Bitondi等(2006)发现工蜂卵巢的发育程度与hexamerin110基因的表达水平有关,卵巢的发育需要hexamerin110基因的高水平表达。因此推测,hexamerin110可能与蜂王的繁殖能力有关,hexamerin110的高表达有利于蜂王卵巢的发育,提高蜂王的繁殖性能。
Hexamerin70b基因有7个外显子,编码683个氨基酸,Cunha等(2005)研究得出hexamerin70b基因的表达受保幼激素(JH)和蜕皮激素的调节,用保幼激素处理或者注射蜕皮激素会使工蜂hexamerin70b的高表达期延长。随着移虫日龄的增加,hexamerin70b的表达量无论是在mRNA水平还是蛋白水平,均呈现降低趋势,与随着移虫日龄的增加,蜂王幼虫的保幼激素和蜕皮激素的含量显著降低的结果一致(沈芳, 2015)。Hexamerin70b的表达之所以会随着移虫日龄的增加而降低可能是因为不同移虫日龄培育的蜂王取食到的蜂王浆不同,而蜂王浆会影响成熟幼虫的保幼激素浓度(彭文, 2007;Riddifordetal., 2010),保幼激素和蜕皮激素能够调控hexamerin70b的表达。Wirtz和Beetsma(1972)的研究表明保幼激素JHⅢ在蜜蜂级型分化过程中具有重要的作用。幼虫血淋巴JHⅢ浓度的差异能够激活幼虫体内不同的发育模式,从而使得幼虫发育成蜂王和工蜂这两种完全不同的级型。同时,JHⅢ可以促进幼虫期卵巢的发育(Barchuketal., 2007),并且与蜕皮激素协同作用,共同调节蜜蜂的发育和变态过程。Hexamerin70b可能与保幼激素和蜕皮激素共同调控蜜蜂的级型分化。
本研究运用qRT-PCR技术及Western blot方法检测了hexamerin110、hexamerin70b在不同移虫日龄培育的西方蜜蜂蜂王卵巢中的表达,结果表明其在1日龄培育的蜂王卵巢中的表达明显高于2日龄、3日龄的表达,而2日龄与3日龄之间表达差异不明显,说明1日龄移虫的蜂王繁殖性能具有更明显的优势。
References)
Barchuk AR, Cristino AS, Kucharski R,etal. Molecular determinants of caste differentiation in the highly eusocial honeybeeApismellifera[J].BMCDevelopmentalBiology, 2007, 7(1):70.
Bitondi MMG, Nascimento AM, Cunha AD,etal. Characterization and expression of theHex110 gene encoding a glutamine-richhexamerinin the honey bee,Apismellifera[J].ArchivesofInsectBiochemistryandPhysiology, 2006, 63(2):57-72.
Burmester T, Scheller K. Ligands and receptors:Common theme in insect storage protein transport[J].Naturwissenschaften, 1999, 86:468-474.
Chen X, Hu FL. Molecular determinants of caste differentiation in honey bee[J].JournalofBee, 2011, 4: 1003-1091. [陈璇, 胡福良. 雌性蜜蜂级型决定的分子机制[J].蜜蜂杂志, 2011, 4: 1003-1091]
Cunha AD, Nascimento AM, Guidugli KR,etal. Molecular cloning and expression of a hexamerin cDNA from the honey bee,Apismellifera[J].JournalofInsectPhysiology, 2005, 51:1135-1147.
Hartfelder K, Engels W. 2 social insect polymorphism:Hormonal regulation of plasticity in development and reproduction in the honeybee[J].CurrentTopicsinDevelopmentalBiology, 1998, 40: 45-77.
Martins JR, Nunes FMF, Cristino AS,etal. The fourhexameringenes in the honey bee:Structure, molecular evolution and function deduced from expression patterns in queens, workers and drones[J].BMCMolecularBiology, 2010, 11:23.
Martins JR, Nunes FMF, Simões ZLP,etal. A honeybee storage protein gene,hex70a, expressed in developing gonads and nutritionally regulated in adult fat body[J].JournalofInsectPhysiology, 2008, 54: 867-877.
Page RE, Peng CYS. Aging and development in social insects with emphasis on the honey bee,ApismelliferaL.[J].ExperimentalGerontology, 2001, 36(4): 695-711.
Pan ML, Telfer WH. Methionine-rich hexamerin and arylphorin as precursor reservoirs for reproduction and metamorphosis in female luna moths[J].ArchivesofInsectBiochemistryandPhysiology, 1996, 33:149-162.
Pan ML, Telfer WH. Storage hexamer utilization in two lepidopterans:Differences correlated with the timing of egg formation[J].JournalofInsectScience, 2001, 1:1-9.
Peng WJ. About the royal jelly[J].ApicultureofChina, 2007, 58(12):46. [彭文君. 关于蜂王浆[J].中国蜂业, 2007, 58(12):46]
Riddiford LM, Truman JW, Mirth CK,etal. A role for juvenile hormone in the prepupal development ofDrosophilamelanogaster[J].Development, 2010, 137(7): 1117-1126.
Seo SJ, Kang YJ, Cheon HM,etal. Distribution and accumulation of storage protein-1 in ovary ofHyphantriacuneaDrury[J].ArchivesofInsectBiochemistryandPhysiology, 1998, 37:115-128.
Shen F. Research on the Effect of the Instar of the Grafted Larvae on Growth and Development and Ovary Proteomic of Queen[D]. Yangzhou University, 2015. [沈芳. 移虫日龄对蜂王生长发育及蜂王卵巢蛋白质组学的影响[D].扬州大学, 2015]
Shi YY. Influence of Nutritional and Spatial Factors in the Development of Females Honeybees (Apismellifera, Apidae)[D]. Jiangxi Agricultural University, 2011. [石元元. 营养和空间因素对雌性蜜蜂发育的影响[D]. 江西农业大学, 2011]
Wheeler DE, Buck NA. Storage proteins in ants during development and colony founding[J].JournalofInsectPhysiological, 1995, 41:885-894.
Wheeler DE, Tuchinskaya I, Buck NA,etal. Hexameric storage proteins during metamorphosis and egg production in the diamondback moth,Plutellaxylostella(Lepidoptera)[J].JournalofInsectPhysiology, 2000, 46:951-958.
Wirtz P, Beetsma J. Induction of caste differentiation in the honeybee (Apismellifera) by juvenile hormone[J].EntomologiaExperimentalisetApplicata, 1972, (15):517-520.
Analysis on differential expression ofhexamerin110 andhexamerin70b in the ovaries of queens reared from different instar of the grafted larvae
PANG Qian1, WANG Ying, WANG Kang, ZHANG Wen-Wen, JI Ting*
(College of Animal Science and Technology, Yangzhou University, Yangzhou 22500, Jiangsu Province, China)
To explore the expression and molecular regulation mechanism ofhexamerin110 andhexamerin70b in the ovaries of queens reared from different instar of the grafted larvae, mRNA and protein expression ofhexamerin110 andhexamerin70b were assessed by qRT-PCR and Western blot. The results showed that the expression levels of thehexamerin110 andhexamerin70b decreased with the increasing instar of the grafted larvae, the expression levels of thehexamerin110 in ovaries of queens reared from 1 day instar of the grafted larvae were significantly higher than others (P<0.05). Meanwhile, the expression levels of thehexamerin70b in ovaries of queens reared from 1 day instar of the grafted larvae were extremely significantly higher than others (P<0.01). The expression levels of thehexamerin110 andhexamerin70b of 1 day instar of the grafted larvae are the highest, it is speculated thathexamerin110 andhexamerin70b may be associated with queen reproductive development and caste differentiation.
Instar of the grafted larvae; ovary;hexamerin110;hexamerin70b; caste differentiation
国家自然科学基金(31502020,31172272);现代农业产业技术体系(CARS-45-SYZ6)
庞倩,女,1994年生,安徽宿州人,硕士研究生,E-mail:18852717155@163.com
*通讯作者Author for correspondence,E-mail:tji@yzu.edu.cn
Received:2016-08-17;接受日期Accepted:2016-09-23
Q963;S89
A
1674-0858(2017)01-0062-06
庞倩,王莹,王康,等.不同移虫日龄蜂王卵巢中hexamerin110、hexamerin70b的差异表达分析[J].环境昆虫学报,2017,39(1):62-67.
