中华蜜蜂气味受体基因AcerOr167的克隆及表达分析
2017-03-16杜亚丽潘建芳王树杰赵慧婷姜玉锁
杜亚丽,潘建芳,王树杰,杨 爽,2,赵慧婷,姜玉锁
(1.山西农业大学动物科技学院,山西太谷030801;2.云南省农业科学院蚕桑蜜蜂研究所,云南蒙自 661101; 3.山西农业大学生命科学学院,山西太谷 030801)
中华蜜蜂气味受体基因AcerOr167的克隆及表达分析
杜亚丽1*,潘建芳*,王树杰1,杨 爽1,2,赵慧婷3,姜玉锁1**
(1.山西农业大学动物科技学院,山西太谷030801;2.云南省农业科学院蚕桑蜜蜂研究所,云南蒙自 661101; 3.山西农业大学生命科学学院,山西太谷 030801)
本研究通过RT-PCR获得中华蜜蜂气味受体基因Or167的cDNA序列,并采用多种生物信息学软件对其结构特征进行预测分析;利用荧光定量PCR检测AcerOr167 mRNA在工蜂羽化后不同发育阶段(1、5、10、15、20、25和30日龄)和不同组织(触角、头、胸、腹、足、翅)中的相对表达量。克隆获得中华蜜蜂Or167的cDNA序列,命名为AcerOr167(GenBank登录号为KF239369),其全长1311 bp,编码436个氨基酸,预测有5个跨膜结构域;多序列比对结果显示,中华蜜蜂AcerOr167与西方蜜蜂AmelOr167的一致性最高,达94%,而与毕氏粗角蚁CbirOr4-like的一致性最低,为49%;荧光定量结果显示,AcerOr167 mRNA在成蜂不同发育期的各个组织中均有表达,且触角中的表达量极显著高于其它各个组织(P<0.01),在头、胸、腹、足、翅中有少量表达;从触角不同发育阶段的表达情况来看,1日龄表达量最低,5日龄表达量显著升高,20日龄表达量最高,且极显著高于其它各日龄(P<0.01)。推测AcerOr167可能在中华蜜蜂的嗅觉识别系统中起着重要的作用,与中华蜜蜂外出采集,识别花香气味有关。本研究为进一步深入研究中华蜜蜂传统气味受体的功能奠定理论基础。
中华蜜蜂;AcerOr167;基因克隆;荧光定量;表达谱
昆虫凭借高度专一、灵敏的嗅觉感受系统进行栖息地的选择、繁殖、飞翔、躲避天敌和传递信息等生命活动(Kriegeretal.,2002;Bruceetal.,2005)。昆虫的嗅觉识别过程非常复杂,需要多种蛋白参与,其中气味受体专一性识别并结合气味分子在嗅觉信号转导途径中起着至关重要的作用。1999年《Science》杂志报道鉴定出黑腹果蝇Drosophilamelanogaster的第一个气味受体基因(Pennisietal.,1999),之后Vosshall等(1999)通过全基因组测序的方法从果蝇的基因组中筛选获得62个气味受体基因,这些基因形成一个高度变异的家族,基因之间的同源性很低。目前已经从至少获得的15种昆虫的全基因组序列中筛选出了气味受体基因(Sánchez-Graciaetal.,2009),例如从冈比亚按蚊Anophelesgambiae、家蚕Bombyxmori、意大利蜜蜂Apismellifera、埃及伊蚊Aedesaegypti和金小蜂Nasoniavitripennis等中分别鉴定得到79、64、170、113和301个Ors基因(Hilletal.,2002;Robertsonetal.,2006;Wanneretal.,2007;Bohbotetal.,2007;Robertsonetal.,2010)。Benton等(2006)利用LacZ融合和绿色荧光蛋白检测技术发现果蝇气味受体与哺乳动物的气味受体家族一样具有7次跨膜结构,但N末端位于细胞膜内。近年来,对昆虫气味受体的功能研究越来越受到科学工作者的青睐。
蜜蜂作为一种高级的社会性昆虫,主要通过灵敏的嗅觉识别个体和群体之间的各类信息素和外界环境中的各种气味物质,如蜂王通过信息素来实现对蜂群的调控、蜂王与雄蜂的交配、蜂王产卵、工蜂之间的分工、采集蜂出巢寻找蜜粉源并准确定位等(Gruterwmetal.,2007;张巧等,2011)。Krieger等(2003)以果蝇Or83b和冈比亚按蚊AgOr7基因的序列为参考,克隆出西方蜜蜂Apismellifera的第一个气味受体基因,命名为AmelR2。2006年西方蜜蜂全基因组测序完成后,Robertson等(2006)利用生物信息学方法从中鉴定出了170个Ors,其中7个是假基因,通过系统发育学分析,将这170个Ors分成了5个亚家族,且研究发现Ors基因能为蜜蜂寻找蜜粉源和检测信息素类物质提供重要的线索。Wanner等(2007)构建西方蜜蜂基因芯片,扫描并检测出Or10,Or11,Or18,Or170在雄蜂触角中呈高丰度表达,并通过电生理学研究发现雄蜂的Or11仅对9-ODA反应敏感,对其他蜂王信息素无反应。中华蜜蜂Apisceranacerana(简称中蜂),是我国独有的蜜蜂品种,具有嗅觉灵敏,采集力强,利用率高,抗寒抗病能力强,消耗饲料少等西方蜜蜂无法比拟的优势(杨冠煌,2001,2005;曾志将,2002)。中华蜜蜂对维持我国动植物的生态平衡起着重要的作用,特别是有利于高寒山区植物的传粉授粉,但由于杀虫剂、除草剂等化学药品在现代农业中的广泛应用,给中华蜜蜂的健康养殖带来了巨大的威胁;西方蜜蜂的引入使中华蜜蜂的种群数量和分布区域明显缩小,因而合理利用和保护我国特有的蜜蜂资源势在必行。
本试验以中华蜜蜂为研究对象,利用RT-PCR技术获得AcerOr167的cDNA序列,并采用多种生物信息学软件对其结构和功能进行了预测分析;利用荧光定量分析AcerOr167在工蜂羽化后不同发育阶段和不同组织中的表达情况,推测AcerOr167在中华蜜蜂嗅觉识别中发挥着重要的作用,为进一步深入研究中华蜜蜂传统气味受体基因的功能奠定理论基础。
1 材料与方法
1.1 供试昆虫
供试中华蜜蜂于2015年5月采自山西农业大学动物科技学院实验蜂场。
采样方法:将即将羽化出房的工蜂巢脾从蜂场带回实验室,放入35℃恒温培养箱中使之继续发育,待新蜂出房后,标记蜜蜂若干头(>3000头),随后将蜜蜂随机放入3个蜂箱中。从工蜂刚羽化出房开始采样,记为1日龄,之后每5 d取一次样,共取7次,每次设置3个生物学重复。用镊子分别取下各日龄工蜂的触角、头(去除触角)、胸、腹、足、翅,立即投入装有液氮的研钵中,研磨至粉末状,加入装有1 mL RNAiso Plus的EP管中,置于-80℃保存备用。
1.2 试剂与试剂盒
Trizol总RNA提取试剂、反转录试剂盒(PrimeScriptTMRT Master Mix perfect Real Time)、实时荧光定量PCR试剂盒、pMDTM19-T载体等分子生物学试剂均购置北京华大基因技术有限公司;Taq DNA聚合酶、快速琼脂糖凝胶DNA回收试剂盒、DH5α感受态细胞为北京康为世纪生物科技有限公司产品。
1.3 引物设计
根据本课题组前期获得的中华蜜蜂触角转录组测序结果,用Primer3 Plus在线软件设计了2对AcerOr167基因的特异性引物,进行PCR扩增;根据获得的cDNA序列,设计荧光定量PCR的特异性引物,以西方蜜蜂肌动蛋白Arp1基因(GenBank登录号为NM_001185146.1)作为内参设计引物;试验所用引物均由北京六合华大基因技术有限公司(TaKaRa)合成。引物序列及产物长度见表1。

表1 设计合成的引物及其用途
1.4 总RNA提取和cDNA的合成
根据Trizol RNA提取试剂说明书,提取工蜂各日龄各个组织的总RNA。按照反转录试剂盒说明书以总RNA为模板、OligdT为引物合成第一链cDNA,用作RT-PCR、qRT-PCR模板。
1.5AcerOr167 PCR扩增
以中华蜜蜂的触角cDNA为模板,利用特异引物扩增AcerOr167的cDNA序列。反应体系(20 μL):2×Es Taq MasterMix 10 μL,cDNA 2 μL,正向和反向引物各1 μL,RNase-Free Water 6 μL,混匀,短暂离心,放入PCR仪中进行扩增。反应条件为94℃预变性4 min;94℃ 30 s,50℃-58℃ 40 s,72℃ 1 min,循环35次;72℃延伸8 min,4℃保存。PCR产物经1.2%的琼脂糖凝胶电泳检测(120 V,30 min)后,在凝胶成像系统中检测并拍照。
1.6 PCR产物的纯化、克隆与测序
将上述PCR产物按照快速琼脂糖凝胶DNA回收试剂盒说明书进行产物的纯化与回收。回收的目的片段与pMDTM19-T载体连接,之后将连接产物转化入100 μL大肠杆菌DH5α感受态细胞中,转化步骤按照DH5α感受态细胞转化说明书操作,转化复苏后,用玻璃棒将E.coli均匀涂抹到加有氨苄青霉素、X-gal和IPTG的固体培养基中37℃培养过夜,次日进行蓝白斑的筛选,随机挑取单一白色菌斑于5 mL含氨苄青霉素的液体培养基中扩大培养,37℃ 200 rpm振荡8-10 h。将阳性菌送至北京华大基因技术有限公司测序。
1.7 实时荧光定量PCR
采用比较Ct值法的相对定量法,分析AcerOr167基因在中华蜜蜂工蜂羽化后不同发育阶段和不同组织中的表达量。将反转录分别合成的7个日龄触角、头、胸、腹、足、翅膀的cDNA稀释4倍后,根据实时荧光定量PCR试剂盒进行实时荧光定量。反应体系为20 μL,其中2×SYBR Premix Ex TaqTMⅡ10 μL,上、下游引物(10 μM)各0.8 μL,ROX Reference Dye Ⅱ(50×)0.4 μL,cDNA模板2 μL,灭菌超纯水6 μL。反应条件为:95℃预变性3 min;95℃变性15 s,60℃退火35 s,40个循环。所有样品均重复3次。
1.8 序列分析
使用EXPASY(Expert Protein Analysis System,http://www.expasy.org)的翻译工具将获得的核酸序列翻译成氨基酸序列,在NCBI中通过Blast方法进行同源序列比对,找到与目的基因具有同源性的其他昆虫气味受体。采用Protparam(http://web.expasy.org/protparam/)对其蛋白质的理化性质进行预测;使用在线软件TMHMM Server v.2.0(http://www.cbs.dtu.dk/services/TMHMM/)预测其跨膜结构域;使用在线软件预测PSIPRED(http://bioinf.cs.ucl.ac.uk/psipred)对该蛋白的二级结构进行预测分析。采用Mega 5.2软件中的Neighbor-joining(NJ)方法构建系统进化树,Bootstrap进行1000次重复构建。
1.9 数据统计与分析
通过2-ΔΔCT值比较AcerOr167基因在工蜂羽化后不同发育阶段和不同组织的相对表达量。运用SPSS软件中的单因素ANOVA方法进行方差分析,并选用新复极差法(new multiple range method)进行多重比较。
2 结果与分析
2.1AcerOr167基因的克隆
用设计的2对引物分别对中华蜜蜂AcerOr167基因进行扩增、克隆和测序(图1),采用DNAStar软件对测序结果进行拼接,获得的中华蜜蜂AcerOr167 cDNA序列的长度为1449 bp,其中ORF全长1311 bp,编码436个氨基酸。将该序列在NCBI数据库中进行Blast搜索比对(图2),发现与西方蜜蜂AmelOr167(GenBank登录号XM_0011230564)编码的氨基酸序列一致性最高,达94%,确定克隆得到中华蜜蜂AcerOr167的cDNA序列,并在GenBank注册,登录号为:KF239369。

图1 AcerOr167的两对特异性引物PCR扩增结果Fig.1 Result of PCR amplification of two pairs of specific primers of AcerOr167 注:M,DNA 分子量标准;1和2泳道分别为1051、529 bp。Note: M, DNA Marker; Lane 1 and 2 are 1051, 529 bp respectively.
2.2 生物信息学分析
2.2.1AcerOr167蛋白的基本理化性质分析
对中华蜜蜂AcerOr167编码的蛋白进行理化性质分析,结果表明,该蛋白分子量为50.238 kDa,理论等电点(pI)为8.85。AcerOr167蛋白包含20种常见的氨基酸,未发现有特殊的吡咯赖氨酸(Pyl)和硒代半胱氨酸(Sec),其中异亮氨酸(Ile)的含量最多,为14.7%;半胱氨酸(Cys)含量最少,为1.1%;带负电荷氨基酸残基数(Asp+Glu)为31,带正电荷氨基酸残基数(Arg+Lys)为37。该蛋白的不稳定系数为36.94,脂溶系数为122.13,总平均疏水性系数为0.562,说明AcerOr167蛋白的结构较稳定,且为水溶性蛋白,亲水性较强。
2.2.2AcerOr167蛋白结构预测分析
使用TMHMM 2.0软件预测AcerOr167蛋白具有5个跨膜结构域(图3),且每两个跨膜结构域之间都含有一段在细胞膜外的亲水序列,它们的氨基酸顺序分别为第5-119、209-258、311-436位,在311-436位氨基酸处的亲水序列最长。AcerOr167蛋白的的二级结构预测结果(图4)显示α-螺旋(helix)占主导地位(74.77%),其次是卷取环(loop)(22.71%),β-折叠(strand)最少(2.52%)。

图2 中华蜜蜂AcerOr167和西方蜜蜂AmelOr167编码的氨基酸序列比对结果Fig.2 Alignment of amino acid sequence between AcerOr167 and AmelOr167注:黑色阴影表示高度一致的残基位点;灰色阴影表示保守性较高的残基位点;缺失位点由点代替。Note: Identical amino acids are shaded in black, amino acids with higher identity are shaded in grey, and gaps are indicated by dots.

图3 AcerOr167蛋白跨膜结构的预测Fig.3 Prediction of transmembrane structure of AcerOr167 protein注:跨膜区1(28-50);跨膜区2(120-142);跨膜区3(186-208);跨膜区4(259-281);跨膜区5(288-310)。Note: Transmembrane region 1 (28-50); transmembrane region 2 (120-142); transmembrane region 3 (186-208); transmembrane region 4 (259-281); transmembrane region 5 (288-310).

图4 PSIPRED软件预测中华蜜蜂AcerOr167蛋白二级结构Fig. 4 Prediction of the secondary structure of AcerOr167 protein from Apis cerana cerana by PSIPRED
2.3AcerOr167与其它膜翅目昆虫气味受体的进化树分析
为进一步确定中华蜜蜂AcerOr167与其他昆虫气味受体的进化关系,将AcerOr167氨基酸序列在NCBI中进行Blastp搜索,结果显示只有膜翅目昆虫的气味受体与目的基因具有较高的一致性(>45%),在其他目类下几乎找不到同源基因,且中华蜜蜂AcerOr167与西方蜜蜂AmelOr167的氨基酸序列一致性最高,达94%,其次是迴条蜂HlabOr82a,为66%,与毕氏粗角蚁CbirOr4-like的氨基酸一致性最低,为49%。用Mega 5.2构建系统进化树(图5),采用邻接法经1000次重复后,该进化树非常直观的呈现中华蜜蜂AcerOr167与膜翅目其他昆虫之间的进化关系。结果显示,中华蜜蜂先与西方蜜蜂聚为一个小的分支,之后与迴条蜂、熊蜂、麦蜂聚为一个较大的分支,而法老蚁、大头阿塔切叶蚁、小火蚁、毕氏粗角蚁则聚为另一大的分支,这表明中华蜜蜂与西方蜜蜂的亲缘关系最近,与膜翅目其他昆虫的亲缘关系相对较远。

图5 基于氨基酸序列构建的AcerOr167与膜翅目其他昆虫气味受体的进化树Fig.5 Phylogenetic tree of AcerOr167 and other known Hymenoptera Ors based on amino acid sequencesNote:AcerOr167, 中华蜜蜂Apis cerana cerana (KF239369); AmelOr167, 西方蜜蜂Apis mellifera (XP_001120564); BterOr4-like,地熊蜂 Bombus terrestris (XP_012168558); BimpOr4-like,熊蜂 Bombus impatiens (XP_012240156); HlabOr82a, 迴条蜂Habropoda laboriosa (KOC62874); MquaOr82a,麦蜂 Melipona quadrifasciata (KOX77416); MphaOr4-like,法老蚁 Monomorium pharaonis (XP_012527971); AcepOr4-like,大头阿塔切叶蚁 Atta cephalotes (XP_012063162); WaurOr4-like,小火蚁 Wasmannia auropunctata (XP_011694618); CbirOr4-like, 毕氏粗角蚁Cerapachys biroi (XP_011333674).
2.4AcerOr167 mRNA的表达谱分析
以Arp1为校正参数,以10日龄工蜂头部的AcerOr167表达量为基准,根据2-ΔΔCt法计算AcerOr167在工蜂羽化后不同发育阶段(触角中)和不同组织中的表达差异(图6)。AcerOr167 mRNA在工蜂各组织中均有表达,且在触角中的表达量极显著高于其它组织(P<0.01),在头部和胸部的表达量相对较低,在腹、足和翅膀中的表达量非常低。1日龄时触角的表达量是头部的30倍左右,且头部的表达量极显著高于其他组织(P<0.01),而胸、腹、足和翅膀之间差异不显著(P>0.05);5日龄时触角的表达量是胸部的90倍左右,且胸部的表达量极显著高于其它组织(P<0.01),但头、腹、足和翅膀之间差异不显著(P>0.05);10日龄时胸部的表达量仅次于触角,但头、腹、足和翅膀之间差异不显著(P>0.05);15-30日龄头部的表达量仅次于触角,而头、胸、腹、足和翅膀之间差异不显著(P>0.05)。AcerOr167 在各日龄成蜂的触角均有表达,1日龄时表达量最低,之后在整个发育阶段呈上升的趋势;5日龄时表达量显著升高,是1日龄表达量的3倍左右;10日龄和15日龄表达量又逐渐降低;20日龄时表达量达到了整个发育阶段的最高值,且极显著高于其他各个日龄(P<0.01)。
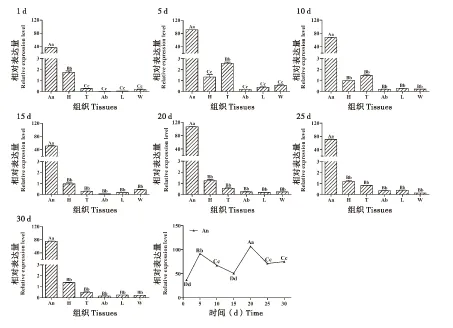
图6 AcerOr167 mRNA在中华蜜蜂不同发育阶段、不同组织中的相对表达情况Fig. 6 Ralative expressions of AcerOr167 mRNA in different developmental stages and different tissues of Apis cerana cerana注:An,触角;H,头(去除触角);T,胸(去除翅膀);Ab,腹;L,足;W,翅膀;1-30 d,成年工蜂的日龄。柱上不同大写字母和小写字母分别表示不同组织和不同发育阶段差异极显著(P<0.01)和显著(P<0.05)。Note: An, Antenna; H, Head without antenna; T, Thorax without wings; Ab, Abdomen; L, Legs; W, Wings; 1-30 d, days of adult worker bees. Different uppercase letters and lowercase letters above bars indicate highly significant difference at the 0.01 level and significant difference at the 0.05 level respectively between different tissues and different developmental stages.
3 结论与讨论
一般认为,昆虫的气味受体属于G蛋白偶联受体家族(GPCRs),具有7个跨膜结构域(Bentonetal.,2006)。而本研究所获得的AcerOr167的跨膜结构预测结果显示只有5个跨膜结构域,这与Bengtsson等(2012)分析得到的在其它昆虫中传统气味受体可能具有4-8个跨膜域的结论相一致,说明昆虫的气味受体不完全具有7次跨膜结构。通过氨基酸序列比对发现,中华蜜蜂AcerOr167与西方蜜蜂AmelOr167的氨基酸一致性最高,且在跨膜结构域上存在高度保守性;与膜翅目不同属其它昆虫的氨基酸一致性相对较低,但在昆虫其它目类下几乎找不到同源基因,这说明传统气味受体在种间具有高度的变异,这可能与传统气味受体通过形成受体复合物,专一性识别并结合不同气味分子的特点相关(Touharaetal.,2009)。
对于传统气味受体的表达研究已有大量报道,部分传统气味受体在成虫触角中高表达甚至特异性表达,如海飞翅夜蛾SlitOr18在触角中特异性表达(Brigandetal.,2009);Wanner等(2007)通过研究家蚕BmOr1,BmOr3,BmOr4和BmOr5,结果表明,这些基因只在雄性家蚕触角中特异性表达,推测它们可能属于信息素受体;棉铃虫HarmOr18和烟夜蛾HassOr18都只在触角中表达,且在雄蛾触角中的表达量高于雌蛾,推测二者可能参与了雄蛾的性信息素识别过程(张帅等,2009;张元臣等,2013)。昆虫气味受体主要在昆虫触角的嗅觉感器神经元中表达,在头部的其他附肢、足、翅膀以及生殖器中也有少量表达(Kwonetal.,2006;Kokozaetal.,2010)。本试验荧光定量结果表明AcerOr167在工蜂各组织中均有表达,除了在触角中的高表达外,在头、胸、腹、足、翅膀中也有少量表达。因而,推测AcerOr167可能在嗅觉识别系统中起着重要的作用,但对AcerOr167在工蜂与雄蜂中的表达差异有待进一步研究。
对家蚕的66个气味受体研究显示,不同气味受体在不同的发育阶段和嗅觉附器中的表达有明显的差异,并且具有不同的功能(Tanakaetal.,2009)。马龙等(2014)发现MmedOr2在中红侧沟茧蜂雌蜂交配后表达量显著降低,推测可能与接受雄性求偶时释放的性信息素和寻找寄主产卵等雌蜂特有的行为有关。蜜蜂是一种高度的社会性昆虫,其行为与其发育阶段密切相关,如18日龄以前为内勤蜂,内勤蜂是蜂群中的幼、青年工蜂,主要以酿蜜、饲喂幼虫和蜂王、清理巢房、夯实花粉等工作为主;18日龄以上为采集蜂,主要承担采蜜、采粉、采胶、采水及巢门防卫工作(Bersheretal.,2001)。本研究中AcerOr167在工蜂整个发育阶段的表达量呈上升趋势,且20日龄时表达量最高,在采集蜂时期的表达量普遍高于内勤蜂时期,推测AcerOr167可能与蜜蜂外出采集,识别花香气味有关。昆虫传统气味受体间的功能分化很大,即使同一物种气味受体基因的表达特性也很难进行横向比较,如赵慧婷等(2014)推测AcerOr1和AcerOr3是位于同一条染色体上呈串联排列的两个重复基因,但从荧光定量结果看,在工蜂不同发育阶段的表达存在较大差异,因而不同的传统气味受体可能具有不同的表达模式并执行不同的功能。
References)
Bengtsson JM, Trona F, Montagné N,etal. Putative chemosensory receptors of the codling moth,Cydiapomonella, identified by antennal transcriptome analysis[J].PLoSONE, 2012, 7(2): e31620.
Benton R.On the origin of smell: Odorant receptors in insects[J].Cellular&MolecularLifeSciencesCmls., 2006, 63(14): 1579-1585.
Benton R, Sachse S, Michnick SW,etal. Atypical membrane topology and heteromeric function ofDrosophilaodorant receptors in vivo[J].PLoSBiology, 2006, 4(2): e20.
Bersher SN, Huang ZY, Oono Y,etal. Social inhibition and the regulation of temporal polyethism in honey bees[J].JournalofTheoreticalBiology, 2001, 213(3): 461-479.
Bohbot J, Pitts RJ, Kwon HW,etal. Molecular characterization of theAedesaegyptiodorant receptor gene family[J].InsectMolecularBiology, 2007, 16(5): 525-537.
Brigand I,Montagné N, Monsempes C,etal. Identification of an atypical insect olfactory receptor subtype highly conserved within noctuids[J].FebsJournal, 2009, 276(22): 6537-6547.
Bruce TJ, Wadhams LJ, Woodcock CM. Insect hostlocation: A volatile situation[J].TrendsinPlantScience, 2005, 10(6): 269-274.
Díaz PC, Grüter C, Farina WM. Floral scents affect the distribution of hive bees around dancers[J].BehavioralEcologyandSociobiology, 2007, 61(10): 1589-1597.
Hill CA, Fox AN, Pitts RJ,etal. G protein-coupled receptors inAnophelesgambiae[J].Science, 2002, 298(5591): 176-178.
Krieger J, Klink O, Mohl C,etal. A candidate olfactory receptor subtype highly conserved across different insect orders[J].JournalofComparativePhysiologyA, 2003, 189(7): 519-526.
Krieger J, Raming K, Dewer YM,etal. A divergent gene family candidate olfactory receptors of the moth Heliothis virescens[J].EuropeanJournalofNeuroscience, 2002, 16(4): 619-628.
Kokoza V, Ahmed A, Shin SW,etal. Blocking of plasmodium transmission by cooperative action of cecropin A and defensin A in transgenicAedesaegyptimosquitoes[J].ProceedingoftheNationalAcademyofSciencesoftheUnitedStatedofAmerica, 2010, 107(18): 8111-8116.
Kwon HW, Lu T, Rützler M,etal. Olfactory responses in a gustatory organ of the malaria vector mosquitoAnopelesgambiae[J].ProceedingoftheNationalAcademyofSciencesoftheUnitedStatedofAmerica, 2006, 103(36): 13526-13531.
Ma L, Wang SN, Lu ZY,etal. Cloning and tissue expression analysis of an olfactory receptorMmedOr2 inMicroplitismediator(Hymenoptera: Braconidae)[J].ChineseJournalofBiologicalControl, 2014, 30(1): 13-19. [马龙, 王山宁, 路子云, 等. 中红侧沟茧蜂嗅觉受体MmedOr2基因的克隆及组织表达谱[J]. 中国生物防治学报, 2014, 30(1): 13-19]
Pennisi E. Fruit fly odor receptors found[J].Science, 1999, 283(5406):1239.
Robertson HM, Gadau J, Wanner KW. The insect chemoreceptor superfamily of the parasitoid jewel waspNasoniavitripennis[J].InsectMolecularBiology, 2010, 19(suppl 1): 121-136.
Robertson HM, Wanner KW. The chemoreceptor superfamily in the honeybeeApismelifera: Expansion of the odorant, but not gustatory, receptor family[J].GenomeResearch. 2006, 16(11): 1395-1403.
Sánchez-Gracia A, Vieira FG, Rozas J. Molecular evolution of the major chemosensory gene families in insects[J].Heredity, 2009, 103(3): 208-216.
Tanaka K, Uda Y, Nakagawa T,etal. Highly selective tuning of a silkworm olfactory receptor to a key mulberry leaf volatile[J].CurrentBiology, 2009, 19(11): 881-890.
Touhara K, Vosshall LB. Sensing odorants and pheromones with chemosensory receptors[J].AnnualReviewofPhysiology, 2009, 71(1): 307-332.
Vosshall LB, Amrein H, Morozov PS,etal. A spatial map of olfactory receptor expression in theDrosophilaantenna[J].Cell, 1999, 96(5): 725-736.
Wanner KW, Nichols AS, Walden KK,etal. A honeybee odorant receptor for the queen substance 9-oxo-2-decenoic acid[J].ProceedingoftheNationalAcademyofSciencesoftheUnitedStatedofAmerica, 2007, 104(36): 14383-14388.
Wanner KW, Anderson AR, Trowell SC,etal. Female-biased expression of odorant receptor genes in the adult antennae of the silkworm,Bombyxmori[J].InsectMolecularBiology, 2007, 16(1): 107-119.
Yang GH.Apisceranacerana[M]. Beijing: China Agricultural Scientech Press, 2001, 35-152. [杨冠煌. 中华蜜蜂[M]. 北京: 中国农业科技出版社, 2001, 35-152]
Yang GH. Harm of introducing the western honeybeeApismelliferaL. to the Chinese honeybeeApisceranaF. and its ecological impact[J].ActaEntomologicaSinica, 2005, 48(3): 401-406. [杨冠煌. 引入西方蜜蜂对中蜂的危害及生态影响[J]. 昆虫学报, 2005, 48(3): 401-406]
Zeng ZJ.Apicultural Science[M]. Beijing: China Agriculture Press, 2002, 28-45. [曾志将. 养蜂学[M]. 北京:中国农业出版社, 2002, 28-45]
Zhang Q, Dong X. Advances in the studies of honeybee′s olfactory receptor genes[J].JournalofBee, 2011, 12: 17-19. [张巧, 董霞. 蜜蜂嗅觉受体基因研究进展[J]. 蜜蜂杂志, 2011, 12: 17-19]
Zhang S, Zhang YJ, Su HH,etal. Cloning and tissue-specific expression of olfactory receptors inHelicoverpaarmigera(Hǜbner)[J].ActaEntomologicaSinica, 2009, 52(7): 728-735. [张帅, 张永军, 苏宏华, 等. 棉铃虫气味受体的克隆与组织特异性表达[J]. 昆虫学报, 2009, 52(7): 728-735]
Zhang YC, Fan MM, An SH,etal. Molecular cloning and tissue-specific expression of odorant receptorOR18 gene fromHelicoverpaassulta(Guenée)[J].JournalofHenanAgriculturalUniversity, 2013, 2(1):50-53. [张元臣, 范萌萌, 安世恒, 等. 烟夜蛾气味受体Or18基因克隆与组织特异性表达[J]. 河南农业大学学报, 2013, 2(1):50-53]
Zhao HT, Gao PF, Du HY,etal. Molecular characterization and differential expression of two duplicated odorant receptor genes,AcerOr1 andAcerOr3, inApisceranacerana[J].JournalofGenetics, 2014, 93(1): 53-61.
Cloning and expression analysis of odorant receptor geneAcerOr167 in the Chinese honeybee,Apisceranacerana(Hymenoptera: Apidae)
DU Ya-Li1*, PAN Jian-Fang1*, WANG Shu-Jie1, YANG Shuang2,ZHAO Hui-Ting3, JIANG Yu-Suo1**
(1.College of Animal Science and Veterinary Medicine, Shanxi Agricultural University, Taigu 030801, Shanxi Province, China; 2.Institute of Sericulture and Apiculture, Yunnan Academy of Agriculture Sciences, Mengzi 661101, Yunnan Province,China; 3.College of Life Science, Shanxi Agricultural University, Taigu 030801, Shanxi Province, China)
In this study, the cDNA sequence of the odorant receptor geneOr167 fromApisceranaceranawas cloned by RT-PCR,and the relative expression of this gene at different developmental stages (1, 5, 10, 15, 20, 25 and 30 days) and in different tissues (antennae, head(without antennae), thorax, abdomen, legs and wings) ofA.c.ceranawere profiled by qRT-PCR. The cDNA sequence of theOr167 was obtained and named asAcerOr167(GenBank accession number: KF239369), the open reading frame ofAcerOr167 is 1311 bp, encoding 436 amino acid residues, and homology analysis showed that the amino acid sequences ofAcerOr167 contain five-transmenbrane domains. The multiple alignment and phylogenetic tree analyses showed thatAcerOr167 shared the highest identity of 94% withAmelOr167, and shared the lowest identity of 49% withCbirOr4-like. The results of qRT-PCR showed thatAcerOr167 was clearly detected in different tissues at different developmental stages of adult workers. The expression ofAcerOr167 in the antennae was significantly higher than other tissues (P<0.01), and the slight expression was detected in head(without antennae), thorax, abdomen, legs and wings. From the expression level ofAcerOr167 in every developmental stages, expression was lowest in the 1st, expression increased significantly in the 5thand reached the highest in the 20th. The expression ofAcerOr167 in 20thwas significantly higher than other days.AcerOr167 may play an important role in the olfactory system ofA.c.cerana, and was closely related to the behavior that Chinese honeybee collect pollen and identify the fragrance of flowers. This findings will provide theoretical basis for further functional study of the traditional odorant receptor genes.
Apisceranacerana;AcerOr167; gene cloning; qRT-PCR; expression profile
国家自然科学基金项目(31502021,31272513);山西农业大学科技创新基金(2014012)
Received:2016-07-21;接受日期Accepted:2016-08-21
Q963;S89
A
1674-0858(2017)01-0039-09
杜亚丽,潘建芳,王树杰,等.中华蜜蜂气味受体基因AcerOr167的克隆及表达分析[J].环境昆虫学报,2017,39(1):39-47.
*共同第一作者简介:杜亚丽,1991年生,在读博士,研究方向为蜜蜂生物学,E-mail:duyali2000@yeah.net; 潘建芳,1989年生,硕士,研究方向为蜜蜂生物学,E-mail:18404966390@163.com
**通讯作者Author for correspondence,E-mail:jiangys-001@163.com
