不同脂肪酸对体外培养猪肌管细胞脂质代谢的影响
2017-03-16席玲玲王新霞汪以真
席玲玲,蔡 旻,王新霞,汪以真 *
(浙江大学饲料科学研究所,农业部动物营养与饲料重点开放实验室,浙江省动物饲料与营养重点实验室,浙江杭州 310058)
不同脂肪酸对体外培养猪肌管细胞脂质代谢的影响
席玲玲,蔡 旻,王新霞,汪以真 *
(浙江大学饲料科学研究所,农业部动物营养与饲料重点开放实验室,浙江省动物饲料与营养重点实验室,浙江杭州 310058)
本研究旨在探究日粮中不同饱和度脂肪酸棕榈酸、油酸、亚油酸在体外培养的猪肌管细胞内的代谢和沉积差异。体外分离培养猪骨骼肌卫星细胞后,诱导成肌分化,分别用100 μmol/L普通和[1-14C]标记棕榈酸、油酸、亚油酸孵育猪肌管细胞24 h后,细胞甘油三酯测定、同位素示踪法跟踪3种脂肪酸的代谢过程,实时荧光定量和Western blot检测脂质代谢相关基因和蛋白的表达。结果表明:亚油酸组细胞中甘油三酯沉积量最高(P<0.05);同位素示踪法发现亚油酸在细胞中的氧化量和摄取量均最高(P<0.05),且在细胞甘油三酯中的沉积量最高(P<0.05);亚油酸能够显著提高肌管细胞脂肪酸摄取相关基因CD36、FABP4、FATP1,脂肪酸氧化相关基因CPT1、CytC、AMPKα2的表达(P<0.05),以及线粒体功能相关蛋白NRF1表达,并能够显著促进甘油三酯合成相关基因DGAT2、FAS的表达(P<0.05)。相比于饱和脂肪酸和单不饱和脂肪酸,多不饱和脂肪酸亚油酸能够促进猪肌管细胞脂肪沉积,并能促进肌管细胞脂肪酸摄取、氧化、甘油三酯合成及促进相关基因表达。
脂肪酸;猪肌管细胞;脂肪酸代谢;脂肪沉积
猪肉风味是猪肉品质的重要组成部分,日粮脂肪酸组成可以影响猪骨骼肌细胞膜和细胞内的脂肪酸组成从而影响猪肉风味[1-2]。骨骼肌细胞内甘油三酯沉积与日常饮食和日粮中的脂肪酸种类密切相关[3-4]。研究日粮不同脂肪酸对骨骼肌肌管细胞脂质代谢的影响,可以为日粮脂肪酸改善猪肉风味提供理论依据。国内外研究发现,不同碳链长度、饱和程度的脂肪酸有着不同的氧化速率[5]。而且不同饱和程度的脂肪酸在不同组织和细胞中的代谢也存在差异。诱导成肌分化的猪骨骼肌卫星细胞可作为研究猪骨骼肌代谢的体外模型。本研究利用同位素示踪法跟踪脂肪酸在猪肌管细胞中的代谢过程,并通过荧光定量PCR和蛋白免疫印迹的方法检测该细胞脂肪酸代谢途径中关键分子的基因和蛋白表达,揭示日粮不同脂肪酸对猪肌管细胞脂质代谢的影响。
1 材料与方法
1.1 试验动物 3~5日龄杜×长×大三元杂交健康新生仔猪(科强生态养殖有限公司)。
1.2 骨骼肌卫星细胞的分离培养、成肌诱导分化无菌条件下分离仔猪背最长肌,剔除筋膜后用PBS清洗3遍,手术剪剪碎,肉块悬浮液用移液管吹成糊状后加入1 g/L链霉蛋白酶(Sigma公司,美国),37℃消化60 min。150目和200目尼龙纱网过滤,
1 250 r/min离心10 min,弃上清,底部细胞用含15% 胎牛血清(Gibco公司,南美)、25 IU青霉素、25 mg/L链霉素、1 mg/L BFGF(PeproTech公司,美国)的DMEM/F12(Gibco公司,美国)的完全培养基于37℃、5% CO2细胞培养箱培养。4 h后上清转移至I型鼠尾胶包被的10 cm细胞培养皿,3 d后换液,得到细胞即为猪骨骼肌卫星细胞。当细胞长至80%~90%密度时,用含2%马血清(Gibco公司,美国)的DMEM/F12(诱导培养基)诱导成肌分化。诱导7 d后,分别用含100 μmol/L棕榈酸(PA)、油酸(OA)、亚油酸(LA)的DMEM/F12培养基孵育24 h后进行下述试验。
1.3 油红O染色 参照Wang等[6]的方法,倒置显微镜拍照。
1.4 细胞中甘油三酯含量测定 采用EnzyChromTMTriglyceride Assay Kit试剂盒(BioAssay Systems公司,美国)测定,细胞蛋白浓度校正,每个处理4个重复, SPASS软件分析后,Graphpad prism 5软件作图。
1.5 同位素示踪脂质代谢试验 分化成熟的肌管用100 μmol/L [1-14C] PA、[1-14C] OA和[1-14C] LA 37℃孵育24 h。对CO2、ASP、细胞放射性、细胞总脂质含量及细胞脂质类型进行相对定量测定,从而计算得到细胞脂肪酸摄取、氧化、细胞脂质、脂质分类。孵育完成后取培养基于10 000 r/min离心10 min,收集上清冰上保存。细胞用冷PBS冲洗3遍,吸干PBS后各加入1 mL甲醇,细胞刮刮下至1.5 mL离心管,收集好的细胞-20℃保存。
脂肪酸氧化测定的方法参照Christiansen等[7]方法并做了调整。CO2测定:选择带塞锥形瓶,瓶塞连接塑料勺,塑料勺内放折叠好的滤纸。塑料勺内加入0.3 mL苯乙胺、甲醇1∶1混合液;取1.5 mL培养基于锥形瓶后,往锥形瓶中加入0.3 mL 1 mol/L的HClO4。所有试剂添加完成后,立即盖上瓶塞,室温孵育60 min。剪下塑料勺,放入测定管,加入5 mL闪烁液,液闪仪分析。ASP测定:取0.4 mL培养基于1.5 mL离心管,加入0.2 mL 2 mol/L HClO4,冰上孵育60 min 后,10 000 r/min离心10 min,取上清用于闪烁分析。
细胞脂肪酸摄取分析:取50 μL细胞悬液用液闪仪测定细胞放射性。细胞脂肪酸摄取为细胞放射性和脂肪酸氧化量数据换算后之和。
细胞脂质分离和脂质种类分析:细胞内总脂质分离参考Folch等[8]的方法。取一半用于液闪仪检测细胞总脂质含量。剩余的脂质用氮吹仪吹干后加入100 μL氯仿重新溶解。通过高效薄层层析色谱法分离游离脂肪酸(FFA)、甘油三酯(TAG)、甘油二酯(DAG)、磷脂(PL)和胆固醇酯(CE),流动相为己烷、乙醚、乙酸((85∶15∶1)。将细胞脂质点到层析板,流动相距顶部1.5 cm时,取出层析板并于通风厨晾干。3%醋酸铜的磷酸溶液(8%磷酸水溶液)显色,每种脂质在层析板上形成一个点,剪下各个点用于闪烁分析。

表1 实时荧光定量 PCR 引物
1.6 实时荧光定量PCR Trizol法(新景生物科技公司,杭州)提取细胞总RNA,NanoDrop 2000(Thermo Fisher,美国)测定浓度后反转录。实时荧光定量PCR测定使用ABI Step-One PlusTM系统(Applied Biosystems,美国),参照文献[9]中的方法。cDNA1∶10稀释后采用10 μL PCR体系:4 μL cDNA,5 μL SYBR Green Master(Roche Applied Science,瑞士),0.5 μL上游引物,0.5 μL下游引物。2-ΔΔCt法进行数据分析,并以18 S为内参。引物序列详见表1。
1.7 蛋白免疫印迹方法 参照文献[9],NRF1单克隆抗体购自Abcam公司(Abcam,英国)。
1.8 统计分析 用SPSS 16.0(SPSS Inc.,美国)进行数据分析,采用One-Way ANOVA显著性分析,并用t检验(Student's t test)法进行统计。
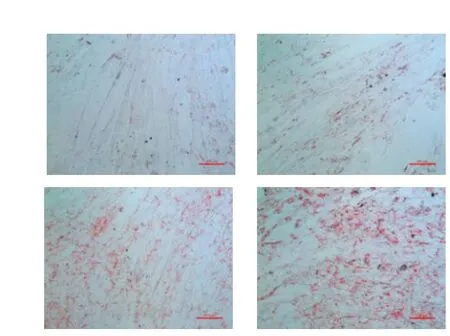
图1A 不同脂肪酸孵育猪肌管细胞后油红O染色
2 结 果
2.1 不同脂肪酸引起体外培养猪肌管细胞甘油三酯沉积差异 100 μmol/L PA、OA、LA 孵育诱导成熟猪肌管细胞24 h,油红O染色后拍照,并用甘油三酯测定试剂盒定量测定细胞内甘油三酯含量。如图1A和图1B所示,体外试验证明细胞外脂肪酸可以显著增加细胞内甘油三酯沉积量,LA孵育后细胞内甘油三酯的沉积量显著高于PA和OA处理组。
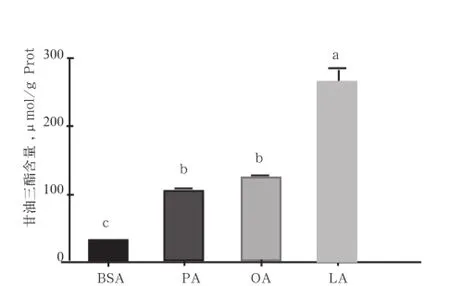
图1B 不同脂肪酸孵育猪肌管细胞甘油三酯含量
2.2 同位素示踪法跟踪不同脂肪酸在体外培养猪肌管细胞中的代谢差异 分别用[1-14C] 标记的PA、OA和LA孵育诱导成熟的猪肌管细胞,用于跟踪脂肪酸的摄取、氧化和酯化过程。试验分别测定了细胞脂质、β氧化产物(CO2+ASP)、全细胞放射性、不同脂质成分的放射性。肌细胞对OA、LA的摄取和氧化均显著高于PA(P<0.05),对LA的氧化显著高于OA(P<0.05)。细胞总的脂质含量未出现显著差异(P>0.05)。甘油三酯分别占[1-14C] PA、OA、LA放 射 性 的61.36%、64.36%和67.49%;磷脂分别占[1-14C] PA、OA、LA放射性的34.58%、29.28%和20.65%。
2.3 不同脂肪酸孵育引起体外培养猪肌管细胞脂肪酸摄取相关基因的表达差异 24 h脂肪酸孵育后,实时荧光定量测定脂质转运相关基因CD36、FABP4、FATP1、FATP4和ACSL的mRNA表达量,并以18 S为内参。如图3所示,相对PA和OA,LA孵育能够显著提高CD36、FABP4和FATP1基因mRNA表达量(P<0.05)。OA孵育后,CD36 mRNA表达量显著高于PA(P<0.05)。OA、LA能够提高ACSL的mRNA表达量,但差异不显著(P>0.05)。
2.4 不同脂肪酸孵育引起体外培养猪肌管细胞脂肪酸氧化相关基因的表达差异 荧光定量测定了脂肪酸β氧化及线粒体相关基因蛋白的表达。由图4可见,β氧化关键基因CPT1的表达量OA和LA组显著高于PA组(P<0.05)。表征线粒体活性的基因细胞色素C即CytC的mRNA表达量显著高于PA和OA组(P<0.05)。其他β氧化相关通路基因呈现出相似趋势,AMPKα2和PPARα的mRNA表达量LA组显著高于PA和OA组(P<0.05)。NRF1即线粒体核呼吸链因子,其表达量能够体现线粒体功能。LA处理组的NRF1显著提高(P<0.05)。
2.5 不同脂肪酸孵育引起体外培养猪肌管细胞甘油三酯代谢相关基因的表达差异 细胞甘油三酯的沉积量是细胞甘油三酯合成和分解途径共同作用的结果,即合成关键基因DGAT和FAS,甘油三酯分解关键基因ATGL。图5结果表示,LA能够显著促进合成相关基因DGAT、FAS的mRNA表达水平(P<0.05),而PA、OA、LA孵育后分解关键基因ATGL的mRNA表达量无显著差异(P>0.05)。

图2 同位素示踪法脂肪酸代谢差异

图3 脂肪酸摄取相关基因表达
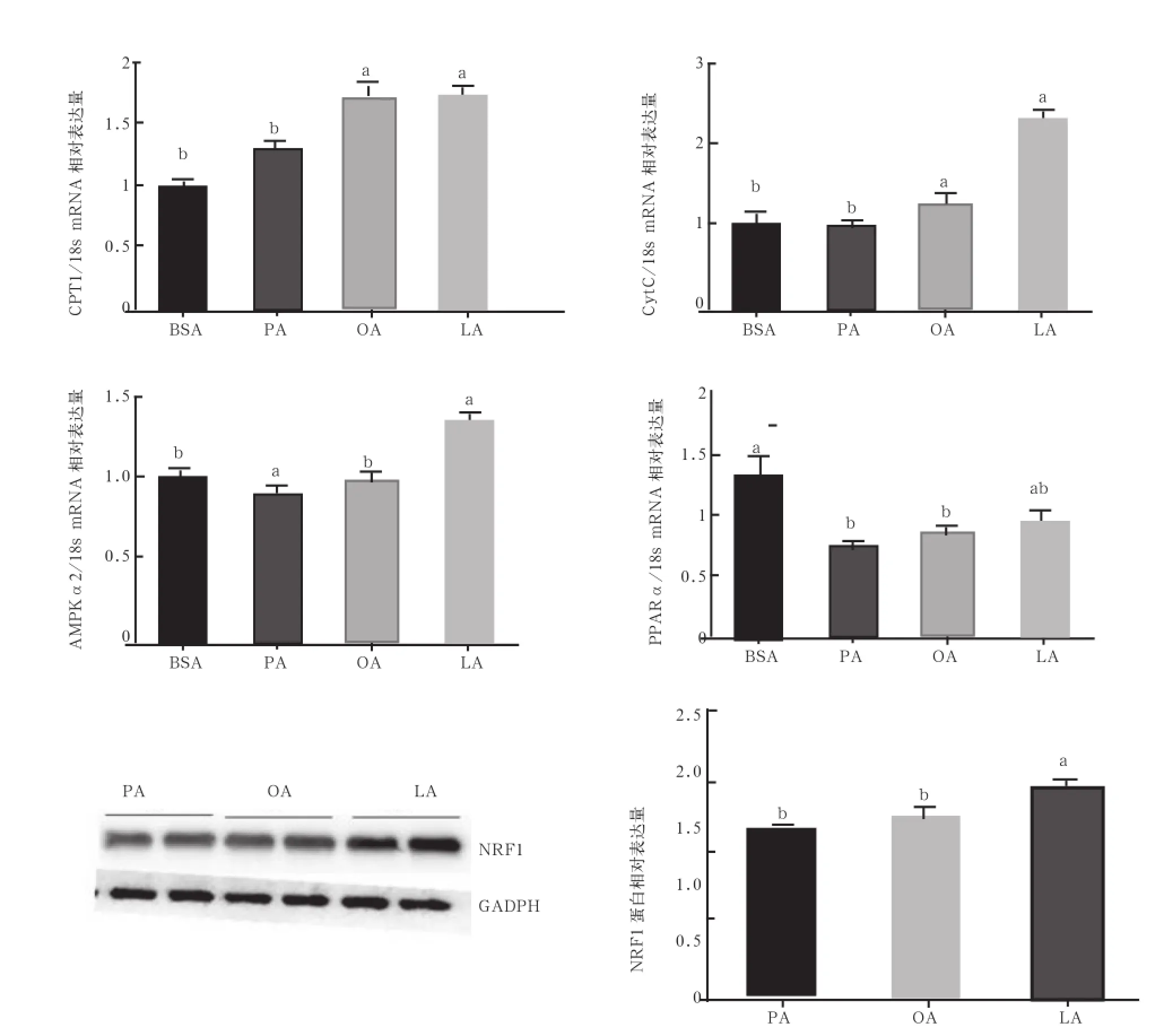
图4 脂肪酸氧化相关基因蛋白表达
3 讨 论
3.1 体外试验中不同脂肪酸引起体外培养猪肌管细胞甘油三酯的沉积差异 本研究发现,不同脂肪酸体外孵育能够引起细胞内的甘油三酯沉积量不同程度的增加。LA处理后,甘油三酯沉积量显著高于PA和OA组,而PA与OA组差异并不显著,这与其在人肌细胞上的结果不同[10]。骨骼肌承担了体内80%以上的糖负荷,肌细胞内过度的甘油三酯沉积又称脂肪异位沉积,是引起机体胰岛素抵抗的重要原因[11]。多项研究证明,n-3多不饱和脂肪酸处理后骨骼肌细胞内的甘油三酯沉积量显著低于其他脂肪酸组[12]。LA作为常见的n-6多不饱和脂肪酸,反而能够增加猪肌管细胞甘油三酯的沉积量,为n-6多不饱和脂肪酸在猪肌肉细胞内的代谢沉积规律提供理论依据。
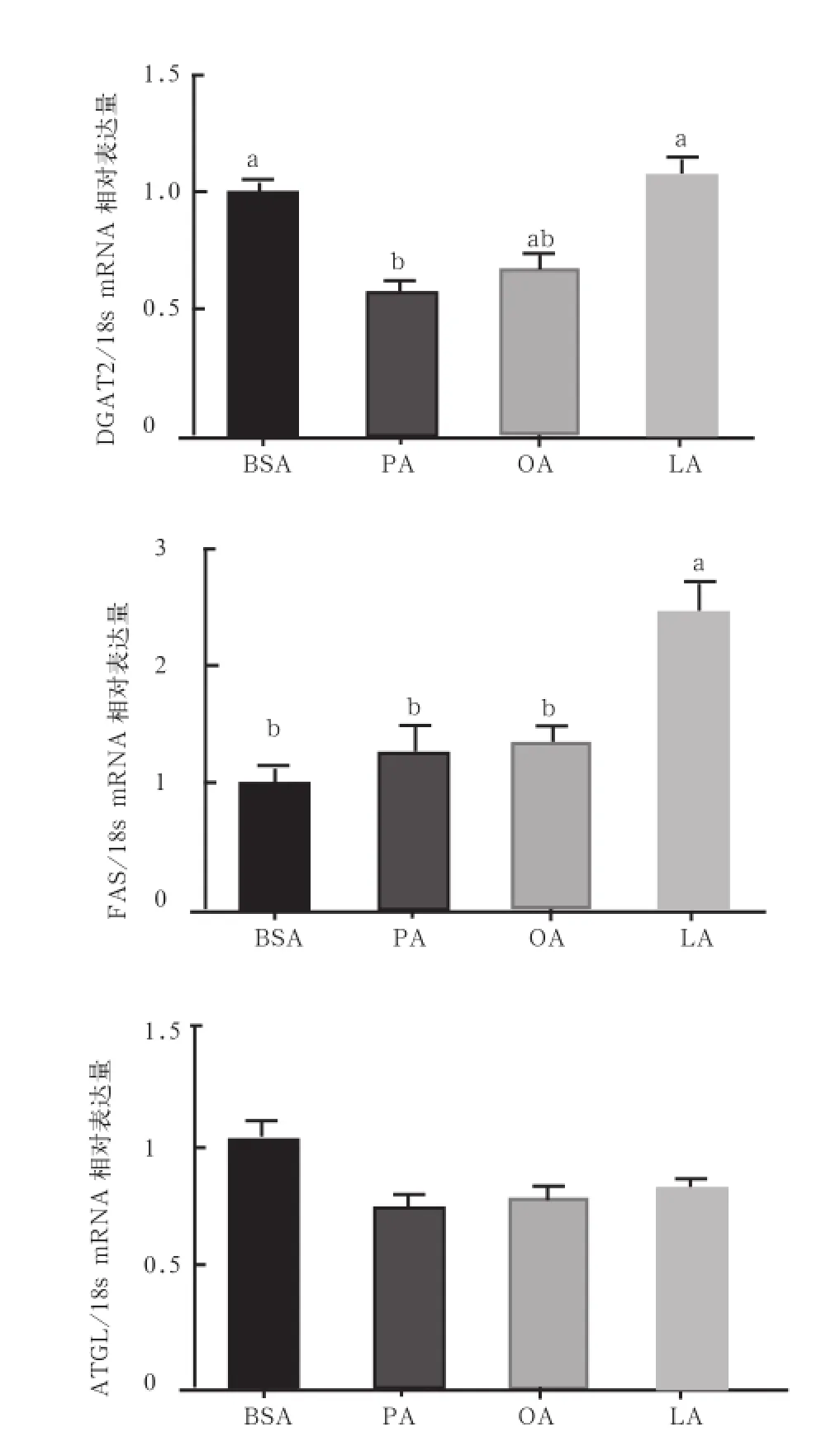
图5 甘油三酯代谢相关基因表达
3.2 不同脂肪酸在体外培养猪肌管细胞脂肪酸的代谢差异 采用[1-14C]同位素示踪的方法,跟踪PA、OA、LA在体外培养肌管细胞内的代谢过程发现,LA的摄取和氧化量显著高于PA和OA,但在细胞总体脂质的沉积方面,3种脂肪酸并无显著差异。然而3种脂肪酸在不同的脂质分配上发生了较大差异,PA在磷脂中的沉积量最高,而LA主要以甘油三酯的形式储存在细胞内,而且在甘油二酯和游离脂肪酸的含量最高,表明不同脂肪酸的结构影响了整个肌管细胞脂肪酸代谢,包括脂肪酸的摄取、氧化、游离脂肪酸酯化(甘油三酯、磷脂、胆固醇)等代谢过程。游离脂肪酸、甘油三酯、甘油二酯、磷脂和胆固醇酯每种细胞内的脂质的脂肪酸组成都对细胞有着重要的影响。磷脂的主要存在形式是胞膜磷脂,胞膜磷脂能影响细胞膜脂肪氧化特性和细胞膜流动性等,从而影响肉色等肉质综合指标。在正常细胞中n-6多不饱和脂肪酸主要以磷脂的形式存在,而饱和脂肪酸和单不饱和脂肪酸主要以中性脂质的形式存在[13]。当细胞外脂肪酸处理时,不同脂肪酸以与正常情况下相反的方式酯化进入不同的细胞脂质。与其他2种脂肪酸相比,LA在甘油三酯、PA在磷脂中的沉积量最大。
3.3 不同脂肪酸影响体外培养猪肌管细胞脂质代谢相关基因的蛋白表达 不同的胞外脂肪酸对体外培养猪肌管细胞脂肪酸代谢过程关键基因影响不同。机体的很大部分能量从长链脂肪酸获取,研究指出当细胞脂肪酸摄取量增加时,相应的转运蛋白的表达量会随之升高。本研究证明,3种脂肪酸孵育后转运相关基因中CD36表达量变化最大,在氧化相关蛋白中线粒体相关基因CPT1和CytC的mRNA表达量差异显著,且氧化相关通路基因AMPKα2和PPARα差异显著,同时合成相关基因DGAT和FAS的mRNA表达量差异显著。这些基因都与AMPK通路关系密切,提示AMPK是细胞内重要的能量调节器,也可能是不同脂肪酸影响细胞脂质代谢的关键。
4 结 论
PA、OA、LA孵育体外培养猪肌管细胞在各脂肪酸代谢过程存在差异,LA能够促进猪肌管细胞摄取量和β氧化关键基因表达,并能够提高线粒体活性,且LA摄取和氧化量均显著高于其他2种脂肪酸,并能促进细胞甘油三酯合成使其更多地以甘油三酯的形式储存在细胞中。
[1] Corino C, Rossi R, Cannata S, et al. E ff ect of dietary linseed on the nutritional value and quality of pork and pork products: systematic review and meta-analysis[J]. Meat Sci, 2014, 98(4): 679-688.
[2] Wood J D, Enser M, Fisher A V, et al. Manipulating meat quality and composition[J]. Proc Nutr Soc, 1999, 58(2): 363-370.
[3] Feskens E J M, Loeber J G, Kromhout D, et al. Diet and physical activity as determinants of hyperinsulinemia: the zutphen elderly study[J]. Am J Epidemiol, 1994, 140(4): 350-360.
[4] Marshall A J, Bessesen H D, Hamman R F, et al. High saturated fat and low starch and fibre are associated with hyperinsulinaemia in a non-diabetic population: The San Luis Valley Diabetes Study[J]. Diabetologia, 1997, 40(4): 430-438.
[5] Delany J P, Windhauser M M, Champagne C M, et al. Differential oxidation of individual dietary fatty acids in humans[J]. Am J Clin Nutr, 2000, 72(4): 905-911.
[6] Wang X, Huang M, Wang Y. The e ff ect of insulin, TNFalpha and DHA on the proliferation, differentiation and lipolysis of preadipocytes isolated from large yellow croaker (Pseudosciaena Crocea R.) [J]. PLoS One, 2012, 7(10): e48069.
[7] Christiansen R, Borrebaek B, Bremer J. The effect of (-) carnitine on the metabolism of palmitate in liver cells isolated from fasted and refed rats[J]. FEBS Lett, 1976, 62(3): 313-317.
[8] Folch J, Lees M, Sloane Stanley G H. A simple method for the isolation and purification of total lipides from animal tissues[J]. J Biol Chem, 1957, 226(1): 497-509.
[9] Yi H, Yu C, Zhang H, et al. Cathelicidin-BF suppresses intestinal inflammation by inhibiting the nuclear factorκB signaling pathway and enhancing the phagocytosis of immune cells via STAT-1 in weanling piglets[J]. Int Immuno pharmacol, 2015, 28(1): 61-69.
[10] Nikolic N, Hessvik N P, Badin P M. Palmitic acid follows a di ff erent metabolic pathway than oleic acid in human skeletal muscle cells; lower lipolysis rate despite an increased level of adipose triglyceride lipase[J]. BBA-Mol Cell Biol L, 2012, 1821(10): 1323-1333.
[11] Bonen A, Dohm G L, van Loon L J. Lipid metabolism, exercise and insulin action[J]. Essays Biochem, 2006, 42: 47-59.
[12] Ewaschuk J B, Almasud A, Mazurak V C. Role of n-3 fatty acids in muscle loss and myosteatosis[J]. Appl Physiol Nutr Metab, 2014, 39(6): 654-662.
[13] Wood J D, Enser M, Fisher A V, et al. Fat deposition, fatty acid composition and meat quality: A review[J]. Meat Sci, 2008, 78(4): 343-358.
E ff ects of Fatty Acids on Lipid Metabolism in Porcine Skeletal Myotubes
XI Ling-ling, CAI Min, WANG Xin-xia, WANG Yi-zhen*
(College of Animal Sciences, Zhejiang University; Key Laboratory of Animal Nutrition & Feed Sciences, Ministry of Agriculture; Zhejiang Provincial Laboratory of Feed and Animal Nutrition; Zhejiang Hangzhou 310058, China)
This study was conducted to investigate di ff erent e ff ects of the dietary fatty acids with di ff erent saturation, oleic acid and linoleic acid on lipids metabolism and accumulation in cultured porcine skeletal myotubes. Skeletal muscle satellite cells were isolated, and induce into myotubes, myotubes were incubation with normal and [1-14C] labeled 100 μmol/L palmitic acid, oleic acid and linoleic acid respectively. To investigate the e ff ects of di ff erent fatty acids on lipid metabolism in porcine skeletal muscle myotubes, cell triglyceride was determined and lipid metabolism was detected by isotope tracing method, lipid metabolism related genes and protein were investigated by real-time fluorescence quantitative assay and western blot. As a result, myotubes treated with linoleic acid had the most amount of triglyceride accumulation (P<0.05). The result of tracing method showed that linoleic acid had the highest oxidation and uptake rate in myotubes ( P<0.05), also with most triglyceride accumulation (P<0.05). Linoleic acid can promote the mRNA expression of genes related to fatty acid uptake(CD36, FABP4, FATP1), fatty acid oxidation(CPT1, CytC, AMPKα2)and triglyceride synthesis(DGAT2, FAS) (P <0.05). Linoleic acid also improved mitochondrial function related protein NRF1 synthesis in porcine skeletal muscle myotubes. It concluded that polyunsaturated fatty acids linoleic acid can promote the fat deposition of pig skeletal myotubes and promote fatty acid uptake, oxidation, triglyceride synthesis and the promotion of related genes in myotubes compared to saturated and monounsaturated fatty acids.
Fatty acids; Porcine skeletal myotubes; Lipid accumulation;Lipid metabolism
S828.5
:A
:10.19556/j.0258-7033.2017-02-058
2016-10-09;
2016-12-27
国家重点基础研究发展计划(973计划)(2012 CB1247)
席玲玲(1990-),女,河北人,硕士研究生,主要从事动物营养与肉品质研究,E-mail: summeryXi@163.com
* 通讯作者:汪以真,E-mail: yzwang321@zju.edu.cn
